稀释生物样品成分的分析方法与流程
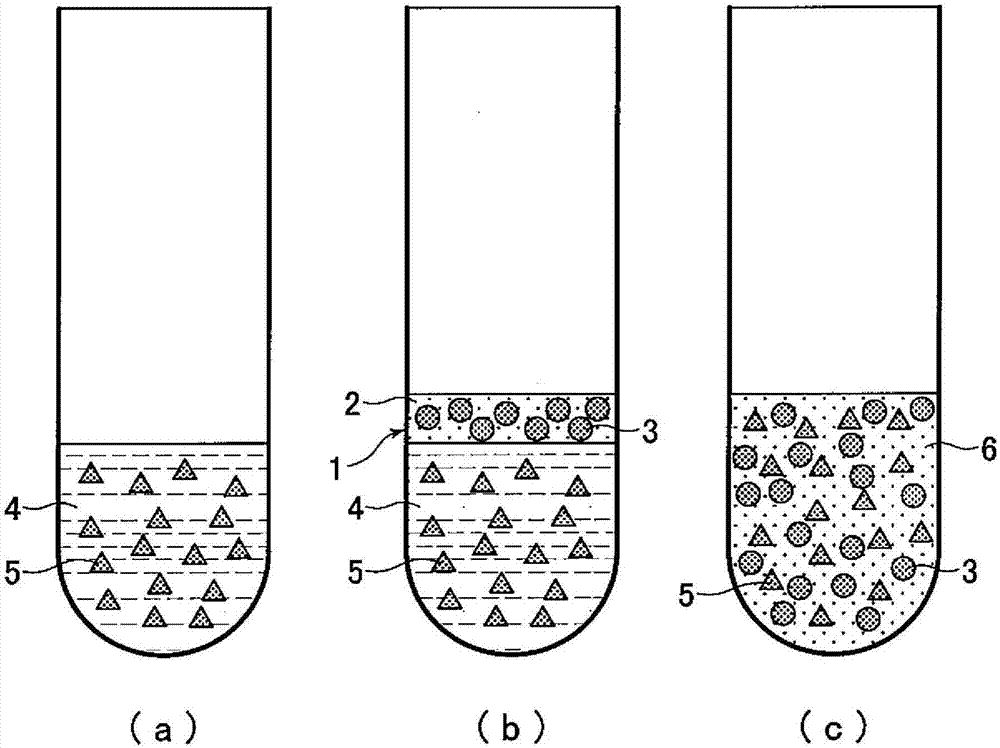
本发明涉及一种对血液等生物样品中的分析物进行测定的方法,其是用具有特定成分的缓冲液稀释生物样品,由稀释样品中的混合溶液对血浆样品成分或酶活性进行分析的测定方法。本发明还涉及一种微量生物样品成分的分析方法与血细胞的计数测定,其用规定缓冲液稀释未定量的微量血液等生物样品,由稀释的样品混合溶液对血浆样品成分的定量和酶活性进行分析。
背景技术:
:患者或受试者为了各种疾病的诊断、治疗效果的判断和健康管理,需要前往医疗机构或体检场所,从静脉采集血液进行检查。但是,为获知检查结果需要长时间等待。此外,存在着为检查而需要请假半天以上工作时间的问题。作为可在任意时间任意地点都可以进行血液检查的方法,报道了用加入内标物的缓冲液稀释微量血液,由内标物的稀释倍数来对稀释血浆中未知量的存在成分量进行定量的方法(例如,参见专利文献1)。具体而言,作为用规定缓冲液稀释微量血液,由稀释的样品混合溶液对血浆样品成分的定量和酶活性进行分析的方法,已知使用甘油-3-磷酸或甘油作为内标物的方法(例如,参见专利文献2)。此外,已知血细胞成分的计数测定中作为其稀释内标物而使用酪胺的方法(例如,参见专利文献3)。另一方面,作为由微量血液进行检查的方法,报道了作为采集血液的方法而使用滤纸的方法(例如,参见专利文献4)。通过利用微量血液,无需选择时间与场所就可以进行检查,期待着能够有助于出现症状前发现或保持健康。现有技术文献专利文献专利文献1:日本特开2003-161729号公报专利文献2:日本特开2006-322829号公报专利文献3:日本特开2011-112451号公报专利文献4:日本特开平10-104226号公报技术实现要素:发明所要解决的问题但是,上述现有的稀释率计算方法中,作为血浆的稀释内标物利用甘油-3-磷酸,但被存在于生物内的酶碱性磷酸酶水解,生成甘油。因此,如果添加血液后的保存时间长、或者温度高,则不能得到准确的血液稀释率。由此,对原血浆中的生物成分或酶活性的测定值的可靠性降低。为解决这种状况而需要在现有方法中添加酶抑制剂edta。但是,该抑制剂的添加并不能完全抑制酶,因此需要进一步添加作为生成物抑制剂的磷酸,由于这两种物质的添加而使天冬氨酸转氨酶或谷丙转氨酶的活性下降。其结果是需要过度添加这些酶的活性剂磷酸吡哆醛。作为解决这些问题的内标物,可将胆碱等阳离子带电的物质作为内标利用,但观察到吸附到塑料容器上,存在着不适于长时间保存的问题。对于这些物质,作为〔专利文献2〕提出了申请,但分子内有芳香环,因而疏水性高,如果长期保存于塑料容器中则发生吸附,存在着不能准确求出血液的稀释倍数的问题。本发明发现了乙醇胺等化合物作为分子内没有芳香环、渗透到血细胞内的物质是有效的。这些物质基本上不存在于血液中,而且是稳定的化合物。此外,能够溶于内标液的缓冲液中,不会因长期保存而吸附到塑料容器上。为了解决上述问题而完成了本发明,目的在于提供稀释率计算方法,该方法能够简单且准确地定量从受试者手指等体表采集并稀释的少量且未知量的全血样品的成分。此外,专利文献3中记载的方法,作为内标物的甘油-3-磷酸作为稳定的化合物而一直以来被利用,但在样品少时,内标物的稀释率小,存在着其稀释倍数的可靠性降低的问题。此外,如专利文献4中记载的,在滤纸或多孔质材料吸收血液后,使其干燥并邮寄,提取血液成分的方法在干燥过程或邮寄时成分有时发生变性。此外,从干燥样品提取生物成分的缓冲液为了调节ph或生物成分稳定化而需要利用添加有naoh或nacl、hcl的缓冲液。因此,样品组分中最平衡、个体间差异小的钠或氯的浓度不能用作对稀释的原来的其他生物成分浓度进行校正的外标物。另一方面,用缓冲液稀释的方法用ph7.4的生理条件下的缓冲液保存生物样品中的生物成分,在输送中的稳定性也优异,但添加内标物缓冲液形成的样品中内标物的稀释率小,添加少量样品容易产生测定误差。本发明的目的在于提供对生物样品中的分析物进行定量分析的方法,其是用缓冲液稀释生物样品而对生物样品中的分析物进行分析的方法,其中,对用缓冲液稀释生物成分的样品中的生物成分浓度,由作为外标的样品中恒定的成分的稀释率来准确地求出生物样品的稀释倍数。进一步,本发明的目的在于提供对生物样品中的分析物进行定量分析的方法,其是用缓冲液稀释生物样品而对生物样品中的分析物进行分析的方法,其中弥补了用内标物求出生物样品的稀释倍数的方法、用外标物求出生物样品的稀释倍数的方法两者的缺点,准确地求出生物样品的稀释倍数。解决问题的技术方案为了实现上述目的,本发明其特征在于,在对血液等生物样品中的生物成分进行分析时,1.利用内标物进行分析、2.利用外标物、或者3.利用内标物和外标物。1.利用内标物的分析方法(内标法)本发明是对血液等生物样品中的生物成分进行分析的方法,其特征在于,对添加所述血液等生物样品的稀释缓冲液和该稀释缓冲液中含有的内标物进行分析并计算稀释率,计算血浆、血清或血细胞生物成分的稀释率,从而对所述血液等生物样品中的血浆、血清或生物样品中的生物成分进行分析。本发明的血浆样品生物样品成分的分析方法中,所述缓冲液中的内标物为长时间稳定、不会吸附到装入所述缓冲液的容器上的成分,所述内标物是在所述血液等生物样品中基本上不含有的物质,优选能够用自动生化分析装置等容易且高精度地进行分析的物质。此外,在本发明的血浆样品生物样品成分的分析方法中,所述缓冲液中的内标物为不渗透到所述血细胞内的成分,优选能够准确反映所述血浆或所述血清的稀释率的物质。同样在血细胞数的计算方法中,所述缓冲液中的内标物为渗透到所述血细胞内的成分,优选能够准确反映所述全血(血浆和血细胞)的稀释率的物质。进一步,本发明的生物样品成分的分析方法中,所述缓冲液相对于血细胞膜的渗透压为250~500mosm/kg,优选缓冲液中具有即使与血液混合也不使所述血细胞发生溶血的试剂成分。进一步此外,本发明的生物样品成分的分析方法中,优选所述缓冲液中具有不使所述血液中的生物样品成分发生变性并能够稳定地保持的组成。进一步,本发明的生物样品成分的分析方法中,优选血浆内标物含有锂或麦芽糖。由血浆的稀释率可以求出血浆浓度,但不能求出血细胞的体积。如果能求出血液全血(血浆和血细胞),则可以进行贫血检查。于是,作为渗透到血细胞内的内标物,优选含有疏水性且不吸附到塑料的乙醇胺。通过测定该内标可求出整体血液的稀释率。由血液的血浆稀释率和整体血液稀释率可求出血细胞的容积比率(血细胞比容值)。即,本发明如下所述:[1-1]一种使用内标物的生物样品成分的分析方法,该方法使用用于加入血液样品的稀释缓冲液,分析该稀释缓冲液中含有的内标物,计算血浆或血清的稀释率,从而对所述血液样品中的血浆或血清成分中的生物成分进行分析,其中,所述稀释缓冲液中含有的内标物具有不渗透到血细胞中的性质,所述内标物选自由包括麦芽糖的二糖、谷氨酸、亮氨酸、缬氨酸、异亮氨酸、4-羟基苯、羟基丁酸、肌酸、苹果酸、trinder试剂和锂构成的组的物质。[1-2]如[1-1]的生物样品成分的分析方法,其中,稀释缓冲液中含有的内标物为锂。[1-3]一种使用内标物的生物样品成分的分析方法,该方法使用用于加入血液样品的稀释缓冲液,分析该稀释缓冲液中含有的内标物,计算血液的稀释率,从而对所述血液样品中的血细胞计数或血浆的生物成分进行分析,其中,所述稀释缓冲液中含有的内标物具有渗透到血细胞中的性质,所述内标物选自由乙醇胺、己胺、苯乙胺、戊胺、组胺、腐胺、次黄嘌呤、色氨酸、孕烯醇酮和β-谷甾醇构成的组的物质。[1-4]一种生物样品成分的分析方法,该方法使用用于加入血液样品的稀释缓冲液,分析该稀释缓冲液中含有的内标物,血液或计算血浆或血清的稀释率,从而对所述血液样品中的血细胞计数或血浆的生物成分或者所述血液样品中的血浆或血清成分中的生物成分进行分析,其中,所述稀释缓冲液含有:具有不渗透到血细胞中的性质的所述内标物,所述内标物选自由锂、包括麦芽糖的二糖、谷氨酸、亮氨酸、缬氨酸、异亮氨酸、4-羟基苯、羟基丁酸、肌酸、苹果酸和trinder试剂构成的组的物质;以及具有渗透到血细胞中的性质的所述内标物,所述内标物选自由乙醇胺、己胺、苯乙胺、戊胺、组胺、腐胺、次黄嘌呤、色氨酸、孕烯醇酮和β-谷甾醇构成的组的物质。[1-5]如[1-1]的生物样品成分的分析方法,其中,所述稀释缓冲液中含有的内标物为分子量在500以下的化学物质,且选自于在分子内具有选自由硫酸根离子即-so3-、羧酸根离子即-coo-、硫醇基即-sh和季胺即-nh3+的构成的组的取代基的化合物。[1-6]如[1-1]的生物样品成分的分析方法,其中,所述稀释缓冲液中含有的内标物为trinder试剂,该trinder试剂为选自由ados(n-乙基-n-(2-羟基-3-磺丙基)-3-甲氧基苯胺)、adps(n-乙基-n-磺丙基-3-甲氧基苯胺)、alps(n-乙基-n-磺丙基苯胺)、daos(n-乙基-n-(2-羟基-3-磺丙基)-3,5-二甲氧基苯胺)、hdaos(n-(2-羟基-3-磺丙基)-3,5-二甲氧基苯胺)、maos(n-乙基-n-(2-羟基-3-磺丙基)-3,5-二甲基苯胺)、toos(n-乙基-n-(2-羟基-3-磺丙基)-3-甲氧基苯胺)和tops(n-乙基-n-磺丙基-3-甲基苯胺)构成的组的化合物。[1-7]如[1-1]~[1-6]中任一项所述的生物样品成分的分析方法,其中,所述稀释缓冲液具有即使与血液混合也不使所述血细胞发生溶血的试剂成分。[1-8]如[1-1]~[1-7]中任一项所述的生物样品成分的分析方法,其中,为了使所述血液中的生物样品成分不发生变性并能够稳定地保持,所述稀释缓冲液中根据被测成分而单独或多个组合地含有如下添加物:乙二胺四乙酸盐、柠檬酸盐、草酸盐等螯合剂;硫酸阿米卡星盐、硫酸卡那霉素盐、噻苯咪唑、叠氮化钠等抗菌剂或防腐剂;磷酸吡哆醛、镁、锌等辅酶;甘露醇、右旋糖、寡糖等糖类;选自由十二烷基硫酸钠、汞、肝素构成的组的抑制剂。[1-9]如[1-4]的生物样品成分的分析方法,其特征在于,由所述内标物的稀释率计算血液的血细胞容积率(血细胞比容值)。2.利用外标物的分析方法(外标法)已知血液中的钠或氯具有非常高的平衡性,个体间变动也小。该钠的中位值浓度142mmol/l与生物浓度均高,因此即使用缓冲液稀释,也可以高精度地测定高稀释倍数的样品浓度。但是,将钠或氯用作外标时,不能将含钠或氯的缓冲液用作稀释用缓冲液。本发明人首先研究了使用体内平衡性高的钠、氯或蛋白质作为外标物。为使用这些外标物,需要在稀释生物样品的缓冲液中避免钠或氯的存在。之前不存在有在ph7.4附近有缓冲能力且不含有碱(naoh等)的缓冲液。本发明人尝试进行新型缓冲液的开发,作为不含碱金属类(naoh等)或氯离子却表现碱性的化合物,利用了2-氨基-2-甲基-1-丙醇、2-乙基氨基乙醇、n-甲基-d-葡糖胺、二乙醇胺、三乙醇胺等氨基醇化合物。新发现通过将这些化合物中与作为生化研究用具有优异性能的good's缓冲液,即与作为酸的pka在ph7.4附近的缓冲液的hepes(2-[4-(2-羟乙基)-1-哌嗪基]乙磺酸)、tes(n-三(羟甲基)甲基-2-氨基乙磺酸)、mops(3-吗啉丙磺酸)、bes(n,n-双(2-羟乙基)-2-氨基乙磺酸)进行混合可调节至ph7.4。此外,发现这些缓冲液不含有作为外标物一例的钠或氯,且不对测定对象钠或氯的测定体系产生干扰。进一步,发现用这些缓冲液稀释的成分即使利用自动生化免疫分析装置进行的各种测定法也不产生干扰,而且血细胞不发生溶血、生物成分即使在37℃下也能稳定地保存。此外,为了测定用缓冲液稀释的血浆中的生物成分,缓冲剂成分不会使这些生物成分发生变性,不对稳定性带来影响。作为其中一例,发现将2-氨基-2-甲基-1-丙醇(amp)与hepes混合并调节至ph7.4的缓冲液不对生物成分给予变性,表现稳定,对这些生物成分的测定试剂也不产生干扰。还发现了对用稀释用缓冲液稀释的生物样品中低浓度钠进行准确定量的方法。本发明将在生物样品中保持恒定浓度的血浆中的钠等用作外标物,这些物质为元素,为稳定的生物成分。通过准确测定作为用缓冲液稀释的外标物钠等来求出血浆的稀释倍数,从而可用市售的自动生化免疫分析装置高效地对采集血液中未知浓度的稀释血浆生物样品成分的定量和酶活性进行多样品分析。即,本发明如下所述。[2-1]一种血液样品中的分析物的定量分析方法,其是用稀释用缓冲液稀释微量血液样品而对分析血液中的分析物进行定量的方法,所述方法包括使用外标物计算血液样品的稀释倍数,其中,外标物是在血液样品中恒定地以规定浓度含有的成分,所述稀释用缓冲液中不含有对外标物的定量产生干扰的成分,所述方法包括对用稀释用缓冲液稀释的血液样品中的外标物浓度进行测定,并根据它们的测定值计算血液样品的稀释倍数。[2-2]一种血液样品中的分析物的定量分析方法,其包括对用稀释用缓冲液稀释的血液样品中的外标物浓度进行测定,并根据它们的测定值计算血液样品的稀释倍数。[2-3]如[2-1]或[2-2]的定量分析方法,其中,外标物选自由钠、氯、白蛋白和总蛋白构成的组。[2-4]如[2-3]的定量分析方法,其中,外标物选自由钠、氯和总蛋白构成的组。[2-5]如[2-1]~[2-4]中任一项所述的定量分析方法,其中,稀释用缓冲液中含有选自由2-氨基-2-甲基-1-丙醇、2-乙基氨基乙醇、n-甲基-d-葡糖胺、二乙醇胺和三乙醇胺的构成的组的氨基醇化合物,以及含有选由于hepes(2-[4-(2-羟乙基)-1-哌嗪基]乙磺酸)、tes(n-三(羟甲基)甲基-2-氨基乙磺酸)、mops(3-吗啉丙磺酸)和bes(n,n-双(2-羟乙基)-2-氨基乙磺酸)构成的组的缓冲剂作为缓冲剂成分,且在ph7.4具有缓冲作用。[2-6]如[2-1]~[2-4]中任一项所述的定量分析方法,其中,稀释用缓冲液实质上不含钠和氯。[2-7]如[2-1]~[2-6]中任一项所述的定量分析方法,其中,微量血液样品的稀释倍数由下述计算式(i)的计算式进行计算,对稀释血浆中的分析物进行定量,乘以用计算式(i)求得的稀释倍数,从而对原血浆中的分析物进行定量:a:血浆中外标物浓度的正常人中位值的吸光度b:稀释血浆中外标物的吸光度x:血浆稀释倍数[其中,稀释血浆是指用稀释用缓冲液稀释血液样品并除去血细胞得到的血浆]。[2-8]如[2-3]~[2-7]中任一项所述的定量分析方法,其利用β-半乳糖苷酶的酶活性随钠离子浓度而变化,从而能够由β-半乳糖苷酶的吸光度变化量对钠离子浓度进行定量,用下述方法测定用稀释用缓冲液稀释的血液样品中的钠:用稀释用缓冲液稀释生物样品,进一步用纯水稀释,以样品量的10~30倍体积量添加含β-半乳糖苷酶的缓冲液即第一试剂,在30~45℃下加温2~20分钟,以第一试剂量的半量添加含邻硝基苯基-β-d-吡喃半乳糖苷的底物溶液即第二试剂,在主波长410nm、副波长658nm处测定反应速度的吸光度。[2-9]一种缓冲液,其是在如[2-1]~[2-8]中任一项所述的定量分析方法中用于稀释微量血液样品的稀释用缓冲液,所述缓冲液含有选自由2-氨基-2-甲基-1-丙醇、2-乙基氨基乙醇、n-甲基-d-葡糖胺、二乙醇胺和三乙醇胺构成的组的氨基醇化合物,以及含有选自由hepes(2-[4-(2-羟乙基)-1-哌嗪基]乙磺酸)、tes(n-三(羟甲基)甲基-2-氨基乙磺酸)、mops(3-吗啉丙磺酸)和bes(n,n-双(2-羟乙基)-2-氨基乙磺酸)构成的组的缓冲剂作为缓冲剂成分,且在ph7.4具有缓冲作用。[2-10]如[2-9]的缓冲液,其实质上不含钠和氯。3.利用内标物和外标物的分析方法(杂交法)如上所述,通过单独利用内标物的分析方法和单独利用外标物的分析方法,能够达到准确地测定微量生物样品中的分析物生物成分。本发明人为了进一步准确地测定,对兼具利用内标物方法的优势与利用外标物方法二者的优势,且对弥补利用内标物方法的缺点与利用外标物方法的缺点的方法进行了深入研究。如上所述,通过使用体内平衡性高的钠、氯、蛋白质作为外标物,且使用不含利用为外标物的物质的缓冲液,能够准确地测定。但是,即使在健康人中具有高平衡性的物质,因受试者也有偏离健康人浓度范围的情况,此时,会影响到准确地测定。另一方面,稀释用缓冲液中的内标物可设定为高浓度,因此能够高精度地测定。但是,生物样品的量少时,内标物的稀释变少,导致稀释倍数的可靠性降低。此外,作为有机化合物的内标物,可利用甘油-3-磷酸为稳定的物质,作为无机物的内标物,适合利用锂。本发明人对能够消除单独使用外标物方法的缺点与能够消除单独使用内标物方法的缺点的方法开发进行了深入研究。本发明人对为了消除现有内标物的缺点而使用稳定性高的碱金属类或属于碱土金属类的元素,作为外标物使用体内平衡性高的钠、氯或蛋白质进行了研究。通过组合内标物与生物样品中的平衡性高的成分的外标物并同时使用,作为测定精度高的定量法,可以成为弥补使用内标物方法和使用外标物的两个定量法缺点且可靠性高的稀释成分定量法,于是完成了本发明。本发明具有如下特征。将生物样品中保持恒定浓度的血浆中的钠等用作外标物,此外使用血浆中完全不含有或者几乎不含有的成分作为内标物即使用不通过血细胞膜的锂等碱金属类或属于碱土金属类的元素、稳定的甘油-3-磷酸作为内标物,将其添加到缓冲液中。将现有的有机化合物用作内标物时,还有受到生物酶作用的保存稳定性的问题。此内标物在缓冲液中长时间稳定,可容易地进行定量。此外测定的生物样品中的外标物的钠也是元素并因此稳定。其结果可以用市售的自动生化免疫分析装置高效地对采集血液中的未知浓度的稀释血浆生物样品成分的定量和酶活性进行多样品分析。即,本发明如下所述。[3-1]一种血液样品中的分析物的定量分析方法,其是用稀释用缓冲液稀释样品而对分析血液中的分析物进行定量的方法,所述方法包括使用内标物和外标物计算血液样品的稀释倍数,其中,内标物以规定浓度添加到稀释用缓冲液中,外标物是在血液样品中恒定地以规定浓度含有的成分,所述稀释用缓冲液中不含有对内标物和外标物的定量产生干扰的成分,所述方法包括对用稀释用缓冲液稀释的血液样品中的内标物浓度与外标物浓度进行测定,并根据它们的测定值计算血液样品的稀释倍数。[3-2]一种定量分析方法,其通过使用所述外标物浓度的测定值对由所述内标物浓度的测定值求得的血液样品的稀释倍数进行校正,从而对所述血液样品中的分析物进行定量分析。[3-3]如[3-1]或[3-2]的定量分析方法,其中,内标物为属于碱金属类或碱土金属类的元素,外标物选自由钠、氯、白蛋白和总蛋白构成的组。[3-4]如[3-3]的定量分析方法,其中,内标物为锂或甘油-3-磷酸,外标物为钠。[3-5]如[3-1]~[3-4]中任一项所述的定量分析方法,其中,稀释用缓冲液中含有选自由2-氨基-2-甲基-1-丙醇、2-乙基氨基乙醇、n-甲基-d-葡糖胺、二乙醇胺和三乙醇胺的构成的组的氨基醇化合物,以及含有选自由hepes(2-[4-(2-羟乙基)-1-哌嗪基]乙磺酸)、tes(n-三(羟甲基)甲基-2-氨基乙磺酸)、mops(3-吗啉丙磺酸)和bes(n,n-双(2-羟乙基)-2-氨基乙磺酸)的构成的组的缓冲剂作为缓冲剂成分,且具有ph6.5~ph8.0的缓冲作用。[3-6]如[3-5]中任一项所述的定量分析方法,其中,稀释用缓冲液实质上不含钠和氯。[3-7]如[3-1]~[3-6]中任一项所述的定量分析方法,其中,微量血液样品的稀释倍数由下述计算式(1)~(4)中任一个计算式进行计算,对稀释血浆中的分析物进行定量,乘以用计算式(1)~(4)中任一个求得的稀释倍数,从而对原血浆中的分析物进行定量:计算式(1)计算式(2)计算式(3)x=a×(b+d)±b(3)其中,a和b为系数,预先获取b+d与稀释倍数的数据,制作以x=a×(b+d)±b表示的标准曲线;以及计算式(4)x=a/b'(4)其中,b'=(a×d)/c,上述各式中,a、b、c、d、b'及x定义如下:a:添加有内标物的缓冲液中内标物的吸光度b:稀释血浆中内标物的吸光度c:血浆中外标物浓度的正常中位值的吸光度d:稀释血浆中外标物的吸光度b':由外标物的吸光度计算出的稀释倍数而得到的稀释血浆中内标物的吸光度校正值x:血浆稀释倍数[其中,稀释血浆是指用稀释用缓冲液稀释血液样品并除去血细胞得到的血浆]。[3-8]如[3-1]~[3-7]的定量分析方法,其利用β-半乳糖苷酶的酶活性随钠离子浓度而变化,从而能够由β-半乳糖苷酶的吸光度变化量对钠离子浓度进行定量,用下述方法对作为用稀释用缓冲液稀释的血液样品中外标之一的钠进行测定:用稀释用缓冲液稀释生物样品,进一步用纯水稀释,以稀释样品量的10~30倍体积量添加含β-半乳糖苷酶的缓冲液即第一试剂,在30~45℃下加温2~20分钟,以第一试剂量的半量添加含邻硝基苯基-β-d-吡喃半乳糖苷的底物溶液即第二试剂,在主波长410nm、副波长658nm处测定生成的邻硝基苯酚的吸光度。[3-9]一种缓冲液,其是在[3-1]~[3-8]的定量分析方法中用于稀释微量血液样品的稀释用缓冲液,所述缓冲液含有选自由2-氨基-2-甲基-1-丙醇、2-乙基氨基乙醇、n-甲基-d-葡糖胺、二乙醇胺和三乙醇胺的构成的组的氨基醇化合物,以及含有选自由hepes(2-[4-(2-羟乙基)-1-哌嗪基]乙磺酸)、tes(n-三(羟甲基)甲基-2-氨基乙磺酸)、mops(3-吗啉丙磺酸)和bes(n,n-双(2-羟乙基)-2-氨基乙磺酸)的构成的组的缓冲剂作为缓冲剂成分,且在ph7.4具有缓冲作用。[3-10]如[3-9]的缓冲液,其实质上不含钠和氯。[3-11]如[3-9]或[3-10]的缓冲液,其用于使用外标物的定量分析方法中。[3-12]如[3-9]或[3-10]的缓冲液,其用于使用内标物的定量分析方法中。发明效果生物样品中的分析物生物样品成分的分析中,通过利用内标物或外标物求出生物样品的稀释倍数来对成分进行定量分析,而不是对微量生物样品成分的生物样品样本量进行测定,从而能够对生物样品成分准确地进行分析测定。此外,根据本发明,对于经手指等从体内采集的微量且未知量的全血样品等生物样品的血浆和生物样品中的任意成分,均可以使用塑料容器简单且准确地进行定量。此外,通过由血浆稀释率和全血稀释率进行计算,可求出作为血液的贫血程度的血细胞容积比(血细胞比容值)。进一步通过用全血的内标物,能够进行血细胞成分(白细胞数:wbc、红细胞数:rbc、血红蛋白量:hgb、血细胞比容:hct)的推算。进一步,以单独内标物或单独外标物使用时,在定量的精度或准确性上有缺陷。本发明中,由于同时使用内标物和外标物这二者来求出生物样品的稀释倍数,因此由内标物求得的稀释倍数通过由外标物求得的稀释倍数进行校正,成为更准确的值,能够以更高的精度对分析物进行定量。此外,之前由于不存在有在ph7.4中性附近有缓冲能力且不含钠或氯的缓冲液,因此不能将作为生物中平衡性高的物质的钠或氯用作外标物。本发明的方法中新开发出通过使用在ph7.4中性附近具有缓冲能力且不含钠或氯的缓冲液,可以将平衡性高的钠或氯用作外标物,从而能够进行更高的精度与准确性高的分析。通过本发明的方法,可以使用微量血液(65μl)进行生化检测13项、肿瘤标志物、肝炎检查等很多检查。该检查方法由于不受时间与场地限制能够发现未能接受健康检查的出现症状前的情况。此外,由于可轻松地进行检查所以能够容易地进行健康管理,因此可在疾病严重化前捕捉到体内的变化,也有助于节省国民医疗费用。附图说明图1是表示本发明的生物样品成分的分析方法中使用的血液组成的示意图。图2是表示本发明的生物样品成分的分析方法中用规定缓冲液稀释血液后状态的示意图。此时,图2中表示使用未透过血液的血细胞膜而只渗透到血浆中的内标物时的说明图。图3是表示本发明的生物样品成分的分析方法中用规定缓冲液稀释血液后状态的示意图。图3是内标物为具有渗透到血液的血浆和血细胞内部这二者的性质时的说明图。图4是静脉血血浆与手指采血稀释血浆的生化检测的相关图。图5是将静脉采血的添加edta-2na全血与用血液稀释缓冲液稀释该全血的稀释全血分别作为样品对白细胞(wbc)、红细胞(rbc)、血红蛋白浓度(hgb)、血细胞比容值(hct)、血小板数(plt)进行推算的相关图。图6是用由麦芽糖内标求得的血浆稀释率和由乙醇胺求得的全血稀释率,由计算式求得的血液中的血细胞体积所表示的血细胞比容值与对全血用血细胞计数器求得的血细胞比容值的相关图。图7是表示钠的酶法测定的线性图。图8是表示氯测定法的线性图。图9是表示锂浓度与吸光度的线性图。图10-1是由杂交法的稀释血浆测定值与原血浆测定值的相关图(总蛋白和白蛋白)。图10-2是由杂交法的稀释血浆测定值与原血浆测定值的相关图(ast和alt)。图10-3是由杂交法的稀释血浆测定值与原血浆测定值的相关图(hdl-胆固醇和γgtp)。图10-4是由杂交法的稀释血浆测定值与原血浆测定值的相关图(总胆固醇和甘油三酯)。图10-5是由杂交法的稀释血浆测定值与原血浆测定值的相关图(尿素氮和肌酸酐)。图10-6是由杂交法的稀释血浆测定值与原血浆测定值的相关图(尿酸和血糖)。具体实施方式1.利用内标物的分析法(内标法)本发明具有以下特征。即,根据本发明的一个特征,是对含有采集的未知浓度血细胞的生物样品成分进行定量和酶活性分析的方法,准备作为生物样品中完全不含有或者几乎不含有的成分的不通过血细胞膜的内标物,将其添加到缓冲液中。在添加血液前对缓冲液中的内标物浓度进行分析,对其吸光度与在添加血液后稀释的缓冲液中的内标物浓度进行测定,由此由其吸光度比例求出血液中的血浆稀释率,从而求出原血浆中的生物成分或酶活性。此时,所述缓冲液的渗透压优选配制为基本为血液渗透压。本发明的方法在求出血浆稀释倍率时,无需求出生物样品的样本量。使用内标物的方法称为内标法,例如,将锂用作内标物的方法称为锂(li)内标法。上述未知浓度的生物样品也可以是不含血细胞的生物样品(唾液、尿等)。用于这种情况的内标物,也可以是透过血细胞膜的物质。作为测定缓冲液中内标物浓度的代表性方法,有酶法测定方法,该方法是向作为底物的该内标物或由内标物衍生的物质加入氧化酶,由此生成过氧化氢,在过氧化物酶存在下,trinder试剂与4-氨基安替比林氧化缩合而得到的醌类色素或nad(p)h、四氮唑盐的显色,对其进行测定并定量为吸光度。作为其他的内标物定量方法,有直接测定内标物本身的吸光度的方法、通过使用针对内标物的抗体和标记抗体的吸光度或者化学发光进行测定的方法、色谱法等,可根据所使用内标物的定量方法来得到。为了求出用缓冲液稀释血液后的血浆成分准确的稀释率,需要加入缓冲液中的内标物是不存在于生物内、或以极微量存在的成分,而且不透过血细胞膜、在缓冲液中稳定、不吸附到容器上。此外,也需要对其他生物成分不产生干扰。如图1所示,已知血液1由液体成分的血浆或血清2、与固体成分的血细胞3构成,而且血细胞3具有血细胞膜等固体成分与在其内侧有液体成分。通过向血液1中加入抗凝剂edta-二钠可阻止血细胞3的凝固。如果对该全血进行离心则比重高的血细胞3沉降到最下层,分离上清为血浆。此外,如图2所示,预先在容器内向缓冲液4中加入不透过血细胞膜内标物5(图2(a)),从容器上部将采集的血液1引入到缓冲液4与内标物5的混合层上侧(图2(b))。于是在用规定缓冲液4稀释血液1后时,原本存在于血浆或血清2中的不透过血细胞膜的成分分布到缓冲液4和血浆或血清2中,成为稀释的血液稀释溶液6(图2(c))。此时,缓冲液4中不透过血细胞膜的内标物5按规定量溶解时,原本存在于缓冲液中的该内标物5分布到缓冲液4和血浆或血清2中且被稀释。只渗透到血浆2中的麦芽糖等被包含作为内标物5。由于麦芽糖作为阴离子溶解在缓冲液4中,因此溶解在血浆2中,未渗透到血细胞3内。作为为求出血浆成分稀释率而可添加到缓冲液中的内标物是分子量在500以下的化学物质且在分子内具有硫酸根离子(-so3-)、羧酸根离子(-coo-)、硫醇基(-sh)、季胺(-nh3+)等取代基的化合物,选自由麦芽糖等二糖、谷氨酸、亮氨酸、缬氨酸、异亮氨酸、4-羟基苯、羟基丁酸、肌酸、苹果酸、金属类(锂、钠、钾、氯)、在分子内具有硫酸基的trinder试剂构成的组。该trinder试剂为(n-乙基-n-(2-羟基-3-磺丙基)-3-甲氧基苯胺)、adps(n-乙基-n-磺丙基-3-甲氧基苯胺)、alps(n-乙基-n-磺丙基苯胺)、daos(n-乙基-n-(2-羟基-3-磺丙基)-3,5-二甲氧基苯胺)、hdaos(n-(2-羟基-3-磺丙基)-3,5-二甲氧基苯胺)、maos(n-乙基-n-(2-羟基-3-磺丙基)-3,5-二甲基苯胺)、toos(n-乙基-n-(2-羟基-3-磺丙基)-3-甲氧基苯胺)和tops(n-乙基-n-磺丙基-3-甲基苯胺)。其中优选锂。图3中表示内标物5在全血(血浆2+血细胞3)中分布的说明图。如图3所示的内标物5(例如,乙醇胺)渗透到血浆2与血细胞3内这两者。预先在容器内向缓冲液4装入透过血细胞膜内标物5(图3(a)),从容器上部将采集的血液1引入到缓冲液4与内标物5的混合层上侧(图3(b))。于是,当用规定缓冲液4稀释血液1后,原本存在于血浆或血清2中的透过血细胞膜内标物存在于血细胞3和血浆或血清2中这二者,均匀分散在血浆或血清2中而构成血液稀释溶液6(图3(c))。即,如图3所示时所使用的内标物5因为分布到血浆2与血细胞3内这两者,所以可求出缓冲液4的稀释倍数。作为透过血细胞膜的内标物是分子量在500以下的化学物质且具有氨基(-nh2)、烷基(-ch3、-c6h6)、酯基(-coor)、烷氧基(-or)、卤素(-cl,-br,-i)等疏水性取代基的化合物,可举出:乙醇胺、己胺、苯乙胺、戊胺、组胺、腐胺、次黄嘌呤、色氨酸、孕烯醇酮、β-谷甾醇等。与这些内标相对应地可利用氧化酶的酶法测定进行分析。这些内标物由于分布在血细胞内与血浆内,因此可利用来求出全血(血浆+血细胞)的稀释倍数。稀释生物成分的缓冲液4可以任意的量与生物样品混合,需要能够稳定地保存生物样品中的被测成分。缓冲液4的成分并不进行限定,可举出:具有缓冲能力的hepes{2-[4-(2-羟乙基)-1-哌嗪基]乙磺酸}缓冲液、aces[n-(2-乙酰胺)-2-氨基乙磺酸]缓冲液、ada[n-(2-乙酰胺)亚氨基二乙酸]缓冲液、bes[n,n-双(2-羟乙基)-2-氨基磺酸]缓冲液、bicine[n,n-双(2-羟乙基)甘氨酸]缓冲液、bis-tris[双(2-羟乙基)亚氨基三(羟甲基)甲烷]缓冲液、caps(n-环己基-3-氨基丙磺酸)缓冲液、capso(n-环己基-2-羟基-3-氨基丙磺酸)缓冲液、ches(n-环己基-2-氨基乙磺酸)缓冲液、dipso{3-[n,n-双(2-羟乙基)氨基]-2-羟基丙磺酸}缓冲液、epps{3-[4-(2-羟乙基)-1-哌嗪基]丙磺酸}缓冲液、heppso{2-羟基-3-[4-(2-羟乙基)-1-哌嗪基]丙磺酸一水合物}缓冲液、mes(2-吗啉乙磺酸一水合物)缓冲液、mops(3-吗啉丙磺酸)缓冲液、mopso(2-羟基-3-吗啉丙磺酸)缓冲液、pipes[哌嗪-1,4-双(2-乙磺酸)]缓冲液、popso[哌嗪-1,4-双(2-羟基-3-丙磺酸)二水合物]缓冲液、taps[n-三(羟甲基)甲基-3-氨基丙磺酸]缓冲液、tapso[2-羟基-n-三(羟甲基)甲基-3-氨基磺酸]缓冲液、tes[n-三(羟甲基)甲基-2-氨基乙磺酸]缓冲液、tricine{n-[三(羟甲基)甲基]甘氨酸}缓冲液、乙酸缓冲液、磷酸缓冲液、柠檬酸缓冲液、硼酸缓冲液、酒石酸缓冲液、磷酸缓冲液生理盐水等,其浓度并没有进行特别限定,优选0.1~1000mmol/l,特别优选10~500mmol/l。缓冲液的ph值并没有进行特别限定,从稀释的生物样品稳定性方面考虑,希望在生物样品原来的ph值附近,血液、血浆或血清时,优选ph值为6~8。为了在稀释缓冲液中稳定保持被测成分,也可含有螯合剂、抗菌剂、防腐剂、辅酶、糖类、抑制剂等。作为螯合剂的一例,可举出:乙二胺四乙酸盐、柠檬酸盐、草酸盐等。作为抗菌剂或防腐剂的一例,可举出:硫酸阿米卡星盐、硫酸卡那霉素盐、噻苯咪唑、叠氮化钠等。作为辅酶的一例,可举出:磷酸吡哆醛、镁、锌等。作为糖类的一例,可举出:甘露醇、右旋糖、寡糖等。作为抑制剂的一例,可举出:十二烷基硫酸钠、汞、肝素等。稳定剂可根据被测成分以多种组合进行添加。用缓冲液稀释血液、血浆或血清,将ast(天冬氨酸转氨酶)和alt(谷丙转氨酶)作为被测成分时,优选缓冲液中含有乙二胺四乙酸盐和磷酸吡哆醛。此时的缓冲液中希望含有乙二胺四乙酸盐为0.1~5.0mmol/l、磷酸吡哆醛为0.01~0.20mmol/l,特别是优选含有乙二胺四乙酸0.5~3.0mmol/l、磷酸吡哆醛0.02~0.10mmol/l。加入到缓冲液的内标物要求如下:在生物内不存在或极微量、不对生物成分产生干扰、在缓冲液内稳定、不吸附到保存容器上、可利用能高精度测定的检测系统等。此外,在稀释血液时,需要不发生血细胞溶血的渗透压,优选250~500mosm/kg的渗透压。表1示出了作为缓冲液的一例,含有如下成分的缓冲液的组成:不透过血细胞膜内标物之一的肌氨酸和透过血细胞膜内标物之一的乙醇胺。[表1]含有麦芽糖、乙醇胺的缓冲液组成物质名称浓度hepes100mm麦芽糖3.87mm乙醇胺4.37mm氯化钠154mmedta-2na1.34mm磷酸吡哆醛0.03mm阿米卡星0.0012%ph7.4其中,hepes为n-2-羟乙基哌嗪-n’-2-乙磺酸。不通过血细胞膜内标物之一的肌氨酸的测定试剂如表2所示。[表2]麦芽糖测定试剂其中,toos为n-乙基-n-(2-羟基-3-磺丙基)-3-甲基苯胺钠二水合物。麦芽糖的测定方法步骤如下所示。麦芽糖测定时,使用上述的r1和r2。1.混合7.0μl的混合生物样品和90μl的r1,37℃下放置5分钟。2.在545/658nm波长处测定吸光度。――a1(吸光度)3.混合30μl的r2,37℃下放置5分钟。4.在545/658nm波长处测定吸光度。――a2(吸光度)吸光度可以表示为测定值之差。因此,一般而言吸光度可得到为δa=a2-a1。通过血细胞膜内标物之一的乙醇胺的测定试剂如表3所示。[表3]乙醇胺测定试剂其中,daos为n-乙基-n(2-羟基-3-磺丙基)-3,5-二甲基苯胺钠盐。乙醇胺的测定方法步骤如下所示。乙醇胺测定时,使用上述的r1和r2。1.混合11μl的混合生物样品和90μl的r1,37℃下放置5分钟。2.在596/805nm波长处测定吸光度。――a3(吸光度)3.混合45μl的r2,37℃下放置5分钟。4.在546/884nm波长处测定吸光度。――a4(吸光度)吸光度可以表示为测定值之差。因此,一般而言吸光度可得到为δa=a4-a3。已知吸光度与浓度的关系由朗伯比尔(lambert-beer)定律表示为a=ε×c×l。其中,a(吸光度)、ε(摩尔吸光系数)、c(溶液的摩尔浓度)、l(光程长)。吸光度(a)与溶液的摩尔浓度(c)呈正比例关系,通过使用测定已知浓度的溶解溶质的溶液而得到的标准曲线,一般而言可计算未知样品中溶质的浓度。如图1所示,已知血液1由液体成分的血浆2或者血清、与固体成分的血细胞3构成,进一步血细胞具有血细胞膜等固体成分与在其内侧的液体成分。血液通过加入抗凝剂的edta-二钠可阻止血细胞凝固。如果离心该全血则比重较大的血细胞沉降到最下层,上清中为分离出的血浆。此外,如图2所示,用规定缓冲液4稀释血液1时,原本存在于血浆2或血清中的不透过血细胞膜的成分,分布到缓冲液4和血浆2、或者血清中,由此被稀释。此时,不透过血细胞膜的内标物5以规定量溶解到缓冲液4中时,原本存在于缓冲液中的内标物,分布到缓冲液和血浆或血清中,由此被稀释。该内标表示为只渗透到血浆中的麦芽糖等内标。由于麦芽糖在缓冲液溶解为阴离子,因此溶解于血浆中,并不渗透到血细胞内。即,缓冲液4中的不透过血细胞膜的内标物5的初始浓度(c0)由添加血液而向浓度(c1)变化。通过此c0和c1而计算出血浆或血清的稀释率(r1)=c0/(c0-c1)。将缓冲液量作为v0、将血浆或血清添加到缓冲液的总量作为v1。其中,原本存在于血浆或血清中的不透过血细胞膜的成分的稀释率,因为与血浆2或血清的稀释率相等,因此由r1=(v0+v1)/v1=c0/(c0-c1)而计算出。用规定缓冲液4稀释血液1时,透过血细胞膜的成分分布到缓冲液和血浆或血清和血细胞中,因此被稀释。此时,透过血细胞膜的内标物以规定量溶解到缓冲液中时,原本存在于缓冲液中的内标物分布到缓冲液和血浆或血清和血细胞中,由此被稀释。如果作为血细胞膜体积(v2)、血细胞内体积(v3),则即缓冲液中的透过血细胞膜的内标物的初始浓度(c2)由添加血液而向浓度(c3)变化。由该c2和c3可计算血液整体的稀释率(r2)=(v0+v1+v2+v3)/(v1+v2+v3)=c2/(c2-c3)。其中,原本存在于血浆或血清和血细胞液体中的透过血细胞膜的成分的稀释率,因为与血液整体的稀释率相等,因此由r2=(v0+v1+v2+v3)/(v1+v2+v3)=c2/(c2-c3)而计算出。上述在下面表4中所示的情形下均可利用。[表4]进一步,用含有不透过血细胞膜的内标物的溶液稀释生物样品时,如果含有内标物的溶液容量(v0)为规定量,则可由不透过血细胞膜的内标物计算出的不透过血细胞膜的生物样品成分的稀释率(r1)计算不透过血细胞膜的生物样品的容量(v1)。即,可由v1=v0/(r1-1)计算。此外,用含有透过血细胞膜的内标物5的溶液稀释生物样品时,如果含有内标物的溶液容量(v0)为定量,则可由透过血细胞膜的内标物计算出的血液的稀释率(r2)计算血液的容量(v1+v2+v3)。即,可由v1+v2+v3=v0/(r2-1)计算。用含有不透过血细胞膜的内标物与透过血细胞膜的内标物的溶液稀释生物样品时,可通过由v0与r1求得的v1、由v0与r2求得的v1+v2+v3的两式,计算v2+v3=(v1+v2+v3)-v1=v0/(r2-1)-v0/(r1-1)。另外,已知血细胞由65%的液体和35%的固体构成。根据v2/(v2+v3)=0.65v2=0.65×{v0/(r2-1)-v0/(r1-1)}v3=0.35×v2/0.65v3=0.35×{v0/(r2-1)-v0/(r1-1)}因此,用含有不透过血细胞膜的内标物的溶液、含有透过血细胞膜的内标物的溶液、或者含有不透过血细胞膜的内标物与透过血细胞膜的内标物的溶液稀释生物样品时,由v0、r1、r2可计算v1、v2、v3。进一步,通过对v0、r1、r2、v1、v2、v3进行组合,可计算:血浆或血清的量(v1)血浆或血清的稀释率(r1)血浆或血清和血细胞液体的量(v1+v2)血液整体的稀释率(r2)血液量(v1+v2+v3)血液的稀释率{(v0+v1+v2+v3)/(v1+v2+v3)}血细胞量(v2+v3)血细胞的稀释率{(v0+v2+v3)/(v2+v3)}血细胞液体的量(v2)血细胞液体的稀释率{(v0+v2)/v2}血细胞固体的量(v3)血细胞固体的稀释率{(v0+v3)/v3}血细胞比容值(%){(v2+v3)/(v1+v2+v3)×100(%)}或1-(血液稀释率-1)/(血浆稀释率-1)缓冲液的量(v0)缓冲液相对于血浆或血清的稀释率{(v0+v1)/v0}缓冲液相对于血浆或血清和血细胞液体的稀释率{(v0+v1+v2)/v0}缓冲液相对于血液的稀释率{(v0+v1+v2+v3)/v0}缓冲液相对于血细胞液体的稀释率{(v0+v2)/v0}缓冲液相对于血细胞固体的稀释率{(v0+v3)/v0}缓冲液相对于血细胞的稀释率{(v0+v2+v3)/v0}等。可通过将v0、r1、r2、v1、v2、v3单独或组合而计算而得的项目并不限定于上述的举例。2.利用外标物的分析法(外标法)本发明是在用缓冲液稀释血液等生物样品后对生物样品中应该定量的分析物进行定量的方法,其特征在于,用生物样品成分的外标物求出生物样品的稀释倍数,由该稀释倍数对生物样品中的分析物进行定量。本发明的方法中在求出生物样品的稀释倍率时,不必求出生物样品的样本量。使用外标物的方法称为外标法,例如,将钠用作外标物的方法称为钠(na)外标法。使用生物成分中含有的恒定成分的外标物求出稀释倍数。本发明中作为分析对象的生物样品,可举出:血液、血清、血浆、尿、唾液、淋巴液、脊髓液、间质液、汗等生物样品,其中优选血液、血清、血浆。特别是本发明的优选方式中、从受试者采集微量血液,用缓冲液稀释后,通过过滤器或离心分离将血细胞进行分离,使用得到的血浆或血清对分析物进行测定。此外,本发明由于使用稀释用缓冲液稀释生物样品,因此生物样品为微量即可。特别是生物样品为血液时,可使用200μl以下的微量血液样品对分析物进行测定。生物样品的来源并不限定于人类,也可以是动物类、鱼类、鸟类等。例如,作为动物类,可举出:马、牛、猪、绵羊、山羊、狗、猫、小鼠、熊、熊猫等。作为分析对象的生物样品成分并不受限定,生物样品中含有的所有物质均作为分析对象。例如,可举出:用于临床诊断的血液中的生化检测项目、肿瘤标志物或肝炎标志物等各种疾病的标志物等,可举出:蛋白质、糖、脂质、低分子化合物等。此外,测定不仅是物质的浓度,具有酶等活性的物质的活性也是测定对象。各分析物的测定可以用公知的方法进行。外标物包含在生物样品中为高平衡性的物质,即,是生物样品中浓度的生理性变动小的物质,进一步优选在人类个体间生物样品中浓度之差小的物质。作为这样的物质,可举出:钠(na+)、氯(cl-)、蛋白质。作为蛋白质,例如可举出血液中含有的高平衡性的白蛋白或血清中总蛋白等。其中,特别优选平衡性高且个体间变动小的钠。人类血浆中的钠浓度的正常值、即健康人的血浆中的钠浓度约为135~145mmol/l(meq/l),中位值约为142mmol/l。95%的受试者中血浆中钠浓度包含在正常范围内。2.5%的受试者中为低于该值的低浓度,2.5%的受试者中为高于该值的高浓度。由用缓冲液稀释后的外标物浓度与健康人的血浆中钠浓度的平均值可以求出用作样本的生物样品的稀释倍数。此外,作为生物样品,在使用除了血液、血清、血浆以外的生物样品时,可以由各生物样品中的钠浓度的中位值求出稀释倍数。作为外标物,由于使用生物样品中含有的物质,因此作为稀释生物样品的缓冲液,需要使用不含有外标物、或者即使含有外标物也在稀释生物样品后的混合物中以不对外标物测定产生影响程度的极微量的浓度含有的缓冲液。此外,需要使用不含有对外标物测定有妨碍的物质、或者即使含有也在稀释生物样品后的稀释溶液中以不对外标物测定产生影响程度的极微量的浓度含有的缓冲液。将不含有这些物质、或者即使含有也在稀释生物样品后的混合物中以不对外标物测定产生影响程度的极微量的浓度含有的缓冲液称为实质上不含所述物质的缓冲液。例如,本发明的方法中使用的稀释用缓冲液中的钠浓度为100nmol/l以下。例如,作为外标物,使用钠或氯时,需要生物样品的稀释用缓冲液中不含钠或氯、或者即使含有也为极微量。进一步,由于钠对属于碱金属类的元素或属于碱土金属类的元素的定量产生影响,因此需要生物样品的稀释用缓冲液中不含钠、或者即使含有也为极微量。此外,为了测定生物样品中的目标分析物,并为了防止目标分析物的分解或变性,生物样品的稀释用缓冲液需要接近于生物样品的ph,为ph6.5~ph8.0的缓冲液,优选ph7.0~ph7.5,进一步优选ph7.4。进一步在本发明中,为了测定用缓冲液稀释的血液中的生物成分,缓冲液成分不能对这些待测定的生物成分的变性或稳定性产生影响。由于之前不存在在ph7.4前后具有缓冲能力且不含钠或氯的缓冲液,因此不能将钠或氯用作外标物。本发明中,新开发出在ph7.4前后具有缓冲能力且不含钠或氯的缓冲液,能够将钠或氯用作外标物。可举出将作为这样的不含钠、氯、碱金属类元素和碱土金属类元素的碱性物质,有2-氨基-2-甲基-1-丙醇(amp)、2-乙基氨基乙醇、n-甲基-d-葡糖胺、二乙醇胺、三乙醇胺等氨基醇化合物类与作为呈酸性的化合物的good's缓冲液(两性离子缓冲液),即pka为ph7.4附近的缓冲液的hepes(2-[4-(2-羟乙基)-1-哌嗪基]乙磺酸)(pka=7.55)、tes(n-三(羟甲基)甲基-2-氨基乙磺酸)(pka=7.50)、mops(3-吗啉丙磺酸)(pka=7.20)或bes(n,n-双(2-羟乙基)-2-氨基乙磺酸)(pka=7.15)进行组合并混合的缓冲液。其中,优选2-氨基-2-甲基-1-丙醇(amp)与hepes、tes、mops或bes的组合,进一步优选2-氨基-2-甲基-1-丙醇(amp)与hepes的组合。为了制备上述缓冲液,氨基醇与good's缓冲液的浓度比为1:2~2:1,优选以1:1.5~1.5:1、进一步优选以1:1的浓度比进行混合即可。缓冲液的浓度并不进行限定,氨基醇或good's缓冲液的浓度为0.1~1000mm/l,优选1~500mm/l,进一步优选10~100mm/l。缓冲液中为了保持分析物稳定,也可以含有螯合剂、表面活性剂、抗菌剂、防腐剂、辅酶、糖类、抑制剂等。作为螯合剂,可举出:乙二胺四乙酸盐(edta)、柠檬酸盐、草酸盐等。作为表面活性剂,例如可举出:阳离子表面活性剂、阴离子表面活性剂、两性表面活性剂或非离子表面活性剂。作为防腐剂,例如可举出:叠氮化钠或抗生素等。作为辅酶,可举出:磷酸吡哆醛、镁、锌等。作为糖类,可举出:甘露醇、右旋糖、寡糖等。作为抑制剂,可举出:十二烷基硫酸钠、汞、肝素等。特别是通过添加甘露醇与磷酸吡哆醛可以使血细胞膜或酶稳定,通过添加3~4种的抗生素或抗菌剂,可以在手指采血时抑制从手指表面混入的一部分细菌的增殖,能够稳定由细菌引起的生物成分的分解。在生物样品中使用全血时,由于稀释的血液中的血细胞成分需要经过滤器进行过滤,因此缓冲液的渗透压使用与血液同等(285mosm/kg)或其以上的渗透压,可防止血细胞的溶血。渗透压可通过对待测定的生物成分定量不产生影响的盐类、糖类等、缓冲液等调节至等渗。本发明也包含由本发明的方法为了使用生物样品的稀释倍数而使用的上述缓冲液。也可以利用公知的方法测定外标物的氯(cl-)、蛋白质。例如,氯有测定吸光度的方法,这是因为淀粉酶通过氯离子活化,因此可由其反应速度进行测定。蛋白质可通过缩二脲法、考马斯亮蓝法(bradford法)、lowry法等进行测定。白蛋白的测定可通过色素法的溴甲酚绿法(bcg法)进行测定。用缓冲液稀释的测定用作外标的生物样品中钠的方法有火焰光度计、原子吸收光谱法、离子选择电极法等。本发明中作为生物样品使用血液时,从手指采集微量血液并用缓冲液稀释的样品仅为150μl左右,由于测定生化成分、免疫检查项目为10项以上,因此需要使用数μl微量的样品测定外标物的钠。此外,由于需要分析大量的样品,因此需要能适用于市售的自动生化免疫分析装置。钠测定中,通过钠离子而使酶半乳糖苷酶的酶活性活化。由此,本发明中,作为钠测定法,开发出使用用数μl缓冲液稀释的非常低浓度钠(24mmol/l以下)样品进行测定的酶法测定。该酶法测定中,稀释的生物样品的微量钠测定利用通过钠活化β-半乳糖苷酶,并利用用缓冲液稀释的样品的钠浓度与半乳糖苷酶活性呈正比例关系进行测定。该方法可适用于自动生化免疫分析装置,在用于钠测定而不需要其他测定仪器的方面具有高效性且经济性。所述钠测定法中,用稀释用缓冲液稀释血液等生物样品,进一步用纯水稀释,以稀释样品的10~30倍体积量添加含β-半乳糖苷酶缓冲液即第一试剂,30~45℃下加温2~20分,以第一试剂的半量添加含有邻硝基苯基-β-d-吡喃半乳糖苷的底物溶液即第二试剂,在主波长410nm、副波长658nm处测定吸光度。更详细地,用稀释用缓冲液稀释血液等生物样品,进一步用纯水稀释至5倍程度,向稀释的生物样品与缓冲液混合物1~10μl,优选3μl中添加作为第一试剂的含β-半乳糖苷酶缓冲液30~100μl,优选为52μl,使含β-半乳糖苷酶缓冲液和稀释的生物样品与缓冲液混合物的容积比为10~30,优选为15~25。接着,30~45℃下、优选37℃下加温2~20分、优选加温5分,接着添加作为第二试剂的含邻硝基苯基-β-d-吡喃半乳糖苷底物溶液25μl。然后,可以通过在主波长410nm、副波长658nm处测定吸光度对钠浓度进行测定。求出本发明的生物样品的稀释倍数的方法希望按照如下的方式。将生物样品10~200μl添加到缓冲液50~500μl中并混合。此时,缓冲液的容积优选为生物样品容积的3~4倍以上。例如,生物样品为血液时,将微量血液样品65μl添加到缓冲液280μl中并混合。生物样品为血液时,在稀释后除去红细胞、白细胞等血细胞。血细胞可利用过滤器除去,也可以用离心分离除去稀释血液样品。用除去血细胞的稀释血浆样品对分析物进行测定。将微量血液样品65μl添加到缓冲液280μl中时,由于血液样品65μl含有约30μl的血浆,因此血浆被稀释至约10倍。作为生物样品使用血液时,如果血液与稀释用缓冲液按照如下混合即可:换算为血浆,血浆被稀释至5~20倍、优选为5~16倍、进一步优选为5~10倍、特别是优选为8~10倍左右。另外,同时测定稀释血浆样品中的外标物浓度。由外标物浓度求出血液的稀释倍数,可通过稀释血浆样品的分析物的测定值乘以稀释倍数计算血液中的分析物浓度。作为生物样品使用血液时,用稀释用缓冲液稀释血液后,因为除去血细胞,所以留下的样品为血浆,将其称为稀释血浆。因此,此时称为求出血浆的稀释倍数。血浆的稀释倍数可通过用外标物利用计算式(i)的下述计算方法而求出。在如下说明的方法中,用稀释用缓冲液稀释血液,使用用过滤器过滤而得到的血浆样品。计算方法1:a:血浆中外标物浓度的正常中位值的吸光度、b:稀释血浆中的外标物的吸光度、x:血浆稀释倍数作为外标物使用钠时,求出钠的吸光度即可。作为血浆中钠浓度的正常中位值的吸光度,使用钠142mmol/l的吸光度即可。3.利用内标物和外标物的测定法(杂交法)本发明是在用缓冲液稀释血液等生物样品后对生物样品中应该定量的分析物进行定量的方法,其特征在于,使用内标物和外标物求出生物样品的稀释倍数,由该稀释倍数对生物样品中的分析物进行定量。本发明的方法在求出生物样品的稀释倍率时,不需要求出生物样品的样本量。同时使用内标物和外标物求出稀释倍数,外标物对由内标物的稀释倍数进行校正,用于准确地求出稀释倍数。使用内标物和外标物二者求出本发明的生物样品的稀释倍数的方法,因此也称为杂交法。在只使用内标物求出生物样品的稀释倍数时,由于用添加有内标物的稀释用缓冲液对生物样品进行稀释,因此生物样品的量少时,稀释倍数会过大,导致由内标物浓度求得的稀释倍数可靠性降低。本发明的杂交法中,对于使用这样的内标物的方法的缺点可通过使用外标物进行弥补。此外,如后述,有时生物样品中含有用作内标物的物质,使原本生物样品中具有的外标物的浓度的正常值发生偏离。即使在这样的情况下,杂交法可以弥补各自方法的缺点,求出准确得稀释倍数。作为本发明的分析对象的生物样品,可使用上述“2.利用外标物的分析法(外标法)”中记载的生物样品,生物样品的来源也如上述2(外标法)所示。分析对象生物样品成分也将上述2(外标法)中记载的分析对象生物样品成分作为对象。内标物添加到用于生物样品稀释的缓冲液中达到规定浓度而使用。作为内标物,使用如下物质:生物样品中完全不含有、或者即使含有也为极微量的物质、不对生物样品中分析物的测定产生干扰的物质、受到生物样品中生物酶的作用不发生分解的物质、缓冲液中稳定的物质、不透过血细胞膜且血细胞中不含有的物质、不吸附到缓冲液的保存容器上的物质、可利用能高精度测定的检测系统的物质。作为这样的物质,可举出上述“1.利用内标物的分析法(内标法)”中记载的物质,其中优选即使在以添加到缓冲液中的状态下长时间保存也稳定的属于碱金属或碱土金属的元素且在天然的生物样品中不含有的物质。作为属于碱金属的元素,可举出:li(锂)、rb(铷)、cs(铯)、fr(钫),作为属于碱土金属的元素,可举出:sr(锶)、ba(钡)、ra(镭),其中优选li。另外,也可以使用日本特开2003-161729号公报中记载的甘油-3-磷酸。向用于稀释内标物的生物样品的缓冲液的添加浓度,如果是稀释后可测定内标物浓度的浓度则没有限定。例如,如果以0.1~1000mm/l、优选以0.1~100mm/l、进一步优选以0.5~10mm/l的浓度添加就可以。例如,将锂用作内标物时,向用于稀释生物样品的缓冲液中以上述浓度添加锂就可以。由用缓冲液稀释后的生物样品稀释液中的内标物浓度与添加到用于稀释的缓冲液中的内标物浓度,可以求出用作样本的生物样品的稀释倍数。向含有内标物的缓冲液中添加样品时的样品稀释倍数的范围并没有限定,为5~20倍、优选5~15倍。外标物为含有在生物样品中,平衡性高的物质,即生物样品中浓度的生理性变动小的物质,进一步优选人类个体间生物样品中浓度差小的物质。作为这样的物质,可举出:钠(na+)、氯(cl-)、蛋白质。作为蛋白质,例如可举出血液中含有的平衡性高的白蛋白或血清中总蛋白等。其中,特别优选平衡性高且个体间变动小的钠。人类血浆中的钠浓度的正常值,即健康人血浆中的钠浓度约为135~145mmol/l(meq/l),正常中位值约为142mmol/l。95%的受试者中血浆中钠浓度包含在正常范围内。2.5%的受试者中为低于正常范围的低浓度,2.5%的受试者中为高于正常范围的高浓度。由用缓冲液稀释后的外标物浓度与健康人血浆中钠浓度的平均值,可求出用作样本的生物样品的稀释倍数。此外,作为生物样品,使用除了血液、血清、血浆以外的生物样品时,由各生物样品中的钠浓度的中位值可求出稀释倍数。由用缓冲液稀释后的生物样品中的内标物浓度与添加到用于稀释的缓冲液中的内标物浓度,可求出用作样本的生物样品的稀释倍数,进一步,使用稀释后的生物样品中的外标物浓度与生物样品中含有的外标物浓度,通过对由内标物浓度计算出的稀释倍数进行校正,可求出更准确的稀释倍数。作为外标物,由于使用生物样品中含有的物质,因此作为稀释生物样品的缓冲液,需要使用如下缓冲液:不含有外标物、或者即使含有外标物也在稀释生物样品后的混合物中以不对外标物测定产生影响程度的极微量的浓度含有的缓冲液。此外,需要使用如下缓冲液:不含有对外标物和内标物的测定有妨碍的物质、或者即使含有外标物也在稀释生物样品后的混合物中以不对内标物或外标物的测定产生影响程度的极微量的浓度含有的缓冲液。将不含有这些物质、或者即使含有也在稀释生物样品后的混合物中以不对内标物或外标物的测定产生影响程度的极微量的浓度含有的缓冲液称为实质上不含所述物质的缓冲液。例如,本发明的方法中使用的稀释用缓冲液中的钠浓度为100nmol/l以下。例如,作为外标物使用钠或氯时,需要生物样品的稀释用缓冲液中不含有钠或氯、或者即使含有也为极微量。此外,作为内标物因为使用属于碱金属类的元素或属于碱土金属类的元素,所以生物样品的稀释用缓冲液需要不含有用作内标物的属于碱金属类的元素和属于碱土金属类的元素、以及近似于这些的物质、或者即使含有也为极微量。进一步,钠由于对属于碱金属类的元素或属于碱土金属类的元素的定量产生影响,因此需要生物样品的稀释用缓冲液中不含有钠、或者即使含有也为极微量。此外,由于测定生物样品中的目标分析物,因此为了防止目标分析物的分解或变性,生物样品的稀释用缓冲液需要为接近于生物样品的ph的ph6.5~ph8.0的缓冲液,优选为ph7.0~ph7.5,进一步优选为ph7.4。进一步,本发明中由于测定用缓冲液稀释的血液中的生物成分,因此缓冲液成分不能对这些待测定的生物成分的变性或稳定性产生影响。由于之前不存在在ph7.4前后具有缓冲能力且不含有钠或氯的缓冲液,因此不可能将钠或氯用作外标物。本发明中新开发出在ph7.4前后具有缓冲能力且不含有钠或氯的缓冲液,能够将钠或氯用作外标物。可举出:作为这样的不含有钠、氯、碱金属类元素和碱土金属类元素的碱性化合物,将2-氨基-2-甲基-1-丙醇(amp)、2-乙基氨基乙醇、n-甲基-d-葡糖胺、二乙醇胺、三乙醇胺等氨基醇化合物类与作为呈酸性的good's缓冲液(两性离子缓冲液),即pka为ph7.4附近缓冲液的hepes(2-[4-(2-羟乙基)-1-哌嗪基]乙磺酸)(pka=7.55)、tes(n-三(羟甲基)甲基-2-氨基乙磺酸)(pka=7.50)、mops(3-吗啉丙磺酸)(pka=7.20)或bes(n,n-双(2-羟乙基)-2-氨基乙磺酸)(pka=7.15)进行组合并混合的缓冲液。其中,优选2-氨基-2-甲基-1-丙醇(amp)与hepes、tes、mops或bes的组合,进一步优选2-氨基-2-甲基-1-丙醇(amp)与hepes的组合。为了制备上述缓冲液,氨基醇与good's缓冲液的浓度比为1:2~2:1、优选以1:1.5~1.5:1、进一步优选以1:1的浓度比进行混合即可。缓冲液的浓度并不进行限定,氨基醇或good's缓冲液的浓度为0.1~1000mm/l,优选1~500mm/l,进一步优选10~100mm/l。缓冲液中为了保持分析物的稳定,也可以含有螯合剂、表面活性剂、抗菌剂、防腐剂、辅酶、糖类、抑制剂等。作为螯合剂,可举出:乙二胺四乙酸盐(edta)、柠檬酸盐、草酸盐等。作为表面活性剂,例如可举出:阳离子表面活性剂、阴离子表面活性剂、两性表面活性剂或非离子表面活性剂。作为防腐剂,例如可举出:叠氮化钠或抗生素等。作为辅酶,可举出:磷酸吡哆醛、镁、锌等。作为糖类,可举出:甘露醇、右旋糖、寡糖等。作为抑制剂,可举出:十二烷基硫酸钠、汞、肝素等。特别是通过添加甘露醇与磷酸吡哆醛可使血细胞膜或酶稳定,通过添加3~4种的抗生素或抗菌剂,在手指采血时可抑制从手指表面混入的一部分的细菌增殖,能够稳定由细菌引起的生物成分的分解。生物样品中使用全血时,由于需要用过滤器对稀释的血液中的血细胞成分进行过滤,因此缓冲液的渗透压可通过使用与血液同等(285mosm/kg)或其以上的渗透压来防止血细胞溶血。渗透压可通过对待测定的生物成分的定量不产生影响的盐类、糖类等、缓冲液等调节为等渗。本发明也包含由本发明的杂交法为了使用生物样品的稀释倍数而使用的上述缓冲液。该缓冲液不仅用于本发明的杂交法,也可以用于使用外标的定量分析方法(外标法)、使用内标的定量分析方法(内标法)。内标物的碱金属类元素或碱土金属类元素可以利用公知的方法进行测定。例如,添加属于碱金属类的元素或属于碱土金属类的元素与形成螯合物的物质,测定形成的螯合物的吸光度即可。作为碱金属类元素或碱土金属类元素与形成螯合物的物质,例如可举出被多价卤素取代的卟啉化合物(例如,多氟卟啉)等卟啉衍生物。此外,可通过原子吸光度法测定元素自身的吸光度。具体而言,作为内标物添加到缓冲液中锂的测定可利用螯合物比色法(卤素卟啉螯合物法:全氟-5,10,15,20-四苯基-21h,23h-卟啉)用自动生化分析装置进行。通过该方法,可容易地以微量样品测定很多样本。外标物的氯(cl-)、蛋白质也可以用上述2(外标法)中记载的公知的方法进行测定。本发明的方法中,也可以使用作为内标物使用锂等碱金属类元素或碱土金属元素,而且作为外标物使用钠(na+)、氯(cl-)或蛋白质等生物样品中含有的物质的两种标准物质的杂交法求出稀释倍数,用外标物对用内标物求得的稀释倍数进行校正,可求出准确的稀释倍数。作为用于改善躁症和躁郁症的躁狂状态的药品,使用碳酸锂。对于需要治疗的受试者,碳酸锂每天给药数百mg~一千数百mg。因此,正在接受碳酸锂给药的受试者的生物样品中含有锂,只将锂作为内标使用时,不能求出准确的稀释倍数。另一方面,钠如前所述在正常人的血液中浓度的正常范围约为135~145mmol/l(meq/l),约5%的受试者中即使是正常人也偏离正常值,约2.5%的受试者中即使是正常人也为低于上述正常值的低浓度,约2.5%的受试者中即使是正常人也为高于上述正常值的高浓度。这样的受试者中,只将钠用作外标时,不能求出准确地稀释倍数。如上所述,即使受试者在将锂等碱金属类元素或碱土金属元素作为药品而被给药时,或者血液中的钠(na+)、氯(cl-)或蛋白质的浓度偏离正常值时,由于通过外标物对使用内标物求出的稀释倍数进行校正,因此能够弥补两者的缺点,可求出准确地生物样品的稀释倍数。求出本发明得生物样品的稀释倍数的方法希望按照如下方式进行。在预先以规定浓度添加内标物的缓冲液50~500μl中添加生物样品10~200μl并混合。此时,缓冲液容积优选为生物样品容积的3~4倍以上。例如,生物样品为血液时,在添加内标的缓冲液280μl中添加微量血液样品65μl并混合。生物样品为血液时,稀释后除去红细胞、白细胞等血细胞。也可以利用过滤器除去血细胞,也可以用离心分离除去稀释的血液样品。使用除去血细胞的稀释血浆样品,测定分析物。在内标添加缓冲液280μl中添加微量血液样品65μl时,由于血液样品65μl中含有约30μl的血浆,因此血浆稀释约10倍。作为生物样品使用血液时,血液与稀释用缓冲液按照如下混合即可:换算为血浆,血浆稀释5~20倍,优选为5~16倍、进一步优选为5~10倍、特别是优选为8~10倍左右。另外,同时测定稀释血浆样品中的内标物浓度与外标物浓度。可由内标物浓度和外标物浓度求出血液的稀释倍数,并通过稀释血浆样品的分析物的测定值乘以稀释倍数计算血液中的分析物浓度。作为生物样品使用血液时,用稀释用缓冲液稀释血液后,由于除去血细胞,所以留下的样品为血浆,从而将其称为稀释血浆。因此,此时称为求出血浆的稀释倍数。血浆的稀释倍数使用内标物和外标物可通过如下3种计算方法求出。下面在说明的方法中,使用用添加有内标物的稀释用缓冲液稀释血液并用过滤器过滤而得到的血浆样品。作为内标物使用锂,作为外标物使用钠。计算方法1a:添加内标物的缓冲液中内标物的吸光度b:稀释血浆中内标物的吸光度c:血浆中外标物浓度的正常中位值的吸光度d:稀释血浆中的外标物的吸光度x:血浆稀释倍数其中,稀释血浆是指用稀释用缓冲液稀释血液样品,除去血细胞而得到的血浆。作为内标物使用锂,作为外标物使用钠时,锂的浓度,例如可以表示为用螯合物比色法等测定锂浓度时得到的吸光度。此外,钠的浓度,可以表示为用酶法测定等测定时的吸光度。血浆中钠浓度的正常中位值为正常人的中位值,作为血浆中钠浓度的正常中位值的吸光度,使用钠142mmol/l的吸光度即可。该值为已知的值。下面的计算方法2和3中也相同。由缓冲液的血浆的稀释倍数x可以由下述计算式(1)或计算式(2)求出。对稀释血浆中的分析物的生化成分的测定浓度或酶活性进行定量,该定量值乘以由计算式(1)或计算式(2)求得的稀释倍数,可以对原血浆中的分析物进行定量。计算方法2b:稀释血浆中内标物的吸光度d:稀释血浆中的外标物的吸光度x:血浆稀释倍数血浆的稀释倍数可以由下述计算式(3)求出。x=a×(b+d)±b(3)(a和b为系数)计算方法2中预先获取b+d与稀释倍数的数据,先制成由x=a×(b+d)±b表示的回归直线。对稀释血浆中的分析物的生化成分的测定浓度或酶活性进行定量,该定量值乘以由计算式(3)求得的稀释倍数,可以对原血浆中的分析物进行定量。计算方法3a:添加内标物的缓冲液中内标物的吸光度b:稀释血浆中内标物的吸光度c:血浆中外标物浓度的正常中位值的吸光度、d:稀释血浆中的外标物的吸光度b':通过由外标物的吸光度计算出的稀释倍数对稀释血浆中内标物的吸光度的校正值x:血浆稀释倍数内标物(例如,锂)与外标物(例如,钠)的稀释倍数x如果假定为相同,则可得到下式。x=a/b=c/d通过外标物(例如,钠)的稀释倍数对内标物(例如,锂)的吸光度变化量校正值b'由下式求出。(b')=(a×d)/c通过用内标物(例如,锂)的吸光度变化量校正值b'除a,求出由外标物(例如,钠)校正的内标物(例如,锂)稀释倍数。x=a/b'(4)对稀释血浆中的分析物的生化成分的测定浓度或酶活性进行定量,该定量值乘以由计算式(4)求得的稀释倍数,可以对原血浆中的分析物进行定量。实施例下面,对本发明的实施例进行说明。1.利用内标的分析法(内标法)[实施例1-1]在将麦芽糖作为内标物添加到稀释缓冲液的血液稀释缓冲液200μl中加入添加edta-2na的全血样品60μl,对50例的静脉血液样品进行研究。对未稀释的全血离心而得到的血浆的测定值与稀释的血浆的测定值乘以内标稀释倍数而求得的稀释血浆测定值的相关进行了考察,结果如图1所示在酶活性(谷丙转氨酶:alt,γ-谷氨酰转肽酶:ggt)、脂质检查(甘油三酯:tg、ldl-胆固醇、葡萄糖、血红蛋白a1c)的检查中均得到良好的相关性。[实施例1-2]在将分布于血细胞和血浆中内标的乙醇胺添加到稀释缓冲液而成的血液稀释缓冲液200μl中加入添加edta-2na的全血样品60μl,对50例的静脉血液样品进行研究。分别将静脉采血的添加edta-2na全血与用血液稀释缓冲液稀释该全血的稀释全血作为样品,推算白细胞(wbc)、红细胞(rbc)、血红蛋白浓度(hgb)、血细胞比容值(hct)、血小板数(plt)的相关图如图5所示。由此除了血小板数,可看到良好的相关性。[实施例1-3]使用由麦芽糖内标求得的血浆稀释率和由乙醇胺求得的全血稀释率,并由计算式求得的表示血液中的血细胞体积的血细胞比容值与对全血用血细胞计数器求得的值的相关进行了考察。结果如图6所示。具有良好的相关性且实用性。2.利用外标物的分析法(外标法)[实施例2-1]使用微量血液样品的定量分析(1)外标物(钠)的测定和稀释倍数的计算在缓冲液280μl中添加微量血液样品65μl并混合,用过滤器过滤血细胞,将稀释血浆作为样品用自动生化分析装置测定外标物和生物成分的各浓度。作为血液样品的稀释用缓冲液,使用将2-氨基-2-甲基-1-丙醇和hepes(2-[4-(2-羟乙基)-1-哌嗪基]乙磺酸)组合并混合而成的ph7.4的缓冲液。使用的缓冲液的组成如表5所示。[表5]用钠外标物的稀释用缓冲液的组成作为外标物,使用包含于血液样品中的钠。稀释血浆的微量钠测定开发出利用通过钠活化β-半乳糖苷酶,并利用用缓冲液稀释的样品的钠浓度与半乳糖苷酶活性呈正比例关系的酶法测定。钠测定试剂的组成如表6所示。[表6]用钠外标物的稀释用缓冲液的组成使用如表6所示的钠测定试剂,进行如下测定。如果在稀释缓冲液280μl中添加全血65μl,则全血中的血浆(约30μl)稀释约10倍。在用纯水稀释该稀释血浆4.5倍后的3μl中加入β-半乳糖苷酶缓冲液(第一试剂)52μl,37℃下加温5分钟,加入底物溶液邻硝基苯基-β-d-吡喃半乳糖苷(第二试剂)26μl,使用日本电子株式会社的jca-bm6050型自动生化分析装置,通过在主波长410nm、副波长658nm处测定吸光度来求得每分钟的吸光度速度变化。图1中示出了显示钠浓度与吸光度变化量的标准曲线。得到经过原点到24mmol/l的线性并可确认钠的定量性。(2)外标物(氯)的测定使用如下试剂:1)第一试剂:在ph6.0、0.1mol/lmes/naoh缓冲液中含有来源于胰腺的淀粉酶2u/ml和10mmol/ledta的溶液2)第二试剂:5mmol/l2-氯-4-硝基苯基麦芽糖溶液氯测定法如下所示。在样品5μl中加入第一试剂150μl,在37℃下加温5分钟后,加入第二试剂50μl后,求得在405nm处从1分钟后到2分钟的吸光度变化。图8中示出了显示氯浓度与吸光度变化量的标准曲线。(3)微量血液样品与静脉血浆的相关性表7中示出了血浆测定值与由外标物(钠)的稀释倍率求得的稀释血浆测定值的相关统计值。测定使用日本电子株式会社的jca-bm6050型自动分析装置。表示将142mmol/l的钠测定吸光度(a)与稀释血浆的钠吸光度(b)由下式(i)求得的稀释倍数(x:8倍稀释),利用该稀释倍数求得的稀释血浆的生化检测数据(稀释血浆测定值)与血浆数据(血浆测定值)的相关性。各检查项目的血浆测定用常用方法进行测定。此外,稀释血浆的测定通过常用方法增加样品的容量并在最优化的条件下进行测定。如表7所示的生化检测13项的相关性为良好,能够由微量血液得到原血浆中的生化检测数据。[表7]与用钠外标法的血浆的相关性3.利用内标物和外标物的分析法(杂交法)[实施例3-1]使用微量血液样品的定量分析(1)内标物(锂、甘油-3-磷酸)和外标物(钠)的测定和稀释倍数的计算在添加内标物的缓冲液280μl中添加微量血液样品65μl并混合,用过滤器过滤血细胞,将稀释血浆作为样品用自动生化分析装置测定内标物和外标物以及生物成分的各浓度。作为血液样品的稀释用缓冲液,使用将2-氨基-2-甲基-1-丙醇和hepes(2-[4-(2-羟乙基)-1-哌嗪基]乙磺酸)组合并混合而成的ph7.4的缓冲液。添加所用内标物的缓冲液的组成如表8所示。[表8]添加钠内标物的稀释用缓冲液的组成作为内标物使用锂,稀释用缓冲液中添加1mm/l的氯化锂。作为外标物,使用血液样品中含有的钠。缓冲液中作为内标物而添加的锂的测定通过螯合物比色法(卤素卟啉螯合物法:全氟-5,10,15,20-四苯基-21h,23h-卟啉)进行测定。稀释血浆的微量钠测定开发出利用通过钠活化β-半乳糖苷酶,并利用用缓冲液稀释的样品的钠浓度与半乳糖苷酶活性呈正比例关系的酶法测定。钠测定试剂的组成如表9所示。[表9]钠测定试剂的组成使用表9所示的钠测定试剂,进行如下测定。在稀释缓冲液280μl中添加全血65μl,全血中的血浆(约30μl)稀释约10倍。在用纯水稀释该稀释血浆4.5倍后的3μl中加入β-半乳糖苷酶缓冲液(第一试剂)52μl,37℃下加温5分钟,加入底物溶液邻硝基苯基-β-d-吡喃半乳糖苷(第二试剂)26μl,用日本电子株式会社的jca-bm6050型自动生化分析装置,通过在主波长410nm、副波长658nm处测定吸光度,求得每分钟的吸光度速度变化。表示钠浓度和吸光度变化量的标准曲线如图7所示。得到经过原点到24mmol/l的线性并可确认钠的定量性。[表10]锂的测定法使用表10的测定试剂按照如下方法进行锂的测定。在稀释缓冲液280μl中添加全血65μl,全血中的血浆(约30μl)稀释约10倍。用日本电子株式会社的jca-bm6050型自动生化分析装置,在用纯水稀释该稀释血浆4.5倍稀释后的5μl中加入螯合物试剂(第一试剂)55μl,37℃下加温10分钟,通过在主波长545nm、副波长596nm处测定吸光度而求得。表示锂浓度和吸光度的标准曲线如图9所示。得到经过原点到1mmol/l的线性并可确认锂的定量性。将甘油-3-磷酸作为内标物时的测定法在稀释缓冲液280μl中添加全血65μl,全血中的血浆(约30μl)稀释约10倍。用日本电子株式会社的jca-bm6050型自动生化分析装置,在用纯水稀释该稀释血浆4.5倍稀释后的9μl中加入第一试剂(过氧化物酶)50μl,37℃下加温5分钟,加入第二试剂(甘油-3-磷酸氧化酶)25μl,在5分钟后,通过在主波长596nm、副波长884nm处测定吸光度而求得。得到经过原点到4mmol/l的线性并可确认甘油-3-磷酸的定量性。甘油-3-磷酸测定法使用如表11所示的试剂成分。[表11]甘油-3-磷酸的测定法(2)微量血液样品与静脉血浆的相关性使用日本电子株式会社的jca-bm6050型自动分析装置进行测定的血浆与稀释血浆的生化检测项目测定值的相关图如图10-1~10-6所示。将稀释用缓冲液中的内标物(锂)的测定吸光度(a)与血浆添加后的内标物的测定吸光度(b)、以及142mmol/l的钠测定吸光度(c)与稀释血浆的钠吸光度(d)通过下述计算式(1)求得杂交中稀释倍数(x:8倍稀释),将利用该稀释倍数求得的稀释血浆的生化检测数据(稀释血浆测定值)表示于y轴、将血浆数据(血浆测定值)表示于x轴。各检查项目的血浆测定用常用方法进行测定。此外,稀释血浆的测定通过常用方法增加样品的容量并在最优化的条件下进行测定。如图10-1~10-6所示的生化检测13项的相关性为良好,能够由微量血液得到原血浆中的生化检测数据。表12中表示同时使用内标物(锂)和外标物(钠)的杂交法的血浆测定值与稀释血浆测定值的相关统计值。[表12]同时使用内标物(锂)和外标物(钠)的杂交法的相关性[实施例3-2]血浆与稀释血浆的生化检测项目测定值的相关使用日本电子株式会社的jca-bm6050型自动分析装置进行测定的血浆与稀释血浆的生化检测项目测定值的相关性如表13所示。将稀释用缓冲液中的内标物(甘油-3-磷酸)的测定吸光度(a)与血浆添加后的内标物的测定吸光度(b)、以及142mmol/l的钠测定吸光度(c)与稀释血浆的钠吸光度(d)通过实施例3-1的计算式(1)求得杂交中稀释倍数(x:8倍稀释),将利用该稀释倍数求得的稀释血浆的生化检测数据(稀释血浆测定值)表示于y轴、将血浆数据(血浆测定值)表示于x轴。各检查项目的血浆测定用常用方法进行测定。此外,稀释血浆的测定通过常用方法增加样品的容量并在最优化的条件下进行测定。如表13所示的生化检测13项的相关性为良好,能够由微量血液得到原血浆中的生化检测数据。表13中表示同时使用内标物(甘油-3-磷酸)和外标物(钠)的杂交法的血浆测定值与稀释血浆测定值的相关统计值。[表13]甘油-3-磷酸和钠的杂交法与血浆测定法的相关性[实施例3-3]同时使用内标物(li)和外标物(na)的检查数据对测定误差与精度产生的影响(1)作为外标物使用血浆钠时对稀释倍数产生的影响正常人的血浆钠浓度在个体内和个体间的生理性变动非常小,其标准范围(正常范围)为135~145mmol/l。利用此正常人的中位值的142mmol/l值,对用稀释用缓冲液稀释血液样品并除去血细胞而得到的稀释血浆中的钠浓度,用高灵敏度的酶法进行测定则可高精度地测定至0~30mmol/l。此外,即使将标准范围上下限的135mmol/l和145mmol/l的样品以142mmol/l为标准对稀释倍数进行校正,可以在±2%的误差范围内进行测定。但是,大于如表14所示的标准范围上下限值的正常人分别存在于全体的2.5%,因此136mmol/l与148mmol/l的血浆中分别有产生±4%以上误差的问题点。在同时使用将锂作为内标物求出稀释倍数的方法和将钠作为外标物求出稀释倍数的方法的杂交法中,如表14所示的±4%以上误差可降低到一半。表14中稀释倍数栏的“na外标”表示只基于外标物的钠浓度求得的稀释倍数,“na-li校正:杂交法校正”表示基于外标物的钠浓度和内标物的锂浓度二者求得的稀释倍数。“杂交法校正”中的稀释倍数使用实施例3-1的计算式(1)计算。单独钠的稀释倍数和杂交的稀释倍数的两个方法中对用血浆胆固醇的测定值产生的误差如表14所示。可知通过使用杂交法使误差降低一半。[表14]作为外标物使用血浆钠时对稀释倍数产生的影响(2)作为内标物使用锂时对稀释倍数产生的影响稀释血液的缓冲液中添加锂作为内标物时,根据血液中的血浆量稀释锂浓度,由于求出血浆稀释倍数的方法到8~10倍程度,血浆添加量较多,因此添加前与添加后的浓度差较大,稀释倍数的重现性为变动系数2%以下。但是,在12~16倍由于血浆的添加量减少,因此稀释倍数提高至变动系数4%~5%。由如表15所示的杂交法校正的12倍至16倍的稀释倍数约为3%,血液不易采集,即使受试者得到精度良好的数据。血浆胆固醇为210mg/dl的受试者稀释16倍时,作为内标物只使用内标物的锂计算稀释倍数,由于校正测定值时产生199~221mg/dl的变动,因此判断为高脂血症(220mg/dl以上)的受试者。表15中,“li内标”表示只根据内标物锂的浓度求得的稀释倍数,“na外标”表示只根据外标物钠的浓度求得的稀释倍数,“杂交法校正”表示根据外标物钠的浓度和内标物锂的浓度二者求得的稀释倍数。“杂交法校正”中的稀释倍数使用实施例3-1的计算式(1)计算。另一方面,同时使用作为内标物的锂与作为外标物的钠计算稀释倍数,并对测定值进行校正时为204~216mg/dl,判断为正常人。因此,通过使用杂交法的校正,可以得到高精度的测定值。[表15]对作为内标物锂与外标物钠以及杂交法的稀释倍数产生重现性(cv%)的影响对血浆稀释倍数为6~16倍中作为内标物锂与外标钠以及杂交法中的稀释倍数产生重现性(cv%)的影响如表15所示。杂交法与单独内标法的重现性相比显示出良好的重现性。工业上的可利用性本发明对于通过如上述受试者的手指等由体内采集的微量且未知量的全血样品等生物样品的血浆和生物样品中的任意成分也能够简单且准确地定量。此外可以求出作为血液的贫血程度的血细胞容积比(血细胞比容值)。由此,即使受试者本身也能进行,虽然血液等微量采集,而且从采集起经过长时间后也能够对受试者的血液等采集的生物样品准确地进行分析。由此,能够有效地用于受试者的健康诊断中,工业上的可利用性高。进一步,由于本发明的微量血液采集方法不受血液采集的时间与场所限制,能够应用于没有时间前往医疗机构的情况、灾害时、远程医疗、健康管理等,可早期发现症状发生前的人等,也有助于医疗费的降低。此外能够高效地用市售的自动生化分析装置对大量样品进行测定。也可以用于测定的检查数据通过发送到智能手机来对日常性的健康管理或疾病的早期发现的系统中。符号说明1:血液2:血浆(血清)3:血细胞4:缓冲液5:内标物6:血液稀释溶液当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1