一种饲料可消化碳水化合物总量的仿生消化测定方法与流程
本发明涉及一种可消化碳水化合物的测定方法,尤其是涉及一种饲料可消化碳水化合物总量的仿生消化测定方法。
背景技术:
碳水化合物是由碳、氢和氧三种元素组成,饲料中的碳水化合物在动物胃、小肠内经过物理消化、消化酶消化,可逐步降解成含有游离醛基或酮基的葡萄糖、果糖、半乳糖等单糖及少量含有游离醛基的双糖(乳糖、麦芽糖)。
客观、准确评定各种饲料原料的生物学效价是动物营养需要量研究、优化饲料配方的基础,是提高畜禽日粮利用率、降低日粮成本及养殖业节能减排的决策依据。饲料中碳水化合物生物学效价的评定方法主要有体内法(in vivo)和体外法(in vitro)。体内法就是进行动物实验,常常耗资、费力、费时,系统误差和偶然误差影响因素多,不同时空条件下的测值重演性、可比性差不能满足研究和生产应用所需。而体外法具有快速、简便、费用低等优点,各国营养学家都有诸多研究报道。近年来,饲料碳水化合物的体外评定技术在国际上越来越受到关注,从而推动了相关研究的快速发展,然而这些体外法大都以三角瓶、试管、透析管等简单实验器材为基础,由于大量的人工操作引入的系统误差,所得结果可重复性和精度较差。
技术实现要素:
本发明要解决的技术问题是:克服现有技术的不足,提供一种操作简便,试验结果准确率高、重复性好的饲料可消化碳水化合物总量的仿生消化测定方法。
本发明解决其技术问题所采用的技术方案是:一种饲料可消化碳水化合物总量的仿生消化测定方法,包括以下步骤:
1)样品的制备:按GB/T 14699.1进行采样,再将采样的饲料样品用四分法分至200g左右,用植物粉碎机或研钵将样品粉碎至过40~100目筛(优选过60目筛,孔径0.30mm),封入样品袋密封存放,做试样备用;
2)制备胃和小肠的缓冲液和模拟消化液及其他试剂;
3)单胃动物仿生消化系统预热:用1000mL去离子水代替胃缓冲液、小肠前段缓冲液、小肠后段缓冲液放入单胃动物仿生消化系统的相应位置,并将系统的管道与缓冲液瓶连接好;在控制软件中,设置单胃动物仿生消化系统的预热时间为60~90min;待所有消化阶段的参数输入完毕后,运行模拟消化过程;
4)上样:将单胃动物仿生消化系统中的模拟消化管清洗干净、烘干,并用翻口硅胶塞将其一端塞严;称取步骤1)制备好备用的0.25g~1.00g(精确到0.0001g,用W标记)饲料试样,并加入单胃动物仿生消化系统的模拟消化管中,同时测定样品的干物质含量(DM);
5)胃模拟消化处理:向单胃动物仿生消化系统中胃缓冲液进入的第一根模拟消化管(对照样)中加入10ml去离子水,其他添加分析试样的模拟消化管中分别加入10ml胃模拟消化液;并在模拟消化管的另一端固定电动搅拌器,待单胃动物仿生消化系统预热结束后,将模拟消化管放置与单胃动物仿生消化系统中,并将多根模拟消化管按下端进上端出的液流方式串联连接,模拟消化管的模拟消化液加液管通过快速接头与单胃动物仿生消化系统连接;通过单胃动物仿生消化系统控制软件设置胃模拟消化参数,开始进行胃模拟消化处理;
6)小肠模拟消化处理:胃阶段消化结束后,通过模拟消化液加液管向小肠缓冲液进入的第一根模拟消化管(对照样)中分两次添加6.0ml和1.6ml去离子水,其他添加分析试样的模拟消化管中分别依次添加6.0ml小肠缓冲液和1.6ml小肠模拟消化液;通过单胃动物仿生消化系统控制软件设置小肠模拟消化参数,开始进行小肠模拟消化处理;
7)消化残渣处理:待饲料试样经胃和小肠模拟消化结束后,将玻璃消化管内的消化液无损失地转移到200ml干净的容量瓶中,然后用去离子水定容,封口膜密封,摇匀,从容量瓶中取30ml消化液,用一次性注射器吸取,通过滤膜过滤,滤液备用;对照组的消化液直接0.22μm滤膜过滤,备用;
8)采用DNS比色法测定对照样和分析试样中的还原糖含量,并计算得出饲料中的可消化碳水化合物总量。
步骤1)中,所述饲料样品为猪饲料、鸡饲料或鸭饲料。
步骤2)中,所述胃缓冲液的制备方法:称取1~3g氯化钠、0.25~5g氯化钾和1~2g山梨酸钾,放入500mL烧杯中,加入400mL去离子水溶解,并用2mol/L的盐酸(HCL)在39℃~42℃下调节溶液的pH至3.0,冷却后将上述溶液转入500mL容量瓶,并用去离子水定容。
步骤2)中,所述胃模拟消化液的制备方法:根据Wirnt R描述的胃蛋白酶活性测定方法(参见Pepsin, measurements with haemoglobin as substrate [A]. In: Bergmeyer H U. Methods of enzymatic analysis[M].Weinheinm:Verlag chemie. 1974),测定胃蛋白酶中胃蛋白酶的活性。然后,根据模拟根据猪模拟胃液中胃蛋白酶的浓度为737.5U/ ml,称取184.38KU的胃蛋白酶溶解于250ml pH 3.0的盐酸溶液中(39℃下标定pH),缓慢搅拌直至溶解,勿在加热板上加热模拟胃液,或配制时过热;临用前配制。
根据鸡模拟胃液中胃蛋白酶的浓度为1550U/ml,称取387.5KU的胃蛋白酶溶解于250ml pH 2.0的盐酸溶液中(41℃下标定pH)。
根据鸭模拟胃液中胃蛋白酶的浓度为1550U/ ml,称取387.5KU的胃蛋白酶溶解于250ml pH 2.0的盐酸溶液中(42℃下标定pH)。
步骤2)中,所述小肠缓冲液的制备方法:称取0.5~5g无水磷酸氢二钠,2.0~3g无水磷酸二氢钠,PBS最终浓度为0.05M,0.2~2g山梨酸钾,青霉素12万U。放入100mL烧杯中,加入40mL去离子水溶解,并用1mol/L的磷酸或1mol/L的氢氧化钠在39℃或41°C或42℃下调节溶液的pH至6.30~6.50。冷却后将上述溶液转入50mL容量瓶,并用去离子水定容。
步骤2)中,所述小肠模拟消化液的制备方法:根据Dahlqvist A描述的α-淀粉酶活性测定方法(参见Dahlqvist A;A method for the determination of amylase in intestinal content [J]. Scandinavian Journal of Clinical and Laboratory Investigation, 1962, 14: 145-151),Wirnt R描述的胰蛋白酶活性测定方法 (参见Wirnt R,Trypsin; measurement with nα-wtoluenesulfonyl-l-arginine methyl ester as substrate [A]. Bergmeyer H U. Methods of enzymatic analysis[M]. Weinheinm:Verlag chemie. 1974),Wirnt R 描述的糜蛋白酶活性测定方法(参见Wirnt R;Chymotrypsin, measurements with n-benzoyl-l-tyrosin ethyl ester as substrate [A]. In: Bergmeyer H U. Methods of enzymatic analysis [M]. Weinheinm:Verlag chemie. 1974),测定试剂级淀粉酶、胰蛋白酶、糜蛋白酶中相应消化酶的活性;然后,根据模拟肠液中这三种消化酶的活性,分别称(量)取淀粉酶41.41KU~97.12KU,胰蛋白酶9.54KU~26.32KU,糜蛋白酶1.62KU~9.44KU溶解于17~20ml 去离子水中,并缓慢搅拌直至溶解(肠液酶粉剂提供的消化酶活性为50%以上);勿在加热板上加热,或配制时过热;临用前配制。步骤5)中,所述胃模拟消化参数为:温度39~42℃;蠕动泵转速188rpm/min,消化时间4~6 h。
步骤5)和6)中,所述添加分析试样的模拟消化管的数量≥3根,优选4~6根。
步骤6)中,所述小肠模拟消化参数:温度39~42°C,蠕动泵转速188rpm/min,小肠消化时间为8~16 h。
步骤6)中,DNS比色法测定试样中的还原糖含量,包括以下步骤:
①绘制标准曲线:吸取去离子水4ml于25ml刻度试管中,加入DNS试剂5ml,沸水浴5min,自来水冷却至室温,去离子水定容至25ml(直接加16ml去离子水),制成标准空白样;分别吸取10mg/ml的葡萄糖溶液1.00ml、2.00ml、3.00ml、4.00ml、5.00ml、6.00ml、和7.00ml,分别用去离子水定容至100ml,配制成浓度为0.10mg/ml~0.70mg/ml的葡萄糖标准溶液;分别吸取上述浓度的葡萄糖标准液各2ml(2个平行),加到25ml刻度试管中,再加入2.0ml去离子水,混匀,加入5.0ml DNS试剂,混匀,沸水浴5min,自来水冷却至室温,加16ml去离子水,摇匀;以标准空白样为对照调零,在540nm处测吸光度OD值;以葡萄糖浓度为Y轴,吸光度OD值为X轴,绘制标准曲线y=aX+b;
②对照样和分析试样中还原糖测定:取步骤7)制备的消化液5ml于试管中,然后再加入5ml去离子水,进行2倍稀释;再取2ml稀释后的消化液加到25ml刻度试管中,然后再加2ml去离子水,振荡混匀,加入5mlDNS,混匀,沸水浴5min。自来水冷去至室温,加16ml去离子水,混匀,分光光度计540nm处测OD值,得到对照样的OD(对照)和分析试样的OD(试样)。
步骤8)中,所述可消化碳水化合物总量的计算公式为:
可消化碳水化合物总量(mg/g DM) = 【(a×OD(试样)+b)×2×200-(a×OD(对照)+b)×17.6】/(w×DM)
式中:a为标准曲线回归系数;
b为标准曲线回归常数;
OD测定为分析试样测定管的吸光度值;
OD空白为对照样管的吸光度值;
W为每个重复测定管饲料样品重量;
DM为饲料样品的干物质含量。
本发明一种饲料可消化碳水化合物总量的仿生消化测定方法的有益效果:克服了传统体外消化法在消化过程中无法实现产物实时分离的缺陷,使用实时动态的消化产物分离技术,结合目前体外法测定饲料可消化碳水化合物的方法,通过单胃动物仿生消化系统中自动控制体外消化过程,基本排除了由于人工操作引入的系统误差,提高了试验结果的重演性和精度;降低了操作人员的工作量,提高了检测效率。
附图说明
图1—为一种饲料可消化碳水化合物总量的仿生消化测定方法的流程示意图;
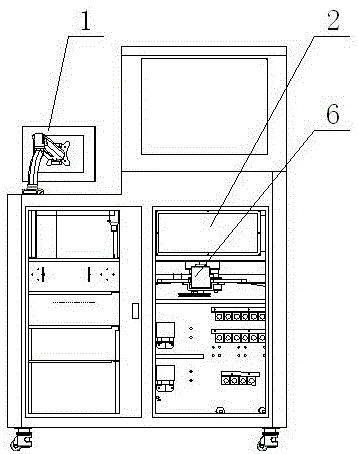
图2—为本发明所采用的单胃动物仿生消化系统的立体结构示意;
图3—为本发明所采用的单胃动物仿生消化系统的后视图;
图4—为图1中A处的放大示意图。
具体实施方式
以下结合附图及实施例对本发明作进一步说明。
本发明一种饲料可消化碳水化合物总量的仿生消化测定方法采用的设备为单胃动物仿生消化系统,包括机壳2、恒温空气浴摇床6、仿生消化装置4、自动加酶装置、缓冲液循环装置、清洗装置、控制电路5,所述机壳2的左上方设有消化反应室3,所述恒温空气浴摇床6装置设于消化反应室3内;所述自动加酶装置固定安装在机壳2内,自动加酶装置与仿生消化装置4通过输液管58相连;所述缓冲液循环装置和清洗装置设于机壳2的下方,缓冲液循环装置、清洗装置分别通过输液管58与仿生消化装置4相连;所述控制电路5设于机壳2内,并通过导线与恒温空气浴摇床6装置、自动加酶装置、缓冲液循环装置、清洗装置相连,所述控制电路5与安装在机壳内的工控机连接,所述工控机与安装在机壳2右上方的显示器1连接;所述仿生消化装置4竖直安装在恒温空气浴摇床6上方,即仿生消化装置4的中心轴线与恒温空气浴摇床6垂直,如图1和图2所示。
参照图4,所述仿生消化装置4包括固定支架、立式模拟消化器、玻璃管固定夹7、搅拌棒11、电机15和传动装置;所述立式模拟消化器由数根串联的透析模拟消化管和/或双层玻璃模拟消化管组成,如2组、每组5根串联的透析模拟消化管组成;所述立式模拟消化器竖直夹持安装在所述玻璃管固定夹7内,所述搅拌棒11安装在立式模拟消化管内,其顶端与传动装置可拆卸连接;所述传动装置与安装在固定支架顶端的电机15电连接;所述玻璃管固定夹7固定安装在固定支架中部。
参照图4,所述固定支架由底板20、下架板19、背板18、侧板17和支撑板16组成,所述底板20与下架板19固定连接;所述下架板19由一块金属板折弯成型,包括一水平固定板和两块竖立的立板,两立板位于水平固定板下方,并与水平固定板的左右两端一体连接;立板的下端均向上弯折成固定块,固定孔上设有定位孔;水平固定板上开设有用于固定竖直玻璃管8固定夹7的第一通孔,所述背板18、侧板17固定在下架板19的后上方,所述背板18和侧板17的顶部与支撑板16固定连接,所述支撑板16上还设有电机固定螺孔和电机轴穿孔。
实施例1
参照图1,本实施例的一种猪饲料可消化碳水化合物总量的仿生消化测定方法,包括以下步骤:
1)样品的制备:按GB/T 14699.1进行采样,再将采样的猪饲料样品用四分法分至200g左右,用植物粉碎机或研钵将样品粉碎至过60目筛(孔径0.30mm),封入样品袋密封存放,做试样备用;
2)制备胃和小肠的缓冲液和模拟消化液及其他试剂:
胃缓冲液(pH 3.0):称取2.59g氯化钠、0.25g氯化钾和1g山梨酸钾,放入500mL烧杯中,加入400mL去离子水溶解,并用2mol/L的盐酸(HCl)在39°C下调节溶液的pH至3.0。冷却后将上述溶液转入500mL容量瓶,并用去离子水定容。
胃模拟消化液:
根据模拟根据猪模拟胃液中胃蛋白酶的浓度为737.5U/ ml,称取184.38KU的胃蛋白酶溶解于250ml pH 3.0的盐酸溶液中(39℃下标定pH),缓慢搅拌直至溶解,勿在加热板上加热模拟胃液,或配制时过热;临用前配制。
小肠缓冲液:称取0.52g无水磷酸氢二钠,2.57g无水磷酸二氢钠,0.2530g山梨酸钾,青霉素12万U。放入100mL烧杯中,加入40mL去离子水溶解,并用1mol/L的磷酸或1mol/L的氢氧化钠在39°C下调节溶液的pH至6.30。冷却后将上述溶液转入50mL容量瓶,并用去离子水定容。
小肠模拟消化液:根据Dahlqvist A描述的α-淀粉酶活性测定方法,Wirnt R描述的胰蛋白酶活性测定方法,Wirnt R 描述的糜蛋白酶活性测定方法,测定试剂级淀粉酶、胰蛋白酶、糜蛋白酶中相应消化酶的活性。然后,根据模拟肠液中这三种消化酶的活性,分别称(量)取淀粉酶41.41KU,胰蛋白酶12.82KU,糜蛋白酶1.62KU溶解于17ml 去离子水中,并缓慢搅拌直至溶解(肠液酶粉剂提供的消化酶活性为50%以上)。勿在加热板上加热,或配制时过热。临用前配制。
DNS配制:称取NaOH 20.0g,去离子水溶解,定容至100ml,配制成200g/L的NaOH溶液,称取3, 5-二硝基水杨酸3.15g(化学纯),加水500ml,搅拌5s,水浴至45℃,然后逐步加入100mlNaOH溶液,同时不断搅拌,直到溶液澄清透明(注意:加入NaOH过程中,溶液温度不要超过48℃)。再逐步加入四水酒石酸钾钠91.0g、苯酚2.50g和无水亚硫酸钠2.50g,继续45℃水浴加热,同时补加水300ml,不断搅拌,直到加入的物质完全溶解,停止加热,冷却至室温后,用水定容至1000ml.储存在棕色瓶子中,避光保存,室温下放置7d后可以使用,有效期6个月。
3)单胃动物仿生消化系统预热:用1000mL去离子水代替胃缓冲液、小肠前段缓冲液、小肠后段缓冲液放入单胃动物仿生消化系统的相应位置,并将系统的管道与缓冲液瓶连接好;在控制软件中,设置单胃动物仿生消化系统的预热时间为60min;待所有消化阶段的参数输入完毕后,运行模拟消化过程;
4)上样:将单胃动物仿生消化系统中的模拟消化管清洗干净、烘干,并用翻口硅胶塞将其一端塞严;称取步骤1)制备好备用的0.25g(精确到0.0001g,用W标记)饲料试样4份,并加入单胃动物仿生消化系统的模拟消化管中,同时测定样品的干物质含量(DM);
5)胃模拟消化处理:向单胃动物仿生消化系统中胃缓冲液进入的第一根模拟消化管(对照样)中加入10ml去离子水,其他添加分析试样的4根模拟消化管(分析试样)中分别加入10ml胃模拟消化液;并在模拟消化管的另一端固定电动搅拌器,待单胃动物仿生消化系统预热结束后,将模拟消化管放置与单胃动物仿生消化系统中,并将5根模拟消化管按下端进上端出的液流方式串联连接,模拟消化管的模拟消化液加液管通过快速接头与单胃动物仿生消化系统连接;通过单胃动物仿生消化系统控制软件设置胃模拟消化参数:温度39°C,蠕动泵转速188rpm/min,消化时间4 h,开始进行胃模拟消化处理;
6)小肠模拟消化处理:胃阶段消化结束后,通过模拟消化液加液管向小肠缓冲液进入的第一根模拟消化管(对照样)中分两次添加6.0ml和1.6ml去离子水,其他添加分析试样的4根模拟消化管(分析试样)中分别依次添加6.0ml小肠缓冲液和1.6ml小肠模拟消化液至模拟消化管内;通过单胃动物仿生消化系统控制软件设置小肠模拟消化参数:温度39°C,蠕动泵转速188rpm/min,小肠消化时间为16 h,开始进行小肠模拟消化处理;
7)消化残渣处理:待饲料试样经胃和小肠模拟消化结束后,将玻璃消化管内的消化液无损失地转移到200ml干净的容量瓶中,然后用去离子水定容,封口膜密封,摇匀,从容量瓶中取30ml消化液,用一次性注射器吸取,通过滤膜过滤,滤液备用;对照组的消化液直接0.22μm滤膜过滤,备用;
8)采用DNS比色法测定对照样和分析试样中的还原糖含量,并计算得出饲料中的可消化碳水化合物总量:
①绘制标准曲线:吸取去离子水4ml于25ml刻度试管中,加入DNS试剂5ml,沸水浴5min,自来水冷却至室温,去离子水定容至25ml(直接加16ml去离子水),制成标准空白样;分别吸取10mg/ml的葡萄糖溶液1.00ml、2.00ml、3.00ml、4.00ml、5.00ml、6.00ml、和7.00ml,分别用去离子水定容至100ml,配制成浓度为0.10mg/ml~0.70mg/ml的葡萄糖标准溶液;分别吸取上述浓度的葡萄糖标准液各2ml(2个平行),加到25ml刻度试管中,再加入2.0ml去离子水,混匀,加入5.0ml DNS试剂,混匀,沸水浴5min,自来水冷却至室温,加16ml去离子水,摇匀;以标准空白样为对照调零,在540nm处测吸光度OD值;以葡萄糖浓度为Y轴,吸光度OD值为X轴,绘制标准曲线y=aX+b;
②对照样和分析试样中还原糖测定:取步骤7)制备的消化液5ml于试管中,然后再加入5ml去离子水,进行2倍稀释;再取2ml稀释后的消化液加到25ml刻度试管中,然后再加2ml去离子水,振荡混匀,加入5mlDNS,混匀,沸水浴5min。自来水冷去至室温,加16ml去离子水,混匀,分光光度计540nm处测OD值,得到对照样的OD(对照)和分析试样的OD(试样)。
实施例2
参照图1,本实施例的一种饲料可消化碳水化合物总量的仿生消化测定方法,与实施例1存在以下不同之处:
步骤1)中,所述饲料样品为鸡饲料。
步骤2)中,所述胃缓冲液的制备方法:称取0.5425g氯化钠、0.3925g氯化钾和1.5g山梨酸钾,放入500mL烧杯中,加入400mL去离子水溶解,并用2mol/L的盐酸(HCL)在41°C下调节溶液的pH至3.0,冷却后将上述溶液转入500mL容量瓶,并用去离子水定容。
步骤2)中,所述胃模拟消化液的制备方法:根据Wirnt R描述的胃蛋白酶活性测定方法,测定胃蛋白酶中胃蛋白酶的活性。然后,根据鸡模拟胃液中胃蛋白酶的浓度为1550U/ml,称取387.5KU的胃蛋白酶溶解于250ml pH 2.0的盐酸溶液中(41℃下标定pH)。缓慢搅拌直至溶解,勿在加热板上加热模拟胃液,或配制时过热;临用前配制。
步骤2)中,所述小肠缓冲液的制备方法:称取0.5837g无水磷酸氢二钠,2.5061g无水磷酸二氢钠,0.25g山梨酸钾,青霉素12万U。放入100mL烧杯中,加入40mL去离子水溶解,并用1mol/L的磷酸或1mol/L的氢氧化钠在41°C下调节溶液的pH至6.50。冷却后将上述溶液转入50mL容量瓶,并用去离子水定容。
步骤2)中,所述小肠模拟消化液的制备方法:根据Dahlqvist A描述的α-淀粉酶活性测定方法,Wirnt R描述的胰蛋白酶活性测定方法,Wirnt R 描述的糜蛋白酶活性测定方法,测定试剂级淀粉酶、胰蛋白酶、糜蛋白酶中相应消化酶的活性;然后,根据模拟肠液中这三种消化酶的活性,分别称(量)取淀粉酶88.32KU,胰蛋白酶10.84KU,糜蛋白酶2.48KU溶解于20ml 去离子水中,并缓慢搅拌直至溶解(肠液酶粉剂提供的消化酶活性为50%以上)。勿在加热板上加热,或配制时过热。临用前配制。
步骤5)中,所述胃模拟消化参数为:温度41℃;蠕动泵转速188rpm/min,消化时间4~6 h。
步骤5)和6)中,所述添加分析试样的模拟消化管的数量为5根。
步骤6)中,所述小肠模拟消化参数:温度41°C,蠕动泵转速188rpm/min,小肠消化时间为8~12h。
实施例3
参照图1,本实施例的一种饲料可消化碳水化合物总量的仿生消化测定方法,与实施例2存在以下不同之处:
步骤1)中,所述饲料样品为鸭饲料。
步骤2)中,所述胃模拟消化液的制备方法:根据Wirnt R描述的胃蛋白酶活性测定方法,测定胃蛋白酶中胃蛋白酶的活性。然后,根据鸭模拟胃液中胃蛋白酶的浓度为1550U/ ml,称取387.5KU的胃蛋白酶溶解于250ml pH 2.0的盐酸溶液中(42℃下标定pH)。缓慢搅拌直至溶解,勿在加热板上加热模拟胃液,或配制时过热;临用前配制。
所述小肠缓冲液的制备方法:称取0.6067g无水磷酸氢二钠,2.4867g无水磷酸二氢钠。
步骤2)中,所述小肠模拟消化液的制备方法:根据Dahlqvist A描述的α-淀粉酶活性测定方法,Wirnt R描述的胰蛋白酶活性测定方法,Wirnt R 描述的糜蛋白酶活性测定方法,测定试剂级淀粉酶、胰蛋白酶、糜蛋白酶中相应消化酶的活性;然后,根据模拟肠液中这三种消化酶的活性,分别称(量)取淀粉酶88.34KU,胰蛋白酶23.92KU,糜蛋白酶8.58KU溶解于20ml 去离子水中,并缓慢搅拌直至溶解(肠液酶粉剂提供的消化酶活性为50%以上)。勿在加热板上加热,或配制时过热。临用前配制。
步骤5)中,所述胃模拟消化参数为:温度42℃;蠕动泵转速188rpm/min,消化时间4 h。
步骤5)和6)中,所述添加分析试样的模拟消化管的数量为6根。
步骤6)中,所述小肠模拟消化参数:温度42°C,蠕动泵转速188rpm/min,小肠消化时间为16h。
本发明一种饲料可消化碳水化合物总量的仿生消化测定方法采用的试剂未做特别注明的均为分析纯试剂,实验用水符合GB/T6682-2008中三级水的规格。
- 还没有人留言评论。精彩留言会获得点赞!