一种基于红外光谱和高斯多峰拟合分析牡丹体内蛋白质二级结构的方法与流程
本发明属于光谱分析技术领域,涉及一种蛋白质二级结构的分析方法,尤其涉及一种基于红外光谱和高斯多峰拟合分析牡丹体内蛋白质二级结构的方法。
背景技术:
蛋白质(Protein)属于生物高分子,是构成细胞的基本物质,也是一切生命的物质基础,是生命活动的主要承担者,没有蛋白质就生物就没有生命。氨基酸是构成蛋白质的基本组成单位,氨基酸以肽键形式连接成多肽链,经过盘曲折叠形成的具有一定空间结构的物质。蛋白质具有一级、二级、三级和四级分子结构,不同的分子结构决定了它的具体活性和功能。蛋白质的一级结构是指氨基酸残基在肽链中的排列顺序;肽链中的主链借助氨基酸残基亚氨基上的氢原子和羰基上的氧原子之间形成的氢键,有规则的卷曲折叠成沿一维方向具有周期性结构的构象被称为蛋白质的二级结构,包括α-螺旋、β-折叠和无规卷曲等。在二级结构的基础上,肽链按照一定的空间结构可进一步形成更复杂的三级结构。具有三级结构的多肽链按一定的空间排列方式结合在一起形成的聚集体结构称为蛋白质的四级结构。研究表明蛋白质二级结构决定着蛋白质分子各个基团的空间分布,而其所占的比例在一定程度上显著影响着蛋白的活性与功能。
目前,鉴定蛋白质的二级结构是一项非常繁琐的工作,研究人员要先对样品中蛋白质进行提取,然而有一部分蛋白质(膜蛋白质)很难被提取出来。提取出的蛋白质需要富集成一定的量才能进一步进行纯化。纯化可以借助硫酸铵沉淀法、琼脂糖凝胶法的一维或二维电泳,主要是根据蛋白质的分子量和等电点等性质进行初步分离。再根据蛋白质的带电性及结构大小,采用分步洗脱的柱层析方法进行分离收集,得到纯的蛋白质样品。纯化后的已知分子量和摩尔浓度的蛋白质才能借助圆二色谱进行蛋白质二级结构的分析。显然,整个过程中实验步骤繁琐、工作量大、未知因素多、所需成本极高。许多研究者都对蛋白质二级结构的分析望而却步,从而限制了蛋白质生物活性的深入研究。因此,通过研究并获得一种简单有效鉴定蛋白质二级结构的方法,这显得尤为迫切。
通过检索国内外现有技术,目前尚未发现利用傅里叶变换红外光谱(Fourier Transformation Infrared Spectroscopy,FTIR)和高斯多峰拟合研究植株水平上植物体内蛋白质二级结构的报道。
技术实现要素:
鉴于现有技术的不足,本发明的目的在于提供一种可简单有效检测牡丹体内全蛋白质二级结构的方法,以填补植株水平上蛋白质二级结构研究的空白,解决现有技术成本高、周期长和数据涵盖面窄等困扰研究者的难题。
为了实现本发明的目的,发明人通过大量试验研究并不懈探索,最终获得了如下一种基于红外光谱和高斯多峰拟合分析牡丹体内蛋白质二级结构的方法,该方法包括如下步骤:将干燥的牡丹植株器官样品磨成粉末,采用溴化钾压片法进行FTIR的扫描,根据所得FTIR原始数据作曲线图,选取图中1600-1700cm-1处氨基I区域的曲线进行高斯单峰正态分布的曲线拟合,再根据不同蛋白质二级结构的FTIR峰位对拟合峰进行高斯多峰拟合,根据峰面积计算样品中蛋白质的各种二级结构百分比。
进一步对本发明技术参数进行优选后,如上所述牡丹体内蛋白质二级结构的分析方法,该方法的具体步骤包括:
(1)取干燥的样品与100-200倍量的干燥KBr研成均一细粉,粒径小于2μm,底模装入模膛,将所述细粉加入液压机模心,然后将顶模放入模心,用(5-10)×107Pa压力在液压机上压成透明薄片,将KBr压片夹放入红外光谱仪中的透射配件中,以KBr空白片或空气为参比,选用4cm-1的分辨率,扫描128次,波数范围是400-4000cm-1,获得FTIR原始数据;
(2)借助Origin 8.0统计软件对FTIR原始数据进行分析,首先对该原始数据作曲线图,得到牡丹植株器官样品的原始FTIR图谱;
(3)在所述原始FTIR图谱中选取1600-1700cm-1处氨基I区域的曲线,对其进行高斯单峰正态分布的曲线拟合;
(4)再根据不同蛋白质二级结构的FTIR峰位,对步骤(3)所得拟合曲线再次进行高斯多峰拟合,根据拟合结果判定多峰拟合的分峰数和峰面积,从而计算出牡丹植株器官样品中蛋白质的各种二级结构百分比。
进一步优选地,如上所述牡丹体内蛋白质二级结构的分析方法,其中牡丹植株器官样品的制样方法是:将清洗干净的牡丹植株器官鲜样切碎后,置于110℃杀青1h,75℃烘干至恒重,然后用经球磨仪将样品粉碎成粉末,粒径小于2μm。
进一步优选地,如上所述牡丹体内蛋白质二级结构的分析方法,其中的牡丹植株器官选自牡丹的根、茎、叶和花的一种。
根据牡丹根氨基I区域(1600-1700cm-1)的曲线拟合结果发现,在牡丹的根系中只存在β+S、β、α和L+T二级结构,不存在β+T的二级结构。这说明对牡丹根中蛋白质进行高斯多峰拟合分析时,为避免β+T对分析结果的影响,应该选用4个分峰而不是5个分峰。再进一步优选地,如上所述牡丹体内蛋白质二级结构的分析方法,其中的牡丹植株器官选自牡丹的根,对牡丹根中蛋白质进行高斯多峰拟合分析时选用β+S、β、α和L+T共4个分峰。
与现有技术相比,本发明利用FTIR、高斯单峰拟合和高斯多峰拟合等方法提出一种简单精确的测定牡丹植株水平上蛋白质二级结构的方法,该方法具有如下有益效果:
(1)可以直接对植株水平上样品进行蛋白质二级结构的分析,不需要对蛋白质进行提取和纯化,能大幅度降低实验成本,缩短实验周期、节约人力物力。
(2)本发明是基于FTIR光谱法和高斯多峰拟合进行数据的采集和分析,不仅简单有效,准确度高,而且数据说服力强。
(3)对其进行3次重复实验,经过计算,实验的相对偏差为0.09%,即实验数据较为精确,重复性较好。
附图说明
图1为牡丹根的FTIR光谱图;
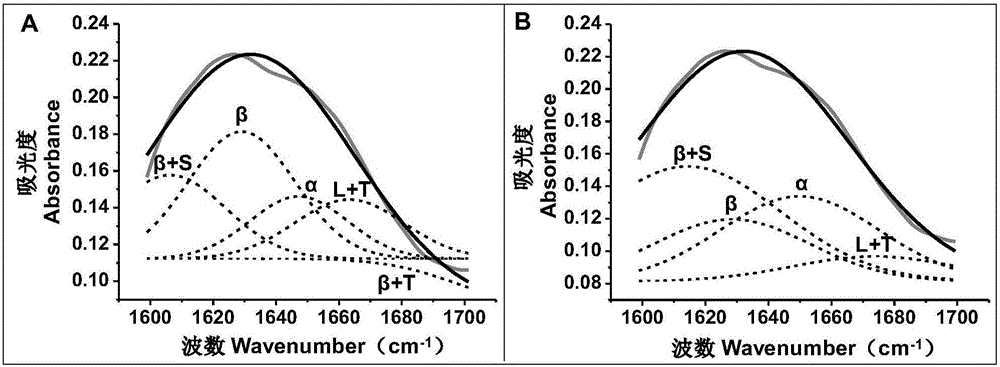
图2为牡丹根氨基I区域(1600-1700cm-1)的拟合曲线图。A,高斯多峰5个分峰拟合曲线图;B,高斯多峰4个分峰拟合曲线图。注:灰色实线为原始数据,黑色实线为非线性曲线单峰拟合图谱,黑色虚线为高斯多峰拟合结果。L、T、α、β和S分别代表环(loop)、转角(turn)、α-螺旋(α-helical)、β-折叠(β-sheet)和侧链(side chain)。
具体实施方式
下面的实施例仅对本发明的技术方案和技术效果作进一步说明,而不以任何方式限制本发明的保护范围。并且,以下提到的牡丹根样品可根据实验换成牡丹植株的任何一个组织器官。
实施例1:牡丹体内蛋白质二级结构的鉴定分析
将干燥的牡丹根样品磨成粉末,采用溴化钾压片方法进行FTIR的扫描。对原始图谱进行高斯单峰拟合,再依据不同蛋白质二级结构的特征峰峰位对拟合单峰进行高斯多峰拟合,根据峰面积计算样品中各种蛋白质二级结构百分比。
具体操作方法如下:
(1)即取干燥牡丹根1-2mg与200mg干燥的KBr研成均一细粉(直径约2μm),以免散射光影响。底模装入模膛(注意抛光面向上),加入少量样品于模心,用药匙将模具中的样品刮平,并使其中心略高,然后将顶模放入模心,用(5-10)×107Pa压力在液压机上压成透明薄片(约1-2min),将KBr压片夹放入红外光谱仪中(Bruker vertex 70)的透射配件中,以KBr空白片(或空气)为参比,选用4cm-1的分辨率,扫描128次;波数范围是400-4000cm-1,扫描后获得FTIR的原始数据。
(2)借助Origin 8.0统计软件对FTIR原始数据进行分析,首先对原始数据进行作图,得到牡丹根的原始FTIR图谱。
(3)在原始图谱中选取氨基I区域(1600-1700cm-1)的曲线并对其进行高斯单峰正态分布的曲线拟合。
(4)再根据不同蛋白质二级结构的FTIR峰位,对高斯单峰拟合曲线再次进行高斯多峰拟合,根据拟合结果判定多峰拟合所需的分峰数。
实施例2:牡丹根中的蛋白质二级结构分析
选用实施例1中描述的操作步骤,对牡丹根进行蛋白质二级结构的分析。牡丹根的FTIR曲线图如图1所示,表明牡丹根存在氨基I的峰,即在1600-1700cm-1处存在红外吸收峰。对1600-1700cm-1谱图(图2中图A和图B中灰色实线)进行高斯单峰拟合,结果如图2中图A和图B中黑色实线所示,拟合方程为:
其中y0为0.08,xc为1631.94,w为67.17,A为11.97,该拟合方程的R2为0.99。
根据蛋白质二级结构的峰位(表1所示)对拟合单峰(图1及如图2中A和B黑色实线)进行高斯多峰拟合。从表1可知,1600-1700cm-1间存在5种蛋白质的二级结构,波数从低到高依次为:β+S、β、α、L+T和β+T,其中L、T、α、β和S分别代表环(loop)、转角(turn)、α-螺旋(α-helical)、β-折叠(β-sheet)和侧链(side chain)。先对其进行5个峰位的分峰,结果如图2中A所示的黑色虚线所示,1615cm-1处的β+T结构对应的峰面积为负值,即牡丹根的蛋白质中不含有β+T的二级结构。因此,为避免蛋白质的β+T二级结构影响分析结果,再次对拟合单峰进行其它4个峰位的分峰(图2中B所示的黑色虚线部分)。结果显示高斯多峰拟合方程的R2为1,每种蛋白质二级结构对应的峰面积如表1所示,根据峰面积可以看出:牡丹根的蛋白质二级结构中β+S(45.98%)>α(27.59%)>β(19.09%)>L+T(7.34%)。
表1牡丹根中蛋白质二级结构的高斯多峰拟合峰位及所占百分比
实施例3:牡丹枝干中蛋白质二级结构的分析
将干燥的牡丹枝干磨成粉末,具体操作方法按照实施例1的操作方法。牡丹枝干FTIR结果显示在1600-1700cm-1处存在红外吸收峰,其高斯单峰拟合方程为:
其中y0为0.34,xc为1633.71,w为84.47,A为10.58,该拟合方程的R2为0.99。
结果显示,高斯多峰(4个分峰)拟合方程的R2为1,如表2所示,牡丹枝干中蛋白质的二级结构为β+S、β、α和L+T。牡丹枝干的蛋白质二级结构中β+S(44.32%)>α(29.65%)>β(13.22%)>L+T(12.81%)。
表2牡丹枝干中蛋白质二级结构的高斯多峰拟合峰位及所占百分比
实施例4:牡丹叶片中蛋白质二级结构的分析
将干燥的牡丹叶片磨成粉末,具体操作方法按照实施例1的操作方法。牡丹叶片FTIR结果显示在1600-1700cm-1处存在红外吸收峰,其高斯单峰拟合方程为:
其中y0为0.10,xc为1639.93,w为85.15,A为20.52,该拟合方程的R2为0.97。
结果显示,高斯多峰(5个分峰)拟合方程的R2为1,如表3所示,牡丹叶片中含有5种蛋白质二级结构:β+S、β、α、L+T和β+T。牡丹叶片的蛋白质二级结构中β+S(33.79%)>β(24.39%)>α(22.22%)>L+T(17.49%)>β+T(2.11%)。
表3牡丹叶片中蛋白质二级结构的高斯多峰拟合峰位及所占百分比
实施例5:牡丹花瓣中蛋白质二级结构的分析
将干燥的牡丹花瓣磨成粉末,具体实施方法参照按照实施例1的操作方法。牡丹花瓣FTIR结果显示在1600-1700cm-1处存在红外吸收峰,其高斯单峰拟合方程为:
其中y0为-0.06,xc为1639.73,w为107.46,A为35.29,该拟合方程的R2为0.98。
结果显示,高斯多峰(4个分峰)拟合方程的R2为1,如表4所示,牡丹花瓣中含有4种蛋白质二级结构:β+S、β、α、L+T。牡丹花瓣的蛋白质二级结构中β+S(37.74%)>α(28.11%)>L+T(18.38%)>β(15.77%)。
表4牡丹花瓣中蛋白质二级结构的高斯多峰拟合峰位及所占百分比
- 还没有人留言评论。精彩留言会获得点赞!