被检物质的检测方法、检测用试剂盒及检测用试剂与流程
本发明涉及被检物质的检测方法、检测用试剂盒及检测用试剂。
背景技术:
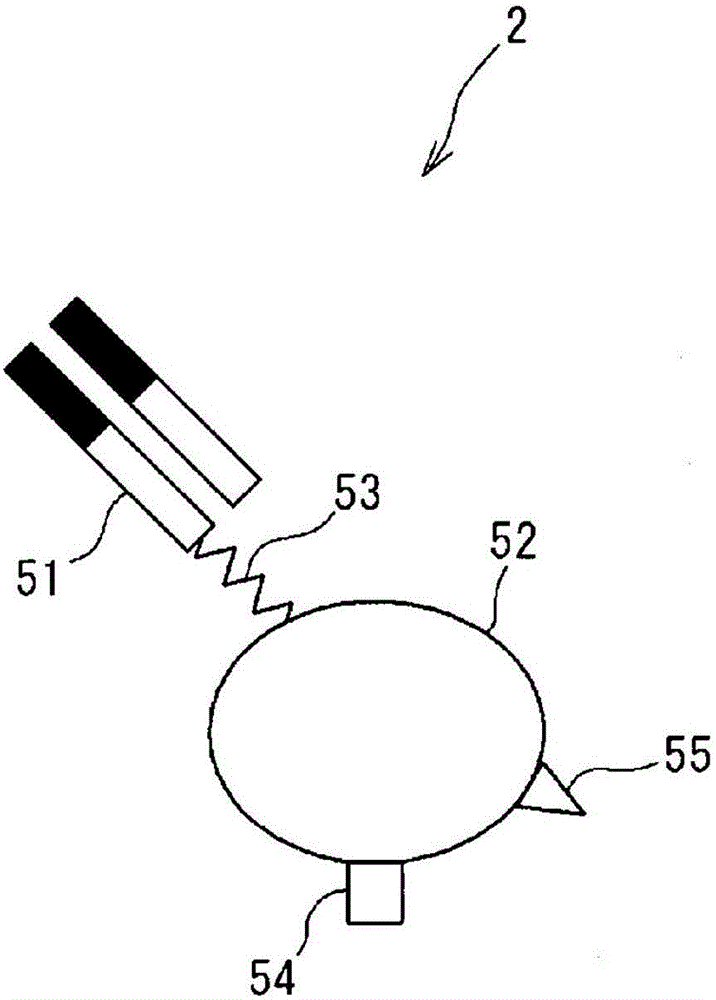
:如JapanesePatentPublicationNo.H01/254868一样,作为被检物质的检测方法,有免疫复合物转移法。在用JapanesePatentPublicationNo.H01/254868中记载的方法时,暂且在载体上形成含测定对象的抗原和活性成分的免疫复合物。载体的清洗后,从载体使免疫复合物解离。使解离的免疫复合物与别的载体结合。载体的清洗后,测定载体上的免疫复合物。技术实现要素:但是,在用JapanesePatentPublicationNo.H01/25486中记载的方法时,当样品中所含的被检物质的量是微量时,难以确保充分的灵敏度。本发明旨在提供能以更高的灵敏度检测被检物质的被检物质的检测方法、检测试剂盒及检测用试剂。【解决课题的技术方案】本发明之一侧面包括被检物质的检测方法,其包括:(A)形成含被检物质、与被检物质特异性地结合的第1捕获体、特异性地结合于与被检物质中的第1捕获体的结合部位不同的部位的第2捕获体、和与第2捕获体特异性地结合的第3捕获体的第1复合物的工序;(B)从第1复合物分离含第1捕获体的一部分的工序;(C)用第4捕获体捕获含第1捕获体的一部分,形成第2复合物的工序;及(D)检测第2复合物中所含的被检物质的工序,其中第2捕获体含与被检物质结合的结合物质、支持体及连接结合物质和支持体之间的接头。本发明的其他侧面含被检物质的检测用试剂盒,其含能与被检物质结合的第1捕获体、能结合于与被检物质中的第1捕获体的结合部位不同的部位的第2捕获体及能与第2捕获体结合的第3捕获体,其中第2捕获体含与被检物质结合的结合物质、支持体及连接结合物质和支持体之间的接头。本发明的还其他侧面含被检物质的检测用试剂,其为用于在前述的被检物质的检测方法中使用的被检物质的检测用试剂,其含能与被检物质结合的第2捕获体,其中第2捕获体含与被检物质结合的结合物质、支持体及连接结合物质和支持体之间的接头。【发明效果】由本发明能提供能以高的灵敏度检测被检物质的被检物质的检测方法、检测用试剂盒及检测用试剂。【附图说明】【图1】是第2捕获体的概略说明图。【图2】是被检物质的检测方法的顺序的一例的工序图。【图3】是检测用试剂盒的构成图。【图4】是显示在实施例1及比较例1中研究复合物保持率的结果的坐标图。【图5】是显示在实施例2及比较例2~4中研究S/N比的结果的坐标图。【图6】是显示在实施例3~5及比较例5~7中研究S/N比的结果的坐标图。【图7】是显示在实施例6~8及比较例8中研究S/N比的结果的坐标图。【实施方式】【1.被检物质的检测方法】本实施方式涉及的被检物质的检测方法包括(A)形成含被检物质、与被检物质特异性地结合的第1捕获体、特异性地结合于与被检物质中的第1捕获体的结合部位不同的部位的第2捕获体及与第2捕获体特异性地结合的第3捕获体的第1复合物的工序;(B)从第1复合物分离含第1捕获体的一部分的工序;(C)用第4捕获体捕获含第1捕获体的一部分,形成第2复合物的工序;及(D)检测第2复合物中所含的被检物质的工序。第2捕获体含与被检物质结合的结合物质、支持体及连接结合物质和支持体之间的接头。本实施方式涉及的被检物质的检测方法,例如,可由免疫测定方法等的利用抗原抗体反应的方法等进行。此时,第1捕获体和所述被检物质利用抗原抗体反应而形成复合物。另外,所述第2捕获体和所述被检物质利用抗原抗体反应而形成复合物。在免疫复合物转移法(以下也称为“ICT-EIA”)中,以由2种捕获体夹被检物质的方式捕获,使免疫复合物形成。在以往的免疫复合物转移法中,由本发明人发现,由一部分的免疫复合物的解离而灵敏度降低。另外,当被检物质的量是微量时,难以确保充分的灵敏度。与此相比,在本实施方式的被检物质的检测方法中,使用结合物质和支持体之间经接头连接的第2捕获体。从而,在本实施方式的被检物质的检测方法中,以由第1捕获体和第2捕获体夹被检物质的方式捕获,使夹心复合物形成。由此认为,在由第2捕获体捕获被检物质时,抑制空间障碍的发生。因此认为,可抑制第1捕获体、被检物质和第2捕获体的复合物的解离,使被检物质的检测的灵敏度升高。作为被检物质,例如,可举出抗体、抗原、核酸、生理活性物质、细菌、病毒、肽、治疗药剂(血中药剂)等,但不特别限定。再者,抗体也可成为抗原。作为抗体,可举出对抗原的抗体、对抗体的抗体等,但不特别限定。作为抗原,可举出核酸、生理活性物质、细菌、病毒、肽等,但不特别限定。作为核酸,例如,可举出编码疾病成因基因等的核酸、编码细菌或病毒的基因的核酸等,但不特别限定。作为生理活性物质,例如,可举出细胞生长因子、分化诱导因子、细胞粘接因子、酶、细胞因子、激素、糖链等,但不特别限定。第1捕获体含与被检物质特异性地结合的第1结合物质。在本说明书中,“特异性地”是指基本上不与特定物质以外的物质结合,或者基本上不与特定物质以外的物质以能检测的水平发生抗原抗体反应。第1捕获体,从提高被检物质的检测容易性的观点,优选还有能检测的标记物质。作为第1结合物质,例如,可举出抗体、适体、Affibody(Affibody公司的注册商标)、凝集素、核酸等,但不特别限定。再者,在本说明书中,只要不特别说明,在“抗体”的概念中也包含“抗体片段”。作为第1结合物质的抗体有与被检物质特异性地结合的功能。作为抗体,例如,可举出小鼠来源的抗体、兔来源的抗体、山羊来源的抗体、绵羊来源的抗体、猪鼠来源的抗体、鳗来源的抗体、鲨来源的抗体、人源化抗体、嵌合抗体等,但不特别限定。另外,抗体可为单克隆抗体及多克隆抗体的任何。作为抗体片段,例如,可举出Fab、Fab’、F(ab’)2、单链抗体〔scFc〕等,但不特别限定。适体也可为核酸适体及肽适体的任何。Affibody(注册商标)是有蛋白A的特定结构域作为骨架的多肽。另外,Affibody有与被检物质特异性地结合的功能。凝集素是与作为被验物质的糖链特异性地结合的蛋白质。核酸是与作为被检物质的核酸特异性地结合的核酸。作为核酸,例如,可举出DNA、RNA、肽核酸(PNA)、交联化核酸(BNA)等,但不特别限定。在这些的结合物质之中,优选为抗体。作为标记物质,可举出酶、荧光物质、放射性物质等,但不特别限定。作为酶,例如,可举出β-半乳糖苷酶、过氧化物酶、碱性磷酸酶、荧光素酶等,但不特别限定。作为荧光物质,例如,可举出荧光素、异硫氰酸荧光素、香豆素、若丹明、荧光素、Cy3、Cy5、Hoechst33342、4’,6-二脒-2-苯基吲哚(DAPI)、碘化丙啶(PI)、AlexaFluor(MolecularProbes公司的注册商标)系列的染料等,但不特别限定。作为放射性物质,可举出32P、35S等,但不特别限定。标记物质是优选为酶、更优选为β-半乳糖苷酶及碱性磷酸酶。第2捕获体特异性地结合于与被检物质中的第1捕获体的结合部位不同的部位。从而,第2捕获体,在与被检物质结合时,不与第1捕获体竞争结合。第2捕获体含与被检物质结合的第2结合物质、支持体和接头。接头连接第2结合物质和支持体。支持体有第1反应基和第2反应基。第2结合物质是结合于与被检物质中的第1捕获体的结合部位不同的部位的物质。作为第2结合物质,例如,可举出抗体、适体、Affibody(Affibody公司的注册商标)、凝集素、核酸等,但不特别限定。作为第2结合物质的抗体有与被检物质特异性地结合的功能。作为抗体,例如,可举出小鼠来源的抗体、兔来源的抗体、山羊来源的抗体、绵羊来源的抗体、猪鼠来源的抗体、鳗来源的抗体、鲨来源的抗体、人源化抗体、嵌合抗体等,但不特别限定。作为支持体,例如,可举出多肽、葡聚糖、酪蛋白等,但不特别限定。多肽是无第1捕获体的结合部位的多肽。多肽随被检物质的种类等而不同。作为多肽,例如,可举出牛血清白蛋白、人血清白蛋白等的白蛋白等,但不特别限定。作为第1反应基,只要是能结合第3捕获体的物质,就不特别限定。作为第1反应基,例如,可举出二硝基苯基(DNP)基、生物素、抗体、抗原、亲和素、链霉亲和素等。作为第2反应基,只要是能结合第4捕获体的物质,就不特别限定。作为第2反应基,例如,可举出DNP基、生物素、抗体、抗原、亲和素、链霉亲和素等。再者,第2反应基是第1反应基。在本说明书中,“接头”是指第2连接结合物质和支持体之间的分子。作为接头,可举出任选有选自取代基、氧原子、硫原子及氮原子的至少1种的聚合物链等,但不特别限定。作为聚合物链,例如,可举出有碳原子数2~6的氧化烯基的聚亚烷基二醇链、式(I):【化1】(式中,X表示氮原子、氧原子、硫原子、碳原子数1~4的亚烷基、-NHCO-基、任选有取代基的碳原子数6~12的芳基或任选有取代基的碳原子数3~8的环烷基、m、n及p互相独立地表示2以上的正整数)所表示的聚合物链等,但不特别限定。再者,式(I)所表示的聚合物链在一侧末端连接第2结合物质。另外,在聚合物链的另一侧的末端连接支持体。式(I)所表示的聚合物链可经用于与结合物质或支持体结合的官能团而与第2结合物质或支持体结合。在聚亚烷基二醇链中,氧化烯基的碳原子数是2~6、优选为2~4。另外,在聚亚烷基二醇链中,氧化烯基的平均加成摩尔数是2~100、优选为2~20。聚亚烷基二醇链的质量平均分子量优选为116~12000、更优选为116~2000。作为碳原子数2~6的氧化烯基,例如,可举出氧乙烯基、氧丙烯基等,但不特别限定。作为聚亚烷基二醇链,例如,可举出聚乙二醇、聚丙烯二醇等,但不特别限定。聚亚烷基二醇链也可均聚物、交替共聚物、嵌段共聚物及无规共聚物的任何。再者,“质量平均分子量”是由凝胶过滤层析求出的值。在式(I)中,X是氮原子、氧原子、硫原子、碳原子数1~4的亚烷基、-NHCO-基、任选有取代基的碳原子数6~12的芳基或任选有取代基的碳原子数3~8的环烷基。芳基的碳原子数是6~12、优选为6~8、更优选为6~7。作为芳基可以有的取代基,例如,可举出甲基、氧代基、羧基、氨基等,但不特别限定。作为芳基,可举出苯基、甲苯基等,但不特别限定。环烷基的碳原子数是3~8、优选为4~6。环烷基也可有的取代基与芳基也可有的取代基同样。作为环烷基,例如,可举出环丙基、环丁基、环戊基、环己基等,但不特别限定。在这些接头之中,从抑制夹心复合物形成时的被检物质的解离等的观点,优选为有碳原子数2~6的氧化烯基的聚亚烷基二醇链,更优选为碳原子数2~6的氧化烯基的平均加成摩尔数是2~100的聚亚烷基二醇链。在聚亚烷基二醇链之中,从更确实地抑制夹心复合物形成时的被检物质的解离等的观点,优选为聚乙二醇链,更优选为氧乙烯基的平均加成摩尔数是2~100的聚乙二醇链。第3捕获体与第2捕获体特异性地结合。第3捕获体优选含与第2捕获体结合的第3结合物质和保持结合物质的固相。第3捕获体中的第3结合物质结合于与第2捕获体中的被检物质的结合部位不同的部位。作为第3捕获体中的第3结合物质,例如,可举出抗体、适体、Affibody(Affibody公司的注册商标)、凝集素、核酸、生物素、亲和素、链霉亲和素等,但不特别限定。作为第3结合物质的抗体有与被检物质特异性地结合的功能。作为抗体,例如,可举出小鼠来源的抗体、兔来源的抗体、山羊来源的抗体、绵羊来源的抗体、猪鼠来源的抗体、鳗来源的抗体、鲨来源的抗体、人源化抗体、嵌合抗体等,但不特别限定。作为固相,例如,可举出粒子、板等,但不特别限定。作为粒子,例如,可举出磁性粒子、乳胶粒子等,但不特别限定。作为板,例如,可举出聚苯乙烯制板等,但不特别限定。再者,作为第2捕获体中的第1反应基与第3捕获体中的第3结合物质的组合,例如,可举出半抗原和抗半抗原抗体的组合、此外的抗原和抗体的组合等,但不特别限定。作为半抗原和抗半抗原抗体的组合,例如,可举出DNP-抗DNP抗体、生物素-抗生物素抗体等,但不特别限定。第4捕获体捕获含第1捕获体的一部分。其中,“含第1捕获体的一部分”是指对于确保第1捕获体的量与被检物质的量之间的相关性充分的部分。含第1捕获体的一部分优选为第1复合物中的第3捕获体以外的部分。作为含第1捕获体的一部分,例如,可举出第1捕获体和被检物质的复合物、第1捕获体和被检物质和第2捕获体的复合物等。第4捕获体优选含与含第1捕获体的一部分结合的第4结合物质和固相。作为第4结合物质,可举出抗体、抗体片段、适体、Affibody(Affibody公司的注册商标)、凝集素、核酸、生物素、亲和素、链霉亲和素、与第2捕获体中的支持体具有的反应基结合的物质等。固相将第4结合物质固定保持。作为第4捕获体中的固相,可举出与第3捕获体中的固相同样的。作为第2捕获体中的第2反应基与第4捕获体中的第4结合物质的组合,例如,可举出半抗原和抗半抗原抗体的组合、其他的抗原和抗体的组合等,但不特别限定。作为半抗原和抗半抗原抗体的组合,例如,可举出DNP-抗DNP抗体、生物素-抗生物素抗体等,但不特别限定。第2反应基和第4捕获体的组合是与第1反应基和第3捕获体的组合不同的组合。第2捕获体的一例示于图1。图1所示的第2捕获体2含作为第2结合物质51的Fab’、支持体52和接头53。第2结合物质51和支持体52由接头53连接。在支持体52的表面,有第1反应基54和第2反应基55。第1反应基54是能结合或脱离第3捕获体的部分。另外,第2反应基55是能结合第4捕获体的部分。第3捕获体中的第3结合物质也可为与图1中的第2捕获体2中的支持体52具有的第1反应基54结合的物质。与图1中的第1反应基54结合的物质可根据图1中的第1反应基54的种类适宜选择。作为图1中的第1反应基54与第3捕获体中的第3结合物质的组合,例如,可举出DNP基和抗DNP抗体的组合、三硝基苯基(TNP)基和抗TNP抗体的组合、生物素和亲和素的组合等,但不特别限定。另外,与图1中的第2反应基55结合的物质可根据图1中的第2反应基55的种类适宜选择。作为第2反应基55与第4捕获体中的第4结合物质的组合,例如,可举出DNP基和抗DNP抗体的组合、TNP基和抗TNP抗体的组合、生物素和亲和素的组合、生物素和链霉亲和素的组合等,但不特别限定。接下来,说明本实施方式涉及的被检物质的检测方法的顺序的一例。本实施方式涉及的被检物质的检测方法的顺序的一例示于图2。在图2中,举例说明检测图2(a)所示的含被检物质S和混杂物质F的样品中的被检物质S的情况。再者,在图2中,第1捕获体1、第2捕获体2、第3捕获体3等的种类等不特别限定。其中,“混杂物质”是指被检物质以外的物质。再者,在图2中,通过使第1捕获体1、第2捕获体2及第3捕获体3依次接触被检物质S形成第1复合物13。但是,被检物质S、第1捕获体1、第2捕获体2及第3捕获体3的混合顺序不特别限定。在工序(A)中,使含被检物质S、第1捕获体1、第2捕获体2和第3捕获体的第1复合物13形成。具体而言,首先,如图2(a)及(b)所示,使第1捕获体1与含被检物质S和混杂物质F的样品接触。由此,形成第1捕获体1和被检物质S的复合物11。接下来,如图2(c)所示,使复合物11和第2捕获体2接触。由此,形成夹心复合物12。夹心复合物12是被检物质S与第1捕获体1及第2捕获体2结合至被第1捕获体1和第2捕获体2所夹的复合物。其后,使夹心复合物12和第3捕获体3接触。由此,如图2(d)所示,形成第1复合物13。第1复合物13含第1捕获体1、被检物质S、第2捕获体2和第3捕获体3。在图2(d)中,第3捕获体3含固相61和在固相61上固定的第3结合物质62。在第1复合物13形成时,如图2(d)所示,第3捕获体3中的第3结合物质62与第2捕获体2中的第1反应基54结合。第1复合物13,例如,可由利用抗原抗体反应等形成。第1复合物13的形成从提高对被检物质S的特异性,使灵敏度升高的观点,优选利用抗原抗体反应。此时,第1捕获体1优选含由抗原抗体反应与被检物质S特异性地结合的物质。另外,第2捕获体2优选含由抗原抗体反应与被检物质S特异性地结合的物质作为第2结合物质。被检物质S是抗原时,可使用与抗原特异性地结合的抗体、使此抗体片段化的抗体片段等。另一方面,被检物质S是抗体时,可使用此抗体的抗原、与所述抗体特异性地结合的抗体等。第1复合物13的形成可在相应于被检物质S、第1捕获体1、第2捕获体2及第3捕获体3各自的种类的条件下进行。第1复合物13的形成可在溶液中进行。溶液是对于第1捕获体1和被检物质S和第2捕获体2和第3捕获体3的结合适宜的溶液即可。第1复合物13的形成温度是对于第1捕获体1和被检物质S和第2捕获体2和第3捕获体3的结合适宜的温度即可。第1复合物13的形成时间是对于进行第1捕获体1和被检物质S和第2捕获体2和第3捕获体3的结合充分的时间即可。从灵敏度的升高的观点,在工序(A)和后述的工序(B)之间,还可进行游离状态的第1捕获体1及游离状态的第2捕获体2的除去的工序(以下称为“第1除去工序”)。在第1除去工序中,例如,可进行使用缓冲液等的清洗等。作为缓冲液,例如,可举出磷酸缓冲化生理盐水、磷酸钠缓冲液、Tris盐酸缓冲液等,但不特别限定。缓冲液的pH是可稳定保持第1复合物13的范围即可。再者,在第1除去工序中,游离状态的混杂物质F也被除去。在工序(B)中,如图2(e)所示,从第1复合物13分离含第1捕获体1的一部分。含第1捕获体1的一部分从确保分离的容易性及充分的定量性的观点,优选为复合物11及夹心复合物12、更优选为夹心复合物12。再者,在图2(e)中,从第1复合物13,作为含第1捕获体1的一部分分离夹心复合物12。但是,含第1捕获体1的一部分也可在夹心复合物12以外。分离,例如,可由对应于第1复合物13中所含的结合的种类等的分离方法进行。作为第1复合物13中所含的结合,例如,可举出第1捕获体1和第2捕获体2的结合、第2捕获体2和第3捕获体3的结合、复合物11中所含的结合、夹心复合物12中所含的结合等。作为第1复合物中所含的结合,具体而言,例如,可举出经二硫键的结合、经DNP基的结合等,但不特别限定。作为经二硫键的结合,例如,可举出经二硫键的抗原和抗体的结合、生物素和亲和素或链霉亲和素的结合等,但不特别限定。作为经DNP基的结合,例如,可举出DNP和抗DNP抗体的结合等,但不特别限定。在分离中可使用,不切断第1捕获体1,并且用于从第1复合物13至少分离第3捕获体3的分离试剂。第1复合物13,在除该第1捕获体1外的部分有二硫键时,作为分离试剂可使用切断二硫键的试剂。作为切断二硫键的试剂,例如,可举出2-巯基乙醇、二硫苏糖醇等,但不特别限定。另外,第1复合物13,在除该第1捕获体1外的部分有经DNP基的结合时,作为分离试剂可使用二硝基苯基氨基酸。作为二硝基苯基氨基酸,例如,可举出二硝基苯基赖氨酸等,但不特别限定。再者,第1除去工序后,有时残留游离状态的第1捕获体1及游离状态的第2捕获体2。从而,从灵敏度的升高的观点,在工序(B)和后述的工序(C)之间,还可进行除去游离状态的第1捕获体1及游离状态的第2捕获体2的工序。在工序(C)中,如图2(f)所示,用第4捕获体4捕获含第1捕获体1的一部分。由此,使第2复合物14形成。在图2(f)中,第4捕获体4含固相71和在固相71上固定的第4结合物质72。在第2复合物14形成时,如图2(d)所示,第4捕获体4中的第4结合物质72与第2捕获体2中的第2反应基55结合。第2复合物14的形成可由与工序(A)中的第1复合物13的形成同样的方法进行。再者,从灵敏度的升高的观点,在工序(C)和后述的工序(D)之间,还可进行除去游离状态的第4捕获体的工序。在工序(D)中,如图2(g)所示,检测第2复合物14中所含的被检物质S。被检物质的检测,在第1捕获体1含标记物质时,可通过检测基于第1捕获体1中所含的标记物质的信号进行。作为信号,例如,可举出发光、荧光、显色、放射线等,但不特别限定。信号为了检测容易,优选为发光、荧光及显色。基于标记物质的信号的检测可由根据标记物质的种类的检测方法进行。当标记物质是酶时,可通过测定由酶反应从酶底物发生的生成物的量等进行信号的检测。酶底物为了容易测定生成物的量,优选为显色底物及化学发光基质。酶底物可根据酶的种类适宜选择。标记物质是荧光物质时,可通过测定基于荧光物质的荧光的强度、荧光波长的变动等进行信号的检测。标记物质是放射性物质时,可通过检测从放射性物质发生的放射线量进行信号的检测。【2.被检物质的检测用试剂盒】本实施方式涉及的检测用试剂盒含能与被检物质结合的第1捕获体、能结合于与被检物质中的第1捕获体的结合部位不同的部位的第2捕获体及能与第2捕获体结合的第3捕获体,第2捕获体含与被检物质结合的结合物质(前述的第2结合物质)、支持体及连接结合物质和支持体之间的接头。第1捕获体、第2捕获体、第3捕获体、第4捕获体、结合物质(前述的第2结合物质)、支持体及接头与在前述的被检物质的检测方法中使用的同样。第1捕获体、第2捕获体、第3捕获体及第4捕获体可在溶解于适宜的溶剂的状态下提供。第1捕获体、第2捕获体及第3捕获体和第4捕获体从抑制混杂物质的非特异性的检测的观点,优选收容在不同的容器中。第1捕获体、第2捕获体、第3捕获体及第4捕获体也可在各自不同的容器中收容。另外,第1捕获体、第2捕获体及第3捕获体也可将2种以上放入相同的容器中。另外,第1捕获体、第2捕获体及第3捕获体也可将2种以上放入相同的容器中。本实施方式涉及的检测用试剂盒还任选含有助剂。作为助剂,例如,可举出用于稳定地维持第1捕获体、第2捕获体、第3捕获体及第4捕获体的保存剂或稳定化剂、用于形成含第1捕获体、第2捕获体和第3捕获体的第1复合物的试剂、分离试剂、用于形成含第1捕获体的一部分和含第4捕获体的第2复合物的试剂等,但不特别限定。作为助剂,例如,可举出缓冲液等。在第1捕获体有标记物质时,本实施方式涉及的检测用试剂盒任选还含有对于基于标记物质的信号的检测必要的试剂。对于信号的检测必要的试剂可根据标记物质的种类适宜选择。作为对于信号的检测必要的试剂,例如,可举出酶基质、显色剂等,但不特别限定。作为本实施方式涉及的检测用试剂盒的一例,可举出图3所示的检测用试剂盒200等,但不特别限定。图3所示的试剂盒200含第1试剂容器201、第2试剂容器202和第3试剂容器203。第1试剂容器201收容能与被检物质结合的第1捕获体。第2试剂容器202收容能结合于与被检物质中的第1捕获体的结合部位不同的部位的第2捕获体。第3试剂容器203收容能与第2捕获体结合的第3捕获体。本实施方式涉及的检测用试剂盒还可含附带文书。附带文书也可含使用本实施方式涉及的检测用试剂盒进行所述的前述的被检物质的检测方法的操作顺序等的记载。【3.被检物质的检测用试剂】本实施方式涉及的被验物质的检测用试剂是用于在前述的被检物质的检测方法中使用的被检物质的检测用试剂。本实施方式涉及的被检物质的检测用试剂含能与被检物质结合的第2捕获体。第2捕获体含与被检物质结合的结合物质(前述的第2结合物质)、支持体及连接结合物质(前述的第2结合物质)和支持体之间的接头。第2捕获体、结合物质(前述的第2结合物质)、支持体及接头与在前述的被检物质的检测方法中使用的同样。本实施方式涉及的检测用试剂还任选含有助剂。作为助剂,例如,可举出用于稳定地维持第2捕获体的保存剂或稳定化剂等,但不特别限定。作为助剂,例如,可举出缓冲液等。【实施例】在下文中,各略语的意思如下所述。<缩略语>BSA:牛血清白蛋白DNP:2,4-二硝基苯基Bio:生物素基EMCS:N-(6-马来酰亚胺己酰氧基)琥珀酰亚胺SH:巯基mal:马来酰亚胺基BSA-Bio-DNP:由生物素和DNP修饰的BSA(PEG)8-BSA-Bio-DNP:加成PEG接头的BSA-Bio-DNPTNFα:肿瘤坏死因子α4-MUG:4-甲基伞形花酰-β-D-吡喃半乳糖苷DMF:N,N-二甲基甲酰胺PEG:聚乙二醇链(PEG)n:氧乙烯基的加成摩尔数是n的聚乙二醇链Gal:β-半乳糖苷酶【实施例1】【(1)夹心复合物的形成】在管内混合含有捕获抗体和检测抗体的抗体溶液100μL和含有被检物质的溶液100μL至表1所示的捕获抗体、检测抗体及作为被检物质的TNFα〔R&Dsystems(R&Dsystems)公司制、商品名:QuantikineKitstandard〕各自的量成表1所示的量。再者,作为抗体溶液及含有被验物质的溶液的溶剂,使用缓冲液A〔0.4M氯化钠、0.1质量%BSA及0.1M磷酸钠缓冲液(pH7.0)〕。再者,表1所示的捕获抗体如下所述制作。基于惯用的方法,将从Biolegend公司制的克隆名:Mab1得到的抗TNFα小鼠IgG用胃蛋白酶片段化而得到F(ab’)2片段。还原得到的F(ab’)2片段而得到Fab’-SH。另外,使BSA-Bio-DNP和接头〔LifeTechnologies制、商品名:SM(PEG)8〕反应而得到(PEG)8-BSA-Bio-DNP。通过使Fab’-SH和(PEG)8-BSA-Bio-DNP反应得到捕获抗体。另外,表1所示的检测抗体如下所述制作。基于惯用的方法,将从R&Dsystems公司制的克隆名:28401得到的抗小鼠IgG抗体用胃蛋白酶片段化而得到F(ab’)2片段。还原得到的F(ab’)2片段而得到Fab’-SH。使EMCS与Gal反应而得到ALP-mal。通过使Fab’-SH和Gal-mal反应而得到检测抗体。【表1】使用量捕获抗体Fab’-(PEG)8-BSA-Bio-DNP300fmol检测抗体Fab’-Gal30fmol被检物质TNFα0或10pg通过将得到的混合物200μL于4℃温育12小时,使夹心复合物形成。【(2)夹心复合物的捕获】向放入了实施例1(1)中得到的夹心复合物的管添加抗DNP抗体固相〔Immunochemical制、商品名:Immunobead使抗DNP抗体固定化的固相〕1个。通过将得到的混合物于25℃温育30分钟而在抗DNP固相上捕获夹心复合物。接下来,将管中的混合物使用清洗液〔0.1M氯化钠、0.1质量%BSA及0.1M磷酸钠缓冲液(pH7.0)〕2mL清洗2次。其后,回收抗DNP抗体固相。【(3)上清及抗DNP固相的回收】将实施例1(2)中回收的复合物添加到2mMDNP溶液150μL。通过将得到的混合物于25℃温育30分钟,切断抗DNP固相和夹心复合物之间的结合。将得到的生成物的上清移到别的管。另外,将残留的抗DNP抗体固相使用缓冲液B〔0.1M氯化钠、0.1质量%BSA及0.1M磷酸钠缓冲液(pH7.0)〕2mL清洗2次。【(4)夹心复合物的捕获】向实施例1(3)中回收的上清添加链霉亲和素固相〔Immunochemical制、商品名:Immunobead使链霉亲和素固定化的固相〕1个。通过将得到的混合物于25℃温育30分钟而在链霉亲和素固相上捕获夹心复合物。接下来,通过将管中的混合物使用缓冲液B〔0.1M氯化钠、0.1质量%BSA及0.1M磷酸钠缓冲液(pH7.0)〕2mL清洗3次,回收链霉亲和素固相。【(5)荧光强度的测定】向新的管中的缓冲液B〔0.1M氯化钠、0.1质量%BSA及0.1M磷酸钠缓冲液(pH7.0)〕200μL添加实施例1(2)中回收的抗DNP抗体固相及0.2mM4-MUG水溶液200μL,得到反应溶液。将得到的反应溶液于30℃温育2小时,得到反应生成物。其后,以激发波长:360nm及荧光波长:450nm,测定管中的反应生成物的荧光强度(以下称为“荧光强度A1”)。通过从荧光强度A1的值减去仅添加0.2mM4-MUG水溶液时的荧光强度的值,算出荧光强度A2。基于3次的测定结果,算出荧光强度A2的平均值(以下称为“荧光强度A”)。向新的管中的缓冲液B〔0.1M氯化钠、0.1质量%BSA及0.1M磷酸钠缓冲液(pH7.0)〕200μL添加实施例1(4)中回收的链霉亲和素固相及0.2mM4-MUG水溶液200μL,得到反应溶液。将得到的反应溶液于30℃温育20小时,得到反应生成物。其后,以激发波长:360nm及荧光波长:450nm,测定管中的反应生成物的荧光强度(以下称为“荧光强度B1”)。通过从荧光强度B1的值减去仅添加0.2mM4-MUG水溶液时的荧光强度的值,算出荧光强度B2。基于3次的测定结果,算出荧光强度B2的平均值(以下称为“荧光强度B”)。向新的管中的缓冲液B〔0.1M氯化钠、0.1质量%BSA及0.1M磷酸钠缓冲液(pH7.0)〕200μL添加实施例1(3)中回收的抗DNP抗体固相及0.2mM4-MUG水溶液200μL,得到反应溶液。将得到的反应溶液于30℃温育2小时,得到反应生成物。其后,以激发波长:360nm及荧光波长:450nm,测定管中的反应生成物的荧光强度(以下称为“荧光强度C1”)。通过从荧光强度C1的值减去仅添加0.2mM4-MUG水溶液时的值,算出荧光强度C2。基于3次的测定结果,算出荧光强度C2的平均值(以下称为“荧光强度C”)。使用被检物质是10pg的情况的荧光强度A、B及C,根据下述式(II):【数1】[复合物保持率]=[1-(1-荧光强度C/温育时间H/(荧光强度A-荧光强度B))]×100(II)算出复合物保持率。再者,式(II)中,“温育时间H”是反应溶液的温育时间。【比较例1】作为捕获抗体,除使用Fab’-BSA-Bio-DNP之外,进行与实施例1同样的操作,算出复合物保持率。再者,捕获抗体如下所述制作。基于惯用的方法,将从Biolegend公司制的克隆名:Mab1得到的抗TNFα小鼠IgG用胃蛋白酶片段化而得到F(ab’)2片段。还原得到的F(ab’)2片段而得到Fab’-SH。另外,使BSA-Bio-DNP和EMCS反应而得到BSA-Bio-DNP-mal。通过使Fab’-SH和BSA-Bio-DNP-mal反应得到捕获抗体。【结果】实施例1及比较例1的结果示于图4。图4中,泳道1显示实施例1中的复合物保持率、泳道2显示比较例1中的复合物保持率。从图4所示的结果得知,实施例1中的复合物保持率超50%。与此相比,得知比较例1中的复合物保持率是约35%。从这些的结果得知,通过使用含接头的捕获抗体,可使复合物保持率升高。【实施例2】进行与实施例1(1)~(4)同样的操作,回收链霉亲和素固相。接下来,向新的管中的缓冲液B〔0.1M氯化钠、0.1质量%BSA及0.1M磷酸钠缓冲液(pH7.0)〕200μL添加回收的链霉亲和素固相及0.2mM4-MUG水溶液200μL,得到反应溶液。将得到的反应溶液于30℃温育20小时,得到反应生成物。其后,以激发波长:360nm及荧光波长:450nm,测定管中的反应生成物的荧光强度B1。通过从荧光强度B1的值减去仅添加0.2mM4-MUG水溶液时的荧光强度的值,算出荧光强度B2。基于3次的测定结果,作为荧光强度B2的平均值算出荧光强度B。使用在被检物质的存在下的荧光强度B和在被检物质非存在下的荧光强度B,根据式(III):【数2】算出ICT-EIA的S/N比。再者,作为“在被检物质的存在下的荧光强度”,使用“在被检物质的存在下的荧光强度B”。另外,作为“在被检物质的存在下的荧光强度”,使用“在被检物质非存在下的荧光强度B”。【比较例2】作为捕获抗体,除使用Fab’-BSA-Bio-DNP之外,进行与实施例2同样的操作,算出ICT-EIA的S/N比。【比较例3】【(1)夹心复合物的形成】进行与实施例1(1)同样的操作,使夹心复合物形成。【(2)夹心复合物的捕获】进行与实施例1(2)同样的操作,回收抗DNP抗体固相。【(3)荧光强度的测定】向新的管中的缓冲液B〔0.1M氯化钠、0.1质量%BSA及0.1M磷酸钠缓冲液(pH7.0)〕200μL添加比较例3(2)中回收的抗DNP抗体固相及0.2mM4-MUG水溶液200μL,得到反应溶液。将得到的反应溶液于30℃温育2小时,得到反应生成物。其后,以激发波长:360nm及荧光波长:450nm,测定管中的反应生成物的荧光强度(以下称为“荧光强度A1”)。通过从荧光强度A1的值减去仅添加0.2mM4-MUG水溶液时的值,算出荧光强度A2。基于3次的测定结果,算出作为荧光强度A2的平均值的荧光强度A。使用在被检物质的存在下的荧光强度A和在被检物质非存在下的荧光强度A,根据式(III)算出夹心ELISA的S/N比。再者,作为“在被检物质的存在下的荧光强度”,使用“在被检物质的存在下的荧光强度A”。另外,作为“在被检物质的存在下的荧光强度”,使用“在被检物质非存在下的荧光强度A”。【比较例4】作为捕获抗体,除使用Fab’-BSA-Bio-DNP之外,进行与比较例3同样的操作,算出夹心ELISA的S/N比。【结果】实施例2及比较例2~4的结果示于图5。图5中,泳道1显示实施例2中的S/N比的相对值、泳道2显示比较例2中的S/N比的相对值、泳道3显示比较例3中的S/N比的相对值、泳道4显示比较例4中的S/N比的相对值。再者,在图5中,实施例2及比较例2各自中的S/N比的相对值是以比较例2中的S/N比的算出值设为100时的值。另外,在图5中,比较例3及比较例4中的S/N比的相对值是以比较例4中的S/N比的算出值作为100时的值。从图5所示的结果,ICT-EIA的情况,实施例2中的S/N比的相对值是220。从而得知,通过使用含接头的捕获抗体的ICT-EIA,可比使用不含接头的捕获抗体的ICT-EIA,使S/N比升高。与此相比,比较例3中的S/N比的相对值是120。从而得知,通过使用含接头的捕获抗体的ICT-EIA,可比使用含接头的捕获抗体的夹心ELISA,使S/N比更升高。【实施例3~5及比较例5~7】将含有捕获抗体的溶液、含有检测抗体的溶液和含有被检物质的溶液在管内混合至表1所示的捕获抗体、检测抗体及被检物质各自的量成表1所示的量。作为被检物质,使用胰岛素〔AcrisAntibodies(AcrisAntibodiesGmbH)制、商品名:HumanInsulin〕、IL-12/23p40〔R&DSystems公司制、商品名:QuantikineKitStandard〕、及HBsAg〔Sysmex(株)制、商品名:HISCLHBsAg校准物〕。再者,捕获抗体如下所述制作。将从表1所示的克隆得到的IgG用胃蛋白酶片段化而得到F(ab’)2片段。还原得到的F(ab’)2片段而得到Fab’-SH。使BSA-Bio-DNP和接头〔LifeTechnologies制、商品名:SM(PEG)8〕反应而得到(PEG)8-BSA-Bio-DNP。另外,使BSA-Bio-DNP和EMCS反应而得到BSA-Bio-DNP-mal。通过使Fab’-SH和(PEG)8-BSA-Bio-DNP反应得到捕获抗体(实施例3~5)。另外,通过使Fab’-SH和BSA-Bio-DNP-mal反应得到捕获抗体(比较例5~7)。检测抗体如下所述制作。基于惯用的方法,将从表2所示的克隆得到的IgG用胃蛋白酶片段化而得到F(ab’)2片段。还原得到的F(ab’)2片段而得到Fab’-SH。使EMCS与Gal反应而得到ALP-mal。通过使Fab’-SH和Gal-mal反应得到检测抗体。【表2】除使用得到的混合物之外,进行与实施例1(1)同样的操作,使夹心复合物形成。其后,进行与实施例1(2)~(4)同样的操作,回收链霉亲和素固相。接下来,向新的管中的缓冲液B0.1M氯化钠、0.1质量%BSA及0.1M磷酸钠缓冲液(pH7.0)〕200μL添加回收的链霉亲和素固相及0.2mM4-MUG水溶液200μL,得到反应溶液。将得到的反应溶液于30℃温育2小时,得到反应生成物。其后,以激发波长:360nm及荧光波长:450nm,测定管中的反应生成物的荧光强度B1。通过从荧光强度B1的值减去仅添加0.2mM4-MUG水溶液时的值,算出荧光强度B2。基于3次的测定结果,作为荧光强度B2的平均值算出荧光强度B。使用在被检物质的存在下的荧光强度B和在被检物质非存在下的荧光强度B,根据式(III)算出ICT-EIA的S/N比。再者,作为“在被检物质的存在下的荧光强度”,使用“在被检物质的存在下的荧光强度B”。另外,作为“在被检物质的存在下的荧光强度”,使用“在被检物质非存在下的荧光强度B”。【结果】实施例3~5及比较例5~7的结果示于图6。图6中,泳道1显示实施例3中的S/N比的相对值、泳道2显示比较例5中的S/N比的相对值、泳道3显示实施例4中的S/N比的相对值、泳道4显示比较例6中的S/N比的相对值、泳道5显示实施例5中的S/N比的相对值、泳道6显示比较例7中的S/N比的相对值。再者,在图6中,实施例3及比较例5各自中的S/N比的相对值是以比较例5中的S/N比的算出值作为100时的值。在图6中,实施例4及比较例6中的S/N比的相对值是以比较例6中的S/N比的算出值作为100时的值。在图6中,实施例5及比较例7中的S/N比的相对值是以比较例7中的S/N比的算出值作为100时的值。从图6所示的结果,被检物质是胰岛素时,实施例3中的S/N比的相对值是190。另外,被检物质是IL-12/23p40时,实施例4中的S/N比的相对值是180。被检物质是HBsAg时,实施例5中的S/N比的相对值是160。从这些的结果得知,由含接头的捕获抗体,可比使用不含接头的捕获抗体时,使S/N比更升高。另外得知,由使用含接头的捕获抗体的ICT-EIA,可以高灵敏度检测各种的被检物质。【实施例6~8及比较例8】除作为捕获抗体,使用LifeTechnologies制、商品名:EMCS(比较例8)、LifeTechnologies制、商品名:SM(PEG)2(实施例6)、LifeTechnologies制、商品名:SM(PEG)8(实施例7)、或LifeTechnologies制、商品名:SM(PEG)24(实施例8)之外,进行与实施例1同样的操作,算出复合物保持率。实施例6~8及比较例8的结果示于图7。图7中,泳道1显示比较例8中的复合物保持率、泳道2显示实施例6中的复合物保持率、泳道3显示实施例7中的复合物保持率、泳道4显示实施例8中的复合物保持率。从图7所示的结果,实施例6~8中的复合物保持率比比较例8中的复合物保持率高。从这些的结果得知,由含氧化烯基的加成摩尔数不同的各种的PEG接头的捕获抗体,可使复合物保持率升高。如以上说明,得知在ICT-EIA中,可由含结合物质、支持体、和连接结合物质与支持体之间的接头的捕获体抑制免疫复合物(即,夹心复合物)的解离,使S/N比升高。【符号的说明】当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1