吞噬能力评价方法和荧光测定方法与流程
本发明涉及吞噬能力评价方法和荧光测定方法。
背景技术:
吞噬(吞噬作用)不仅对细菌、病毒、粉尘等的外来异物而且对死细胞、氧化低密度脂蛋白(ldl)、变性蛋白质等的生物体内产生的异物(不需要的物质)也起作用,是细胞的内吞作用(细胞内摄入)。巨噬细胞和中性粒细胞等吞噬细胞进行的异物排除在恒常性维持(稳态)方面承担着重要的作用。
另一方面,已知有因吞噬能力的下降而导致的恒常性维持功能的下降。例如,已有:关于因年龄增加而导致的创伤治愈的延迟和浸润至创伤部的巨噬细胞的吞噬功能下降的报告(非专利文献1);在因年龄增加而导致的肺炎菌的感染中,游离的中性粒细胞的吞噬能力的下降与易感性相关联的报告(非专利文献2);显示因年龄增加而导致的脑的吞噬细胞(小胶质细胞)的淀粉样蛋白β的吞噬作用下降的报告(非专利文献3);通过增强小胶质细胞的吞噬而提高淀粉样蛋白β的排除效果的报告(非专利文献4)等。因此,吞噬细胞的排除异物的能力(吞噬能力)可以成为促进创伤治愈、防止传染病的能力、维持脑功能等的指标。已有因年龄增加而使人的末梢血的吞噬细胞(单核细胞)的吞噬能力下降的报告(非专利文献5),另外,已知可以因应激反应(非专利文献6和非专利文献7)而使吞噬作用下降。根据以上的说明,考虑将末梢血的吞噬能力评价作为健康状态的指标进行测定是有用的。
作为对吞噬细胞的吞噬能力进行评价的方法,例如已知有:使吞噬细胞摄入荧光胶乳珠,利用荧光显微镜对已摄入的细胞进行计数的方法;使吞噬细胞摄入荧光胶乳珠,利用流式细胞仪进行分析的方法(例如,非专利文献8)。
现有技术文献
专利文献
非专利文献1:journalofinvestigativedermatology,2001年,117卷,pp.1027~1035
非专利文献2:mechanismsofageinganddevelopment,2001年,122卷,pp.1899~1913
非专利文献3:pharmacology&therapeutics,2013年,139卷,pp.313~326
非专利文献4:naturemedicine,2001年,7卷,pp.369~372
非专利文献5:aids,2012年,26卷,pp.843~853
非专利文献6:产业医科大学杂志,1993年,15卷,pp.161~171
非专利文献7:neuroimmunomodulation,2007年,14卷,pp.4-7
非专利文献8:日卫志,2001年4月,第56卷,第1号,pp.315
技术实现要素:
发明所要解决的课题
关于吞噬能力的下降,不只是容易罹患传染病,其与肾结石的增大化、阿尔茨海默病的恶化、肌肉再生的下降、肺泡蛋白质沉积症等多种疾病的关联性已被指出。另外,也已知吞噬能力因年龄增加而下降,在已进入超老龄化社会的日本,为了实现健康长寿社会,需要可以在个人水平上简便地评价吞噬能力的方法。
在使用荧光显微镜或流式细胞仪的现有的吞噬能力的评价方法中,对于包含红血球等的试样,不能进行测定,因此需要对吞噬细胞进行分离。在吞噬细胞的分离中,需要繁杂的操作。
本发明的目的在于:提供一种不需要繁杂的操作、使用包含全血的试样就能够对吞噬细胞的吞噬能力进行评价的方法。
用于解决课题的方法
本发明涉及吞噬细胞的吞噬能力评价方法。本发明的吞噬能力评价方法包括:在包含全血的试样中,使吞噬细胞摄入荧光物质,得到被测定试样的步骤;将被测定试样静止放置2分钟以上的静止放置步骤;对上述荧光物质的荧光进行测定的测定步骤;以及根据所测定的荧光的强度,对吞噬细胞的吞噬能力进行评价的步骤;上述测定步骤包括:向放置的被测定试样的重力方向的中间区域照射激发光,对上述激发光激发上述荧光物质产生的荧光进行检测。
本发明的吞噬能力评价方法在将被测定试样静止放置2分钟以上后,向放置的被测定试样的重力方向的中间区域照射激发光并检测荧光,因此不需要血细胞分离等的繁杂的操作,使用包含全血的试样就能够对吞噬细胞的吞噬能力进行评价。在测定荧光之前通过将被测定试样静止放置2分钟以上,能够提高被测定试样的透明性,使微弱的荧光的检测成为可能。另外,通过向放置的被测定试样的重力方向的中间区域照射激发光,能够更加正确地测定来自吞噬细胞所吞噬的荧光物质的荧光的强度。
关于上述吞噬能力评价方法,优选在上述得到被测定试样的步骤中,将上述荧光物质的摄入进行120分钟以上。由此,使吞噬细胞的吞噬饱和,因此能够更加简便地测定吞噬细胞最大的吞噬能力。
关于上述吞噬能力评价方法,优选在上述静止放置步骤之前,还包括将上述被测定试样进行混合的步骤。由此,能够更加正确地测定来自吞噬细胞所吞噬的荧光物质的荧光。
关于上述吞噬能力评价方法,必要的检体量(血液量)可以是微量的,因此上述被测定试样所包含的上述全血的量可以为0.5~10μl。这样微量的血液(全血)例如可以利用糖尿病患者为了每日的血糖值评价而使用的少痛的自采血仪器(刺血针)进行采血。也就是说,不需要医院相关人员的采血,可以在个人水平上简便地测定吞噬能力。
另外,本发明也能够提供使用包含全血的试样对细胞所摄入的荧光物质的荧光进行测定的荧光测定方法。本发明的荧光测定方法包括:在包含全血的试样中,使细胞摄入荧光物质,得到被测定试样的步骤;将被测定试样静止放置2分钟以上的静止放置步骤;和对上述荧光物质的荧光进行测定的测定步骤;上述测定步骤包括:向放置的被测定试样的重力方向的中间区域照射激发光,对上述激发光激发上述荧光物质产生的荧光进行检测。
关于上述荧光测定方法,优选在上述静止放置步骤之前,还包括将上述被测定试样进行混合的步骤。
发明效果
根据本发明,能够提供一种不需要从血液分离吞噬细胞等的繁杂的操作、使用包含全血的试样就能够对吞噬细胞的吞噬能力进行评价的方法。
附图说明
图1是表示细胞所摄入的荧光物质的荧光测定方法的一个实施方式的说明图。
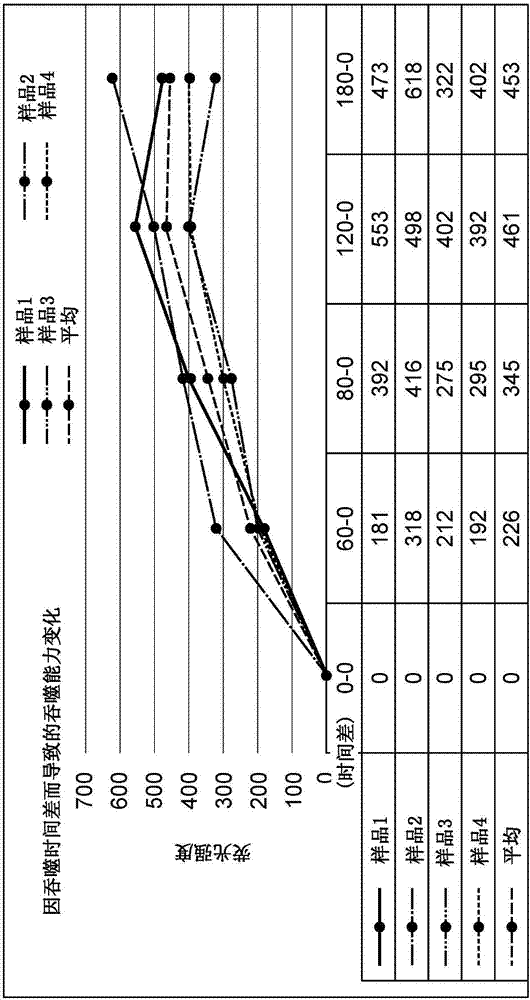
图2是表示吞噬能力相对吞噬时间的评价结果的图表。
图3是表示因荧光测定前的静止放置时间而导致的荧光强度的变化的图表。
符号说明
10…荧光测定装置
20…测定容器
30…摄入荧光物质的吞噬细胞
40…被测定试样
50…气液界面
a…第一区域
b…第三区域(中间区域)
c…第二区域
g…重力方向
具体实施方式
以下,根据情况参照附图对本发明的具体实施方式进行详细地说明。但是,本发明并不限定于以下的实施方式。其中,在附图中,对于相同或者相当的部分标注相同的符号,适当省略重复的说明。
本实施方式所涉及的吞噬细胞的吞噬能力评价方法包括:在包含全血的试样中,使吞噬细胞摄入荧光物质,得到被测定试样的步骤(以下,也称为“制备步骤”。);将被测定试样静止放置2分钟以上的步骤(以下,也称为“静止放置步骤”。);对上述荧光物质的荧光进行测定的步骤(以下,也称为“荧光测定步骤”。);以及根据所测定的荧光的强度,对吞噬细胞的吞噬能力进行评价的步骤(以下,也称为“评价步骤”)。
吞噬细胞是利用内吞作用向细胞内摄入(吞噬)异物,在细胞内使该异物等发生分解等的承担吞噬作用的细胞。所谓吞噬细胞的吞噬能力,是指该吞噬作用的能力(即,排除异物的能力)。异物也包括细菌、病毒、粉尘等的外来异物、以及死细胞、氧化ldl和变性蛋白质等的生物体内产生的异物(不需要的物质)。作为吞噬细胞的具体例,可以列举巨噬细胞、单核细胞、中性粒细胞、树状细胞等。
制备步骤是在包含全血的试样中,使吞噬细胞摄入荧光物质,得到被测定试样的步骤。本实施方式所涉及的吞噬能力评价方法不需要对吞噬细胞进行分离,因此能够使用包含全血的试样对吞噬能力进行评价。
包含全血的试样可以是全血,另外,也可以是对全血进行稀释后的试样。在全血的稀释中,例如可以使用生理盐水、磷酸缓冲生理盐水(pbs)、hanks平衡盐溶液、tris缓冲溶液、hepes缓冲溶液等一般的生理的等渗缓冲溶液。稀释全血时的稀释率没有特别限制,可以根据目的适当设定。通常优选为10~2000倍,更优选为100~1000倍。
对全血的使用量没有特别限制,关于本实施方式所涉及的吞噬能力评价方法,必要的检体量(血液量)可以是微量的,因此被测定试样所包含的全血的量可以为0.5~10μl,优选为0.5~7.5μl,更优选为0.5~5μl。
关于荧光物质,只要是可以由吞噬细胞吞噬的物质就不作特别限制,可以适当使用在目前吞噬细胞的吞噬能力的评价中所使用的荧光物质。作为荧光物质的具体例,例如可以列举荧光胶乳珠、ph敏感性荧光粒子(例如,使用greene.coli(molecularprobes公司制)、acidifluor(五稜化药公司)等的ph敏感性荧光色素,对酵母聚糖、大肠杆菌、金黄色葡萄球菌等进行染色而得到的粒子)等。荧光物质可以单独使用1种,另外,也可以组合使用2种以上。
使吞噬细胞摄入荧光物质可以按照通常的方法进行。具体而言,例如,向包含全血的试样中添加荧光物质,通过在25~37℃培养30分钟~24小时,可以使吞噬细胞摄入荧光物质。培养时间只要在10分钟以上,就可以看到使吞噬细胞充分摄入荧光物质。另外,通过使培养时间成为120分钟(2小时)以上,可以使吞噬细胞的荧光物质的摄入饱和,因此能够更加简便地评价吞噬细胞的最大的吞噬能力。
静止放置步骤是将被测定试样静止放置2分钟以上的步骤。通过在测定荧光之前将被测定试样静止放置2分钟以上,即使是使用包含全血的试样的情况,也可以提高被测定试样的透明性,使微弱的荧光的检测成为可能。关于对被测定试样进行静止放置的时间,即使在1分钟左右也可以显现效果,但更适当而言,只要在2分钟以上就没有特别限制,然而从提高检测效率的观点考虑,优选为2分钟以上30分钟以下,更优选为2分钟以上10分钟以下。
静止放置步骤优选在将被测定试样容纳于测定容器中的状态下静止放置2分钟以上,更优选将被测定试样容纳在测定容器中,然后在将测定容器放置在荧光的测定装置中的状态下静止放置2分钟以上。由此,可以进一步提高微弱的荧光的检测灵敏度。
在一个实施方式中,优选在静止放置步骤之前,还包括对被测定试样进行混合的步骤(以下,也称为“混合步骤”。)。通过包括混合步骤,能够更加正确地测定来自吞噬细胞所吞噬的荧光物质的荧光。混合步骤例如可以利用将含有被测定试样的容器倒转混合的方法、对被测定试样进行搅拌的方法等而实施。
荧光测定步骤是使用静止放置步骤中静止放置2分钟以上的被测定试样,对荧光物质的荧光进行测定的步骤。荧光测定步骤包括:向放置的被测定试样的重力方向的中间区域照射激发光,对激发光激发荧光物质产生的荧光进行检测。荧光测定步骤优选在静止放置步骤之后直接实施。
激发光照射在放置的被测定试样的重力方向的中间区域。其中,所谓“重力方向的中间区域”,是指沿着放置的被测定试样的重力方向,划分为包括气液界面的第一区域(上端区域)、包括容纳被测定试样的测定容器的底面的第二区域(下端区域)和第一区域与第二区域之间的第三区域时的第三区域。
图1是表示细胞所摄入的荧光物质的荧光测定方法的一个实施方式的说明图。如图1所示,荧光的测定通过从荧光测定装置10向包含摄入荧光物质的吞噬细胞30的被测定试样40照射激发光并利用荧光测定装置10检测与之对应的荧光而进行。通常,将被测定试样40容纳在能够放置于荧光测定装置10的试样部的测定容器20中。
如图1所示,沿着被测定试样40的重力方向,划分为包括气液界面50的第一区域a、包括测定容器20的底面的第二区域c和第一区域a与第二区域c之间的第三区域(中间区域)b,向第三区域b照射激发光。通过向第三区域b照射激发光,能够更加正确地测定来自吞噬细胞所吞噬的荧光物质的荧光的强度。即,包括摄入荧光物质的吞噬细胞30的、全血所包含的细胞向重力方向(图1中,g方向)缓慢地沉降。此时,关于作为中间区域的第三区域b,由于使从第一区域a进入第三区域b的细胞的数与从第三区域b进出第二区域c的细胞的数变得均衡,因此吞噬细胞所吞噬的荧光物质的数也变得均衡。因此,能够更加正确地测定荧光的强度。另外,第一区域a容易在气液界面发生光(激发光和荧光)散射,第二区域c容易在测定容器底面发生光(激发光和荧光)散射,与之相对,第三区域b不容易发生这样的散射,这也是能够正确测定的一个原因。
“重力方向的中间区域”例如也可以是沿着放置的被测定试样的重力方向,等分为n个区域时的最上端的区域与最下端的区域之间的区域。其中,n是3~10的自然数。例如,n为10时,“重力方向的中间区域”就是从最上端向最下端依次成为第一~第十区域时的第二~第九区域。另外,“重力方向的中间区域”也可以是放置的被测定试样的重力方向的大致中央部。
测定容器和荧光的测定装置可以不特别限制地使用在荧光的测定中使用的现有的测定容器和测定装置。
评价步骤是根据所测定的荧光的强度,对吞噬细胞的吞噬能力进行评价的步骤。测定的荧光的强度越高,显示吞噬细胞吞噬的荧光物质的量越多。即,测定的荧光的强度越高,评价吞噬能力越高。
在评价步骤中,也可以根据由测定的荧光的强度修正对照荧光强度而得到的值,评价吞噬细胞的吞噬能力。其中,所谓对照荧光强度,例如是使用制备步骤中刚将包含全血的试样与荧光物质进行混合之后的试样(即,吞噬细胞没有吞噬荧光物质或者只吞噬了一点点时的试样),同样地对荧光的强度进行测定的值。关于怎样设定对照荧光强度,可以根据修正的目的适当设定。
本实施方式所涉及的吞噬细胞的吞噬能力评价方法通过在静止放置步骤中将被测定试样静止放置2分钟以上,并且在荧光测定步骤中向放置的测定容器的重力方向的中间区域照射激发光,即使是在包含全血的试样中,也能够更高灵敏度地测定来自被摄入细胞内的荧光物质的荧光。因此,本发明还可以提供使用包含全血的试样对细胞所摄入的荧光物质的荧光进行测定的荧光测定方法。
本实施方式所涉及的荧光测定方法包括:在包含全血的试样中,使细胞摄入荧光物质,得到被测定试样的步骤(制备步骤);将被测定试样静止放置2分钟以上的步骤(静止放置步骤);和对上述荧光物质的荧光进行测定的步骤(荧光测定步骤)。
本实施方式所涉及的荧光测定方法中的各步骤的具体方式、优选方式等如在吞噬能力评价方法中所说明的那样。
[实施例]
以下,根据实施例对本发明进行更加详细地说明。但是,本发明并不限定于以下的实施例。
[吞噬细胞的吞噬能力评价]
将含有0.2w/v%的ph敏感性荧光粒子(greene.coli,molecularprobes公司制)的磷酸缓冲生理盐水(pbs)加入微型管,在37℃保温。接着,添加利用刺血针采血的人末梢血3μl,上下缓慢地倒转数次进行混合。接着,在37℃静止放置2分钟后,将微型管放置在具有图1所示的光学系统的荧光测定装置中,测定荧光。对荧光进行测定10秒左右,算出其测定值的平均值(对照荧光强度)。
接着,将微型管在37℃培养规定时间(60分钟、80分钟、120分钟、180分钟)从而使吞噬细胞吞噬ph敏感性荧光粒子后,上下缓慢地倒转数次进行混合。接着,在37℃静止放置2分钟,与对照荧光强度同样测定荧光。将得到的测定值(平均值)减去对照荧光强度而得到的值表示在图2中。
如图2所示,直到吞噬时间120分钟,荧光强度增加,因此可知吞噬正在进行。另外,在吞噬时间120分钟和180分钟中,荧光强度没有较大的差异,因此可知在吞噬时间120分钟以上吞噬已饱和。从该结果可知,可以将在吞噬时间120分钟以内的测定值作为吞噬细胞的吞噬能力进行评价。另外,可知:由于吞噬已饱和,因此可以将在吞噬时间120分钟(或者120分钟以上)的测定值作为吞噬细胞的最大的吞噬能力进行评价。
[细胞内荧光物质的荧光测定]
将含有0.2w/v%的ph敏感性荧光粒子(greene.coli)的磷酸缓冲生理盐水(pbs)加入微型管,在37℃保温。接着,添加利用刺血针采血的人末梢血3μl,上下缓慢地倒转数次进行混合。接着,在37℃静止放置规定时间(0分钟、1分钟、2分钟、3分钟、4分钟或5分钟)后,将微型管放置在具有图1所示的光学系统的荧光测定装置中,测定荧光。对荧光进行测定10秒左右,算出其测定值的平均值。
将结果表示在图3中。通过使荧光测定前的静止放置时间成为2分钟以上,可以使荧光的测定值稳定。即,可知通过使荧光测定前的静止放置时间成为2分钟以上,能够正确地测定来自吞噬细胞所吞噬的ph敏感性荧光粒子的荧光。
- 还没有人留言评论。精彩留言会获得点赞!