一种基于双通道荧光强度同时探测的荧光共振能量转移效率的快速测量方法与流程
本发明涉及荧光共振能量转移效率的测量方法,具体涉及一种基于双通道荧光强度同时探测的荧光共振能量转移(FRET)效率(E)的快速测量方法。
背景技术:
荧光共振能量转移(Fluorescence Resonance Energy Transfer,FRET)是指两个荧光基团足够靠近时,处于激发态的供体荧光团将能量以非辐射形式转给邻近受体荧光团的过程。FRET发生需要满足三个条件:(1)供受体之间的距离小于10nm;(2)供体偶极子与受体偶极子的取向不能相互垂直;(3)供体的发射光谱与受体的激发光谱有重叠且重叠率大于30%。供受体之间的FRET效应一般采用FRET效率(E)来表征。E为供体吸收能量后转移给受体的能量所占的百分比,其高度依赖供体受体分子之间的距离r,可表示为:
其中R0(半径)是指E为50%时,供体与受体之间的距离。R0与供体的发射光谱、受体的吸收光谱、供体的量子产率、受体的消光系数及介质的折射率和供体分子与受体分子空间取向有关。
目前主要的FRET定量成像方法包括:
荧光寿命成像法(Fluorescence Lifetime Imaging Microscopy,FLIM):通过测量受体存在和不存在时的供体分子的荧光寿命τD和τDA来得到E=1-τDA/τD(Jares-Erijman E A.&Jovin T M.FRET imaging[J].Nat Biotechnol.2003,21(11):1387-1395)。虽然FLIM测量结果准确,但是需要选择性地探测供体荧光(Zal T.&Gascoigne NR.Photobleaching-corrected FRET efficiency imaging of live cells[J].Biophys J.2004,86(6):3923-3939),而且一般需要较长的测量时间,因而无法用于实时检测活细胞中的快速动态变化过程。
基于受体光漂白方法(photobleaching FRET,pbFRET):通过探测受体漂白前后供体通道荧光强度的变化来得到FRET效率(Kenworthy A.K.Imaging protein-protein interactions using fluorescence resonance energy transfer microscopy[J].Meth.2001,24(3):289-296)(Yu HN.,Zhang JW.,Li HL.,Qu JL.&Chen TS.(2012)An empirical quantitative fluorescence resonance energy transfer method for multiple acceptors based on partial acceptor photobleaching.Appl.Phys.Lett.100,253701)。该方法需要供体通道选择性地探测供体荧光。虽然pbFRET方法是最为直接的FRET定量检测方法,但是光漂白受体会对细胞造成一定的损伤,同时也需要较长的时间。因此,pbFRET方法不适合在单细胞中进行多次测量,也不能在活细胞中进行实时动态监测。
基于光谱分离的FRET成像法(Spectral unmixing-based FRET imaging):基本思想是通过线性分离出FRET样本光谱中的供体荧光、受体直接激发荧光和受体敏化荧光的相对占比权重从而得到样本的FRET效率(Thaler C.,Koushik S.V.,Blank P.S.&Vogel S.S.Quantitative multiphoton spectral imaging and its use for measuring resonance energy transfer[J].Biophys.J.2005,89(4):2736-2749)。(Mustafa S.et al.Quantitativeresonance energy transfer efficiency measurements using simultaneous spectral unmixing of excitation and emission spectra[J].J.Biomed.Opt.2013,18(2):026024)(Lili Zhang,Guiqi Qin,Liuying Chai,Jiang Zhang,Fangfang Yang,Hongqin Yang,Shusen Xie,Tongsheng Chen*.Spectral wide-field microscopic FRET imaging in live cells.J.Biomed.Opt,2015,20(8).086011)。由于光谱扫描成像需要较长时间,因此很难实现快速实时测量。
3-cubes强度测量方法(E-FRET):三个荧光图像是通过3个不同的荧光滤光片组合(cube)获取,即供体通道成像(IDD,供体光激发在供体通道上探测到的荧光强度),FRET通道成像(IDA,供体光激发在受体通道上探测到的荧光强度),受体通道成像(IAA,受体光激发在受体通道上探测到的荧光强度)。该方法需要增加额外的参考样本对系统进行校正,并且需要在恒定的仪器参数状态下进行所有的检测(Zal T,Gascoigne N R.Photobleaching-corrected FRET efficiency imaging of live cells[J].Biophysical journal,2004,86(6):3923-3939)。另外,该方法要求供体通道选择性探测到供体荧光,受体激发光必须选择性激发受体。因此,该方法的实际测量难度很大(Seitz A.,Terjung S.,Zimmermann T.&Pepperkok R.Quantifying the influence of yellow fluorescent protein photoconnersion on acceptor phoyobleaching-based fluorescence resonance energy transfer measurements[J].J Biom Opt.2012 17(1)011010)。
技术实现要素:
为了克服现有技术的缺点与不足,本发明的目的在于提供一种基于双通道荧光强度同时探测的荧光共振能量转移效率的快速测量方法。该方法是在不需要选择性激发供体和受体,而且也不需要选择性收集探测供体和受体荧光的情况下实现快速FRET显微定量动态成像检测。
本发明的目的通过下述技术方案实现:
本发明是基于双通道荧光强度同时探测的荧光共振能量转移(FRET)效率(E)的快速测量,即是一种改进的双通道E-FRET(Zal T,Gascoigne N R.Photobleaching-corrected FRET efficiency imaging of live cells[J].Biophysical journal,2004,86(6):3923-3939)快速测量方法。
这种基于双通道荧光强度同时探测的荧光共振能量转移(FRET)效率(E)的快速测量方法,包括以下的具体步骤:
(1)利用两种不同波段的激发光分别激发单供体样本并进行双通道同时荧光成像,分别得到和(上标1和2分别表示两种不同波段的激发光,下标1和2分别表示两个探测通道,D表示单转供体样本),通过如下公式得到供体的激发吸收比率系数vD和发射分布系数uD;
其中表示两种不同波段的激发光对应的激发光的强度,表示在两种不同波段的激发光激发下供体对应的消光系数;下标j(j=1,2)表示探测通道j上标i(i=1,2)表示激发波段λi;
(2)利用两种不同波段的激发光分别激发单受体样本并进行双通道同时荧光成像,分别得到和(上标1和2分别表示两种不同波段的激发光,下标1和2分别表示两个探测通道,A表示单转受体样本),通过如下公式得到受体的激发吸收比率系数vA和发射分布系数uA;
其中表示两种不同波段的激发光对应的激发光的强度,表示在两种不同波段的激发光激发下受体对应的消光系数;下标j(j=1,2)表示探测通道j上标i(i=1,2)表示激发波段λi;
(3)利用供受体浓度比已知的串联质粒校正系统得到校正因子g;
所述的校正因子g可以通过供受体浓度比为1:1的两种质粒来得到;也可以通过已知效率的供受体浓度比为1:1的一种质粒等方法得到;
①利用两种不同波段的激发光分别激发供受体浓度比为1:1的两种FRET参照样本并进行双通道同时荧光成像,分别得到两种样本对应的和(上标1和2分别表示两种不同波段的激发光,下标1和2分别表示两个探测通道,DA表示FRET样本),通过公式(5)得到和再结合公式(2)和(4)中的uD和uA,由公式(6)得到和(上标1和2分别表示两种不同波段的激发光,下标1和2表示两种FRET质粒),结合公式(1)和(3)中的vD和vA,由公式(7)得到系统校正因子g;
②利用两种不同波段的激发光分别激发供受体浓度比为1:1的一种FRET参照样本并进行双通道同时荧光成像,分别得到该样本对应的和然后通过公式(5)得到和再结合公式(2)和(4)中的uD和uA,由公式(6)得到δ1和δ2,结合公式(1)和(3)中的vD和vA,最后由公式(8)得到系统校正因子g;
所述的和中的上标1和2分别表示两种不同波段的激发光,下标1和2分别表示两个探测通道,DA表示FRET样本;
所述的δ1,δ2中的上标1和2分别表示两种不同波段的激发光;
所述的E表示该FRET参照样本的FRET效率;
(4)待测FRET样本的FRET效率的测量:利用两种不同波段的激发光分别激发待测FRET样本并进行双通道同时荧光成像,得到和(上标1和2分别表示两种不同波段的激发光,下标1和2分别表示两个探测通道,DA表示待测FRET样本),通过公式(5)计算得到和再通过公式(6)计算得到δ1和δ2(上标1和2表示两种不同波段的激发光),最后代入公式(9)计算得到待测FRET样本的表观FRET效率;
所述的两种不同波段的激发光不需要选择性激发供体和受体;
所述的两个探测通道不需要选择性收集探测供体和受体荧光;
本发明的方法能够实现快速FRET显微定量动态成像。
为了更好的阐述本发明,下面以测量一种质粒的FRET效率的实例进行说明:
供体和受体荧光基团:供体荧光基团为基因编码荧光蛋白Cerulean(简称C),受体为基因编码荧光蛋白Venus(简称V)。
FRET串联质粒结构:参照串联质粒C32V编码的蛋白由32个氨基酸组成的肽链(TSGLETRDIRSENLYFQGPREFPGGTAGPVAT)将供体C和受体V连接而成,参照串联质粒CTV即Cerulean-TRAF-Venus,其中TRAF是一个由229个氨基酸组成的长肽链肿瘤坏死因子的受体相关因子域。
待测FRET样本:待测串联质粒CVC(Cerulean-5-Venus-5-Cerulean)编码的蛋白包含两个供体C和一个受体V,C和V之间由5个氨基酸连接(Koushik S V,Blank P S,Vogel S S.Anomalous surplus energy transfer observed with multiple FRET acceptors[J].PloS one,2009,4(11):e8031)。
测量系统:本实例采用双通道宽场荧光显微镜,结构如图1所示。
具体测量过程如下:
(1)在人的肝癌细胞(HepG2细胞)中分别转染并表达C(单转C),V(单转V),C32V,CTV和CVC(下面分别简称单转C样本,单转V样本,C32V样本,CTV样本和CVC样本);
(2)双通道宽场荧光显微成像系统设置:激发1的激发波长为430±12.5nm(430/25nm),激发2的激发波长为470±10nm(470/20nm);探测通道1的探测波长范围为500~520nm(510/20nm),探测通道2的探测波长范围为522.5~551.5nm(537/29nm);实验过程中采用两种不同波段的激发光分别激发样本,双通道同时荧光成像。
(3)利用两种不同波段的激发光分别激发单转C样本并进行双通道同时荧光成像,分别得到和(上标1和2分别表示两种不同波段的激发光,下标1和2分别表示两个探测通道,D表示单转供体样本),通过上述公式(1)和(2)得到供体的激发吸收比率系数vD和发射分布系数uD;
(4)利用两种不同波段的激发光分别激发单转V样本并进行双通道同时荧光成像,分别得到和(上标1和2分别表示两种不同波段的激发光,下标1和2分别表示两个探测通道,A表示单转受体样本),通过上述公式(3)和(4)得到受体的激发吸收比率系数vA和发射分布系数uA;
(5)利用两种不同波段的激发光分别激发供受体浓度比为1:1的两种FRET参照样本C32V样本和CTV样本并进行双通道同时荧光成像,分别得到两种样本对应的和(上标1和2分别表示两种不同波段的激发光,下标1和2分别表示两个探测通道,DA表示FRET样本),通过公式(5)得到和再结合公式(2)和(4)中的uD和uA,由公式(6)得到和(上标1和2分别表示两种不同波段的激发光,下标1和2表示两种FRET质粒),结合通过公式(1)和(3)中得到的vD和vA,由公式(7)得到系统校正因子g;
或者,
利用两种不同波长的激发光分别激发供受体浓度比为1:1的一种FRET参照样本C32V样本或CTV样本并进行双通道同时荧光成像,分别得到该样本对应的和(上标1和2分别表示两种不同波段的激发光,下标1和2分别表示两个探测通道,DA表示FRET样本),然后通过公式(5)得到和再结合公式(2)和(4)中的uD和uA,由公式(6)得到δ1和δ2(上标1和2分别表示两种不同波段的激发光),结合公式(1)和(3)中的vD和vA,最后由公式(8)得到系统校正因子g;
(6)待测FRET样本的FRET效率的测量:利用两种不同波段的激发光分别激发待测FRET样本CVC并进行双通道同时荧光成像,得到到和(上标1和2分别表示两种不同波段的激发光,下标1和2分别表示两个探测通道)。然后通过公式(5)计算得到和再通过公式(6)计算得δ1和δ2(上标1和2表示两种不同波段的激发光)。结合公式(1)和(3)中得到的vD和vA,最后代入公式(9)计算得到待测FRET样本的表观FRET效率。
本发明的基本原理如下:
符号说明:上标数字i表示激发光i(激发波长λi)(i=1,2),下标数字j表示探测通道j(j=1,2),大写字母D表示供体样本,大写字母A表示受体样本,大写字母DA表示FRET样本。
1.供体/受体的激发吸收比率系数与发射分布系数
(1)供体/受体的发射分布系数(Emission distribution coefficients)
发射分布系数(u)表示荧光基团被激发后分别在两个发射通道上探测到的发射荧光强度的分布比率,可以在分别激发供体样本和受体样本时由两个探测通道探测到的荧光强度之比得到。供体的发射分布系数(uD)和受体的发射分布系数(uA)分别通过公式(2)和(4)得到。
其中表示用λi波段的激发光激发供体样本时在探测通道1和2测量的荧光强度;同理,表示用λi波段的激发光激发受体样本时在探测通道1和2测量的荧光强度;
由于uD、uA由供体和受体的发射光谱性质、两个探测通道的光谱传输函数以及探测器的光谱响应函数共同决定,与激发光无关。因此,测量时激发光的波长和强度可以根据需要进行调节。并且对于特定的供受体和系统,一旦测定,一般情况就不必每次再测量uD和uA。
(2)供体/受体的激发吸收比率系数(Excitation absorption ratio coefficients)
激发吸收比率系数(v)表示用两种不同波段的激发光激发荧光基团时的摩尔吸收光强的比值。可以通过供体样本和受体样本分别在两种不同波段的激发光激发下测量到的荧光强度之比得到。供体的激发吸收比率系数(vD)和受体的激发吸收比率系数(vA)分别通过公式(1)和(3)得到。
其中表示供体样本在两种不同波段的激发光激发下探测通道j上测量到的荧光强度;同理,表示受体样本在两种不同波段的激发光激发下探测通道j上测量到的荧光强度。
测量单独转染的供体和受体样本时,公式(1)和(3)必须保持两种不同波段的激发光对应的激发光的强度之比一致。对于特定的供受体和稳定的系统,一旦测定,一般情况不需每次测量vD和vA。
2.待测FRET样本的定量测量
(1)测量FRET样本在两个探测通道的荧光强度之比
对于存在自由供受体的FRET样本,任意探测通道的荧光是由自由供体发射的荧光,自由受体发射的荧光,FRET对中的供体发射的荧光和直接激发受体发射的荧光以及受体FRET敏化发射的荧光5部分线性叠加组成。故任意通道探测的荧光强度理论上可以表示为如下公式(10):
其中表示λi波段激发光对应的激发光的强度,分别表示在λi波段激发光激发下供体和受体对应的消光系数,QD、QA分别表示供体和受体的量子产率。CD-CHj=∫eD(λ)Lj(λ)Sj(λ)dλ,CA-CHj=∫eA(λ)Lj(λ)Sj(λ)dλ,eD(λ)、eA(λ)分别表示供体和受体按面积归一化的标准光谱;Lj(λ)分别表示探测通道j的光谱传输函数;Sj(λ)表示探测通道j所对应探测器的光子响应函数。DA表示FRET样本;表示FRET样本在λi波段激发光激发下通道j探测的荧光强度;[D]、[A]、[d]、[a]分别表示FRET样本中FRET对供受体的浓度和自由供受体的浓度;γi表示在λi波段激发光激发下供体和受体的消光系数之比:
根据公式(10),可得到在激发下两个探测通道实际测量荧光强度之比:
结合公式(2)和(4)(供受体的发射荧光分布系数uD、uA),可得:
其中
其中fD=[D]/[Dt]=[D]/([D]+[d])表示FRET对中供体的浓度占所有供体浓度的比例,Rt=[At]/[Dt]=([A]+[a])/([D]+[d])表示总受体与总供体的浓度之比;
由公式(5)得到
(2)基于双波长激发的双通道FRET定量检测
采用两种不同波段的激发光(λ1和λ2)分别激发同一个FRET样本,得到在两种激发光下两个探测通道收集到的荧光强度的比值结合uD和uA,根据公式(6)可以得到δ1和δ2的值,再根据公式(12)有:
由公式(1)、(3)(供受体的激发吸收比率系数vD、vA)和(11),可得两种激发波长所对应的供体-受体消光系数的比值满足下式关系:
vDγ2=vAγ1 (15)
结合公式(14)和(15),得到FRET待测样本的表观FRET效率EfD和受供体浓度比Rt的表达式:
3.测量待定参数g值
待测参数g是与供受体的发射光谱性质(eD(λ)和eA(λ))和发射能力(QD和QA)以及探测通道2的光谱性质(L(λ)和S(λ))有关的参量,表达式如下(即为公式(13)):
(1)为了确定g值,可以通过在相同细胞系中转入与待测样本相同供受体组合且浓度比为1:1的两种固定质粒来得到。根据公式(16)可以得到:
其中中的上标1和2分别表示两种不同波段的激发光,下标1和2分别表示所对应的质粒编号。公式(17)结合公式(15)可得:
(2)另外可以通过在相同细胞系中转入与待测样本相同供受体组合且浓度比为1:1的已知效率的一种固定质粒来得到待定参数g值,在这种情况下,[d]=[a]=0,Rt=A/D=1,fD=1,结合公式(15)、(9)和(16)可得,
所述的E表示该FRET参照样本的FRET效率;
如果固定质粒的效率E未知,可以利用受体光漂白方法和光谱分离方法等FRET效率定量检测方法测量得到。
由公式(13)可知,g只与供受体的量子产率和光谱性质以及测量仪器探测通道2的传输函数和探测器的光谱响应函数有关。因此对于特定的供受体和系统,g值一旦测定,就不必每次再测量。
本发明相对于现有技术,具有如下的优点及效果:
本发明是一种基于双通道荧光强度同时探测的荧光共振能量转移(FRET)效率(E)的快速测量方法,不需要选择性激发供体和受体,也不需要选择性收集探测供体和受体荧光。因此,该方法对仪器的配置要求不高,成本低,而且测量过程只需要切换一次激发光,因而具有能够快速实时动态测量的优点,可实现毫秒时间尺度的快速FRET定量显微成像检测。因此,本发明对于活细胞FRET定量实时动态检测具有重要的应用价值,必将极大地推动FRET定量检测技术在细胞生物学中的应用。
附图说明
图1是实施例中所述的双通道宽场荧光显微镜系统的结构示意图。
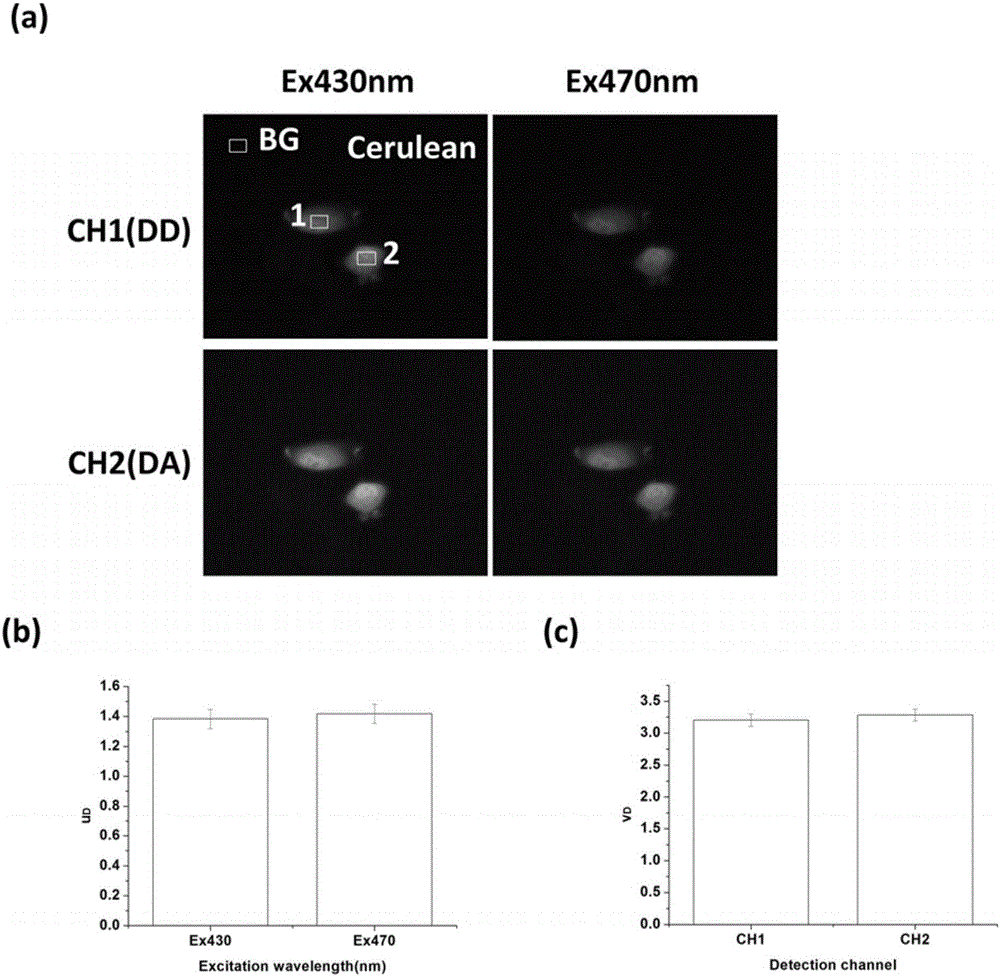
图2是单转C样本的典型荧光图和uD和vD的统计结果;其中,(a)是在双通道宽场荧光显微镜系统上用双波长430±12.5nm和470±10nm激发单转C样本时在通道510±10nm(CH1(DD))和通道537±14.5nm(CH2(DA))上同时分别探测到的典型荧光图;(b)和(c)分别是uD和vD的统计结果。
图3是单转V样本的典型荧光图和uA和vA的统计结果;其中,(a)是在双通道宽场荧光显微镜系统上用双波长430±12.5nm和470±10nm激发单转V样本时在通道510±10nm(CH1(DD))和通道537±14.5nm(CH2(DA))上同时分别探测到的典型荧光图;(b)和(c)分别是uA和vA的统计结果。
图4是C32V样本和CTV样本的典型荧光图;其中,(a)和(b)分别是在双通道宽场荧光显微镜系统上用双波长430±12.5nm和470±10nm激发C32V样本和CTV样本时在通道510±10nm(CH1(DD))和通道537±14.5nm(CH2(DA))上同时分别探测到的对应的典型荧光图。
图5是FRET样本CVC的典型荧光图;其是在双通道宽场荧光显微镜系统上用双波长430±12.5nm和470±10nm激发CVC样本时在通道510±10nm(CH1(DD))和通道537±14.5nm(CH2(DA))上同时分别探测到的典型荧光图。
具体实施方式
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
实施例1
1.质粒来源
供体荧光基团为基因编码荧光蛋白Cerulean(简称C),受体为基因编码荧光蛋白Venus(简称V),参照串联质粒C32V编码的蛋白是由32个氨基酸组成的肽链(TSGLETRDIRSENLYFQGPREFPGGTAGPVAT)将供体C和受体V连接而成的,参照串联质粒CTV即Cerulean-TRAF-Venus,其中TRAF是一个由229个氨基酸的组成的长肽链肿瘤坏死因子的受体相关因子域;待测串联质粒CVC(Cerulean-5-Venus-5-Cerulean)包含两个供体C和一个受体V,C和V之间由5个氨基酸连接,这些质粒都购于美国addgene质粒库(Koushik S V,Blank P S,Vogel S S.Anomalous surplus energy transfer observed with multiple FRET acceptors[J].PloS one,2009,4(11):e8031)。
2.双通道宽场荧光显微镜系统
该双通道宽场荧光显微镜系统产自德国卡尔蔡司公司,型号为Axio Observer,结构如图1所示。光源是美国Lumen Dynamics公司的X-Cite 120Q系列的金属卤化灯,物镜是放大倍数为40、数值孔径为1.3(40×1.3NA)的油镜,一个三孔的激发滤光片拉板,一个衰减片转轮,一个cube(每个cube中可安装激发片、分光片、发射片各一个)转轮,外接两个CCD相机。激发光波长通过推拉激发滤光片拉板来进行选择,激发光强通过选择光源输出的不同档位和衰减片转轮的不同衰减程度来调节。
3.细胞培养以及质粒转染
HepG2细胞来自中国广州暨南大学,用DMEM培养基加入10%的新生牛血清放在含有5%二氧化碳的37℃的培养箱中培养。细胞用胰蛋白酶消化,转到细胞培养皿中,培养24小时后,当细胞生长至70~90%时,用体外转染试剂TurbofectTM将质粒短暂转入细胞。
质粒转染的具体步骤:(1)取两只灭菌的EP管,每个EP管中先加入40μL无血清的DMEM。然后向一只EP管中加入1~2μL的转染试剂,另一只EP管中加入1~2μL(500~600ng/μL)的质粒,静置5分钟;(2)5分钟后,将两只EP管混匀,轻轻吹打6~8次后静置20分钟,(3)20分钟后,将420μL的无血清的DMEM加入到刚刚混匀的EP管中,轻轻混匀;(4)用无血清的DMEM培养基或PBS清洗培养皿中细胞2~3次,主要洗去死细胞等脏污,然后把上述的(3)中的混合物移到培养皿中,把培养皿重新放回培养箱中4~6小时;(5)4~6小时后,吸去转染液,然后用用无血清的DMEM培养基或PBS清洗培养皿中细胞2~3次,再往培养皿中加入含有新生牛血清的DMEM培养基,培养24~48小时即可用于实验。
4.FRET样本的测量过程
4.1.通过单转C样本和单转V样本测量得到供受体的激发吸收比率系数(vD和vA)和发射分布系数(uD和uA)
将分别载有表达单转C和单转V的HepG2细胞(简称单转C细胞和单转V细胞)的培养皿分别置于宽场荧光显微镜40×1.3NA的油镜上进行双通道同时荧光成像。在FRET检测时,使用430/25nm激发光(表示的是以430nm为中心、带宽为25nm的激发光)激发Cerulean,使用470/20nm激发光(表示的是以470nm为中心、带宽为20nm的激发光)激发Venus,双通道的荧光探测通道分别是采用510/20nm(表示的是以510nm为中心、带宽为20nm的发射光)通道检测Cerulean发射的荧光,537/29nm(表示的是以537nm为中心、带宽为29nm的发射光)通道检测Venus发射的荧光。得到图2(a)和3(a)中的表达了单转C和单转V的典型细胞荧光图。将图2(a)中单转C细胞在各个通道中荧光图的第一个区域(ROI1)的平均强度减去对应通道的背景区域(BG)的平均强度,然后除以测量通道图像时相机的曝光时间,我们就可以得出单转C细胞ROI1在各个通道所对应的相对荧光强度值:IDD(C,ROI1,Ex430nm)=6.471,IDA(C,ROI1,Ex430nm)=4.886,IDD(C,ROI1,Ex470nm)=1.984,IDA(C,ROI1,Ex470nm)=1.459。将所求的各通道的相对荧光强度代入公式(1)和(2)中,可以求出uD(C,ROI1,Ex430nm)=1.324,uD(C,ROI1,Ex470nm)=1.360,vD(C,ROI1,CH1)=3.261,vD(C,ROI1,CH2)=3.349。按照这种方法,统计27个细胞区域分别得到uD和vD的统计结果,如图2(b)和(c)所示,即uD=1.383±0.064,vD=3.201±0.093。我们也可以用同样的方法计算出图3(a)中单转V细胞ROI1所对应的各个参数值:IDD(V,ROI1,Ex430nm)=1.781,IDA(V,ROI1,Ex430nm)=9.671,IDD(V,ROI1,Ex470nm)=14.907,IDA(V,ROI1,Ex470nm)=83.160。将所求的各通道的相对荧光强度代入公式(3)和(4)中,可以求出uA(V,ROI1,Ex430nm)=0.184,uA(V,ROI1,Ex470nm)=0.179,vA(V,ROI1,CH1)=0.119,vA(V,ROI1,CH2)=0.116。按照这种方法,统计15个细胞区域分别得到uA和vA的统计结果,如图3(b)和(c)所示,即uA=0.183±0.009,vA=0.110±0.004。
4.2.通过受供体浓度比为1:1的样本C32V和CTV来测量系统校正因子g
将分别载有表达C32V和CTV的HepG2细胞(简称C32V细胞和CTV细胞)的培养皿分别置于宽场荧光显微镜40×1.3NA的油镜上进行双通道同时荧光成像。同样方法进行FRET检测,得到图4(a)和(b)分别为C32V和CTV的典型细胞荧光图。按上面的方法也可以计算出图4(a)中C32V细胞ROI1所对应的各个参数值:IDD(C32V,ROI1,Ex430nm)=3.398,IDA(C32V,ROI1,Ex430nm)=7.192,IDD(C32V,ROI1,Ex470nm)=2.454,IDA(C32V,ROI1,Ex470nm)=9.393,代入公式(5)计算得结合前面得到的uD和uA,将和分别代入公式(6)分别得到和同样得到图4(b)中CTV细胞ROI1所对应的各个参数值:IDD(CTV,ROI1,Ex430nm)=4.272,IDA(CTV,ROI1,Ex430nm)=4.227,IDD(CTV,ROI1,Ex470nm)=2.598,IDA(CTV,ROI1,Ex470nm)=8.198,代入公式(5)计算得结合前面得到的uD和uA,将和分别代入公式(6)分别得到和将和结合公式(1)和(3)中得到的vD和vA代入公式(7),得到g=4.038。最后我们统计了测量得到的10个C32V的细胞和10个CTV的细胞所对应的g值(共100(10×10)组),得到平均值为g=4.111±0.914。
4.3.测量FRET样本CVC的FRET效率
将载有表达CVC的HepG2细胞(简称CVC细胞)的培养皿分别置于宽场荧光显微镜40×1.3NA的油镜上进行双通道同时荧光成像。同样方法进行FRET检测,得到图5(a)为CVC的典型细胞荧光图。按上面的方法也可以计算出图5(a)中CVC细胞ROI1所对应的各个参数值:IDD(CVC,ROI1,Ex430nm)=4.951,IDA(CVC,ROI1,Ex430nm)=10.551,IDD(CVC,ROI1,Ex470nm)=3.089,IDA(CVC,ROI1,Ex470nm)=8.095,代入公式(5)计算得结合前面得到的uD和uA,将和分别代入公式(6)分别得到δ1(Ex430nm)=3.480和δ2(Ex470nm)=5.647;再结合得到的vD、vA和g将δ1和δ2代入公式(9)得到CVC的FRET效率为E=0.469。按这种方法统计了18个CVC细胞得到效率的平均值为ECVC=0.459±0.024。本实验的结果可以通过Zal T等人[Zal T,Gascoigne N R.Photobleaching-corrected FRET efficiency imaging of live cells[J].Biophysical journal,2004,86(6):3923-3939.]提出的3-cubes强度法测量FRET效率的方法来进行验证,得到CVC的效率为0.444±0.038,与用本发明测量得到的结果(0.459±0.024)一致。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!