一种口蹄疫病毒胶体金试纸条、病原快速检测试剂盒及其制备方法与流程
本发明属于生物技术领域,具体涉及一种口蹄疫病毒胶体金试纸条、病原快速检测试剂盒及其制备方法。
背景技术:
口蹄疫(Foot-and-mouth disease,FMD)又称口疮热(Aphthous fever),是由口蹄疫病毒(Foot-and-mouth disease virus,FMDV)感染引起的偶蹄动物共患的急性、热性、高度接触性传染病。除了猪、牛、羊等主要家畜之外,FMDV还可以感染三十多种野生动物,感染后发病率几乎高达100%。患病动物的口、舌、蹄和乳房等部位出现水泡,破溃并形成烂斑。人也可以感染FMD,症状较轻,大多病程呈良性经过。世界各国都高度重视FMD疫情,世界动物卫生组织(OIE)和世界粮农组织(FAO)将其列为A类动物传染病之首。FMD的爆发,不仅给流行国家或地区的畜牧业造成巨大的经济损失,而且严重地干扰了这些国家或地区的社会经济秩序,并导致政治危机和国际间贸易摩擦。
FMDV属于小RNA病毒科(Picornaviridae)口蹄疫病毒属(Aphthovirus)成员,病毒基因组为单股正链RNA,大约8,500个核苷酸,有7个血清型和80多种血清亚型,7个血清型分别为O型、A型、C型、SATⅠ型(南非Ⅰ型)、SATⅡ型(南非Ⅱ型)、SATⅢ型(南非Ⅲ型)、AsiaⅠ型(亚洲Ⅰ型),由于病毒的遗传不稳定性,抗原特征的不断改变而导致的新的病毒亚型不断出现。FMDV颗粒呈球形,正二十面体对称,直径为20-30nm,无囊膜,是已知的动物最小的RNA病毒。其衣壳由4种结构蛋白1A(VP4,85个氨基酸)、1B(VP2,218个氨基酸)、1C(VP3,220个氨基酸)、1D(VP1,213个氨基酸)各60个分子组成,其中1B、1C、1D位于衣壳表面(Jackson et al.,2003)。FMDV超速离心后,可见大小不同的粒子,第一种颗粒称为146S完整病毒颗粒,是由60个拷贝的VP1、VP2、VP3和VP4组成的外壳蛋白包裹而成的最大的颗粒,直径为25nm,沉降系数146S,在氯化铯中的浮密度为1.43g/cm3,分子量为8.08×106u;第二种颗粒称为75S空衣壳颗粒,由VP0(未裂解的VP2和VP4)、VP1、和VP3三种结构蛋白各60个分子组成,直径为21nm,沉降系数75S,在氯化铯中的浮密度为1.31g/cm3,分子量为4.7×106u;第三种颗粒称为12S衣壳蛋白亚单位颗粒,是由VP1、VP2、VP3各5分子组成的五聚体结构,直径为7nm,沉降系数12S,在氯化铯中的浮密度为1.5g/cm3,分子量为3.8×106u;第四种颗粒称为5S原体,是由VP0、VP1、和VP3各1个分子组成的。一个蛋白亚单位构成病毒粒子二十面体的一个面,用酸处理FMDV,可使每个病毒粒子释放出20个蛋白亚单位(柳纪省,1999)。
FMD诊断技术是FMD防制的重要环节,随着生物技术的迅速发展和仪器设备的不断更新换代,FMD的检测技术也得到了空前的发展。补体结合试验(complement fixation test,CFT)是最早标准化的检测方法,自1943年成功地用于FMD病毒分型鉴定以来,一直被WRL和各FMD研究或定型中心应用至今。该方法可鉴定抗原,也可鉴定抗体,并可进行定量测定。一般用常量CFT为待检血清定型,微量CFT用于亚型和毒株抗原性分析,但现在国际上已经不用亚型这一个概念,因为在试验中所用的标准毒株不统一造成亚型分类的混乱,而且病毒亚型并不能准确地说明毒株之间的免疫关系。CFT操作繁琐,不适于大规模样品的检测;加上CFT试验结果不够稳定,误差较大,因此,OIE已经正式推荐酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)代替传统的补体结合试验。OIE的Anon(2000)认为病毒中和试验(virus neutralization test,VNT)是检测FMD抗体的“黄金标准”,是国际贸易指定的检测方法之一。VNT既可鉴定抗原,又可对抗体定量测定,具有型特异性,是最经典和最具权威性的FMD检测方法,常作为其它检测方法的参照。国际检疫条款规定用此法判定进出境动物是否感染或携带FMD病毒。VNT的缺点是要用活病毒,对操作人员和环境要求较高,只能在专门的实验室里进行。上述的传统血清学诊断方法皆不能区分FMD野毒感染的动物群体和疫苗免疫的动物群体(differentiate infected from vaccinated animals,DIVA)。由于FMDV有7个血清型和几十种血清亚型,型与型之间无交叉免疫保护作用,这就增加了FMD诊断的难度,特别是FMD疫苗免疫的国家和地区要确诊FMD的感染更加困难。
技术实现要素:
有鉴于此,本发明的目的在于提供快速诊断口蹄疫群特异性胶体金层析试纸条试剂盒,用于快速简便的口蹄疫检测中,本发明的申请人利用自主研制的口蹄疫单克隆抗体研制出可以快速诊断口蹄疫群特异性胶体金层析试纸条试剂盒,本发明成果的推广应用,可以满足现场检测的需要,达到显著降低检测成本,大大缩短检验周期,提高口岸通关速度和疫病监测效率的目的,为我国口蹄疫的监测、预警和控制提供坚强的技术支持。
即本发明的第一目的在于提供一种口蹄疫病毒胶体金试纸条,包括背衬、硝酸纤维素膜、吸水垫、金标垫、样品垫,所述背衬板设在最底部,硝酸纤维素膜设置于衬板上部中央,硝酸纤维素膜上部右端贴有吸水垫,硝酸纤维素膜上部左端设有金标垫,金标垫上部右端设有样品垫,其中所述的硝酸纤维素膜上右端喷有兔抗鼠免疫球蛋白作为质控带,硝酸纤维素膜上左端喷有口蹄疫病毒多克隆抗体作为检测带,金标垫上喷有胶体金标记的口蹄疫病毒单克隆抗体。
优选地,本发明所述的口蹄疫病毒胶体金试纸条中,所述金标垫与样品垫之间有交叠,所述吸水垫和金标垫与硝酸纤维素膜的衔接处有交叠;更优选地,所述标垫与样品垫之间的交叠,与所述吸水垫和金标垫与硝酸纤维素膜的衔接处的交叠为0.3cm。
优选地,本发明所述的口蹄疫病毒胶体金试纸条中,所述胶体金标记的口蹄疫单克隆抗体为口蹄疫O型群特异性单克隆抗体。
优选地,本发明所述的口蹄疫病毒胶体金试纸条中,所述检测带的口蹄疫病毒抗体为口蹄疫病毒多克隆抗体。
本发明的另一目的在于提供上述口蹄疫病毒胶体金试纸条的制备方法,包括以下步骤:
1)制备胶体金:采用柠檬酸三钠还原法制备胶体金;
2)制备胶体金标记的口蹄疫病毒单克隆抗体:调节步骤1)胶体金的pH值,将口蹄疫病毒单克隆抗体溶液加入胶体金溶液,以牛血清白蛋白饱和游离胶体金,离心即得胶体金标记的口蹄疫病毒单克隆抗体;
3)组装口蹄疫病毒胶体金试纸条:制备含有检测带和质控带的硝酸纤维素膜,并制备胶体金垫,分别将背衬板、样品垫、胶体金垫,包括检测带、质控带的硝酸纤维素膜以及吸水垫按由下至上顺序装配,剪切成条状,即制成不同型口蹄疫病毒诊断试纸条。
优选地,本发明所述的口蹄疫病毒胶体金试纸条的制备方法中,所述步骤2)制备胶体金标记的口蹄疫病毒单克隆抗体的方法为:用0.2mol/L K2CO3或0.1mol/L HC1调节步骤1)获得的胶体金溶液的pH8.4~8.7;
在磁力搅拌下,将口蹄疫病毒单抗溶液加入50mL胶体金溶液中,加入单抗时应逐滴加入,lmg的单抗蛋白质大约5min加完。在最低稳定量(20μg/ml)的基础再加10%~20%即为待标记单抗的实际用量;
在磁力搅拌器下,加入终浓度为1%(w/v)的牛血清白蛋白(BSA)以饱和游离的胶体金,继续搅拌30min;
先将金标抗体用1500r/min低速离心1h,弃去沉淀;将离心获得的上清再以15000r/min第二次离心1h,弃去上清;将第二次离心获得的沉淀以原体积的0.02mol/L TBS pH8.2(内含1%BSA,0.05%叠氮钠)溶解后,重复离心2-3次,沉淀溶于原体积的1/10TBS中,即获得胶体金标记的口蹄疫病毒单克隆抗体。
优选地,本发明所述的口蹄疫病毒胶体金试纸条的制备方法中,在所述步骤3)中含有检测带(7)和质控带(6)的硝酸纤维素膜(2)的方法为:用浓度为(1.5-2.5mg/mL)纯化的FMDV多抗和兔抗鼠免疫球蛋白(0.8-1.2mg/mL)分别用划膜仪划在硝酸纤维膜上。分别作为检测线和对照线,点样量为0.75μL/cm,37℃干燥2h,4℃密封保存备。
优选地,本发明所述的口蹄疫病毒胶体金试纸条的制备方法中,在所述步骤3)中制备胶体金垫的方法为使用步骤2)获得的胶体金标记的口蹄疫病毒单克隆抗体,用划膜喷金仪喷于玻璃纤维素膜上,喷样量为1.5-2.0μL/cm,取出于4℃真空抽干,加入干燥剂或变色硅胶,密封保存于4℃冰箱中。
优选地,本发明所述的口蹄疫病毒胶体金试纸条的制备方法中,所述的胶体金溶液的配制:取2g BSA,溶解于45mL去离子水中;取1g PVP,溶解于20mL去离子水;取1g PEG溶解于20mL去离子水;取2g脱脂奶粉,溶解于45mL去离子水;8mL 5%酪蛋白溶液,溶解后,12500±200r/min离心30min,取上清备用。取0.8L去离子水,加入6.4g柠檬酸,6.06g trizma base,2.8g NaOH,充分混合,调节pH至8.1±0.05;加入0.2g NaN3,3g Tween-20,25g蔗糖,6.25g海藻糖。将所有的上述液体加入到最后一个溶液中充分混合。用三蒸去离子水补平至1L。2-8℃保存备用。
本发明的又一目的在于提供口蹄疫病毒胶体金试纸条病原快速检测试剂盒,所述试剂盒包含上述口蹄疫病毒胶体金试纸条。
本发明的试纸条检测方法为:
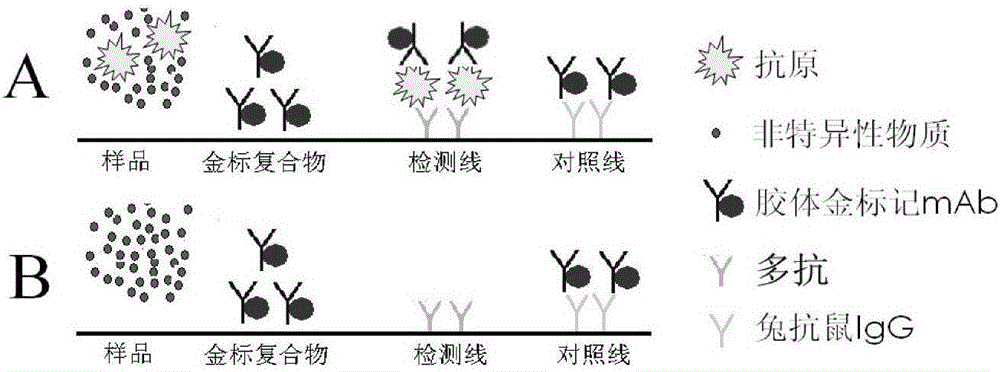
如图2所示,当样品中的抗原首先与金标FMDV单抗发生反应,形成复合物。当样品沿着试纸条通过毛细作用向上泳动时,如果被检样品中含有口蹄疫病毒抗原时,抗原首先与金标单抗结合形成“口蹄疫病毒一金标FMDV单抗”复合物,该复合物继续流动,与被固定在检测线上的FMDV多抗结合形成“FMDV多抗一口蹄疫病毒一金标FMDV单抗”复合物,金颗粒在检测线上富集而呈现红色;没有结合的金标FMDV单抗继续向前流动,与固定在阴性对照线上的兔抗Balb/c小鼠免疫球蛋白形成“兔抗Balb/c小鼠免疫球蛋白一金标抗FMDV单抗”复合物,金颗粒在阴性对照线上富集而呈现红色(对照线),如图2所示。同时出现在检测线和对照线的为阳性反应,只在对照线出现红色条带为阴性反应。对照线内未出现红色条带,表明操作过程不正确或试纸条失效。
由上可知,本发明的口蹄疫病毒胶体金试纸条、口蹄疫病毒胶体金试纸条病原快速检测试剂盒及其制备方法,至少有以下优点:
1)本发明研制了FMDV群特异性胶体金试纸条,优化了检测方法胶体金颗粒、硝酸纤维素规格和吸水垫规格等。
2)本发明所研制的FMDV群特异性胶体金试纸条特异性强,没有与其他家畜病毒抗原的交叉反应。
附图说明
图1本发明的一个实施例中胶体金试纸条结构示意图;
图2本发明的口蹄疫病毒胶体金试纸条反应原理示意图;
图3本发明的一个实施例中胶体金颗粒的电镜图;
图4本发明的一个实施例中FMDV群特异性试纸条特异性试验图。
具体实施方式
以下通过具体实施例进一步对本发明的技术方案进行说明,应理解以下仅为本发明的示例性说明,并不用于限制本发明权利要求的保护范围。
本实施例中3株O型FMDV细胞毒购自兰州兽医研究所,O型口蹄疫免疫抗原和检测抗原以及O、A、C、Asia1型FMDV、猪水疱病病毒、猪瘟病毒的灭活病毒抗原购自兰州兽医研究所。
血清:O、A、C、AsiaI血清型FMD阳性血清、阴性血清,猪瘟阳性血清,猪水疱病阳性血清均购自兰州兽医研究所,豚鼠FMD感染阳性血清和阴性血清由农业部兽医诊断中心购得,FMD不同免疫次数的猪待检血清由广东温氏集团公司(采自多个养猪场)购得,山羊抗豚鼠IgG-HRP和山羊抗猪IgG-HRP购自Sigma公司,兔抗Balb/c小鼠免疫球蛋白为Sigma公司产品。
3株口蹄疫群特异性单克隆抗体,具有较高的效价的抗O型口蹄疫病毒的特异性单克隆抗体细胞株1D4、2E11、4C12,由兰州兽医研究所购得。
实施例1口蹄疫病毒胶体金试纸条的制备
1、胶体金的制备:采用柠檬酸三钠还原法制备胶体金
0.01%的氯金酸l00mL置于锥形瓶内在微波炉内加热,直至煮沸,约3min。
准确吸取1.0mL,1.5mL,2.0mL,2.5mL,3mL,4mL的1%柠檬酸三钠,分别迅速加入锥形瓶中,摇晃均匀后,立即放入微波炉中继续煮沸15min,此时可观察到淡黄色的氯金酸水溶液在柠檬酸钠加入后很快变灰色,续而转成黑色,随后逐渐稳定成红色,全过程约2~3min。直至金黄色的氯金酸变成红色后,停止反应,加入柠檬酸三钠的量和金颗粒直径大小的关系,以及金颗粒的基本特性见下表1。
表1胶体金制备中柠檬酸三钠的使用量和金颗粒直径大小的关系
*还原100mL 0.01%HauC14所需量
制备的胶体金悬液冷却至室温后用超纯水恢复至原体积,加入0.02%的NaN3,经一次性灭菌滤器过滤,装入洁净棕色玻璃瓶中4℃冰箱保存备用。为鉴定制备的胶体金颗粒的质量,可以用电镜观察胶体金的直径大小及均匀度,选择合适直径的胶体金颗粒。
胶体金溶液外观呈酒红色,色泽鲜艳,晶莹透亮,迎着日光可见有光带;紫外分光光度计测得胶体金溶液的ODmax在525nm处;电镜下观察,可见胶体金颗粒大小一致,分布均匀,具体见图3。可见制备的胶体金直径为41nm。
2、胶体金标记的口蹄疫病毒单克隆抗体的制备:
2.1口蹄疫病毒单克隆抗体的纯化
将提纯的FMDV群特异性单抗(3株细胞株分泌的口蹄疫0型群特异性单克隆抗体)置于透析袋中在双蒸水中进行透析,中间换几次透析液,透析三天。取出50μL的透析过的抗体,加入1mL 0.5M BaCl2检验是否透析彻底。取3-4mL透析过的腹水,加入萘氏试剂1-2滴,至无颜色变化。标记前以5000r/min 4℃离心60min以除去聚合物,取上清液备用。用核酸蛋白仪测定浓度,根据公式:mg/mL=(1.450D260-0.740D280)×稀释倍数,计算得到纯化后抗体浓度。
将经提纯的FMDV单抗稀释,用蛋白核酸测定仪在280nm和260nm处的吸光度,根据公式:mg/mL=((1.450D260-0.740D280)×稀释倍数,计算得单抗蛋白含量为:C1=1.00mg/mL(第一管),C2=1.55mg/mL(第二管)。
2.2胶体金与待标记抗体用量比例的确定
胶体金标记蛋白时,首先要确定最佳蛋白标记量。一般用固定胶体金溶液体积(1mL),改变蛋白质用量(体积)的方法进行。核酸蛋白仪测定抗体浓度后,将抗体逐级稀释后(由10μg/mL~40μg/mL,另设对照管),各取0.lmL(1/10体积的蛋白质溶液)按顺序加入一系列装有lmL胶体金的离心管中,震荡混匀,室温放置30min,在上述各管内分别加入0.1mL 10%(w/v)氯化钠溶液。按照表2中的顺序进行,当加入氯化钠后、混匀静置2h以上观察结果。未加抗体和加入抗体的量不足以稳定胶体金的各管,会呈现由红变蓝的聚沉现象,而加入抗体量达到或超过最低稳定量的各管仍保持红色不变。
表2胶体金标记FMDV单抗定量试验
注:第1管为没有加入单抗的对照管,第9管为没有加入NaCl的对照管,相应的加入0.1mL的三蒸水。
按表2测定的结果:第l管加入0.1mL 10%氯化钠后胶体金溶液很快沉聚,从第2管和第3管由于抗体量不足以稳定胶体金,胶体金溶液逐渐沉聚,试管的颜色变蓝或变淡,从第4管开始胶体金的颜色与对照管的颜色基本一致,所以本实验确定胶体金标记FMDV单抗的最低量为20μg。
2.3胶体金标记抗体的最适pH
胶体金与蛋白的标记,是在一定的酸碱条件下完成的,因为其酸碱度的差别,会导致蛋白与胶体金的解离,所以必须选择最佳的pH标记。根据文献资料,常用的几种蛋白质标记时,胶体金所用的pH值如下表3所示。
表3胶体金pH与待标记蛋白质之间的对应关系
用0.2mol/L K2CO3或0.1mol/L HC1调节步骤1)获得的胶体金溶液的pH稍高于最适PI(pH8.2)的0.2~0.5pH,即pH8.4~8.7。
在磁力搅拌下,将口蹄疫病毒单抗溶液加入50mL胶体金溶液中,加入单抗时应逐滴加入,lmg的单抗蛋白质大约5min加完。在最低稳定量(20μg/ml)的基础再加10%~20%即为待标记单抗的实际用量;
在磁力搅拌器下,加入终浓度为1%(w/v)的牛血清白蛋白(BSA)以饱和游离的胶体金,继续搅拌30min。
先将金标抗体用1500r/min低速离心1h,弃去沉淀;将上清再以15000r/min离心1h,弃去上清,以去除上清液中未结合的蛋白质。
将沉淀以原体积的0.02mol/L TBS pH8.2(内含1%BSA,0.05%叠氮钠)溶解,重复离心2-3次,沉淀溶于原体积的1/10TBS中。4℃保存备用。
3、组装口蹄疫病毒胶体金试纸条
1)金标膜的制备
金标单抗制备后,用划膜喷金仪喷于玻璃纤维素膜上,喷样量分别为1.0,1.5,2.0,2.5,3.0μL/cm,得到最佳喷样量为1.5-2.0μL/cm,取出于4℃真空抽干,加入干燥剂或变色硅胶,密封保存于4℃冰箱中。
2)制备含有检测带和质控带的硝酸纤维素膜
用不同浓度纯化的FMDV多克隆抗体(纯化方法同实施例1单抗的纯化方法,区别仅在于将三种单抗等比例同时使用)(1.0,1.5,2.0,2.5,3.0mg/mL)和兔抗鼠免疫球蛋白(0.75、1.0、1.5、2.0、2.5mg/mL)分别作为检测线和对照线试剂。将两种试剂分别用划膜仪划在硝酸纤维膜上,得到最佳划膜浓度,纯化的FMDV多抗浓度为(1.5-2.5mg/mL),兔抗鼠免疫球蛋白浓度为(0.8-1.2mg/mL),划膜量为0.75μL/cm。37℃干燥2h,4℃密封保存备。
3)试纸条的组装
按图1所示,将NC膜平贴于背衬的中央。要注意伸展平贴,贴后不能有空隙或气泡。胶金垫平贴于NC膜T线的下方,重叠NC膜0.3cm,样品垫再平贴于胶金垫上,重叠胶金垫一部分。将吸水纸平放于NC膜C线的一端,重叠NC膜0.3cm。并于CM4000切条机中,将其切成3mm宽的试纸条,于4℃干燥保存备用。
FMDV群特异性胶体金试纸条检测结果判定方法为:
所建立的FMDV群特异性胶体金试纸条检测结果判定为:
阳性:在观察孔内,检测线区(T)及对照线区(C)同时出现紫红色线;
阴性:在观察孔内,只有对照线区(C)出现一条紫红色线;
失效:在观察孔内,对照线区(C)和检测线区(T)都不出现色线;或仅检测线区(T)出现色线。
实施例2口蹄疫病毒试纸条检测实验方法
1特异性试验
用试纸条对O、A、Asia1型FMDV、猪水疱病病毒(VSV)、猪瘟病毒的灭活病毒抗原(CSPV),蒸馏水和正常细胞培养物分别进行检测,观察结果。
结果试纸条只与各型FMDV反应,如图4所示,说明该试纸条具有很好的特异性。其中,图4中试纸条从左到右依次为:
1 O型FMDV、2Asia1型FMDV、3VSV、4正常细胞培养物、5CSPV、6BTV、7WNV、8正常猪血清、9蒸馏水。
2敏感性试验
将标准抗原做倍比稀释,分别将试纸条插入不同稀释液中,与反向间接血凝试验比对测定能检测出病毒的量。再用核酸蛋白仪测定标准抗原蛋白含量,用试纸条测定最低检出量。
对纯化的FMDV抗原(经测定蛋白含量为0.84mg/mL)5倍稀释后作连续倍比稀释,用试纸条测试其最低检出量。测试结果显示FMDV抗原在2560倍稀释时仍可检出,可见试纸条对纯化FMDV抗原的最低检出量为0.31μg/mL。约是病毒中和试验中相当于100-200ECID50的病毒含量,灵敏度已经非常高,且比其它方法明显简便易行。
表4 FMDV群特异性胶体金试纸条的敏感性试验
注:+++代表显示最深,强阳性;+为阳性,-为阴性。
3重复性试验
随机取出不同批次的试纸条,每个批次挑取5个试纸条分别与1,3,6个月后进行检测,做批间重复试验。用O、Asia1型FMDV灭活病毒抗原5份作5个重复,观察结果。
对随机挑取的不同批次间的试纸进行重复试验,每一批次挑取5个试纸条分别对同一份标准阳性样品进行检测,结果发现每一批次内试纸条的检测结果完全一致,且不同批次间的检测结果也完全一致,从而表明该方法的检测重复性良好。
4保质期试验
取标准抗原稀释40倍后,用4℃保存不同时间(1、2、3、4、5、6、7、8、9个月)的试纸条各40条(30条检测标准抗原,10条检测正常细胞培养液)进行定性检测。
结果发现,在4℃保存7个月内,试纸条检测结果没有任何变化,用在4℃保存8个月和9个月的试纸条检测时,各有2份为假阳性;在室温条件下保存7、8和9个月的试纸条分别检测时,各有2份、2份和3份为假阳性;不同温度保存不同时间的试纸条检测10份阴性样品均为阴性,详细结果如表3所示。试验表明,该试纸条在4℃可以保存7个月和室温下保存半年,敏感性和特异性均不受影响。
表5试纸条保质期试验
注:n/m,表示阳性样品数量/阴性样品数量。
5临床样品检测
采用研制的FMDV群特异性胶体金试纸条对50份临床疑似样品进行检测,并和兰州兽医研究所提供的反向间接血凝检测试剂盒对比,所有的检测结果一致。
本发明实施例获得的试纸条的重复性较好,而且稳定性也很好,在室温就可以保存半年,增加了其临床的实用性,不需要特殊试验条件,结果客观,肉眼易于判断。所以此法是一项很有前途的技术,非常适宜在广大基层单位推广和应用。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!