一种蜂胶和杨树胶的鉴别方法与流程
本发明属于食品、药品质量控制方法领域,具体涉及一种蜂胶和杨树胶的鉴别方法。
背景技术:
蜂胶因其具有广泛的生物学活性,如抗癌,抗氧化,抗炎,抗菌和抗真菌活性,受到了人们广泛的关注,在医疗保健等领域得到了广泛的应用,然而,蜂胶的生产受到蜂种、采胶方式以及胶源情况的影响,产量相对较低,一直处于供不应求状况。因杨树芽提取物与杨树型蜂胶提取物在成分、颜色、气味上极其相似,近年来用杨树胶(杨树芽提取物)冒充蜂胶的现象屡屡发生。现行蜂胶质量控制主要针对类黄酮和多酚两大类成分,而这两类成分杨树芽提取物与杨树型蜂胶同时存在,这使得区分蜂胶和杨树胶变得相当因难。因此,建立一种有效区分蜂胶与杨树胶的分析方法是控制蜂胶质量的关键。
中国发明专利CN101620208B公开了《一种蜂胶与杨树胶的鉴别方法》,通过反相高效液相色谱仪分别测定了蜂胶、杨树胶和掺入不同比例的蜂胶的指纹图谱,通过指纹图谱对比,判断蜂胶的真假,以控制蜂胶质量。但是该方法由于受仪器、实验条件等条件限制,在不同条件下指纹图谱的重现性很差,给鉴别带来难度,方法很难普及。
为了克服这一缺陷,中国发明专利CN101871919B公开了一种《蜂胶与杨树胶的鉴别方法》,杨树胶中含有水杨苷,而蜂胶中不含水杨苷,用高效液相色谱测定水杨苷来判断蜂胶的真假,以此来控制蜂胶质量。该方法采用明确的标准品(水杨苷),即使在不同条件下操作,根据水杨苷的出峰时间及紫外吸收,也可以进行准确鉴别。但是水杨苷易被水解,若不法商贩用化学手段将其破坏,则该方法即失去了原有的作用。
蜂胶中的众多活性组分都具有抗氧化性,目前尚未有将蜂胶中的抗氧化活性组分作为对照品来鉴别蜂胶和杨树胶的报道。专利CN102507772A公开了《一种检测混合物中抗氧化活性化合物的方法》,采用高效液相色谱-自由基检测系统联用的在线检测抗氧化组分的方法,该方法相当于在高效液相色谱已有的可见紫外检测器的基础上再加上抗氧化活性检测器,一次色谱分析即可得到混合物中各个化合物的抗氧化活性数据,相较于离线抗氧化检测法简捷快速,且能避免活性组分的降解。
技术实现要素:
本发明所要解决的技术问题是针对现有技术的现状,提供一种重复性好,检测准确的蜂胶和杨树胶的鉴别方法。该鉴别方法采用高效液相色谱-自由基检测系统联用的在线检测方法。
本发明解决上述技术问题所采用的技术方案为:一种蜂胶和杨树胶的鉴别方法,包括如下步骤:
(1)将蜂胶用乙醇在20℃~27℃超声溶解,随后离心,过滤后将滤液旋转蒸发至膏状,得蜂胶提取物;将杨树胶用乙醇在20℃~27℃超声溶解,随后离心,过滤后将滤液旋转蒸发至膏状,得杨树胶提取物。
(2)将步骤(1)的蜂胶提取物和杨树胶提取物分别用有机溶剂配制成浓度为1mg/mL~3mg/mL的蜂胶提取物分析液和1mg/mL~3mg/mL的杨树胶提取物分析液。
(3)将步骤(2)获得的蜂胶提取物分析液和杨树胶提取物分析液分别进样到高效液相色谱-自由基检测系统联用的在线检测系统中:高效液相色谱的检测条件设定:流动相A为含乙酸的甲醇,B为含乙酸的水,流速为0.6mL/min~0.9mL/min,柱温30℃~40℃;冲洗梯度为:0~20min,30%~60%A;20~25min,60%~50%A;25~35min,50%A;34~37min,50%~55%A;37~45min,55%A;45~80min,55%~85%A;80~85min,85%A,检测波长为280nm,选用shimp-pack VP-ODS色谱柱;加入自由基溶液的流速为0.10mL/min~0.40mL/min,加入该溶液后在特定波长处扫描。
该高效液相色谱-自由基检测系统联用的在线检测系统的工作过程如下:蜂胶提取物分析液或杨树胶提取物分析液经高效液相色谱柱分离后,进入UV检测器在280nm处检测酚类组分的正峰吸收,然后进入一个三通混合器的一个入口,自由基溶液用一个恒流泵输送进入另一个入口,二者在其中混合后,进入一个PEEK盘管组成的柱后反应系统反应一定时间,然后进入另一台UV检测器,在特定波长处检测,记录由于抗氧化活性组分对自由基的清除造成的其在该波长处吸收的降低值(负峰)。
(4)将蜂胶的色谱图与杨树胶的色谱图进行对比,以鉴别蜂胶和杨树胶。蜂胶的色谱图具有山奈酚,咖啡酸,高良姜素,短叶松素-3-乙酸酯,咖啡酸苯乙酯和咖啡酸肉桂酯这几个负峰,杨树胶的色谱图负峰强度较大的只有高良姜素。
若色谱图具有咖啡酸、山奈酚、短叶松素-3-乙酸酯、咖啡酸苯乙酯、高良姜素、咖啡酸肉桂酯这几个负峰,则为蜂胶的色谱图;若色谱图仅具有高良姜素这个强度较大的负峰,则为杨树胶的色谱图。
作为进一步优选,所述步骤(1)中超声温度为25℃。
作为优选,所述步骤(2)中蜂胶提取物分析液和杨树胶提取物分析液的浓度均为1.60mg/mL。
作为优选,所述步骤(2)中有机溶剂为甲醇或乙醇。
作为优选,所述步骤(3)中流动相A中乙酸体积分数为0.05%~0.2%,流动相B中乙酸体积分数为0.05%~0.2%。
作为优选,所述步骤(3)中流动相A中乙酸体积分数为0.1%,流动相B中乙酸体积分数为0.1%。
作为优选,所述步骤(3)中流动相的流速为0.80mL/min。
作为优选,所述步骤(3)中高效液相色谱柱的柱温为35℃。
作为优选,所述步骤(3)中加入自由基溶液的流速为0.20mL/min。
作为优选,所述步骤(3)中自由基为ABTS自由基或DPPH自由基。
与现有技术相比,本发明的优点:本发明采用高效液相色谱-自由基检测系统联用的在线检测方法对蜂胶与杨树胶进行鉴别,既可以抗氧化活性组分为对照品,克服指纹图谱的重现性差的缺陷,又可避免活性组分降解,活性损失,从而导致对照品不稳定的缺陷;且该检测方法高效、直观,操作简便,灵敏度高,重复性好。
附图说明
图1为高效液相色谱-自由基检测系统联用的在线检测系统的工作过程示意图;
图2为实施例2蜂胶的色谱图;
图3为实施例2杨树胶的色谱图;
图4为实施例4蜂胶的色谱图;
图5为实施例4杨树胶的色谱图。
具体实施方式
以下结合具体实施例对本发明作进一步详细描述。
本发明提供了一种蜂胶和杨树胶的鉴别方法,该鉴别方法采用高效液相色谱-自由基检测系统联用的在线检测方法,在本发明的实施例中,自由基溶液优选为ABTS(2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐)溶液。
其中ABTS溶液的配制方法为将ABTS和过硫酸钾分别用水溶解,混合后避光放置一定时间,即得ABTS溶液。
如图1所示,该高效液相色谱-自由基检测系统联用的在线检测系统的工作过程如下:蜂胶提取物分析液或杨树胶提取物分析液分别经高效液相色谱柱分离后,进入UV检测器在280nm处检测酚类组分的正峰吸收,然后进入一个三通混合器的一个入口,ABTS溶液用一个恒流泵输送进入另一个入口,二者在其中混合后,进入一个PEEK盘管组成的柱后反应系统反应一定时间,然后进入另一台UV检测器,在734nm处检测,记录由于抗氧化活性组分对自由基的清除造成的其在该波长处吸收的降低值(负峰)。
实施例1-3的蜂胶和杨树胶均来自山东临沂,以杨树为主要胶源植物。
实施例1
蜂胶和杨树胶的鉴别方法,包括如下步骤:
(1)将0.2g蜂胶用乙醇在20℃超声溶解,随后离心,过滤后将滤液旋转蒸发至膏状,得蜂胶提取物;将0.2g杨树胶用乙醇在20℃超声溶解,随后离心,过滤后将滤液旋转蒸发至膏状,得杨树胶提取物。
(2)将步骤(1)的蜂胶提取物和杨树胶提取物分别用甲醇配制成浓度为1mg/mL的蜂胶提取物分析液和1mg/mL的杨树胶提取物分析液。
(3)将步骤(2)获得的蜂胶提取物分析液和杨树胶提取物分析液分别进样20uL到高效液相色谱-自由基检测系统联用的在线检测系统中,高效液相色谱的检测条件设定:流动相A为含0.05%乙酸的甲醇,B为含0.05%乙酸的水,流速为0.6mL/min,柱温30℃;冲洗梯度为:0~20min,30%~60%A;20~25min,60%~50%A;25~35min,50%A;34~37min,50%~55%A;37~45min,55%A;45~80min,55%~85%A;80~85min,85%A;检测波长为280nm,选用shimp-pack VP-ODS(150mm×4.6mm,5μm)色谱柱;加入ABTS溶液的流速为0.10mL/min,加入该溶液后的检测波长为734nm。
(4)将蜂胶的色谱图与杨树胶的色谱图进行对比,以鉴别蜂胶和杨树胶。化学组分被色谱柱分离后在280nm处被检测得到正峰,具有抗氧化活性的组分在柱后与引入的ABTS自由基溶液反应,在734nm处被检测得到负峰。蜂胶的色谱图具有咖啡酸、山奈酚、短叶松素-3-乙酸酯、咖啡酸苯乙酯、高良姜素、咖啡酸肉桂酯这几个负峰;杨树胶的色谱图仅具有高良姜素这个强度较大的负峰,以此来鉴别蜂胶和杨树胶。
实施例2
鉴别蜂胶和杨树胶的方法,包括如下步骤:
(1)将0.2g蜂胶用乙醇在25℃超声溶解,随后离心,过滤后将滤液旋转蒸发至膏状,得蜂胶提取物;将0.2g杨树胶用乙醇在25℃超声溶解,随后离心,过滤后将滤液旋转蒸发至膏状,得杨树胶提取物。
(2)将步骤(1)的蜂胶提取物和杨树胶提取物分别用甲醇配制成浓度为1.6mg/mL的蜂胶提取物分析液和1.6mg/mL的杨树胶提取物分析液。
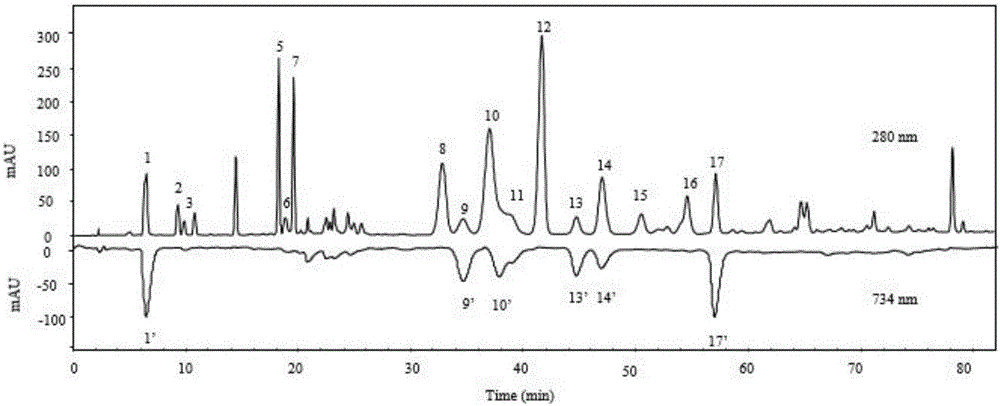
(3)将步骤(2)获得的蜂胶提取物分析液和杨树胶提取物分析液分别进样20uL到高效液相色谱-自由基检测系统联用的在线检测系统中,其中HPLC的检测条件设定:流动相A为含0.1%乙酸的甲醇,B为含0.1%乙酸的水,流速为0.8mL/min,柱温35℃;冲洗梯度为:0~20min,30%~60%A;20~25min,60%~50%A;25~35min,50%A;34~37min,50%~55%A;37~45min,55%A;45~80min,55%~85%A;80~85min,85%A,检测波长为280nm,选用shimp-pack VP-ODS(150mm×4.6mm,5μm)色谱柱;加入ABTS溶液的流速为0.20mL/min,加入该溶液后的检测波长为734nm。
(4)将蜂胶的色谱图与杨树胶的色谱图进行对比,以鉴别蜂胶和杨树胶。如图2所示,色谱图具有咖啡酸(1’)、山奈酚(9’)、短叶松素-3-乙酸酯(10’)、咖啡酸苯乙酯(13’)、高良姜素(14’)、咖啡酸肉桂酯(17’)这几个负峰,为蜂胶的色谱图;如图3所示,色谱图仅具有高良姜素(14’)这个强度较大的负峰,为杨树胶的色谱图,以此来鉴别蜂胶和杨树胶。
实施例3
蜂胶和杨树胶的鉴别方法,其特征在于,包括如下步骤:
(1)将0.2g蜂胶用乙醇在27℃超声溶解,随后离心,过滤后将滤液旋转蒸发至膏状,得蜂胶提取物;将0.2g杨树胶用乙醇在27℃超声溶解,随后离心,过滤后将滤液旋转蒸发至膏状,得杨树胶提取物。
(2)将步骤(1)的蜂胶提取物和杨树胶提取物分别用甲醇配制成浓度为3mg/mL的蜂胶提取物分析液和3mg/mL的杨树胶提取物分析液。
(3)将步骤(2)获得的蜂胶提取物分析液和杨树胶提取物分析液分别进样20uL到高效液相色谱-自由基检测系统联用的在线检测系统中:高效液相色谱的检测条件设定:流动相A为含0.2%乙酸的甲醇,B为含0.2%乙酸的水,流速为0.9mL/min,柱温40℃;冲洗梯度为:0~20min,30%~60%A;20~25min,60%~50%A;25~35min,50%A;34~37min,50%~55%A;37~45min,55%A;45~80min,55%~85%A;80~85min,85%A;检测波长为280nm,选用shimp-pack VP-ODS(150mm×4.6mm,5μm)色谱柱;加入ABTS溶液的流速为0.40mL/min,加入该溶液后的检测波长为734nm。
(4)将蜂胶的色谱图与杨树胶的色谱图进行对比,以鉴别蜂胶和杨树胶。蜂胶的色谱图具有咖啡酸、山奈酚、短叶松素-3-乙酸酯、咖啡酸苯乙酯、高良姜素、咖啡酸肉桂酯这几个负峰;杨树胶的色谱图仅具有高良姜素这个强度较大的负峰,以此来鉴别蜂胶和杨树胶。
由实施例1-3的检测结果得到,实施例2的实验参数最优。因此以实施例2的实验条件对以杨树为主要胶源植物,选自湖南衡阳的蜂胶和杨树胶进行了测试。
实施例4
鉴别蜂胶和杨树胶的方法,包括如下步骤:
(1)将0.2g蜂胶用乙醇在25℃超声溶解,随后离心,过滤后将滤液旋转蒸发至膏状,得蜂胶提取物;将0.2g杨树胶用乙醇在25℃超声溶解,随后离心,过滤后将滤液旋转蒸发至膏状,得杨树胶提取物。
(2)将步骤(1)的蜂胶提取物和杨树胶提取物分别用甲醇配制成浓度为1.6mg/mL的蜂胶提取物分析液和1.6mg/mL的杨树胶提取物分析液。
(3)将步骤(2)获得的蜂胶提取物分析液和杨树胶提取物分析液分别进样20uL到高效液相色谱-自由基检测系统联用的在线检测系统中,其中HPLC的检测条件设定:流动相A为含0.1%乙酸的甲醇,B为含0.1%乙酸的水,流速为0.8mL/min,柱温35℃;冲洗梯度为:0~20min,30%~60%A;20~25min,60%~50%A;25~35min,50%A;34~37min,50%~55%A;37~45min,55%A;45~80min,55%~85%A;80~85min,85%A,检测波长为280nm,选用shimp-pack VP-ODS(150mm×4.6mm,5μm)色谱柱;加入ABTS溶液的流速为0.20mL/min,加入该溶液后的检测波长为734nm。
(4)将蜂胶的色谱图与杨树胶的色谱图进行对比,以鉴别蜂胶和杨树胶。如图4所示,色谱图具有咖啡酸(1’)、山奈酚(9’)、短叶松素-3-乙酸酯(10’)、咖啡酸苯乙酯(13’)、高良姜素(14’)、咖啡酸肉桂酯(17’)这几个负峰,为蜂胶的色谱图;如图5所示,色谱图仅具有高良姜素(14’)这个强度较大的负峰,为杨树胶的色谱图,以此来鉴别蜂胶和杨树胶。
- 还没有人留言评论。精彩留言会获得点赞!