一种气‑液界面暴露系统联合高内涵技术定量检测1,3‑丁二烯致细胞DNA损伤的方法与流程
本发明属于体外遗传毒性测定技术领域,更具体而言,本发明涉及1,3-丁二烯的遗传毒性测定方法。
背景技术:
1,3-丁二烯是一种常见的大气和环境污染物,可以通过吸入途径诱导多器官肿瘤。此外,1,3-丁二烯环氧代谢产物可以形成dna加合物,诱导hprt(次黄嘌呤磷酸核糖基转移酶)基因突变等。目前世界卫生组织(who)下属的国际癌症研究组织(iarc)已经将1,3-丁二烯列为1类致癌物,同时世界卫生组织烟草控制框架公约(fctc)将1,3-丁二烯列为烟气优先级管制污染物之一。因此,准确检测1,3-丁二烯气体对细胞dna的损伤,对于1,3-丁二烯遗传毒性和危害性评价具有较为重要的意义。
dna双链断裂是dna最严重的一种损伤形式,如果这种损伤不能被正确或者及时修复就可能会导致染色体畸变或者细胞凋亡等。作为dna双链断裂的一种生物标志物,磷酸化组蛋白γh2ax已经被广泛地应用于临床医药学、放射学及毒理学等研究方面。包括很多单体化合物和混合物通过γh2ax实验对其遗传毒性进行了测定和评价。例如,tanaka等利用γh2ax实验对卷烟烟气冷凝物的遗传毒性进行了检测和评价;smart等采用γh2ax实验对依托泊苷、米托蒽醌及甲基亚硝脲的dna双链断裂的剂量-效应关系进行了研究,并且通过已知的不同类型遗传毒性化合物对该实验进行了评价。该实验因其灵敏性高、结合其他仪器检测技术可以进行大规模分析检测,拥有其他遗传毒性检测技术并不具备的多种优点,目前已经被广泛地应用于化合物和有毒物质的遗传毒性筛选和评价。
目前对γh2ax进行分析检测的主要方法有流式细胞仪、elisa(酶联免疫吸附试验)、westernblot(蛋白质印迹)、显微镜技术等。流式细胞仪和westernblot操作繁琐,检测前需要将贴壁细胞酶解成单细胞悬液,破坏了细胞的结构和功能完整性,且检测通量较低。elisa不能提供细胞内荧光焦点的分布情况且需要额外添加其他检测蛋白对结果进行校正,而显微镜技术的检测通量低,且人为计数的误差较大。
由于技术和条件的限制,传统上对于气态类物质的暴露和毒性检测通常将气态物质溶解于液体中,从而实现细胞和气体的接触暴露,即气-液混合暴露方式。这种暴露方式虽然对于很多物质有用,但并不是经常有效。这是因为有些气体溶解于液体(通常是水)中的溶解度有限,从而限制了暴露浓度的上限;第二,有些气态物质能和水发生反应,从而间接改变了检测目的;第三,气-液混合暴露虽然对于悬浮细胞来说能使溶解于液体基质中的气体与细胞充分接触,但是对于贴壁培养的细胞很难实现充分接触。
气-液界面暴露系统的发展极大地避免了传统的气-液混合暴露方式存在的问题,极大地提高了贴壁细胞体外暴露的有效性。因此,气-液界面系统目前已经被广泛用来研究挥发性物质或者气溶胶类物质的暴露。
技术实现要素:
针对上述问题,本发明的目的是提供一种无需破坏细胞、简单、有效且灵敏度高的1,3-丁二烯dna损伤的定量检测方法,该方法可以采用直接的气体暴露方式进行,检测结果准确并且可视化,以克服现有技术的缺陷。
本发明的目的通过将气-液界面暴露技术和高内涵检测γh2ax技术相结合而实现。具体而言,本发明的目的是通过以下技术方案来实现的:
一种气-液界面暴露系统联合高内涵技术定量检测1,3-丁二烯致细胞dna损伤的方法,所述方法包括以下步骤:
1)细胞培养:将细胞接种在底部为渗透性滤膜的装置中,然后将所述装置在细胞培养液中进行细胞培养,使细胞在渗透性滤膜上单层生长;
2)细胞染毒:移除所述装置中的细胞培养液,取出装置并置于包含细胞染毒液和毒性气体的染毒仓中,使得装置中的渗透性滤膜底部与细胞染毒液接触,同时渗透性滤膜上的细胞表面暴露于毒性气体,其中所述毒性气体包含1,3-丁二烯和空气;
3)免疫荧光标记:从染毒仓中取出所述装置,进行细胞中γh2ax的免疫荧光标记与细胞核的dapi染色;
4)高内涵技术定量检测:分别进行所述细胞的细胞核和γh2ax的荧光测定,以所识别的有效细胞的有效细胞核内检测到的平均荧光强度来表征γh2ax的含量。
优选地,所述步骤1)中,所述细胞为贴壁生长细胞;更优选地,接种时,所述细胞处于对数生长期,以单细胞悬液接种于所述装置中;
更优选地,所述细胞以单细胞悬液接种于底部为渗透性滤膜的装置中,然后在细胞培养液中于37℃,5%co2条件下培养24h;
优选地,关于本发明采用的底部为渗透性滤膜的装置,所述渗透性滤膜为涤纶膜,膜上小孔的孔径为0.4μm。因此,将所述装置在细胞培养液中进行细胞培养时,细胞培养液可以通过渗透性滤膜浸没接种其上的细胞;
优选地,在细胞接种之前,用细胞培养液或pbs将所述装置在37℃下平衡1-2h。
优选地,所述步骤2)中,所述染毒仓中的细胞染毒液包含步骤1)中的细胞培养液,优选与步骤1)中的细胞培养液相同;
优选地,所述毒性气体由空气与1,3-丁二烯组成;
更优选地,所述毒性气体中1,3-丁二烯的浓度为0-43.98mmol/l、优选>0且≤43.98mmol/l,更优选8.80-43.98mmol/l;
根据本发明的具体实施方式,所述毒性气体中1,3-丁二烯的浓度可以是0、8.80、17.59、26.39、35.18或43.98mmol/l。
优选地,所述毒性气体的流量为10-50ml/min,优选20ml/min,优选与毒性气体接触≤2h,优选1h。染毒仓中含有细胞染毒液,但是渗透性滤膜上的细胞部分暴露于细胞染毒液的气液界面上,从而实现该暴露部分与染毒仓中的毒性气体接触。
优选地,所述步骤3)包括:
3-1)从染毒仓中取出所述装置,洗涤,然后置于托盘内,向装置内的细胞中加入多聚甲醛进行细胞固定;
3-2)洗涤所述装置和托盘,然后向装置内的细胞中加入triton-100x以使细胞通透;
3-3)洗涤所述装置和托盘,然后向装置内的细胞中加入血清白蛋白封闭,之后加入一抗即抗γh2ax抗体进行孵育;
3-4)洗涤所述装置和托盘,然后向装置内的细胞中加入免疫荧光标记的二抗进行孵育;
3-5)洗涤所述装置和托盘,然后向装置内的细胞中加入dapi(4',6-二脒基-2-苯基吲哚)进行染色;
3-6)洗涤所述装置和托盘,保存。
优选地,所述步骤4)中,所述细胞的细胞核和γh2ax的荧光测定分别在两组不同的激发波长和发射波长下进行;
优选地,所述步骤3-4)中,免疫荧光标记的二抗为alexafluor488标记的二抗,并且所述步骤4)中,在通道一中以激发波长358nm和发射波长461nm进行细胞核的荧光测定,在通道二中以激发波长495nm和发射波长519nm进行γh2ax的荧光测定,以获得通道一所识别的有效细胞的有效细胞核内通道二所检测的平均荧光强度,由此表征γh2ax的含量;
更优选地,在两个通道中,测量倍数为100倍,每孔分析和测定9个视野。
根据本发明的具体实施方式,步骤4)采用高内涵细胞分析系统进行,例如购自thermoscientific的型号为arrayscanvti600的高内涵细胞分析系统。
任选地,本发明的方法还包括,设置在步骤3-3)中没有加入一抗、仅在步骤3-4)中加入二抗的空白对照组,从而在步骤4)中得到由非特异吸附引起的空白信号,由此从检测到的荧光测定信号中扣除空白信号。
本发明的方法还可包括剂量-效应曲线的绘制。即,通过在步骤2)中设置多种包含不同浓度的1,3-丁二烯的毒性气体,进行所述方法,最后根据γh2ax的平均荧光强度和1,3-丁二烯的浓度绘制剂量-效应曲线。
或者,本发明的方法还可包括时间-效应曲线的绘制。即,通过在步骤2)中使细胞在染毒仓中接触包含相同浓度的1,3-丁二烯的毒性气体达不同时间,进行所述方法,最后根据γh2ax的平均荧光强度和接触毒性气体的时间绘制时间-效应曲线。
优选地,所述毒性气体经过0.2μm滤膜过滤后进入所述染毒仓内。在排出时,所述毒性气体仍可经过0.2μm滤膜过滤后排出到排气管道中。
根据本发明的具体实施方式,在本发明的方法中采用的底部为渗透性滤膜的装置与托盘是可商购的transwell插件,例如购自corning的型号为3450的transwell插件,装置为transwell插件顶部,托盘为transwell插件底部。当细胞为人肺癌细胞株a549时,可以如下进行本发明的方法:
1)细胞培养:采用含10%fbs和2mmol/ll-谷氨酰胺的rpmi-1640培养液于37℃、5%co2条件下在培养箱中培养人肺癌细胞株a549,当细胞汇合率达到70-80%时,采用0.25%的胰蛋白酶进行消化后获得单细胞悬液;
接种前,在transwell插件顶部和底部分别加入0.5和2ml的pbs(磷酸盐缓冲液,ph7.2~7.4;全文同),于37℃的条件下平衡1-2h;吸弃transwell插件顶部和底部的pbs,于插件顶部加入0.5ml浓度为4×105个细胞/ml的单细胞悬液,在插件底部加入2ml含有0.01mol/lhepes、2mmol/ll-谷氨酰胺和10%fbs的rpmi-1640培养液;将插件顶部放入底部中,并于37℃,5%co2条件下培养24h。
2)细胞染毒:移除transwell插件顶部的培养液,取出transwell插件顶部放入体外暴露装置的染毒仓内,使得transwell插件中的渗透性滤膜与细胞染毒液接触,渗透性滤膜上的细胞表面暴露于染毒仓中的毒性气体1h;所述毒性气体通过采用空气将1,3-丁二烯分别稀释成0、8.80、17.59、26.39、35.18和43.98mmol/l的浓度,流量为20ml/min。
3)免疫荧光标记:
3-1)染毒结束后,从染毒仓取出transwell插件顶部,然后在transwell插件顶部和底部分别加入1mlpbs洗涤两次,每次至少5min;然后将transwell插件顶部放入底部中,向顶部中加入0.5ml4%的多聚甲醛溶液在室温下固定15min;
3-2)在transwell插件顶部和底部分别加入1mlpbs洗涤两次,每次至少5min,然后向transwell插件顶部加入0.5ml0.5%的triton-100x溶液(在pbs中),在室温下通透15min;
3-3)在transwell插件顶部和底部分别加入1mlpbs洗涤两次,每次至少5min,然后向transwell插件顶部加入0.5ml的3%bsa溶液(在pbs中),于37℃下封闭1h,然后向transwell插件顶部加入0.5ml含有小鼠抗人γh2ax抗体溶液(1:200,v/v)于37℃下恒温孵育2h;
3-4)在transwell插件顶部和底部分别加入1mlpbs洗涤三次,每次至少5min,然后向transwell插件顶部加入0.5mlalexafluor488标记的山羊抗小鼠抗体溶液(1:200,v/v)于37℃下避光孵育2h;
3-5)在transwell插件顶部和底部分别加入1mlpbs洗涤三次,每次至少5min,然后向transwell插件顶部加入500μl1μg/ml的dapi溶液(在pbs中)在室温下避光染核10min;
3-6)在transwell插件顶部和底部分别加入2mlpbs洗涤三次后,再分别加入0.5和2mlpbs,4℃避光保存,待测。
4)高内涵技术定量检测:通道一(细胞核荧光测定)设置激发波长和发射波长分别为358nm和461nm,通道二(目标物γh2ax的荧光测定)设置激发波长和发射波长分别为495nm和519nm,测量倍数为100,每孔分析和测定9个视野,以通道一所识别的有效细胞的有效细胞核内通道二所检测的平均荧光强度表征γh2ax的含量。
5)数据处理:设置在步骤3-3)中没有加入一抗、仅在步骤3-4)中加入二抗的空白对照组,在步骤4)中所检测信号即为由非特异吸附引起的空白信号,从所有样品测试孔的检测信号中扣除空白信号;最后根据目标物γh2ax的荧光强度和1,3-丁二烯的浓度绘制剂量-效应曲线。
参见图1,本发明提供了一种基于气-液界面暴露系统和高内涵技术来定量检测1,3-丁二烯致细胞dna损伤的方法,克服了现有1,3-丁二烯气体体外染毒和dna损伤检测方法的不足。具体而言,本发明提供了一种评估染毒毒物为1,3-丁二烯气体时所导致的dna双链断裂情况的方法,其中磷酸化组蛋白γh2ax作为1,3-丁二烯诱导的dna双链断裂的生物标志物,并且采用体外气-液界面暴露方式实现了气态1,3-丁二烯使细胞体外染毒的高效和准确控制,采用高内涵技术对γh2ax进行检测,提高了检测效率和灵敏度。在本发明的方法中,生长于渗透性滤膜上的贴壁细胞在气-液界面暴露系统中暴露1,3-丁二烯后,通过细胞免疫荧光染色γh2ax和高内涵自动成像与分析实现了细胞样本的直接、高通量检测。
本发明的方法具有以下技术特点:
首先,本发明的方法确定了指数期细胞在渗透性滤膜上单层生长,从而在与毒性气体的染毒过程中,确保了气体与细胞能充分接触,特别是相对于传统的气液混合染毒方式而言,显著提高了贴壁细胞的染毒效率;
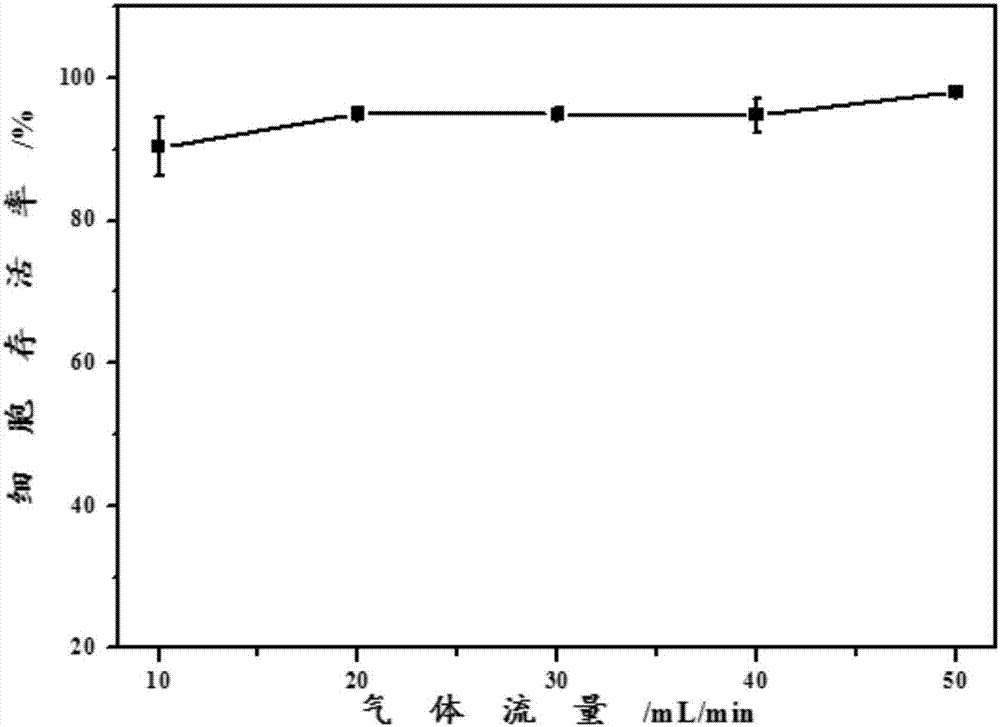
第二,为减少气体冲击对细胞活性的影响,本发明对不同气体流量对细胞活性的影响进行了优化。研究发现,不同气体流量10-50ml/min形成的冲击对细胞的存活率均无明显的影响(p>0.05),如图2所示,确保了在这一流量范围内细胞能有效存活,进而保证染毒效果。结合暴露仓体积及染毒气体对环境的影响,本发明优选采用20ml/min的气体流量作为最终的染毒流量。并且,本发明还对1,3-丁二烯的使用浓度与染毒时间等条件进行了优化。
与现有技术相比,本发明的方法还具有如下优良效果:
1)用气-液界面暴露方式替代了传统的气-液混合暴露方式,由此提高了贴壁细胞与1,3-丁二烯的接触效率,进而提升了染毒的有效性和准确性;
2)检测前无需破坏细胞,也无需酶解制备单细胞悬液或提取蛋白,所以样本处理更为简单和快捷;
3)高内涵技术具有高分辨率的成像获取功能,因此γh2ax在细胞核内的分布可直接观测,且图像资料也便于存储以备再分析;
4)通过细胞核识别,可对每个细胞核内荧光标记的γh2ax进行定量分析,所以检测结果更为灵敏和准确。
附图说明
以下,结合附图来详细说明本发明的实施方案,其中:
图1示出了本发明方法的流程图。
图2示出了不同气体流量对细胞存活率的影响。
图3示出了1,3-丁二烯诱导a549细胞产生γh2ax的剂量-效应曲线,其中染毒仓中的细胞染毒液没有添加代谢活化系统大鼠肝s9。
图4示出了1,3-丁二烯诱导a549细胞产生γh2ax的剂量-效应曲线,其中染毒仓中的细胞染毒液添加代谢活化系统大鼠肝s9。
图5示出了1,3-丁二烯诱导a549细胞产生γh2ax的时间-效应曲线。
具体实施方式
以下参照具体的实施例来说明本发明。本领域技术人员能够理解,这些实施例仅用于说明本发明,其不以任何方式限制本发明的范围。
下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的药品原料、试剂材料等,如无特殊说明,均为市售购买产品。
一抗:小鼠抗人γh2ax抗体,购自biolegend,货号613402;
使用时配制成溶液:取100μl小鼠抗人γh2ax抗体加入1%的bsa溶液中,1:200(v/v)稀释,充分混匀。
二抗:alexafluro488标记的山羊抗小鼠抗体,购自武汉珈源量子点公司,货号ym002;
使用时配制成溶液:取100μlalexafluro488标记的山羊抗小鼠抗体加入pbs溶液中,1:200(v/v)稀释,充分混匀。
大鼠肝s9溶液:购自moltox,货号11-101.1。
使用时配制成10%s9混合物:由4体积溶液a、60体积溶液b、16体积溶液c、10体积溶液d与10体积大鼠肝s9溶液混合而成,其中溶液a含有0.2mol/l的mgcl2和0.825mol/l的kcl;溶液b含有0.176mol/l的na2h2po4和0.024mol/l的nah2po4;溶液c含有0.025mol/l的nadp。溶液d含有0.05mol/l的葡萄糖-6-磷酸盐;溶液a-d均采用去离子水配制。
transwell插件:购自corning,型号3450。
高内涵细胞分析系统,购自thermoscientific,型号arrayscanvti600。
细胞暴露系统,购自北京慧荣和,型号hrh-ces3969。
实施例1
在细胞染毒液中没有添加代谢活化系统大鼠肝s9时,测定1,3-丁二烯暴露1h后诱导的γh2ax。
在transwell插件顶部和底部分别加入0.5和2ml的pbs,于37℃的条件下平衡1-2h。吸弃transwell插件顶部和底部的pbs,于插件顶部加入0.5ml浓度为4×105个细胞/ml对数生长期的a549细胞的单细胞悬液,在插件底部加入2ml含有0.01mol/lhepes、2mmol/ll-谷氨酰胺和10%fbs的rpmi-1640培养液,并于37℃,5%co2条件下培养24h。
移除transwell插件顶部的培养液,取出transwell插件顶部放入细胞暴露系统的染毒仓内,使得transwell插件中的渗透性滤膜与细胞染毒液(同样为含有0.01mol/lhepes、2mmol/ll-谷氨酰胺和10%fbs的rpmi-1640培养液)接触,渗透性滤膜上的细胞表面暴露于染毒仓中的毒性气体,其中毒性气体由1,3-丁二烯与空气组成,1,3-丁二烯的浓度分别为0、8.80、17.59、26.39、35.18和43.98mmol/l,于37℃的条件下染毒1h,气体流量为20ml/min。
染毒结束后,从染毒仓取出transwell插件顶部,在transwell插件顶部和底部分别加入1mlpbs洗涤两次,每次至少5min;然后将transwell插件顶部放入底部中,顶部加入0.5ml4%的多聚甲醛溶液在室温下固定15min;在transwell插件顶部和底部分别加入1mlpbs洗涤两次,每次至少5min,然后向transwell插件顶部加入0.5ml0.5%的triton-100x溶液(在pbs中),在室温下通透15min;在transwell插件顶部和底部分别加入1mlpbs洗涤两次,每次至少5min,然后向transwell插件顶部加入0.5ml的3%bsa溶液(在pbs中),于37℃下封闭1h,然后向transwell插件顶部加入0.5ml含有小鼠抗人γh2ax抗体溶液(1:200,v/v)于37℃下恒温孵育2h;在transwell插件顶部和底部分别加入1mlpbs洗涤三次,每次至少5min,然后向transwell插件顶部加入0.5mlalexafluor488标记的山羊抗小鼠抗体溶液(1:200,v/v)于37℃下避光孵育2h;在transwell插件顶部和底部分别加入1mlpbs洗涤三次,每次至少5min,然后向transwell插件顶部加入0.5ml1μg/ml的dapi溶液(在pbs中)在室温下避光染核10min;在transwell插件顶部和底部分别加入2mlpbs洗涤三次后,于顶部和底部分别加入0.5和2mlpbs,4℃避光保存,待测。
设置高内涵细胞分析系统的通道一(细胞核荧光测定)的激发波长和发射波长分别为358nm和461nm,设置通道二(目标物γh2ax的荧光测定)的激发波长和发射波长分别为495nm和519nm,测量倍数为100倍,每孔分析和测定9个视野,γh2ax的含量以通道一所识别的有效细胞的有效细胞核内通道二所检测的平均荧光强度进行表征。
试验中设置空白对照组,即没有加入一抗,仅加入荧光标记的二抗抗体,所检测信号即为由非特异吸附引起的空白信号;所有样品测试孔的检测信号应扣除空白信号;最后根据目标物γh2ax的荧光强度和1,3-丁二烯的浓度绘制剂量-效应曲线。
图3所示为不同浓度的1,3-丁二烯在染毒1h后诱导a549细胞产生的γh2ax的剂量-效应关系曲线。由图可知,随着1,3-丁二烯的浓度增大,a549细胞产生的γh2ax逐渐增多,呈现出显著的剂量-效应关系。当1,3丁二烯的浓度为80%(35.18mmol/l)时,其诱导的γh2ax超过正常组(即1,3-丁二烯浓度为0时)的1.5倍。
实施例2
在细胞染毒液中添加代谢活化系统大鼠肝s9时,测定1,3-丁二烯暴露1h后诱导的γh2ax。
实验过程按照实施例1所述进行,唯一的区别是,在染毒仓中的细胞染毒液为细胞培养液与10%s9混合物的混合液,使得细胞染毒液中含有1%s9混合物。
图4所示为染毒培养液中添加1%s9后,不同浓度的1,3-丁二烯在诱导a549细胞产生的γh2ax的剂量-效应关系曲线,与图3所示结果基本相同。
细胞染毒液中添加s9可以增强1,3-丁二烯在体外的代谢转化。由于1,3-丁二烯是一种前遗传毒性物质,因此添加体外代谢活化系统s9可以避免体外测试中由于细胞代谢能力的不足而导致的测试结果为假阴性的可能。因此,通过添加和不添加s9可以更准确地了解1,3-丁二烯在体外对细胞dna损伤的诱导,并由此证明了本发明的方法是客观、可用的。
实施例3
在细胞染毒液中没有添加代谢活化系统大鼠肝s9时,测定35.18mmol/l1,3-丁二烯分别暴露15、30、45、60和90min后诱导的γh2ax。
实验过程按照实施例1所述进行,唯一的区别是,1,3-丁二烯的染毒浓度固定在浓度35.18mmol/l,染毒时间分别为0、15、30、45、60和90min。
图5所示为35.18mmol/l的1,3-丁二烯在染毒0、15、30、45、60和90min后诱导a549细胞产生的γh2ax的时间-效应关系曲线。由图可知,随着染毒时间增加,a549细胞产生的γh2ax逐渐增多,呈现出显著的时间-效应关系。当染毒时间超过60min时,其诱导的γh2ax超过正常组的1.5倍。
以上对本发明具体实施方式的描述并不限制本发明,本领域技术人员可以根据本发明作出各种改变或变形,只要不脱离本发明的精神,均应属于本发明所附权利要求的范围。
- 还没有人留言评论。精彩留言会获得点赞!