直接免疫荧光检测肠道病毒71型和柯萨奇病毒A16型的试剂盒及其应用的制作方法
本发明是专利“一种直接检测肠道病毒71型和柯萨奇病毒a16型的试剂盒及其应用”的分案,原申请的申请日是:2016.01.21;申请号为:201610041545.6
本发明属于病原体检测技术领域,具体涉及直接检测肠道病毒71型和柯萨奇病毒a16型的试剂盒及其应用。
技术背景
手足口病(hand,footandmouthdisease,hfmd)是由肠道病毒引起的传染病,引发手足口病的肠道病毒有20多种(型),其中以柯萨奇病毒a16型(ca16)和肠道病毒71型(ev71)最为常见。多发生于5岁以下儿童,表现口痛、厌食、低热、手、足、口腔等部位出现小疱疹或小溃疡,多数患儿一周左右自愈,少数患儿可引起心肌炎、肺水肿、无菌性脑膜脑炎等并发症。个别重症患儿病情发展快,导致死亡。
儿童感染ev71病毒致重症手足口病后各组织器官病毒抗原分布情况表现为,在中枢神经系统显示神经细胞和胶质细胞阳性,以脑干为甚,其次为大脑和小脑,提示神经细胞和小胶质细胞是其攻击的主要靶细胞。呼吸系统中喉、气管、支气管和细支气管粘膜上皮细胞阳性,部分病例肺泡细胞和巨噬细胞阳性,提示呼吸道上皮细胞也是ev71攻击的靶细胞。肠道粘膜上皮细胞ev71抗原检测亦呈阳性。ev71感染的靶器官和靶细胞仍未完全清楚。一般认为,ev71经上消化道或呼吸道进人体内,引起病毒血症,并随血流到达全身各个器官,在相应的靶器官或组织中复制,引起一系列病变。
据文献报道,已经被鉴定的ca16和ev71病毒特异受体有p-选择素糖蛋白受体-1(psgll)和清道夫受体b2(scarb2),psgll在人体中枢神经尤其是脑干组织中呈高密度分布,在呼吸道中主要分布于喉部、气管、支气管、细支气管和肺泡上皮细胞,在消化系统中,肠道组织的粘膜上皮细胞和腺体细胞也有分布。scarb2受体也主要分布于中枢神经、呼吸道以及肠道组织中。另一个被鉴定的ca16病毒受体是柯萨奇-腺病毒受体(car)。柯萨奇病毒-腺病毒受体是柯萨奇病毒与腺病毒的共同受体,只有car的胞外区对病毒的感染起决定作用,去除car的跨膜区和胞内区即不能阻止病毒的感染,同时,病毒衣壳蛋白与car的胞外区相互作用可诱导病毒rna的释放,使其通过内吞或其他作用机制进入细胞。有文献检测了car受体mrna在人类组织中的表达,发现在胰腺、脑、心脏、小肠、睾丸和前列腺组织中均有表达。对于重症手足口病患者往往表现多器官组织被感染,可见ca16和ev71病毒在人体内可感染多组织器官。
目前已经发展并使用的诊断方法包括:
(1)rt-pcr法检测病毒:灵敏度高,能及时检查带毒者。但仪器设备昂贵、实验场地要求高,操作人员要求高,容易污染,易产生假阳性而导致误诊。
(2)通过临床症状综合评价诊断:这种方法在疾病的早期,因症状不典型,而无法准确诊断。在疾病的晚期,虽然可以准确诊断,但延误了对疾病的治疗。
(3)血清免疫检查病毒抗体(间接荧光免疫法或间接elisa)。igg抗体产生需要在发病后至少14天,且一般要二次感染才可能有足够的量被检测到,因此,这种方法不能做早期诊断。igm抗体在病毒感染5-7天产生,且受血清igm浓度的限制,导致灵敏度不高,容易出现假阴性的情况。病毒感染到igm抗体产生的窗口期用血清免疫检查病毒抗体不适用,因此检测血清igm的方法也有很大的限制。
以上三种方法在临床使用过程中,具有操作不简便、花费时间长、诊断不准确等缺点。
技术实现要素:
为克服现有技术的缺点与不足,本发明的目的在于提供了一种直接检测检测肠道病菌71型和柯萨奇病毒a16型的试剂盒及其应用。
为实现上述目的,本发明提供的试剂盒中包含了荧光素标记的抗体、细胞固定液、pbs溶液、pbst溶液、1%triton-x100、细胞对照品、防腐剂叠氮化钠和抗体稳定剂bsa。
优选的,所述荧光素标记的抗体包括与荧光素共价连接的肠道病毒71型和与荧光素共价连接的柯萨奇病毒a16型的抗体。所述抗体为能与荧光素共价连接的单克隆抗体或多克隆抗体。
优选的,所述荧光素为亚历克萨荧光染料(alexafluor)、藻红蛋白(pe)及其衍生物、花青苷(cy)及其衍生物、藻红蛋白-花青苷(pe-cy)和荧光素-5-异硫氰酸酯(fitc)中的任一种。
优选的,所述细胞对照品包括阳性细胞对照品和阴性细胞对照品。阳性细胞对照品为冻干的含肠道病毒71型的rd细胞和冻干的含柯萨奇病毒a16型的rd细胞,阴性对照品为冻干的正常rd细胞。
优选的,所述细胞固定液为质量体积比为4%的多聚甲醛。
优选的,所述试剂盒按以下步骤使用:
(1)将待测细胞样本用所述pbst溶液离心弃上清,再用所述细胞固定液固定,最后加入pbst溶液重悬,制备得到单细胞悬浮液;
(2)将所述荧光素标记的抗体与1%triton-x100、防腐剂叠氮化钠和抗体稳定剂bsa混合均匀后,得到染色液;
(3)将所述步骤(2)中的染色液分别加入所述步骤(1)中的所述单细胞悬浮液和所述试剂盒中的细胞对照品中,室温避光孵育30min;
(4)用所述pbst溶液洗脱除去未结合细胞的染色液,并用pbst重悬细胞后,用流式细胞仪检测所述细胞样本内与所述荧光素标记的抗体结合的病毒抗原;
(5)结果分析:如果第q2-1、q2-2、q2-4象限百分比大于临界值,则判定样本为对应病毒或双病毒感染阳性;如果在q2-2小于或等于临界值时,第q2-1、q2-4小于或等于临界值,则判定样本为对应病毒感染阴性。
本发明的试剂盒还包含荧光染料伊文斯兰、封片剂、载玻片和质控玻片,其中,所述载玻片上有孔;所述质控玻片上有阳性孔和阴性孔,阳性孔为1:1混合的肠道病毒71型的rd细胞和柯萨奇病毒a16型的rd细胞,阴性孔为正常rd细胞;所述封片剂为一种含1,4-二偶氮双环[2,2,2]-辛烷、甘油和聚乙烯醇的缓冲液。
优选的,所述检测试剂盒按以下步骤使用:
(1)将待测细胞样本用所述pbs溶液离心弃上清,再用所述细胞固定液固定,最后加入pbst溶液重悬,制备得到单细胞悬浮液;
(2)将所述荧光素标记的抗体与所述1%triton-x100、防腐剂叠氮化钠和抗体稳定剂bsa混合均匀后,添加伊文斯兰,得到荧光鉴定试剂;
(3)将所述步骤(1)中的单细胞悬浮液滴加到载玻片的孔中,挥发干燥后,滴加所述步骤(2)中得到的荧光鉴定试剂,37℃避光孵育20min;
(4)在所述质控玻片的阳性孔和阴性孔上各滴加步骤(2)中的荧光鉴定试剂,37℃避光孵育20min;
(5)用所述pbst溶液和蒸馏水洗片,用吸水纸吸掉多余水分后滴加封片剂,盖上盖玻片,用荧光显微镜观察所述待测细胞样本内与所述荧光素标记的抗体结合的病毒抗原,拍照记录实验结果;
(6)结果分析:如果所述载玻片孔内发现2个以上绿色荧光细胞且孔内细胞总数大于100个,则判定所述待测细胞样本ev71阳性,否则为ev71阴性;如果所述载玻片孔内发现2个以上橘黄色荧光细胞且孔内细胞总数大于100个,则判定所述待测细胞样本ca16阳性,否则为ca16阴性。
利用本发明提供的试剂盒,可以直接检测样本细胞内肠道病毒71型和柯萨奇病毒a16型。
本发明的试剂盒充分利用了流式细胞术和直接免疫荧光术在自动化和高通量的优势,能够实现对病毒快速、灵敏、高效的检测,对于临床的快速准确诊断具有重要意义,能满足大型医院和基层医院的不同需求。
附图说明
图1是用本发明的试剂盒结合流式细胞仪检测样本2ev71、ca16感染的结果图,图1-a为细胞门(p1),图1-b是所述细胞门对应的细胞荧光信号双参数二维点图;
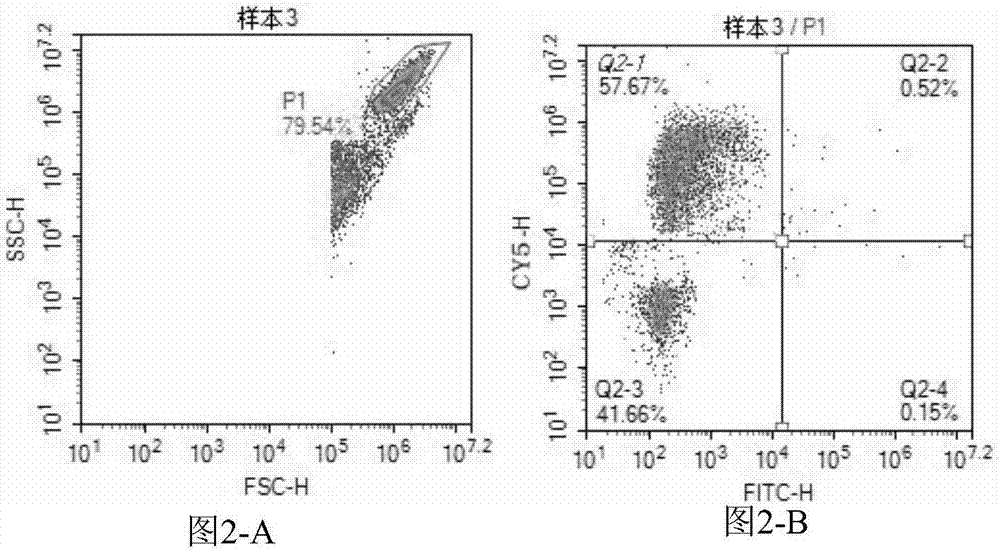
图2是用本发明的试剂盒结合流式细胞仪检测样本3ev71、ca16感染的结果图,图2-a为细胞门(p1),图2-b是所述细胞门对应的细胞荧光信号双参数二维点图;
图3是用本发明的试剂盒结合流式细胞仪检测样本4ev71、ca16感染的结果图,图3-a为细胞门(p1),图3-b是所述细胞门对应的细胞荧光信号双参数二维点图;
图4是用本发明的试剂盒结合流式细胞仪检测样本5ev71、ca16感染的结果图,图4-a为细胞门(p1),图4-b是所述细胞门对应的细胞荧光信号双参数二维点图;
图5是用本发明的试剂盒结合荧光显微镜检测样本2加入荧光鉴定试剂的荧光照片;
图6是用本发明的试剂盒结合荧光显微镜检测样本3加入荧光鉴定试剂的合成荧光照片;
图7是用本发明的试剂盒结合荧光显微镜检测样本4加入荧光鉴定试剂的合成荧光照片;
图8是用本发明的试剂盒结合荧光显微镜检测样本5加入荧光鉴定试剂的荧光照片。
具体实施方式
为使本发明更加容易理解,下面结合具体实施例,进一步阐述本发明。应理解,实施例仅用于说明本发明所描述的试剂盒及其使用方法和应用而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规实验方法或按照制造厂商所建议的方法进行。
实施例1:试剂盒的制备
1细胞收集与处理
1.1细胞收集:本发明所述试剂盒用于检测样品细胞内的ev71和ca16病毒抗原,ev71和ca16病毒感染涉及范围广,因此,理论上任何可以被制备成单细胞悬液的细胞样品均适用于本发明试剂盒。从病人感染ev71和ca16病毒的路径以及收集样本的经验来看,鼻咽拭子采集容易、无创伤而且迅速,病人漱口后采集基本无杂质,不需要反复洗涤,所以,细胞样本采集首推鼻咽拭子,实施例均以鼻咽拭子为例。
1.2单细胞悬浮液的制备:检测样品放入含有3mlpbs或病毒运输培养基的采样管中,500g离心8min,弃去上清,注意不要吸走细胞层;然后加入3ml细胞固定液质量体积比为4%的多聚甲醛并重悬细胞,旋紧管盖,放4℃固定至少15min,500g离心8min,弃去上清,加入100μlpbst,用移液枪轻轻吹打细胞层以重悬细胞,得到单细胞悬浮液,4℃保存。
血液样本可通过商品化的人外周血淋巴细胞分离液,按说明书操作,最终用pbs重悬后形成单细胞悬浮液;皮肤溃疡和疱疹、痰液、腹水等体液样本可通过多次振荡、离心、加pbs洗涤去除杂质后重悬后形成单细胞悬液。
2染色液(荧光鉴定试剂)的制备
2.1抗体的制备:本发明试剂盒中的单克隆抗体的制备方法为常规方法,即采用杂交瘤技术经过细胞融合,通过筛选得到能持续、稳定分泌抗ev71和ca16的单克隆抗体的杂交瘤细胞株,并由该细胞株分泌得到抗体。而常规制备多克隆抗体的方法是通过用纯化病毒、重组蛋白、载体蛋白偶联的多肽免疫动物,并进行纯化获得。因此,结合荧光素标记抗体的过程,可以认为但凡能与荧光素共价连接的单克隆抗体和多克隆抗体均可应用于本发明试剂盒中。
特别指出的是,本发明以下实施例中的特异性识别ev71的单克隆抗体专一性结合ev71,不与ca16、肠道病毒其他型别及其他病原体结合;特异性识别ca16的单克隆抗体,只专一与ca16的结合而不与ev71、柯萨奇病毒其他型别及其他病原体结合。
2.2荧光素标记抗体:标记方法会与抗体偶联的荧光素的不一样而有所变化,具体标记过程可按照荧光素使用说明书操作。理论上,所有能标记抗体的荧光素都适用于本方法试剂盒。在本发明实施例2中,分别采用alexafluor488、pe-cy5共价连接ev71小鼠igg和ca16小鼠igg,alexafluor488购自赛默飞世尔科技,pe-cy5购自赛默飞世尔科技;在本发明实施例3中,分别采用fitc、r-pe共价连接ev71小鼠igg和ca16小鼠igg,fitc购自北京泛博生物化学有限公司,r-pe购自赛默飞世尔科技。
2.3将采用荧光素标记的ev71小鼠igg、ca16小鼠igg,分别加入1%的triton-x100,抗体稳定剂bsa和防腐剂叠氮化钠,在pbs溶液中混合均匀后,获得染色液,于4℃避光保存。染色液基础上添加所述荧光材料伊文思蓝,获得荧光鉴定试剂。
3参考品材料准备
为了实现发明试剂盒的有效性及特异性,所涉及的材料准备还包括:
3.1阳性对照品和阴性对照品:阳性对照品有两种,分别为冻干的含ev71的rd细胞和冻干的含ca16的rd细胞;阴性对照品为冻干的正常rd细胞。
3.2质控玻片的制备:质控玻片上有1个阳性对照孔和1个阴性对照孔。阳性对照孔内含混合ev71和ca16的rd细胞,阴性对照孔内含正常rd细胞,细胞培养后经洗涤固定等步骤,对应加入到载玻片上,干燥后密封。
实施例2:肠道病毒71型和柯萨奇病毒a16型检测试剂盒(流式细胞法)
本实施例提供一种利用流式细胞仪直接检测肠道病毒71型和柯萨奇病毒a16型的试剂盒。该试剂盒可用于辅助临床诊断手足口病。
1.试剂盒的成分:
注:为了使用上的方便,试剂盒中的抗体、防腐剂、抗体稳定剂和1%的triton-x100均按实施例1中的操作方法制备成染色液,装在一个棕色瓶中;百分比均为质量体积比(g/100ml);
2.试剂盒中试剂的制备
2.1pbs和pbs-t成分
用dh2o定容至1l即为pbs溶液,pbst溶液为在此基础上加0.05%tween-20;
2.2细胞固定液:4%多聚甲醛:4g多聚甲醛溶解于100mlpbs溶液中。
3.试剂盒中未提供但实验过程中必须的器材:
3.1流式细胞仪:本实例所用的流式细胞仪为aceanovocytetm2060r;
3.2不低于700g的离心机(含水平转子);
3.3普通96孔细胞培养板;
3.4植绒拭子和移液枪及枪头、采集管、废液容器、振荡器。
4.检测步骤
4.1样品采集,除杂及细胞固定(操作见实施例1);
4.2单细胞悬浮液的制备(操作见实施例1);
4.3样本染色:将单细胞悬浮液转入96孔板内,一个样本对应一个孔,再用水平离心机500g离心8min,用移液器小心吸去上清。再加入25μl染色液,于室温避光孵育30min。之后500g离心8min,用移液器小心吸去上清。
4.4洗脱:每孔再加入100μlpbst,用移液器将细胞轻轻吹打以重悬细胞。再500g离心8min,用移液器小心吸去上清。再加入100μlpbst,用移液器将细胞轻轻吹打以重悬细胞。
4.5上流式细胞仪进行分析。用流式细胞仪(艾森生物,novocyte2060r)检测。
4.6结果分析方法:根据前向散射光信号和侧向散射光信号,划出细胞门。先设置荧光补偿,再根据所述细胞门,做出双参数二维点图(x轴为fitc-h,y轴cy5-h,alexafluor488和pe-cy5都是488nm激光器激发,alexafluor488所用通道与fitc(510nm左右)相同,pe-cy5所用通道与cy5(650nm左右)相同,可参照流式细胞仪说明书操作)。然后设定在双参数二维点图上设定象限门(q2),其中q2-1百分比为ca16阳性百分比,q2-2百分比为双病毒阳性百分比,q2-3百分比为阴性百分比,q2-4百分比为ev71阳性百分比。所述阳性百分比作为诊断依据,第q2-1、q2-2、q2-4象限百分比大于临界值的判为对应病毒或双病毒感染阳;在q2-2小于临界值等于临界值的前提下,第q2-1、q2-4小于或等于临界值的判为对应病毒感染阴性。所述象限阳性门临界值根据大量手足口病样本染色结果划定。
5.本实施例结果和结论
本实施例中,检测样本采自4位临床手足口病患者的咽拭子样本。图1是用本发明的试剂盒结合流式细胞仪检测样本2ev71、ca16感染的结果图,图1-b是所述细胞门对应的细胞荧光信号双参数二维点图,如图1-a所示,根据前向散射光信号(fsc-h)和侧向散射光信号(ssc-h),划出细胞门(p1)。如图1-b所示,根据所述细胞门,作出做出细胞荧光信号双参数二维点图(x轴为fitc-h,y轴cy5-h)。在双参数二维点图上设定象限门(q2),其中q2-1百分比为ca16阳性百分比,q2-2百分比为双病毒阳性百分比,q2-3百分比为阴性百分比,q2-4百分比为ev71阳性百分比。所述阳性百分比作为诊断依据,本实施例q2-1、q2-2和q2-4临界值分别设为0.20%、0.80%和0.20%,大于临界值的样本判为对应病毒感染阳性或双病毒感染阳性,如果q2-1和q2-2小于或等于临界值的样本判为ca16感染阴性;如果q2-4和q2-2小于或等于临界值的样本判为ev71感染阴性。图中显示q2-1、q2-2和q2-4均小于或等于临界值,说明被检测样本2为ca16和ev71双阴性。
图2是用本发明的试剂盒结合流式细胞仪检测样本3ev71、ca16感染的结果图,图2-a为细胞门(p1),图2-b是所述细胞门对应的细胞荧光信号双参数二维点图,图中显示q2-2和q2-4均小于或等于临界值,说明被检测样本3为ca16阳性和ev71阴性。图3是用本发明的试剂盒结合流式细胞仪检测样本4ev71、ca16感染的结果图,图3-a为细胞门(p1),图3-b是所述细胞门对应的细胞荧光信号双参数二维点图,图中显示q2-1和q2-2均小于或等于临界值,说明被检测样本4为ca16阴性和ev71阳性。图4是用本发明的试剂盒结合流式细胞仪检测样本5ev71、ca16感染的结果图,图4-a为细胞门(p1),图4-b是所述细胞门对应的细胞荧光信号双参数二维点图,图中显示q2-1、q2-2和q2-4均大于临界值,说明被检测样本5为ca16和ev71双阳性。
综上,所述检测的4个咽拭子样本中,如图1所示,样本2为ca16和ev71阴性,如图2所示,样本3为ca16阳性ev71阴性,如图3所示,4为ev71阳性ca16阴性,如图4所示,样本5为ev71和ca16双阳性。
实施例3:肠道病毒71型和柯萨奇病毒a16型检测试剂盒(直接免疫荧光法)
本实施例提供一种利用荧光显微镜直接检测肠道病毒71型和柯萨奇病毒a16型的试剂盒。该试剂盒可用于辅助临床诊断手足口病。
1试剂盒的成分为:
质控玻片
注:为了使用上的方便,试剂盒中的抗体、防腐剂、抗体稳定剂、evansblue和1%的triton-x100均按实施例1中的操作方法制备成荧光鉴定试剂,装在一个棕色瓶中;百分比均为质量体积比(g/100ml);
2试剂盒中试剂的制备
2.1pbs
用dh2o定容至1l即的pbs溶液。
2.2细胞固定液:4g多聚甲醛溶解于100mlpbs溶液中制备。
2试剂盒中未提供但实验过程中必须的器材:
2.1配备有适合于检测荧光b波段激发组滤镜(发射光滤片最好能过滤620nm以上波长)和g波段激发组滤镜的正置荧光显微镜,能实现100倍至200倍的放大能力。
2.2蒸馏水:用来稀释pbs干粉。
2.3离心机,能产生700g速度;
2.4盖玻片、载玻片染色架或染色缸、移液枪和枪头、离心管、镊子、废液容器、37℃温育箱、振荡器、吹风机和吸水纸。
3检测步骤
3.1样本的采集和细胞固定(操作见实施例1);
3.2单细胞悬液的制备(操作见实施例1);
3.3样本染色:将上述单细胞悬液5μl滴加到载玻片的1个孔上。将载玻片放入37℃恒温箱自然挥发干燥。然后对应的在每份样本的1个孔内分别滴加1滴荧光鉴定试剂,于37℃恒温箱避光孵育20min。
同时,向质控玻片的阳性孔和阴性孔对应滴加1滴荧光鉴定试剂,于37℃恒温箱避光孵育20min,作为对照。
3.4洗片:先将质控玻片与样本载玻片用pbs洗涤一遍,再用蒸馏水洗涤一遍,洗涤方法为在液体中上下提拉4次。
3.5用吸水纸吸掉多余水分后滴加封片剂,盖上盖玻片,用荧光显微镜观察并拍照记录结果。先调试好显微镜,用200倍观察,ev71阳性细胞在b波段激发组滤镜下为明亮的绿色荧光,ca16阳性细胞在b波段激发组滤镜下为明亮的橘黄色荧光,因为荧光鉴定试剂中含有evansblue,所以所有细胞都会在g波段激发组滤镜下呈现红色荧光,拍照后将红色荧光照片与绿色荧光照片或橘黄色荧光照片合并便可明显地判断呈黄绿色的ev71阳性细胞和黄色的ca16阳性细胞。
4结果分析方法:在保证质控玻片结果符合说明书的前提下,如果孔内发现2个以上绿色荧光细胞且孔内细胞总数大于100个(注意孔内细胞总数小于100个则判定此次样本不合格,需重新取样)时判定样本ev71阳性,否则为样本ev71阴性。同理,如果孔内发现2个以上橘黄色细胞且孔内细胞总数大于100个时判定样本ca16阳性,否则为样本ca16阴性。注意操作人员需经过专业培训,知道排除非细胞产生的荧光信号,避免结果的误判。
5本实施例结果和结论
本实施例中的检测样本同实施例2,采自4位临床手足口病患者的咽拭子样本。
5.1图5是样本2加入ev71和ca16荧光鉴定试剂红色荧光照片,该样本无绿色荧光和橘黄色荧光,图中只有正常细胞的红色荧光(黑白图片中表示为灰色),由此可判断样本2为ca16和ev71阴性。
5.2图6是样本3加入ev71和ca16荧光鉴定试剂后,阳性的橘黄色荧光照片与红色正常细胞照片合成的照片(相机2倍对焦),图中显示出ca16阳性的橘黄色荧光(黑白图片中表示为亮白色)和正常细胞的红色荧光(黑白图片中表示为灰色),此样本无绿色荧光。由此可判断样本3为ca16阳性ev71阴性。
5.3图7是样本4加入ev71和ca16荧光鉴定试剂后,阳性的绿色荧光照片与红色正常细胞照片合成的照片,图中显示出ev71阳性的绿色荧光(黑白图片中表示为亮白色)和正常细胞的红色荧光(黑白图片中表示为灰色),此样本无橘黄色荧光,由此可判断样本4为ev71阳性ca16阴性。
5.4图8是样本5加入ev71和ca16荧光鉴定试剂的荧光照片,ev71阳性细胞的黄绿色荧光(黑白图片中表示为白色)和ca16阳性的橘黄色荧光(黑白图片中表示为灰色),由此可判断样本5为ca16ev71双阳性。
由实施例2和实施例3,可见本实施例中直接免疫荧光法试剂盒检验结果与上述流式细胞法试剂盒检验结果一致。
实施例4:手足口病ev71和ca16的流式细胞法、直接免疫检测法、pcr-荧光探针法和细胞培养分离病毒法比较实验
本实施例的手足口病ev71和ca16的流式细胞检测法、直接免疫检测法分别利用本发明提供的试剂盒,pcr-荧光探针法所用试剂盒购自达安基因股份有限公司的肠道病毒71型核酸检测试剂盒(pcr-荧光探针法)和柯萨奇病毒a16型核酸检测试剂盒(pcr-荧光探针法)。采用与达安基因股份有限公司试剂盒进行对比试验研究,对本公司制备的ev71和ca16抗原检测试剂盒进行临床验证,以细胞培养法为检测的金标准,比较三种试剂盒在检测ev71和ca16时的灵敏度及特异性。
1.样本来源及处理
咽拭子标本140份,取自广州医科大学附属第一医院疑似手足口病患者。将样本混悬于3mldmem培养基中,用旋涡混合器打散黏液,500g离心8min,各取100ul上清做为细胞培养法检测样品。
2.操作步骤
2.1细胞培养法按以下步骤进行:取上述检测样品100ul,接种于有70-80%饱和单层vero细胞中,换维持培养基培养,观察细胞病变情况。
2.2pcr-荧光探针法(核酸法)按照其说明书操作。
2.3流式细胞检测法(fcm)、直接免疫检测法分别(dfa)按本发明的试剂盒说明操作。
3结果统计及结论
用上述4种方法对140份样品进行检测,结果见表1,表1是临床验证检测结果。
表1
注:+为阳性,-表示阴性
通过对实验结果的统计发现,140份样品中,细胞培养法测得有35份ca16阳性,62份ev71阳性,1份ev71和ca16双阳性,42份为阴性;fcm和dfa的检测结果相同,它们与细胞培养法检测结果相符的样本有133(91+42)份。其中,ca16阳性样本一致的有32份,ev71阳性样本一致的有58份,ev71和ca16双阳性样本一致的有1份,阴性样本相符的有42份;结果不相符的有7份,用细胞培养法可验证为假阴性。核酸法与细胞培养法检测结果相符的样本有137(96+41)份,其中ca16阳性样本一致的有34份,ev71阳性样本一致的有60份,ev71和ca16双阳性样本一致的有1份,阴性样本相符的有41份;结果不相符的有4份,用细胞培养法验证,其中3份验证为假阳性,1份验证为假阴性。
4灵敏度(阳性符合率):
4.1ca16阳性符合率
本发明试剂盒(fcm和dfa):灵敏度=(32+1)/(35+1)*100%=91.4%
核酸法:灵敏度=(34+1)/(35+1)*100%=97.2%
4.2ev71阳性符合率
本发明试剂盒(fcm和dfa):灵敏度=(58+1)/(62+1)*100%=93.7%
核酸法:灵敏度=(60+1)/(62+1)*100%=96.8%
5特异性(阴性符合率):
本发明试剂盒(fcm和dfa):灵敏度=42/42*100%=100%
核酸法:灵敏度=41/42*100%=97.6%
6结论:通过以上结果可以看出,本发明试剂盒(fcm和dfa)检测ca16和ev71在灵敏度(分别为91.4%、93.7%)方面要略低于核酸检测法(分别为97.2%、96.8%),但特异性(100%)则高于核酸检测法(96.6%)。与核酸检测法相比,本发明试剂盒(fcm和dfa)操作方便快速,对实验仪器、实验场地要求低。基层医院手足口病患者较少,适合用直接免疫荧光这种对设备要求较低的方法;fcm具有高通量和自动分析的特点,但流式细胞仪较为昂贵,适合患者较多的大型医院。
最后应当说明的是,以上实施例仅用以说明本发明的技术方案而非对发明专利保护范围的限制,尽管参照较佳实施例对本发明做了详细说明,本领域的普通技术人员应当理解,在不脱离本发明技术方案的实质和范围的前提下,还可以对本发明的技术方案做出修改或者等同替换,这些都属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!