一种同时检测鸡组织中二硝托胺及其代谢产物残留的确证分析方法与流程
本发明涉及兽药残留检测领域,具体涉及一种同时检测鸡组织中二硝托胺及其代谢产物(3-氨基-5-硝基邻甲苯酰胺,3-anot)残留的确证分析方法。
背景技术:
目前,国内外对二硝托胺及其代谢产物3-anot的残留检测方法主要有薄层层析法、分光光度法、高效和超高效液相色谱法、高效和超高效液相色谱-串联质谱法等。而同时检测鸡组织中二硝托胺及其代谢产物3-anot残留的主要有高效和超高效液相色谱法、高效和超高效液相色谱-串联质谱法。由于高效和超高效液相色谱法的主要缺点是对目标化合物不能准确定性,串联质谱能根据目标化合物的离子对信息对目标化合物进行准确定性和定量,能有效避免复杂生物样品中杂质的干扰,简化样品前处理过程,减少假阳性的结果。所以色谱-串联质谱法可以对生物样品中痕量目标化合物进行准确定性和定量。但到目前为止,关于同时检测鸡组织中二硝托胺及其代谢产物3-anot残留的气相色谱-串联质谱法(gc-ms/ms)的研究国内外尚未见报道。二硝托胺的沸点为298℃,3-anot的沸点为339.3℃,而常规气相毛细管色谱柱的最高耐受温度通常为320℃。解决此类问题的方法主要有两种:1)目标化合物的衍生化;2)用耐高温毛细管色谱柱代替普通的毛细管色谱柱。相比之下,衍生化方法费时费力,本研究采用耐高温毛细管色谱柱代替普通的毛细管色谱柱的方法解决二硝托胺及其代谢产物3-anot在gc-ms/ms应用中的高沸点问题,为同时检测鸡组织中二硝托胺及其代谢产物3-anot的残留提供新的技术手段。
技术实现要素:
为了能同时检测并确证二硝托胺及其代谢产物3-anot在鸡组织中的残留,满足欧盟标准,本发明提供了一种气相色谱-串联质谱法(gc-ms/ms),能快速、准确地同时检测鸡组织中二硝托胺及其代谢产物3-anot的残留。
本发明所述的同时检测鸡组织中二硝托胺及其代谢产物残留的确证分析方法,是将鸡组织样品经过提取和净化后,气相色谱-串联质谱法(gc-ms/ms)检测。
所述的气相色谱-串联质谱法的条件是:以高纯氦气(99.999%)为载气,流速为0.8ml/min,程序升温模式,不分流进样,进样体积:1.0μl。采用电子轰击(ei)离子源,全扫描(fullscan)方式定性,选择反应监测(autosrm)方式定量。
所述的鸡组织包括鸡肌肉、肝脏、肾脏、皮肤+脂肪、蛋清、蛋黄和全蛋等。
本发明的有益效果体现在:wu等用超高效液相色谱-串联质谱的方法(uplc-ms/ms)检测鸡组织(肌肉和肝脏)中二硝托胺和3-anot的含量,鸡组织中二硝托胺和3-anot的回收率为77.90%-94.20%,不同基质中二硝托胺和3-anot的检测限(lod)相同,分别为8.0μg/kg和15.0μg/kg。吴银良等用超高效液相色谱方法检测鸡组织(肌肉和肝脏)中二硝托胺和3-anot的含量,回收率为79.20%-88.10%,不同基质中二硝托胺和3-anot的lod相同,分别为25.0μg/kg和50.0μg/kg。赵健等用液相色谱串联质谱法(hplc-ms/ms)测定鸡肌肉中二硝托胺及其代谢产物3-anot的含量,回收率为81.00%-94.00%,二硝托胺和3-anot的lod分别为10.0μg/kg和14.0μg/kg。本研究采用气相色谱-串联质谱法(gc-ms/ms)测定鸡组织中二硝托胺及其代谢产物3-anot的含量,回收率为81.96%-94.31%,二硝托胺在鸡肌肉、肝脏、肾脏、皮肤+脂肪、蛋清、蛋黄和全蛋中的lod分别为0.9、2.5、1.0、0.9、1.0、2.8、2.5μg/kg,3-anot在鸡肌肉、肝脏、肾脏、皮肤+脂肪中的lod分别为0.8、2.4、0.9、0.9、0.8、2.5、2.4μg/kg。与高效液相色谱法、hplc-ms/ms和uplc-ms/ms相比,本发明具有回收率、灵敏度高的优势,即具有高准确度和灵敏度。此外,与hplc-ms/ms和uplc-ms/ms仪器相比,gc-ms/ms仪器价格便宜得多,以高纯氦气作为流动相,不需要使用用价格昂贵的色谱级甲醇和乙腈,无需配制流动相。因此,本方法还具有简便和经济的优点。
附图说明
图1二硝托胺质谱图。
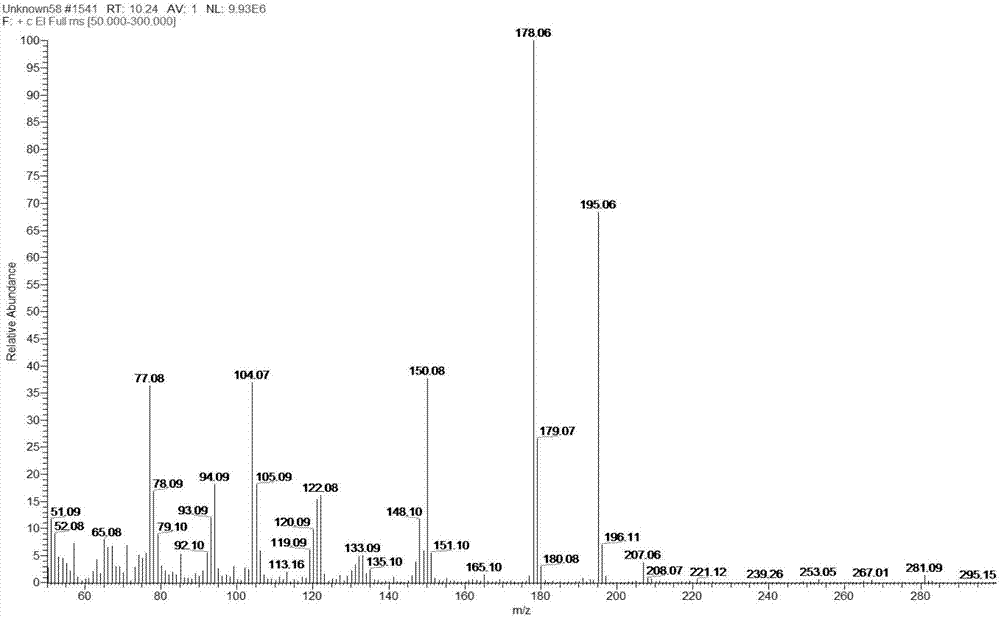
图23-氨基-5-硝基邻甲苯酰胺(3-anot)质谱图。
图3空白鸡肌肉样品添加二硝托胺和3-anot混合标准品(100.00μg/kg)的总离子流图(tic)和定量离子的质量色谱图(mc)。
图4空白鸡肝脏样品添加二硝托胺和3-anot混合标准品(80.00μg/kg)的总离子流图(tic)和定量离子的质量色谱图(mc)。
图5空白鸡肾脏样品添加二硝托胺和3-anot混合标准品(100.00μg/kg)的总离子流图(tic)和定量离子的质量色谱图(mc)。
图6空白鸡皮肤+脂肪样品添加二硝托胺和3-anot混合标准品(100.00μg/kg)的总离子流图(tic)和定量离子的质量色谱图(mc)。
图7空白鸡蛋清样品添加二硝托胺和3-anot混合标准品(100.00μg/kg)的总离子流图(tic)和定量离子的质量色谱图(mc)。
图8空白鸡蛋黄样品添加二硝托胺和3-anot混合标准品(90.00μg/kg)的总离子流图(tic)和定量离子的质量色谱图(mc)。
图9空白鸡全蛋样品添加二硝托胺和3-anot混合标准品(90.00μg/kg)的总离子流图(tic)和定量离子的质量色谱图(mc)。
图10鸡肌肉中二硝托胺(a)及主要代谢产物3-anot(b)基质添加标准曲线(n=7)
图11鸡肝脏中二硝托胺(a)及主要代谢产物3-anot(b)基质添加标准曲线(n=7)
图12鸡肾脏中二硝托胺(a)及主要代谢产物3-anot(b)基质添加标准曲线(n=7)
图13鸡皮肤+脂肪中二硝托胺(a)及主要代谢产物3-anot(b)基质添加标准曲线(n=7)。
图14鸡蛋清中二硝托胺(a)及主要代谢产物3-anot(b)基质添加标准曲线(n=7)
图15鸡蛋黄中二硝托胺(a)及主要代谢产物3-anot(b)基质添加标准曲线(n=7)。
图16鸡全蛋中二硝托胺及(a)主要代谢产物3-anot(b)基质添加标准曲线(n=7)。
具体实施方式
在本发明中所使用的术语,除非有另外说明,一般具有本领域普通技术人员通常理解的含义。
下面结合具体实施例,并参照数据进一步详细地描述本发明。这些实施例只是为了举例说明本发明,而非以任何方式限制本发明的范围。
在以下的实施例中,未详细描述的各种过程和方法是本领域中公知的常规方法。所用试剂的来源、商品名以及有必要列出其组成成分者,均在首次出现时标明,其后所用相同试剂如无特殊说明,均以首次标明的内容相同。
1.实验家禽的饲养和样品采集
从江苏京海禽业集团有限公司选取112d的京海黄鸡10只(公、母各半),单笼饲养,饲喂来自扬州市扬大饲料厂的不含任何药物的全价饲料,自由饮水,饲养2周后屠宰。屠宰后,分别取供试鸡的胸肌肉、肝脏、肾脏、皮肤+脂肪,分别将其搅碎并充分混匀作为空白样品,分装,密封,于-35℃冰箱中保存。
从江苏京海禽业集团有限公司选取196d的京海黄鸡产蛋鸡20只,单笼饲养,饲喂来自扬州市扬大饲料厂的不含任何药物的全价饲料,自由饮水。饲养2周后,连续收集10d鸡蛋,并置于4℃冰箱中暂时保存。样品采集完毕后,分别去蛋壳并将蛋清、蛋黄和全蛋匀浆后分别作为空白蛋清、蛋黄和全蛋样品,分装,密封,于-35℃冰箱中保存。
2.本发明提取与净化步骤
1)准确称取(2.0±0.02)g均质好的空白组织样品,在研钵中与3.0g左右硅藻土研磨至粉状混匀后,装填入22ml不锈钢萃取池;
2)在80℃和1500psi条件下,每个萃取池萃取首先使用正己烷萃取一次(5min),去脂用,收集液弃掉,再使用纯乙腈萃取2次(10min),萃取用,萃取液收集于60ml收集瓶,转移至50ml聚丙烯离心管;
3)将装有萃取液的50ml的聚丙烯离心管置于40℃的干浴氮吹仪上氮吹至干,然后用2ml的二氯甲烷-丙酮(8︰2,v/v)溶液溶解,作为上样液;
4)依次分别用10.0ml丙酮和10.0ml二氯甲烷-丙酮(7︰3,v/v)溶液将中性氧化铝固相萃取小柱活化;
5)向活化后的固相萃取小柱中加入上样液,匀速流干后,用2ml二氯甲烷-丙酮(7︰3,v/v)溶液冲洗上样后的50ml的聚丙烯离心管,并作为淋洗液置入固相萃取小柱的样品管中,使其匀速全部流出;
6)待固相萃取小柱干燥后,用15ml甲醇-丙酮(8︰2,v/v)溶液分5次洗脱,洗脱液收集于50ml聚丙烯离心管;
7)将离心管置于离心浓缩仪中,40℃真空负压浓缩至干;
8)用2ml的二氯甲烷-丙酮(8︰2,v/v)溶解残渣(肝脏样品用16ml的二氯甲烷-丙酮(8︰2,v/v)溶解残渣,鸡蛋清和鸡蛋黄样品用18ml的二氯甲烷-丙酮(8︰2,v/v)溶解残渣),旋涡震荡使基质混匀,12000×g,常温离心10min,上层液体过0.22μm滤膜,滤液供gc-ms/ms分析。
3试验条件
3.1气相色谱条件
色谱柱:vf-5ht(30m×0.25mmi.d.×0.1μm);载气:高纯氦气(>99.999%,60psi),载气柱流速:0.8ml/min;程序升温参数:120℃保持1min,20℃/min升至240℃,保持1min,10℃/min升至320℃,保持1min。进样口温度:340℃;分流模式:不分流进样,分流流量:50.0ml/min;2min后开阀(载气节省时间2min,载气节省流量20ml/min);不分流时间:1.0min;进样体积:1.0μl。3.2质谱条件
电离模式:电子轰击(ei);电子束能量(电离能):70ev;碰撞气:高纯氩气(>99.999%,40psi);离子源温度:320℃;传输线温度:320℃;溶剂延迟:4.0min;采集数据方式:全扫描(fullscan)方式定性,选择反应监测(autosrm)方式定量。二硝托胺及其代谢产物(3-氨基-5-硝基-邻甲苯酰胺,3-anot)的分子质量和质谱参数见表1,质谱图见附图1和附图2。
表1二硝托胺及其代谢产物3-anot的分子量和质谱参数
注:*定量离子对
4定量方法与定性方法
4.1标准曲线的绘制
分别准确称取10份2.0±0.02g均质后的空白肌肉、肾脏、皮肤+脂肪、蛋清样品于研钵中,按照2的提取、净化步骤,制备空白鸡肌肉、肾脏、皮肤+脂肪、蛋清基质提取液并合并10份空白鸡肌肉、肾脏、皮肤+脂肪、蛋清基质提取液作为空白基质提取液。准确吸取1.0μg/ml浓度的二硝托胺和3-anot混合对照品工作液适量,10.0μg/ml浓度的二硝托胺和3-anot混合对照品工作液2、4、10、20、30、40μl于10ml的聚丙烯离心管中,置于40℃干浴氮吹仪上氮吹至干,并用空白基质液定容至2ml,配置成浓度分别为定量限(loq)、10.0、20.0、50.0、100.0、150.0、200.0ng/ml的系列对照品工作液(对应在空白肌肉、肾脏、皮肤和脂肪中二硝托胺及其代谢产物3-anot的添加浓度为loq、10.0、20.0、50.0、100.0、150.0、200.0μg/kg)。
分别准确称取10份2.0±0.02g均质后的空白肝脏、蛋黄和蛋清样品于研钵中,按照2的提取、净化步骤,制备鸡肝脏、蛋清和蛋黄基质提取液。从10份基质液各移取2ml并合并混匀作为空白基质提取液。准确吸取1.0μg/ml浓度的二硝托胺和3-anot混合对照品工作液适量,10.0μg/ml浓度的二硝托胺和3-anot混合对照品工作液2、4、10、20、30、40μl于10ml的聚丙烯离心管中,置于40℃氮吹仪上氮吹至干,并用空白基质液定容至2ml,配置成浓度分别为1.0、10.0、20.0、50.0、100.0、150.00、200.0ng/ml的系列对照品工作液(对应在空白鸡肝脏中二硝托胺及其代谢产物3-anot的添加浓度为loq、80.0、160.0、400.0、800.0、1200.0、1600.0μg/kg;对应在空白鸡蛋清、蛋黄中二硝托胺及其代谢产物3-anot的添加浓度为loq、90.0、180.0、450.0、900.0、1350.0、1800.0μg/kg)。
用优化好的气相色谱和质谱条件进行gc-ms/ms检测。分别以对照品工作液在空白基质液中二硝托胺、3-anot的添加浓度为横坐标(x),二硝托胺定量离子对m/z118.0>64.0、3-anot定量离子对m/z178.0>104.0的峰面积分别为纵坐标,分别绘制二硝托胺和3-anot在不同鸡组织中的基质标准曲线,以此曲线作为待测样品的定量曲线,并得出其回归方程和决定系数。
表2二硝托胺和3-anot的线性回归方程、决定系数和线性范围
由表2和附图10-16可见,本发明条件下,二硝托胺和3-anot在空白鸡肌肉、肾脏、皮肤+脂肪和蛋清中loq-200.0μg/kg添加浓度范围内,在空白鸡肝脏中loq-1600.0μg/kg添加浓度范围内,在空白鸡蛋黄和全蛋中loq-1800.0μg/kg添加浓度范围内,二硝托胺定量离子对(118.0>64.0*)和3-anot定量离子对(178.0>104.0*)的色谱峰面积(y)与其添加浓度(x)呈线性相关,且线性关系良好。
4.2回收率及精密度的测定
准确称取2.0±0.02g匀质后的空白组织样品于研钵中,分别加入二硝托胺和3-anot混合对照品工作液适量(对应在鸡肌肉、蛋清和蛋黄中添加浓度为loq、1500.0、3000.0、6000.0μg/kg;对应在鸡肝脏和肾脏中添加浓度为loq、3000.0、6000.0、12000.0μg/kg;对应在鸡皮肤+脂肪中添加浓度为loq、1000.0、2000.0、4000.0μg/kg;),与硅藻土研磨混匀装填入22ml萃取池,每个添加水平设置6个平行,经提取和净化处理后(除loq水平外,鸡肌肉、肾脏和皮肤+脂肪上机液分别用空白基质液稀释50、100、40倍,肝脏用空白基质液稀释10倍,蛋清、蛋黄和全蛋分别用空白基质液稀释50、10、10倍),在上述优化好的气相色谱和质谱分析条件(3.1、3.2)下,进行gc-ms/ms分析,计算添加回收率。空白鸡肌肉样品添加二硝托胺和3-anot混合对照品(100.00μg/kg)的总离子流图(tic)和定量离子的质量色谱图(mc)见图3;空白鸡肝脏样品添加二硝托胺和3-anot混合对照品(80.00μg/kg)的总离子流图(tic)和定量离子的质量色谱图(mc)见图4;空白鸡肾脏样品添加二硝托胺和3-anot混合对照品(100.00μg/kg)的总离子流图(tic)和定量离子的质量色谱图(mc)见图5;空白鸡皮肤+脂肪样品添加二硝托胺和3-anot混合对照品(100.00μg/kg)的总离子流图(tic)和定量离子的质量色谱图(mc)见图6;空白鸡蛋清样品添加二硝托胺和3-anot混合对照品(100.00μg/kg)的总离子流图(tic)和定量离子的质量色谱图(mc)见图7;空白鸡蛋黄样品添加二硝托胺和3-anot混合对照品(90.00μg/kg)的总离子流图(tic)和定量离子的质量色谱图(mc)见图8;空白鸡全蛋样品添加二硝托胺和3-anot混合对照品(90.00μg/kg)的总离子流图(tic)和定量离子的质量色谱图(mc)见图9。
日内精密度测定:在同日内不同时间用同一条标准曲线及同一台仪器6次重复测定上述添加浓度的样品,求得日内(批内)精密度。
日间精密度测定:在一周内不同日以不同的标准曲线及同一台仪器6次重复测定上述添加浓度的样品,求得日间(批间)精密度。
将添加样品所得定量子离子(二硝托胺,m/z118.0>64.0;3-anot,m/z178.0>104.0)的峰面积代入标准曲线中求得浓度,与实际添加的分析物的浓度相比求得添加回收率。
在此条件下,本发明方法提取鸡组织中二硝托胺及其代谢产物3-anot的添加回收率及精密度见表3和表4。
表3鸡组织中二硝托胺的添加回收率和精密度(n=6)
注:a.最高残留限量
表4鸡组织中3-anot的添加回收率和精密度(n=6)
注:a.最高残留限量
4.3检测限及定量限的确定
每种组织各取6个平行空白样品进行添加回收试验,通过逐级降低二硝托胺和3-anot的浓度,经提取和净化后,gc-ms/ms条件进行分析,得出信噪比(s/n)平均值,重复试验,以子离子的信噪比大于等于10(s/n≥10)时所对应的的添加浓度为定量限(loq);以子离子的信噪比大于等于3(s/n≥3)时所对应的的添加浓度为检测限(lod),同时对loq浓度点的回收率及相对标准偏差(rsd)进行考察。
根据6个平行空白组织样品的添加回收试验,得到在现有条件下,二硝托胺在鸡肌肉、肝脏、肾脏、皮肤+脂肪、蛋清、蛋黄和全蛋中的lod分别为0.9、2.5、1.0、0.9、1.0、2.8、2.5μg/kg,loq分别为3.0、8.0、3.2、2.9、3.5、10.0、9.5μg/kg。3-anot在鸡肌肉、肝脏、肾脏、皮肤+脂肪中的lod分别为0.8、2.4、0.9、0.9、0.8、2.5、2.4μg/kg,loq分别为2.7、8.0、3.0、2.8、3.0、9.5、9.0μg/kg。
4.3确定限及检测容量的确定
选取20个空白组织样品(2.0±0.02g),添加最高残留限量(mrl)浓度水平(鸡肌肉:3000.0μg/kg;鸡肝脏和肾脏:6000.0μg/kg;鸡皮肤+脂肪:2000.0μg/kg;鸡蛋清、蛋黄和全蛋:3000.0μg/kg)二硝托胺和3-anot,进行回收试验,经提取和净化后,进行gc-ms/ms分析,求得标准差(sd)。确定限(ccα)和检测容量(ccβ)的计算公式分别为ccα=mrls+1.64×sd(α=5%)和ccβ=ccα+1.64×sd(β=5%)。ccα和ccβ均在最高残留限量的附近,符合欧盟的规定,完全满足药物残留分析要求。各组织确定限和检测容量结果见表5。
表5鸡组织中二硝托胺和3-anot的确定限和检测容量(μg/kg)
- 还没有人留言评论。精彩留言会获得点赞!