一种超浸润高灵敏电化学微芯片、制备及应用的制作方法
本发明涉及功能材料制备和电化学检测分析领域,特别涉及一种超浸润高灵敏电化学微芯片、制备及应用。
背景技术:
超浸润表面图案化是科学家们模仿一些大自然超浸润现象如沙漠甲虫集水等发明出来的。这种具有超浸润图案化的基底可以用来液体的定向运输,同时因其超疏水与超亲水两个极端态,在亲水位置对液滴有极好的固定作用。因为这种固定作用,超浸润图案化基底在生化检测中有了很大的应用,如高通量细胞筛选,细胞药物成像,浓缩富集和微重力检测等。现今在这种超浸润图案化基底上检测的方法有表面拉曼增强检测,比色检测,荧光增强检测等方法。这些方法只能对物质进行粗略的检测,很难做到精准定量检测,这就大大降低了超浸润图案化基底在生化检测中的应用。
电化学检测作为一种传统检测方法,因其极高的灵敏度被广泛应用。电化学生物传感器也广泛的用来检测葡萄糖,一氧化氮,DNA/RNA,蛋白质等物质。然而电化学检测需要的检测液体量较大,生物检测样品珍贵。溶液体系将限制了电化学在痕量生物检测中的应用。
技术实现要素:
本发明的目的就是克服现有技术的不足,提供了一种超浸润高灵敏电化学微芯片,将超浸润基底与电化学相结合,解决了传统超浸润基底检测方法中的检测灵敏度低的问题,也克服了电化学检测液体量大的问题。这种超浸润微芯片对于体液中特定成分检测,单细胞分析检测等生物检测提供了一种新的快捷、易操作、灵敏度高的检测手段,在生物痕量检测分析中有着巨大的应用前景。
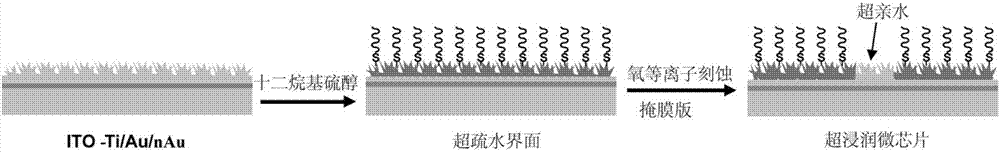
本发明一种超浸润高灵敏电化学微芯片,自下而上依次包括:ITO玻璃、钛层、金层、纳米枝状金层、超疏水表面;所述钛层、金层通过磁溅射法依次沉积在所述ITO玻璃导电一面;所述纳米枝状金层通过电化学法沉积到所述金层上;所述超疏水表面通过溶液浸泡修饰在所述纳米枝状金层上;所述超疏水表面上设有用于固定微液滴的超亲水位点。
进一步的,将具有所述纳米枝状金层的ITO玻璃浸泡在乙醇和叔十二硫醇的混合溶液中,取出并用乙醇冲洗,自然风干得到所述超疏水表面;通过光掩模板法用等离子清洗仪照射,未被模板遮住的区域超疏水表面修饰被破坏变成所述超亲水位点。
进一步的,所述超疏水表面的基底接触角为151.9±1.6°;所述超亲水位点的亲水表面接触角为0°。
进一步的,所述超亲水位点的直径尺寸为0.5-2.0mm。
本发明还提供了一种超浸润高灵敏电化学微芯片的制备方法,包括如下步骤:
步骤一、制备纳米枝状金基底:将ITO玻璃洗净干燥,利用磁控溅射方法在ITO玻璃导电一面沉积一层钛,再沉积一层金;将沉积得到的ITO/Ti/Au基底浸泡在氯金酸溶液中,用电化学沉积的方法得到纳米枝状金基底;
步骤二、修饰超浸润表面:将得到的纳米枝状金基底浸泡在具有乙醇和叔十二硫醇的溶液中12-24 h,取出并用乙醇冲洗,自然风干得到超疏水基底;通过光掩模板法用等离子清洗仪照射,未被模板遮住的地方超疏水修饰被破坏变成超亲水位点。
进一步的,步骤一中,所述电化学沉积采用三电极体系进行,以ITO玻璃为工作电极,铂片为对电极,Ag/AgCl电极为参比电极。
进一步的,步骤二中,用长尾夹将具有孔的光掩模板与具有超疏水表面的纳米枝状金基底夹在一起,等离子清洗仪清洗1-2min,将有孔位置修饰的叔十二硫醇破坏掉变成超亲水,其他盖住的区域仍为超疏水,完成对基底的超浸润修饰。
本发明还提供了一种上述的超浸润高灵敏电化学微芯片作为电化学生物传感器的应用,用于基本电化学检测,或对癌症标志物进行检测。
进一步的,所述对癌症标志物进行检测,具体为对微量前列腺癌标志物miRNA-141,miRNA-375和前列腺癌特异性抗原蛋白进行检测。
进一步的,miRNA的检测是通过一端修饰巯基,一端修饰二茂铁的长链DNA,DNA两端碱基互补,中间序列与miRNA互补;通过金硫键将DNA修饰到基底,通过加入miRNA改变DNA另一端二茂铁与基底的距离来改变电化学信号强弱;
特异性抗原蛋白的检测是通过将蛋白质特异性适配体修饰到基底,适配体抓取蛋白质使基底电阻变大改变电信号检测。
本发明的有益效果为:基底制作过程简单,成本廉价,检测操作过程简单快速,检测液需求量小,灵敏度高,特异性识别效果好;有望成为新一代癌症早期诊断的生物传感器,应用前景广阔。
附图说明
图1a所示为本发明实施例一种超浸润高灵敏电化学微芯片纳米结构制备方法示意图。
图1b所示为本发明实施例一种超浸润高灵敏电化学微芯片表面修饰方法示意图。
图2a所示为超浸润高灵敏电化学微芯片表面纳米结构电镜表征图片。
图2b所示为超浸润高灵敏电化学微芯片接触角表征图片。
图2c所示为超浸润高灵敏电化学微芯片接触角对比的实物图片。
图3a所示为不同液滴大小的实物图和电化学检测曲线图片。
图3b所示为不同检测角度的实物图和电化学检测曲线图片。
图3c所示为不同亲水孔径实物图和电化学检测曲线图。
图4a所示为本发明提供多组分检测示意图。
图4b所示为本发明提供电化学特异性检测miRNA示意图和电化学标准曲线。
图4c所示为本发明提供电化学特异性检测PSA蛋白示意图和电化学标准曲线。
图5所示为超浸润高灵敏电化学微芯片在血清中对癌症标志物检测。
具体实施方式
下文将结合具体附图详细描述本发明具体实施例。应当注意的是,下述实施例中描述的技术特征或者技术特征的组合不应当被认为是孤立的,它们可以被相互组合从而达到更好的技术效果。在下述实施例的附图中,各附图所出现的相同标号代表相同的特征或者部件,可应用于不同实施例中。
本发明实施例一种超浸润高灵敏电化学微芯片自下而上依次包括:ITO玻璃、钛层、金层、纳米枝状金层、超疏水表面;所述钛层、金层通过磁溅射法依次沉积在所述ITO玻璃导电一面;所述纳米枝状金层通过电化学法沉积到所述金层上;所述超疏水表面通过溶液浸泡修饰在所述纳米枝状金层上;所述超疏水表面上设有用于固定微液滴的超亲水位点;所述超疏水表面的基底接触角为151.9±1.6°;所述超亲水位点的亲水表面接触角为0°;所述超亲水位点的直径尺寸为0.5-2.0mm。
优选的,将具有所述纳米枝状金层的ITO玻璃浸泡在乙醇和叔十二硫醇的混合溶液中,取出并用乙醇冲洗,自然风干得到所述超疏水表面;通过光掩模板法用等离子清洗仪照射,未被模板遮住的区域超疏水表面修饰被破坏变成所述超亲水位点。
实施例1
如图1所示,一种超浸润高灵敏电化学微芯片的制备方法,包括:
步骤一、纳米枝状金基底的制备:(1)将整块的ITO玻璃切割成2cm×1cm的小块并进行清洗,将切割后的ITO玻璃浸泡在食人鱼洗液(98% H2SO4:30% H2O2,V/V=3:1)加热至100℃保持1h,再分别在丙酮,乙醇,超纯水中超声30min,用氮气吹干,用万用表欧姆档确定ITO玻璃导电的一面向上,并用等离子清洗仪清洗五分钟。将充分清洗的ITO玻璃固定到磁控溅射的靶台上,利用磁控溅射的方法在ITO玻璃上先沉积一层均匀的5nm的钛层,再沉积一层厚度为75nm的均匀的金层(图1a)。沉积的金层为了让电沉积的纳米枝状金更稳定的固定在ITO玻璃上,沉积的钛层为了解决后期化学修饰金层易脱落问题,增加了芯片的使用时间和次数。(2)将得到的ITO玻璃进行电化学金沉积(图1a)。沉积液为氯金酸溶液,1g氯金酸用0.5mol/L的硫酸定容到150mL。采用三电极体系进行电化学沉积,以ITO玻璃为工作电极,铂片为对电极,Ag/AgCl电极为参比电极,将ITO玻璃部分浸入到氯金酸溶液中,采用时间电流曲线,电压为-1.8V,电沉积时间1800S,即可得到沉积一层纳米枝状金的ITO玻璃(图2a)。
步骤二、基底超浸润修饰(图1b):(1)将步骤一得到的具有纳米枝状金基底玻璃片浸泡到疏水修饰液(叔十二硫醇:乙醇,V/V=1:9)中,通风橱中放置24h,取出玻璃片分别用乙醇和超纯水冲洗,保证表面没有残留的叔十二硫醇,等待自然风干,得到修饰枝状金位置超疏水的微芯片。(2)用长尾夹将具有孔的掩模板与得到的超疏水微芯片夹在一起,通过等离子清洗仪清洗1-2min,将有孔位置修饰的叔十二硫醇破坏掉变成超亲水,其他盖住的位置仍为超疏水。这样就完成了对基底的超浸润修饰(图2b和图2c)。
对上述超浸润高灵敏电化学微芯片电化学检测可行性判断及影响因素分析:
(1)采用两电极体系,微芯片为工作电极,Ag/AgCl为对电极和参比电极,在超亲水位点滴加一滴检测液(包含0.1M KCL和5mM K3[Fe(CN)6]/K4[Fe(CN)6]的0.01M的磷酸盐缓冲液),通过循环伏安法多次扫描得到一条几乎重合的循环伏安曲线,确认该芯片电化学检测的可行性(图3)。
(2)分别研究液滴大小,检测角度和亲水位点孔径大小对检测的影响。在角度和孔径大小不变,逐渐增加检测液的量,分别为1μL,4μL,8μL,16μL,如图3a所示,得到的四条循环伏安曲线峰值大小几乎相同,说明液滴大小不影响电化学检测的结果。同样在控制液滴大小与孔径大小不变时,改变检测角度,分别为0°,45°,90°和180°,如图3b所示,得到四组循环伏安曲线,四组曲线的峰值几乎相同,说明检测角度不影响电化学检测的结果。控制液滴大小和检测角度不变,增大亲水位点的孔径大小,孔直径分别为0.5mm,1mm,1.5mm和2.0mm,测得四组循环伏安曲线如图3c所示,得到的曲线峰值随着孔径的增大而增大,说明亲水位点孔径越大电化学检测信号越大。
实施例2
超浸润高灵敏电化学微芯片电化学检测癌症标志物miRNA:以前列腺癌为例,前列腺癌标志物中miRNA为miRNA-141(图4a)和miRNA-375(图4b)。
(1)检测原理:其中miRNA-141的碱基序列为5’-UAA CAC UGU CUG GUA AAG AUG G-3’,miRNA-375的碱基序列为5’-UUU GUU CGU UCG GCU CGC GUG A-3’。发明设计了可以特异性识别miRNA的DNA序列。识别miRNA-141的DNA序列为5′-Fc-(CH2)6 TTA GCC CAT CTT TAC CAG ACA GTG TTA GCTAA- (CH2)6 –SH-3’,识别miRNA-375的序列为5′-Fc-(CH2)6 TTA GCT CAC GCG AGC CGA ACG AAC AAA GCTAA- (CH2)6 –SH-3’。DNA序列的一段修饰巯基,可以自组装的方式和枝状金基底固定结合,另一端为二茂铁用来电化学检测电信号。其中DNA序列两端碱基序列互补,中间碱基序列与相应miRNA互补,在自然状态下DNA序列两端互补为成环状态,5’端的二茂铁与金基底距离较近,电化学检测时可以检测到其强氧还原信号。当加入相匹配的miRNA后成环部位和miRNA互补,DNA变成直链状态,5’端的二茂铁远离金基底,电化学检测时就检测不到其氧化还原峰。
(2)检测步骤:用超纯水清洗微芯片,将5μL含有10uM DNA序列液滴滴加到微芯片亲水位点上,在室温下保持30min,使得DNA通过自组装的方法固定在亲水基底表面,用水清洗亲水位点去除未组装的DNA序列,再在亲水位点滴加5μL含有140mM NaCl, 100mM NaClO4的缓冲液,用于实施例1相同的两电极体系,采用差分脉冲伏安法在电压从-0.2V到0.2V进行电化学检测,得到空白miRNA下的电化学曲线。再检测不同浓度miRNA下的电化学曲线,在DNA自组装完成后,分别在亲水位点滴加5μL含有140mM NaCl, 100mM NaClO4和不同浓度特异性miRNA(10nM,100nM,1μM 和10μM)的检测液,在室温下放置30min,保证DNA与miRNA可以充分杂交,用差分脉冲伏安法测得不同浓度的电化学曲线整合得到标准曲线。
实施例3
超浸润高灵敏电化学微芯片电化学检测癌症标志物特异性蛋白:以前列腺癌为例,前列腺特异性蛋白为PSA(图4c)。
(1)检测原理:蛋白大都是由DNA转录翻译合成,而转录翻译的DNA序列可以和蛋白进行特异性结合。可以和PSA特异性结合的适配体序列为5’-SH-(T)10-ATTAAAGCTCGCCATCAAATAGCTGC-3’。5’端修饰巯基保证适配体与枝状金基底结合从而固定到微芯片基底,加入PSA后,DNA序列会特异性抓取PSA,将PSA从溶液中固定到基底表面,增加基底电阻从而改变电化学曲线峰值从而达到检测的目的。
(2)检测步骤:将5μL含有10uM PSA适配体DNA序列的液滴滴加到微芯片亲水位点上,在室温下保持30min,使得DNA通过自组装的方法固定在亲水基底表面,用水清洗亲水位点去除未组装的DNA序列。再分别滴加5μL含有1mM C11H12FeO, 1mM MgCl2,140mM NaCl和不同浓度的PSA(0M, 10pM, 100pM, 1nM和 10nM)检测液,室温放置30min保证PSA 与适配体充分结合,用差分脉冲伏安法对不同浓度PSA检测液检测得到不同峰值的曲线图,整合得到标准曲线。
实施例4
超浸润高灵敏电化学微芯片在血清中对癌症标志物检测(图5):为确定该芯片的实用性和特异性选择性,本发明采用山羊血清(用0.1M PBS稀释10倍,内含各种蛋白)为检测液,对miRNA与蛋白质进行检测并加入不同特异性物质判断检测的特异性。将PSA的适配体修饰到基底上,分别滴加含有miRNA-141,miRNA-375和PSA的山羊血清(用0.1M PBS稀释10倍,内含1mM C11H12FeO,1mM MgCl2,140mM NaCl,各种蛋白),差分脉冲伏安法检测电化学曲线峰值整合,空白组与实施例2中空白组相差不大,加入miRNA组与空白组差别不大,加入PSA组电化学曲线峰值明显变化,确定在真实血清中该芯片的实用性和对PSA的特异性检测。将miRNA-141对应的DNA序列修饰到基底上,分别在亲水位点滴加含有miRNA-141,miRNA-375和PSA的山羊血清(用0.1M PBS稀释10倍,内含140mM NaCl, 100mM NaClO4,各种蛋白),差分脉冲伏安法检测电化学曲线整合,空白组与实施例2中空白组差别不大,加入miRNA-375与PSA组与空白组几乎相同,加入miRNA-141组电化学峰值有明显变化,确定该芯片在真实血清中实用性和对miRNA的特异性检测。
本文虽然已经给出了本发明的几个实施例,但是本领域的技术人员应当理解,在不脱离本发明精神的情况下,可以对本文的实施例进行改变。上述实施例只是示例性的,不应以本文的实施例作为本发明权利范围的限定。
- 还没有人留言评论。精彩留言会获得点赞!