一种基于微纳米弹性薄膜可变电容式的血小板微力传感器的制作方法
本实用新型属于医疗器械技术领域,涉及一种用于快速定性检测血小板综合功能的新型微纳米即时监测传感器。
背景技术:
血小板作为人体中最小的细胞,除了在正常的生理性止血上发挥着至关重要的作用,在病理性血栓形成和动脉粥样硬化过程中也同样扮演着关键的角色。如图6所示,血小板在皮肤破损后激活的示意,其中:(a)当血管壁上的内皮细胞层未出现破损时,血小板处于未激活状态;(b)当内皮细胞层出现破损时,血小板被快速激活,粘附到受损部位的细胞外基质上;(c)被激活的血小板会通过改变自身形状来增大表面积,覆盖受损的血管壁;(d)被激活的血小板会分泌促凝因子,激活更多的血小板;(e)被激活的众多血小板松散的聚集形成止血栓,达到快速暂时止血的效果;(f)血小板产生收缩力,使松散的止血栓变得紧致,从而起到彻底长期止血的效果。如果产生的收缩力不够大,血小板在止血过程中所起到的作用是极其有限的,并且松弛的止血栓容易从受损的血管壁上脱落,不仅会导致患处重新出血,还会诱发其他部位出现栓塞;相反的,如果血小板收缩力超过正常范围,处于过度活跃状态下的血小板会生成过多的止血栓,引发血栓。
越来越多的实验表明血小板收缩力在定量综合评估血小板功方面有着巨大的潜力。但是目前世界上对血小板进行功能性检测与研究依然主要依赖于测量血小板在止血响应过程中的一些中前期指标和止血栓的粘弹性特征(诸如LTA、VerifyNow P2Y12 Assay、Plateletworks、Impact-R、PFA 100 血小板功能分析仪等),缺乏针对血小板在后期时功能发挥的评估,这限制了其在科学研究和临床诊断中的应用,难以对血小板的综合功能提供确凿有力的结论。而且现阶段对血小板收缩力的测量依赖于封闭式大尺度的检测系统,其测量精度低,且无法实时观测动态亚细胞尺度下血小板的机械交互作用现象。
技术实现要素:
为了实现从微观角度上对中后期血小板功能表达进行精确测量,本实用新型提供一种基于微纳米技术的弹性薄膜可变电容式的血小板微力传感器。
一种基于微纳米技术的弹性薄膜可变电容式的血小板微力传感器为平行板可变电容器,包括相互平行的阳极板1和阴极板2,阳极板1位于上方、阴极板2位于下方,且阳极板1的阳极工作面对应着阴极板2的阳极工作面;
所述阳极板1包括板状的阳极本体11,所述阳极本体11上设有阳极孔,阳极孔的孔底和孔壁上设有阳极材料构成阳极材料区域15,所述阳极材料区域15由桶状的阳极金膜31和阳极引出测量触点32组成,所述阳极引出测量触点32位于阳极本体11的一侧面;阳极本体11的另一侧面为阳极工作面,阳极工作面上设有有机硅中间体材料层;
阳极孔内阳极金膜的底面上设有人纤维连接蛋白层;
所述阴极板2包括板状的阴极本体21,与阳极孔的孔底对应的阴极本体21的一侧面为阴极工作面,阴极工作面上设有阴极材料区域22,所述阴极材料区域22由阴极金膜41和阴极引出测量触点42组成;
所述阳极本体11和阴极本体21的材料均为硅片;
所述阳极工作面和阴极工作面之间的间距为10微米-1000微米;
测试时,直接将待检测的血小板悬浮液滴在阳极板1的阳极孔内桶状的阳极金膜31上,同时将阳极引出测量触点32和阴极引出测量触点42分别接阻抗分析仪的电容档,根据阻抗分析仪测得的电容值变化率,换算出血小板的凝结能力。
进一步限定的技术方案如下:
所述阳极本体11的厚度和阴极本体21的厚度为400-1000微米。
所述阳极孔的孔径为50微米~500微米。
所述桶状的阳极金膜31的底面为向上凸起的圆弧面。
所述阳极金膜31的厚度和阴极金膜41的厚度均为100nm。
所述有机硅中间体材料层14的厚度为10nm,有机硅中间体材料为二甲基硅氧烷(PDMS)。
所述人纤维连接蛋白层的厚度为50nm。
阴极金膜41的面积至少大于桶状的阳极金膜31底部面积的10%。
制备基于微纳米技术的弹性薄膜可变电容式的血小板微力传感器包括阳极板的制作和阴极板的制作两大工序,具体操作步骤如下:
一、阳极板制作
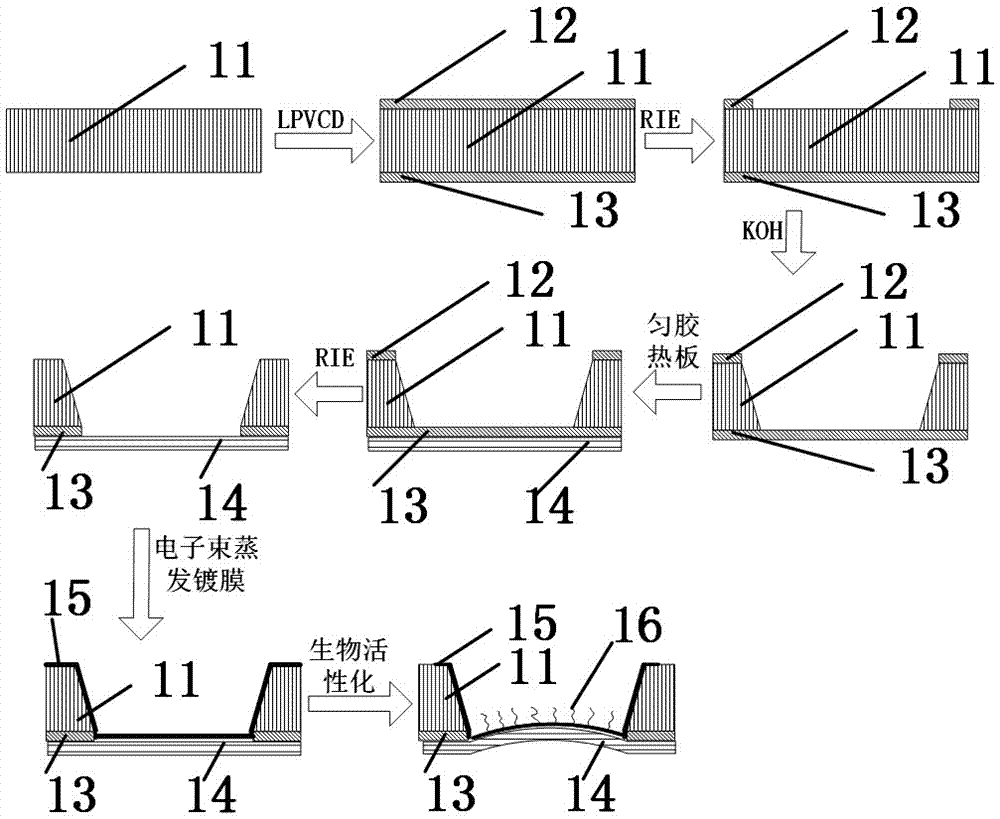
步骤(1):使用低压化学气相沉积(LPVCD)方法,在一片双面抛光的阳极本体11两侧面上分别镀50nm厚的氮化硅(SiN)薄膜,形成上氮化硅薄膜12和下氮化硅薄膜13;
步骤(2):使用标准紫外光刻技术(UV Photolithography)和反应式离子刻蚀技术(Reactive Ion Etching, RIE),在上氮化硅薄膜12上蚀刻出若干个直径为2mm的阳极孔,使阳极本体11暴露出来;
步骤(3):在阳极本体11的下氮化硅薄膜13上用匀胶热板技术镀上10um厚的二甲基硅氧烷材料层(PDMS)14;
步骤(4):用氢氧化钠(KOH)湿法刻蚀技术蚀刻掉阳极孔内的阳极本体11材料;
步骤(5):为了降低薄膜破损的概率,提高良品率,采用深反应式离子刻蚀技术(Deep Reactive Ion Etching, DRIE)去除上氮化硅薄膜12的剩余部分和阳极孔内所剩的最后一部分氮化硅13,但是,不贯通二甲基硅氧烷材料层(PDMS)14;
步骤(6):通过电子束蒸发镀膜技术,在阳极孔内镀上100nm厚度的金膜形成阳极材料区域15,阳极材料区域15由阳极孔内桶状的阳极金膜31和阳极引出测量触点32组成,其中阳极引出测量触点32位于阳极本体11的阳极工作面;
步骤(7):对桶状的阳极金膜31内的底部表面进行生物活性化处理,涂设人纤维连接蛋白层(Human Fibrinogen) 16;完成阳极板1制作。
二、阴极板制作
步骤(8):在阴极本体21的阴极工作面上用电子蒸发镀膜技术,镀上一层100nm厚度的阴极材料区域22,阴极材料区域22包括阴极金膜41和阴极引出测量触点42组成;
步骤(9):用匀胶热板技术在阴极材料区域22上均匀涂覆一层对紫外线敏感的光刻胶层;
步骤(10):用标准紫外光刻技术,在光刻胶层上预定图形,所述预定图形与阳极板1上的阳极孔的孔形一致,并在空间上互相对应与对齐;
步骤(11):用王水将未被光刻胶保护的预定图形以外的金洗除,保留下阴极金膜41和阴极引出测量触点42;
步骤(12):用光刻胶去除液将覆盖在下阴极金膜41和阴极引出测量触点42上的光刻胶去除,完成阴极板2制作;
三、血小板微力传感器的组装
将阳极板1的二甲基硅氧烷材料层(PDMS)14对应配合位于阴极板2的阴极材料区域22上方,即得到血小板微力传感器。
本实用新型的有益技术效果体现在以下方面:
1、本实用新型将微纳米生物微力传感器和血小板收缩力的研究相结合,旨在快速定量评估血小板的综合功能。
2、现如今对血小板功能的检测和血小板生理以及病理性研究都严重受制于实验检测设备的精度,本实用新型提出的通过微纳米加工工艺制造出的电容式柔性薄膜生物微力传感器,能实现从微观上对血小板收缩力进行定量快速的测量,为早期发现血小板功能异常,指导血小板抗凝药物开发和阐明相关疾病的形成机理,提供必要的技术设备和奠定一定的理论和实验基础。
3、本实用新型的顺利开展将为把血小板收缩力作为对血小板功能进行综合评测的新的临床标准提供必要的理论依据和实验结果。
附图说明
图1为本实用新型传感器结构示意图。
图2为传感器阳极的制作过程示意图。
图3为传感器阳极工作面的俯视图。
图4为传感器阴极工作面的俯视图。
图5(a)、图5(b)和图5(c)为本实用新型测量血小板凝结时收缩力的原理图。
图6为血小板在皮肤破损后激活的示意图。
图1-5(a)、5(b)、5(c)中序号:阳极板1、阴极板2、阳极本体11、上氮化硅薄膜12、下氮化硅薄膜13、二甲基硅氧烷材料层14、阳极材料区域15、人纤维连接蛋白层16、17、18、阳极金膜31、阳极引出测量触点32、阴极本体21、阴极材料区域22、阴极金膜41、阴极引出测量触点42。
具体实施方式
下面结合实施例,对本实用新型作进一步地描述。
参见图1,一种基于微纳米技术的弹性薄膜可变电容式的血小板微力传感器为平行板可变电容器,包括相互平行的阳极板1和阴极板2,阳极板1位于上方、阴极板2位于下方,且阳极板1的阳极工作面对应着阴极板2的阳极工作面,阳极工作面和阴极工作面之间的间距为500微米。
参见图1和图3,阳极板1包括板状的阳极本体11,阳极本体11上设有阳极孔,阳极孔的孔径为250微米。阳极孔的孔底和孔壁上设有阳极材料构成的阳极材料区域15;阳极材料区域15由桶状的阳极金膜31和阳极引出测量触点32组成,阳极金膜31的底面为向上凸起的圆弧面,阳极金膜31的厚度为100nm。阳极引出测量触点32位于阳极本体11的一侧面;阳极本体11的另一侧面为阳极工作面,阳极工作面上设有有机硅中间体材料层14,有机硅中间体材料层14的厚度为10nm,有机硅中间体材料为二甲基硅氧烷(PDMS)。阳极孔内阳极金膜的底面上设有人纤维连接蛋白层16,人纤维连接蛋白层16的厚度为50nm。
参见图1和图4,阴极板2包括板状的阴极本体21,与阳极孔的孔底对应的阴极本体21的一侧面为阴极工作面,阴极工作面上设有阴极材料区域22,阴极材料区域22由阴极金膜41和阴极引出测量触点42组成,阴极金膜41的厚度为100nm,阴极金膜41的面积至少大于桶状的阳极金膜31底部面积的10%。
阳极本体11和阴极本体21的材料均为硅片,厚度为800微米。
制备基于微纳米技术的弹性薄膜可变电容式的血小板微力传感器包括阳极板的制作和阴极板的制作两大工序,具体操作步骤如下:
一、阳极板制作
参见图2,制作阳极板的操作如下:
步骤(1):使用低压化学气相沉积(LPVCD)方法,在一片双面抛光的阳极本体11两侧面上分别镀50nm厚的氮化硅(SiN)薄膜,形成上氮化硅薄膜12和下氮化硅薄膜13。
步骤(2):使用标准紫外光刻技术(UV Photolithography)和反应式离子刻蚀技术(Reactive Ion Etching, RIE),在上氮化硅薄膜12上蚀刻出若干个直径为250微米的阳极孔,使阳极本体11暴露出来。
步骤(3):在阳极本体11的下氮化硅薄膜13上用匀胶热板技术镀上10um厚的二甲基硅氧烷材料层(PDMS)14。
步骤(4):用氢氧化钠(KOH)湿法刻蚀技术蚀刻掉阳极孔内的阳极本体11材料。
步骤(5):为了降低薄膜破损的概率,提高良品率,采用深反应式离子刻蚀技术(Deep Reactive Ion Etching, DRIE)去除上氮化硅薄膜12的剩余部分和阳极孔内所剩的最后一部分氮化硅13,但是,不贯通二甲基硅氧烷材料层(PDMS)14。
步骤(6):通过电子束蒸发镀膜技术,在阳极孔内镀上100nm厚度的金膜形成阳极材料区域15,阳极材料区域15由阳极孔内桶状的阳极金膜31和阳极引出测量触点32组成,其中阳极引出测量触点32位于阳极本体11的阳极工作面。
步骤(7):对桶状的阳极金膜31内的底部表面进行生物活性化处理,涂设厚度50nm的人纤维连接蛋白层(Human Fibrinogen) 16;完成阳极板1制作。
二、阴极板制作
步骤(8):在阴极本体21的阴极工作面上用电子蒸发镀膜技术,镀上一层100nm厚度的阴极材料区域22,阴极材料区域22包括阴极金膜41和阴极引出测量触点42组成。
步骤(9):用匀胶热板技术在阴极材料区域22上均匀涂覆一层对紫外线敏感的光刻胶层。
步骤(10):用标准紫外光刻技术,在光刻胶层上预定图形,所述预定图形与阳极板1上的阳极孔的孔形一致,并在空间上互相对应与对齐。
步骤(11):用王水将未被光刻胶保护的预定图形以外的金洗除,保留下阴极金膜41和阴极引出测量触点42。
步骤(12):用光刻胶去除液将覆盖在下阴极金膜41和阴极引出测量触点42上的光刻胶去除,完成阴极板2制作。
三、血小板微力传感器的组装
将阳极板1的二甲基硅氧烷材料层(PDMS)14对应配合位于阴极板2的阴极材料区域22上方,得到血小板微力传感器,并放置在亚克力材料的支架上。
本实用新型的典型应用如下
用于检测时,由一对血小板微力传感器同时使用,一个对生物微力进行测量,另外一个则被用作参考,这样可以最大限度的降低实验环境噪音对生物微力测量精度的影响。整个实验过程参见图5(a)、5(b)、5(c),本实用新型血小板微力传感器测量血小板凝结时收缩力的原理,其中:图5(a)为一个电容的示意图;由于是微纳米加工,实际操作中一个硅片上是加工多个微纳米传感器电容的,图5(b)为1个硅片上2个相邻的传感器电容的示意图;图5(c)为血小板悬浮液滴入一个传感器电容的示意图。
具体测试时,先将血小板悬浮液滴在阳极孔的人纤维连接蛋白层16上,测量此时传感器电容阳极和阴极间的电容值。然后将凝血剂滴入血小板悬浮液滴上,等血小板悬浮液滴完全凝固后,由于血小板的收缩力,阳极孔底部的二甲基硅氧烷材料层14会向上进一步凸起,此时再次通过阳极板1的阳极引出测量触点32和阴极板2的阴极引出测量触点42测量传感器电容阳极和阴极间的电容值。根据两次测量的电容差值变化的大小,可以测量出血小板凝血收缩能力的大小。
- 还没有人留言评论。精彩留言会获得点赞!