用于测定T细胞依赖性双特异性抗体的方法与流程
本申请要求2016年1月25日提交的美国临时申请62/286,862的权益,据此通过援引完整收录其内容。
ascii文本文件上的序列表的提交
通过援引将ascii文本文件上的下述提交的内容完整收入本文中:计算机可读形式(crf)的序列表(文件名:146392036240seqlist.txt,记录日期:2017年1月20日,大小:17kb)。
发明领域
本发明提供用于分析具有结合t细胞受体复合物亚基(诸如cd3亚基)的抗原结合片段和结合靶抗原的抗原结合片段的多特异性抗体的制剂的方法。在一些实施方案中,本发明提供用于检测组合物中的tdb,量化组合物中tdb的量,测定tdb的效力和/或特异性,或确定细胞群体是否表达靶抗原的方法。还涵盖组合物和试剂盒。
发明背景
t细胞依赖性双特异性抗体(tdb)是设计成结合在靶细胞上表达的靶抗原和在t细胞上表达的t细胞受体(tcr)复合物亚基(例如cd3亚基,诸如cd3ε)的双特异性抗体。该双特异性抗体对该靶抗原和该tcr复合物亚基(tcs)二者的胞外域的结合导致t细胞募集至靶细胞,从而引起t细胞活化和靶细胞消减。靶抗原特异性和tcs特异性(诸如cd3特异性)抗原结合片段的某些组合对于在靶细胞存在下特异性活化t细胞会比其它组合更加有效。弱活化性tdb会具有很少的治疗性好处。在脱靶细胞存在下的非特异性t细胞活化会引起不想要的炎性细胞因子释放。因此想要测定由各种tdb介导的t细胞活化的程度和特异性来支持安全且有效的临床药物候选物的开发。
最佳的t细胞活化测定法应当是准确的,精确的,且对使用者友好的,周转时间短且适合于自动化和高通量缩放。数种传统生物测定法可用,诸如基于pbmc的方法,基于facs的方法,和用于分泌型细胞因子的elisa。不幸的是,这些测定法许多产生高度可变的结果和/或是费时的。本文中描述的新颖tdb测定法使用用靶细胞和报告t细胞进行的基于细胞的办法来检测t细胞活化,而且得到基于elisa的桥接结合测定法验证来同时检测两种tdb抗原结合片段对它们的靶的结合。
通过援引完整收录本文中引用的所有参考文献,包括专利申请和出版物。
发明概述
本发明提供用于检测由t细胞依赖性双特异性抗体(tdb)介导的t细胞活化的方法,其中该tdb包含靶抗原结合片段和t细胞受体复合物亚基(tcs)结合片段,及其各种用途。
在一些实施方案中,有提供一种检测组合物中的tdb的方法,其中该tdb包含靶抗原结合片段和tcs结合片段(诸如cd3结合片段),该方法包括使该组合物与细胞群体接触,该细胞群体包含a)包含可操作连接至响应于t细胞活化的启动子和/或增强子的编码报告物的核酸的t细胞;和b)表达该靶抗原的靶细胞,其中该报告物的表达指示该组合物中存在该tdb。在一些实施方案中,该报告物是萤光素酶,荧光蛋白,碱性磷酸酶,β内酰胺酶,或β半乳糖苷酶。在一些实施方案中,该萤光素酶是萤火虫萤光素酶,海肾(renilla)萤光素酶,或纳米萤光素酶。在一些实施方案中,该响应于t细胞活化的启动子和/或增强子是nfat启动子,ap-1启动子,nfκb启动子,foxo启动子,stat3启动子,stat5启动子或irf启动子。在一些实施方案中,该响应于t细胞活化的启动子和/或增强子包含来自nfat,ap-1,nfκb,foxo,stat3,stat5和irf中任一项或多项的t细胞活化响应性元件。在一些实施方案中,该细胞群体中的t细胞是cd4+t细胞或cd8+t细胞。在一些实施方案中,该细胞群体中的t细胞是jurkatt细胞或ctll-2t细胞。在一些实施方案中,该tcs结合片段是cd3结合片段。在一些实施方案中,该cd3结合片段是cd3ε结合片段。在一些实施方案中,该靶抗原在该靶细胞的表面上表达。在一些实施方案中,该靶抗原是cd4,cd8,cd18,cd19,cd11a,cd11b,cd20,cd22,cd34,cd40,cd79α(cd79a),cd79β(cd79b),egf受体,her2受体,her3受体,her4受体,fcrh5,cll1,lfa-1,mac1,p150,95,vla-4,icam-1,vcam,αv/β3整联蛋白,vegf,flk2/flt3受体;肥胖(ob)受体;mpl受体;ctla-4;蛋白c,br3,c-met,组织因子,β7,tenb2,steap,或跨膜肿瘤相关抗原(taa)。在一些实施方案中,a)该靶抗原是her2受体且该靶细胞是bt-474细胞,b)该靶抗原是her2受体且该靶细胞是skbr3细胞,c)该靶抗原是cd20且该靶细胞是wil2-s细胞,或d)该靶抗原是cd79b且该靶细胞是bjab细胞。在一些实施方案中,该细胞群体中t细胞对靶细胞的比是约1:1,约1:2,约1:3,约1:4,约1:5,约1:6,约1:7,约1:8,约1:9,或约1:10。在一些实施方案中,该细胞群体中t细胞对靶细胞的比是约1:4。在一些实施方案中,该细胞群体范围为约1×103至约1×106。在一些实施方案中,该细胞群体是约1×104至约5×104。
在上文描述的检测组合物中的tdb的方法任一的一些实施方案中,该细胞群体与以约0.01ng/ml至约5000ng/ml,约0.05ng/ml至约5000ng/ml,约0.1ng/ml至约5000ng/ml,约0.5ng/ml至约5000ng/ml,约1ng/ml至约5000ng/ml,约5ng/ml至约5000ng/ml,约10ng/ml至约5000ng/ml,约0.01ng/ml至约4000ng/ml,约0.01ng/ml至约3000ng/ml,约0.01ng/ml至约2000ng/ml,约0.01ng/ml至约1000ng/ml,约0.01ng/ml至约500ng/ml,约0.01ng/ml至约100ng/ml,约0.01ng/ml至约50ng/ml,约0.01ng/ml至约10ng/ml,约0.01ng/ml至约5ng/ml,约0.1ng/ml至约1000ng/ml,约0.5ng/ml至约1000ng/ml,约1ng/ml至约100ng/ml,约1ng/ml至约1000ng/ml,或约5ng/ml至约5000ng/ml任一的浓度范围包含该tdb的组合物接触。
在上文描述的检测组合物中的tdb的方法任一的一些实施方案中,在使该细胞与该组合物接触之后大于约1小时,2小时,3小时,4小时,5小时,6小时,7小时,8小时,9小时,10小时,12小时,16小时,20小时,或24小时任一之后检测该报告物。在一些实施方案中,在使该细胞与该组合物接触之后约1小时和约24小时,约1小时和约12小时,约1小时和约8小时,约1小时和约6小时,约1小时和约4小时,约1小时和约2小时,约4小时和约24小时,约4小时和约12小时,约4小时和约8小时,约8小时和约24小时,约8小时和约12小时,约16小时和约24小时,约16小时和约20小时,或约20小时和约24小时任一之间检测该报告物。
在一些实施方案中,有提供一种量化组合物中tdb的量的方法,其中该tdb包含靶抗原结合片段和tcs结合片段(诸如cd3结合片段),该方法包括使该组合物与细胞群体接触,该细胞群体包含a)包含可操作连接至响应于t细胞活化的启动子和/或增强子的编码报告物的核酸的t细胞;和b)表达该靶抗原的靶细胞,并将作为抗体浓度的函数的该报告物的表达与通过使该t细胞和靶细胞群体与不同浓度的纯化的参照tdb接触生成的标准曲线关联。在一些实施方案中,该报告物是萤光素酶,荧光蛋白,碱性磷酸酶,β内酰胺酶,或β半乳糖苷酶。在一些实施方案中,该萤光素酶是萤火虫萤光素酶,海肾萤光素酶,或纳米萤光素酶。在一些实施方案中,该响应于t细胞活化的启动子和/或增强子是nfat启动子,ap-1启动子,nfκb启动子,foxo启动子,stat3启动子,stat5启动子或irf启动子。在一些实施方案中,该响应于t细胞活化的启动子和/或增强子包含来自nfat,ap-1,nfκb,foxo,stat3,stat5和irf中任一项或多项的t细胞活化响应性元件。在一些实施方案中,该细胞群体中的t细胞是cd4+t细胞或cd8+t细胞。在一些实施方案中,该细胞群体中的t细胞是jurkatt细胞或ctll-2t细胞。在一些实施方案中,该tcs结合片段是cd3结合片段。在一些实施方案中,该cd3结合片段是cd3ε结合片段。在一些实施方案中,该靶抗原在该靶细胞的表面上表达。在一些实施方案中,该靶抗原是cd4,cd8,cd18,cd19,cd11a,cd11b,cd20,cd22,cd34,cd40,cd79α(cd79a),cd79β(cd79b),egf受体,her2受体,her3受体,her4受体,fcrh5,cll1,lfa-1,mac1,p150,95,vla-4,icam-1,vcam,αv/β3整联蛋白,vegf,flk2/flt3受体;肥胖(ob)受体;mpl受体;ctla-4;蛋白c,br3,c-met,组织因子,β7,tenb2,steap,或跨膜肿瘤相关抗原(taa)。在一些实施方案中,a)该靶抗原是her2受体且该靶细胞是bt-474细胞,b)该靶抗原是her2受体且该靶细胞是skbr3细胞,c)该靶抗原是cd20且该靶细胞是wil2-s细胞,或d)该靶抗原是cd79b且该靶细胞是bjab细胞。在一些实施方案中,该细胞群体中t细胞对靶细胞的比是约1:1,约1:2,约1:3,约1:4,约1:5,约1:6,约1:7,约1:8,约1:9,或约1:10。在一些实施方案中,该细胞群体中t细胞对靶细胞的比是约1:4。在一些实施方案中,该细胞群体范围为约1×103至约1×106。在一些实施方案中,该细胞群体是约1×104至约5×104。
在上文描述的量化组合物中tdb的量的方法任一的一些实施方案中,该标准曲线是通过使该细胞群体与处于范围为约0.01ng/ml至约5000ng/ml的多种浓度的该纯化的参照tdb接触生成的。在一些实施方案中,该纯化的参照tdb的多种浓度包括约0.01ng/ml,0.1ng/ml,1ng/ml,10ng/ml,100ng/ml,150ng/ml,200ng/ml,250ng/ml,500ng/ml,750ng/ml,1μg/ml,2.5μg/ml,5μg/ml,10μg/ml,25μg/ml,50μg/ml,100μg/ml,250μg/ml,或500μg/ml任一。在一些实施方案中,该参照tdb的多种浓度是约3,4,5,6,7,8,9,10或大于10种浓度。
在上文描述的量化组合物中tdb的量的方法任一的一些实施方案中,在使该细胞与该组合物接触之后大于约1小时,2小时,3小时,4小时,5小时,6小时,7小时,8小时,9小时,10小时,12小时,16小时,20小时,或24小时任一之后检测该报告物。在一些实施方案中,在使该细胞与该组合物接触之后约1小时和约24小时,约1小时和约12小时,约1小时和约8小时,约1小时和约6小时,约1小时和约4小时,约1小时和约2小时,约4小时和约24小时,约4小时和约12小时,约4小时和约8小时,约8小时和约24小时,约8小时和约12小时,约16小时和约24小时,约16小时和约20小时,或约20小时和约24小时任一之间检测该报告物。
在一些实施方案中,有提供一种测定由tdb介导的t细胞活化的特异性的方法,其中该tdb包含靶抗原结合片段和tcs结合片段(诸如cd3结合片段),该方法包括a)使包含该tdb的组合物与如下细胞群体接触,该细胞群体包含i)包含可操作连接至响应于t细胞活化的启动子和/或增强子的编码报告物的核酸的t细胞;和ii)不表达该靶抗原的测试细胞;并b)使包含该tdb的组合物与如下细胞群体接触,该细胞群体包含i)包含可操作连接至响应于t细胞活化的启动子和/或增强子的编码报告物的核酸的t细胞;和ii)表达该靶抗原的靶细胞,并比较部分a)中在该测试细胞存在下该报告物的表达与部分b)中在靶细胞存在下该报告物的表达,其中该测试细胞对该靶细胞的该报告物的表达的比指示该tdb对该靶细胞的特异性。在一些实施方案中,该报告物是萤光素酶,荧光蛋白,碱性磷酸酶,β内酰胺酶,或β半乳糖苷酶。在一些实施方案中,该萤光素酶是萤火虫萤光素酶,海肾萤光素酶,或纳米萤光素酶。在一些实施方案中,该响应于t细胞活化的启动子和/或增强子是nfat启动子,ap-1启动子,nfκb启动子,foxo启动子,stat3启动子,stat5启动子或irf启动子。在一些实施方案中,该响应于t细胞活化的启动子和/或增强子包含来自nfat,ap-1,nfκb,foxo,stat3,stat5和irf中任一项或多项的t细胞活化响应性元件。在一些实施方案中,该细胞群体中的t细胞是cd4+t细胞或cd8+t细胞。在一些实施方案中,该细胞群体中的t细胞是jurkatt细胞或ctll-2t细胞。在一些实施方案中,该tcs结合片段是cd3结合片段。在一些实施方案中,该cd3结合片段是cd3ε结合片段。在一些实施方案中,该靶抗原在该靶细胞的表面上表达。在一些实施方案中,该靶抗原是cd4,cd8,cd18,cd19,cd11a,cd11b,cd20,cd22,cd34,cd40,cd79α(cd79a),cd79β(cd79b),egf受体,her2受体,her3受体,her4受体,fcrh5,cll1,lfa-1,mac1,p150,95,vla-4,icam-1,vcam,αv/β3整联蛋白,vegf,flk2/flt3受体;肥胖(ob)受体;mpl受体;ctla-4;蛋白c,br3,c-met,组织因子,β7,tenb2,steap,或跨膜肿瘤相关抗原(taa)。在一些实施方案中,a)该靶抗原是her2受体且该靶细胞是bt-474细胞,b)该靶抗原是her2受体且该靶细胞是skbr3细胞,c)该靶抗原是cd20且该靶细胞是wil2-s细胞,或d)该靶抗原是cd79b且该靶细胞是bjab细胞。在一些实施方案中,步骤a)的细胞群体中t细胞对测试细胞的比和/或步骤b)的细胞群体中t细胞对靶细胞的比是约1:1,约1:2,约1:3,约1:4,约1:5,约1:6,约1:7,约1:8,约1:9或约1:10。在一些实施方案中,步骤a)的细胞群体中t细胞对测试细胞的比和/或步骤b)的细胞群体中t细胞对靶细胞的比是约1:4。在一些实施方案中,步骤a)和/或b)的细胞群体范围为约1×103至约1×106。在一些实施方案中,步骤a)和/或b)的细胞群体范围为约1×104至约5×104。
在上文描述的测定由tdb介导的t细胞活化的特异性的方法任一的一些实施方案中,步骤a)的t细胞和测试细胞群体和步骤b)的t细胞和靶细胞群体与以约0.01ng/ml至约5000ng/ml,约0.05ng/ml至约5000ng/ml,约0.1ng/ml至约5000ng/ml,约0.5ng/ml至约5000ng/ml,约1ng/ml至约5000ng/ml,约5ng/ml至约5000ng/ml,约10ng/ml至约5000ng/ml,约0.01ng/ml至约4000ng/ml,约0.01ng/ml至约3000ng/ml,约0.01ng/ml至约2000ng/ml,约0.01ng/ml至约1000ng/ml,约0.01ng/ml至约500ng/ml,约0.01ng/ml至约100ng/ml,约0.01ng/ml至约50ng/ml,约0.01ng/ml至约10ng/ml,约0.01ng/ml至约5ng/ml,约0.1ng/ml至约1000ng/ml,约0.5ng/ml至约1000ng/ml,约1ng/ml至约100ng/ml,约1ng/ml至约1000ng/ml,或约5ng/ml至约5000ng/ml任一的浓度范围包含该tdb的组合物接触。
在上文描述的测定由tdb介导的t细胞活化的特异性的方法任一的一些实施方案中,在使该细胞与该组合物接触之后大于约1小时,2小时,3小时,4小时,5小时,6小时,7小时,8小时,9小时,10小时,12小时,16小时,20小时,或24小时任一之后检测该报告物。在一些实施方案中,在使该细胞与该组合物接触之后约1小时和约24小时,约1小时和约12小时,约1小时和约8小时,约1小时和约6小时,约1小时和约4小时,约1小时和约2小时,约4小时和约24小时,约4小时和约12小时,约4小时和约8小时,约8小时和约24小时,约8小时和约12小时,约16小时和约24小时,约16小时和约20小时,或约20小时和约24小时任一之间检测该报告物。
在一些实施方案中,有提供一种用于检测组合物中的tdb的试剂盒,其包含包含靶抗原结合片段和tcs结合片段的双特异性抗体,其中该试剂盒包含包含可操作连接至响应于t细胞活化的启动子和/或增强子的报告物的工程化t细胞。在一些实施方案中,该试剂盒进一步包含参照tdb测定标准品(已知浓度的纯化的tdb)和/或tdb对照。在一些实施方案中,该试剂盒进一步包含包含表达该靶抗原的靶细胞的组合物。在一些实施方案中,该报告物是萤光素酶,荧光蛋白,碱性磷酸酶,β内酰胺酶,或β半乳糖苷酶。在一些实施方案中,该萤光素酶是萤火虫萤光素酶,海肾萤光素酶,或纳米萤光素酶。在一些实施方案中,该响应于t细胞活化的启动子和/或增强子是nfat启动子,ap-1启动子,nfκb启动子,foxo启动子,stat3启动子,stat5启动子或irf启动子。在一些实施方案中,该响应于t细胞活化的启动子和/或增强子包含来自nfat,ap-1,nfκb,foxo,stat3,stat5和irf中任一项或多项的t细胞活化响应性元件。在一些实施方案中,该工程化t细胞是cd4+t细胞或cd8+t细胞。在一些实施方案中,该工程化t细胞是jurkatt细胞或ctll-2t细胞。在一些实施方案中,该tcs结合片段是cd3结合片段。在一些实施方案中,该cd3结合片段是cd3ε结合片段。在一些实施方案中,该靶抗原在该靶细胞的表面上表达。在一些实施方案中,该靶抗原是cd4,cd8,cd18,cd19,cd11a,cd11b,cd20,cd22,cd34,cd40,cd79α(cd79a),cd79β(cd79b),egf受体,her2受体,her3受体,her4受体,fcrh5,cll1,lfa-1,mac1,p150,95,vla-4,icam-1,vcam,αv/β3整联蛋白,vegf,flk2/flt3受体;肥胖(ob)受体;mpl受体;ctla-4;蛋白c,br3,c-met,组织因子,β7,tenb2,steap,或跨膜肿瘤相关抗原(taa)。在一些实施方案中,a)该靶抗原是her2受体且该靶细胞是bt-474细胞,b)该靶抗原是her2受体且该靶细胞是skbr3细胞,c)该靶抗原是cd20且该靶细胞是wil2-s细胞,或d)该靶抗原是cd79b且该靶细胞是bjab细胞。在一些实施方案中,该试剂盒在上文描述的方法任一中使用。
在一些实施方案中,有提供一种确定测试细胞群体是否表达靶抗原的方法,该方法包括a)使该测试细胞群体与t细胞群体接触,其中该t细胞包含可操作连接至响应于t细胞活化的启动子和/或增强子的编码报告物的核酸;并b)使该t细胞和测试细胞群体与该tdb接触,其中该tdb包含靶抗原结合片段和tcs结合片段(诸如cd3结合片段),其中该报告物的表达指示存在由该测试细胞表达的该靶抗原。在一些实施方案中,该报告物是萤光素酶,荧光蛋白,碱性磷酸酶,β内酰胺酶,或β半乳糖苷酶。在一些实施方案中,该萤光素酶是萤火虫萤光素酶,海肾萤光素酶,或纳米萤光素酶。在一些实施方案中,该响应于t细胞活化的启动子和/或增强子是nfat启动子,ap-1启动子,nfκb启动子,foxo启动子,stat3启动子,stat5启动子或irf启动子。在一些实施方案中,该响应于t细胞活化的启动子和/或增强子包含来自nfat,ap-1,nfκb,foxo,stat3,stat5和irf中任一项或多项的t细胞活化响应性元件。在一些实施方案中,该t细胞群体是cd4+t细胞或cd8+t细胞。在一些实施方案中,该t细胞群体是jurkatt细胞或ctll-2t细胞。在一些实施方案中,该tcs结合片段是cd3结合片段。在一些实施方案中,该cd3结合片段是cd3ε结合片段。在一些实施方案中,该靶抗原在该靶细胞的表面上表达。在一些实施方案中,该靶抗原是cd4,cd8,cd18,cd19,cd11a,cd11b,cd20,cd22,cd34,cd40,cd79α(cd79a),cd79β(cd79b),egf受体,her2受体,her3受体,her4受体,fcrh5,cll1,lfa-1,mac1,p150,95,vla-4,icam-1,vcam,αv/β3整联蛋白,vegf,flk2/flt3受体;肥胖(ob)受体;mpl受体;ctla-4;蛋白c,br3,c-met,组织因子,β7,tenb2,steap,或跨膜肿瘤相关抗原(taa)。在一些实施方案中,该测试细胞群体是肿瘤细胞,免疫细胞或血管细胞群体。在一些实施方案中,该测试细胞群体不包含t细胞。在一些实施方案中,t细胞对测试细胞的比是约1:1,约1:2,约1:3,约1:4,约1:5,约1:6,约1:7,约1:8,约1:9或约1:10。在一些实施方案中,t细胞对测试细胞的比是约1:4。在一些实施方案中,该测试细胞和t细胞群体包含约1×103至约1×106个细胞。在一些实施方案中,该测试细胞和t细胞群体包含约1×104至约5×104个细胞。
在上文描述的确定测试细胞群体是否表达靶抗原的方法任一的一些实施方案中,该测试细胞和t细胞群体与以约0.01ng/ml至约5000ng/ml,约0.05ng/ml至约5000ng/ml,约0.1ng/ml至约5000ng/ml,约0.5ng/ml至约5000ng/ml,约1ng/ml至约5000ng/ml,约5ng/ml至约5000ng/ml,约10ng/ml至约5000ng/ml,约0.01ng/ml至约4000ng/ml,约0.01ng/ml至约3000ng/ml,约0.01ng/ml至约2000ng/ml,约0.01ng/ml至约1000ng/ml,约0.01ng/ml至约500ng/ml,约0.01ng/ml至约100ng/ml,约0.01ng/ml至约50ng/ml,约0.01ng/ml至约10ng/ml,约0.01ng/ml至约5ng/ml,约0.1ng/ml至约1000ng/ml,约0.5ng/ml至约1000ng/ml,约1ng/ml至约100ng/ml,约1ng/ml至约1000ng/ml,或约5ng/ml至约5000ng/ml任一的浓度范围包含该tdb的组合物接触。
在上文描述的确定测试细胞群体是否表达靶抗原的方法任一的一些实施方案中,在使该细胞与该组合物接触之后大于约1小时,2小时,3小时,4小时,5小时,6小时,7小时,8小时,9小时,10小时,12小时,16小时,20小时,或24小时任一之后检测该报告物。在一些实施方案中,在使该细胞与该组合物接触之后约1小时和约24小时,约1小时和约12小时,约1小时和约8小时,约1小时和约6小时,约1小时和约4小时,约1小时和约2小时,约4小时和约24小时,约4小时和约12小时,约4小时和约8小时,约8小时和约24小时,约8小时和约12小时,约16小时和约24小时,约16小时和约20小时,或约20小时和约24小时任一之间检测该报告物。
附图简述
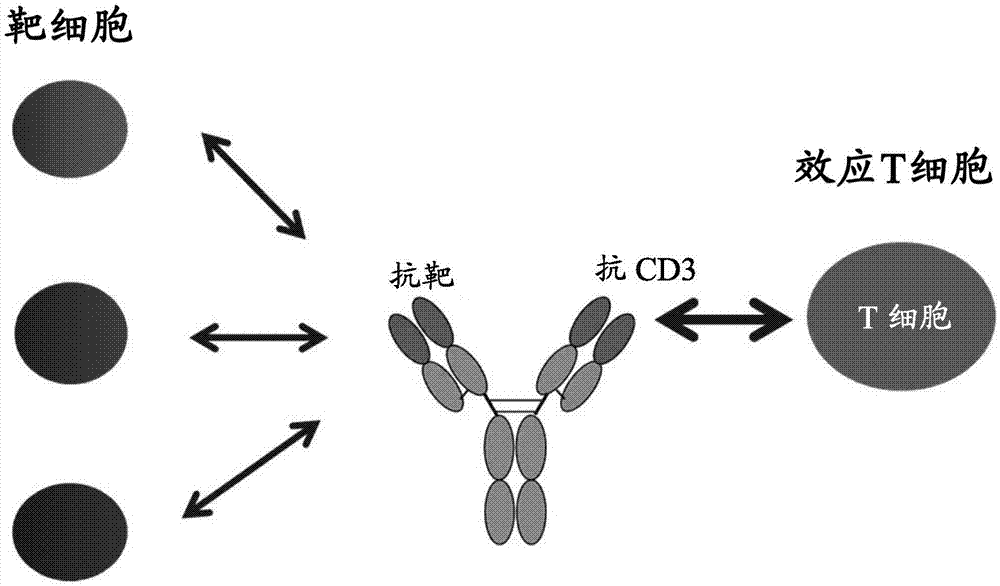
图1显示一种例示性t细胞依赖性双特异性抗体(tdb)的示意图,第一臂具有针对靶抗原的结合特异性且第二臂具有针对cd3亚基的特异性。
图2显示一种报告t细胞中由一种例示性tdb介导的活化的示意图。该报告t细胞含有由nfκb响应元件驱动的萤火虫萤光素酶报告物,其在由该报告t细胞与靶肿瘤细胞通过该tdb的桥接介导的t细胞活化之后表达。
图3a显示抗cd3同二聚体所致t细胞活化可使用报告物基因测定法来监测。遗传工程化人jurkatcd4+t细胞系以稳定表达由各种t细胞受体(tcr)响应性转录响应元件(ap-1,nfat,和nfκb)驱动的萤火虫萤光素酶报告物基因,选择稳定细胞池,并对池评估对于用10μg/ml纯化的抗cd3同二聚体处理4小时的响应。将发光响应(萤光素酶报告物基因活性)绘图,自jurkat/nfκb萤光素酶稳定池观察到最高响应。图3b显示jurkat/nfκb萤光素酶稳定克隆。
图4a和4b显示纯化的抗cd3同二聚体能在靶细胞存在或缺失下活化t细胞。图4a显示纯化的cd20tdb和纯化的抗cd3同二聚体活化t细胞的潜力的比较。表达nfκb萤光素酶报告物基因的jurkatt细胞在靶抗原表达性细胞存在下由cd20tdb剂量依赖性活化。cd20tdb在靶抗原表达性细胞系存在下活化jurkat/nfκb-萤火虫萤光素酶细胞。在共刺激性靶抗原表达性细胞存在下,纯化的cd20tdb比纯化的抗cd3同二聚体活性高1000倍。图4b显示在靶抗原表达性细胞缺失下(正方形),cd20tdb不活化jurkat/nfκb萤光素酶细胞,但是纯化的抗cd3同二聚体剂量依赖性诱导nfκb依赖性萤光素酶活性(菱形)。
图5显示在适宜靶细胞(分别是wil2-s,bt-474,和bjab细胞)存在下αcd20/cd3,αher2/cd3,和αcd79b/cd3tdb所致t细胞活化可使用用jurkat/nfκb-萤火虫萤光素酶细胞进行的报告物基因测定法来监测。将发光响应(萤光素酶报告物基因活性)作为tdb浓度的函数绘图。
图6a和6b显示t细胞活化标志物cd69和cd25响应与αcd20/αcd3tdb一起的温育以剂量依赖性方式升高。图6a显示一种例示性αcd20/αcd3tdb,bctc4465a在各种浓度所致的t细胞活化的流式细胞术分析。图6b显示流式细胞术结果的量化。
图7显示αcd20/αcd3tdbbctc4465a所致t细胞活化的剂量-响应曲线的比较,使用基于jurkat/nfκb-萤火虫萤光素酶的报告物测定法或用于cd69和cd25的阳性表面表达的流式细胞术测量。
图8显示一种例示性tdb在一种基于elisa的桥接结合测定法中的示意图,该tdb的第一臂是对her2表位特异性的且该tdb的第二臂是对cd3ε表位特异性的。在板的表面上包被her2蛋白含有her2表位的细胞外片段,通过抗her2/cd3εtdb与生物素标记的含有cd3ε表位的cd3ε肽桥接,并通过链霉亲合素缀合的hrp检测结合。
图9显示在bt-474靶细胞存在下t细胞活化的效力在具有不同cd3结合亲和力的两种αher2/cd3tdb(αher2/cd3vx和αher2/cd3wt)之间变化,使用基于jurkat/nfκb-萤火虫萤光素酶细胞的报告物测定法监测。将发光响应(萤光素酶报告物基因活性)作为tdb浓度的函数绘图。
图10a和10b显示t细胞活化的效力在经受不同热压力条件的αher2/cd3tdb样品之间变化,包括无压力,40℃2周,和40℃4周,使用基于jurkat/nfκb-萤火虫萤光素酶细胞的报告物测定法和基于elisa的桥接结合测定法监测。图10a显示使用每一种测定法计算并针对所测试的每一种条件绘图的相对效力。图10b显示使用每一种测定法计算的相对效力之间的线性关联。
图11显示在fcrh5表达性ejm靶细胞存在下αfcrh5/cd3tdb的t细胞活化的效力,使用基于jurkat/nfκb-萤火虫萤光素酶细胞的报告物测定法监测。将发光响应(萤光素酶报告物基因活性)作为tdb浓度的函数绘图。
图12显示αfcrh5/cd3tdb的t细胞活化的效力,使用基于elisa的桥接测定法。
发明详述
本发明提供用于检测由t细胞依赖性双特异性抗体(tdb)介导的t细胞活化和/或测定tdb的效力的方法,其中该tdb包含结合靶抗原的抗原结合片段和结合在t细胞上表达的t细胞受体复合物亚基(tcs),诸如cd3亚基,例如cd3ε的抗原结合片段,及其各种用途,格外包括检测组合物中的tdb,量化组合物中tdb的量,测定tdb的特异性,和确定细胞群体是否表达靶抗原。
在其它方面,本发明提供用于检测由tdb介导的t细胞活化和/或测定tdb的效力的试剂盒,其中该试剂盒包含包含可操作连接至响应于t细胞活化的启动子和/或增强子的报告物的工程化t细胞,而且任选包括该tdb,参照tdb,对照tdb,和/或靶细胞。
i.定义
术语“多肽”或“蛋白质”在本文中可互换用于指任何长度的氨基酸聚合物。所述聚合物可为直链型或分支型,其可包含经过修饰的氨基酸,并且其可由非氨基酸中断。所述术语还涵盖已经天然修饰或通过干预修饰的氨基酸聚合物;例如,二硫键形成,糖基化,脂质化,乙酰化,磷酸化,或任何其它操作或修饰,诸如与标记组分或毒素缀合。在所述定义内还包括,例如,含有氨基酸的一种或多种类似物(包括,例如,非天然氨基酸,等等)的多肽,以及本领域已知的其它修饰。如本文所用的术语“多肽”和“蛋白质”具体地包括抗体。
“纯化的”多肽(例如,抗体或免疫粘附素)意指所述多肽的纯度已经提高,使得它以比其天然环境中存在和/或当在实验室条件下最初合成和/或扩增时的纯度更高的形式存在。纯度是一个相对的术语,并且不一定意味着绝对的纯度。
术语“拮抗剂”以最广义使用,并且包括部分或完全阻断,抑制或中和天然多肽的生物活性的任何分子。在类似的方式中,术语“激动剂”以最广义使用,并且包括模拟天然多肽的生物活性的任何分子。适合的激动剂或拮抗剂分子明确包括天然多肽等的激动剂或拮抗剂抗体或抗体片段,片段或氨基酸序列变体等。用于鉴定多肽的激动剂或拮抗剂的方法可包括使多肽与候选激动剂或拮抗剂分子接触以及测量一种或多种通常与多肽相关的生物活性的可检测变化。
“结合”感兴趣的抗原(例如,肿瘤相关的多肽抗原靶标)的多肽是以足够的亲和力结合抗原,使得所述多肽可用作靶向表达所述抗原的细胞或组织的诊断剂和/或治疗剂,并且不与其它多肽显著地交叉反应的。在此类实施方案中,如通过荧光活化细胞分选(facs)分析或放射免疫沉淀法(ria)测定,多肽与“非靶”多肽结合的程度将小于多肽与其特定靶多肽结合的约10%。
关于多肽与靶分子的结合,术语“特异性结合”或“特异性地结合”或“特异于”特定多肽或特定多肽靶标上的表位意指与非特异性相互作用有可测量的不同的结合。特异性结合可例如通过测定分子的结合相较于对照分子的结合来测量,所述对照分子一般为不具有结合活性的结构类似分子。例如,特异性结合可通过与类似于靶标(例如,过量未标记靶标)的对照分子的竞争来测定。就此而言,若标记靶标对探针的结合受到过量未标记靶标的竞争抑制,则指示为特异性结合。
本文中的术语“抗体”以最广义使用并且具体地涵盖单克隆抗体,多克隆抗体,由至少两种完整的抗体形成的多特异性抗体(例如,包括tdb的双特异性抗体)和抗体片段,只要它们展现出所期望的生物活性。术语“免疫球蛋白”(ig)在本文可与抗体互换使用。
抗体是天然存在的免疫球蛋白分子,其具有不同的结构,全部基于免疫球蛋白折叠。例如,igg抗体具有进行二硫键结合以形成形成功能性抗体的两个“重”链和两个“轻”链。每个重链和轻链本身包含“恒定”(c)区和“可变”(v)区。v区确定抗体的抗原结合特异性,而c区在与免疫效应物的非抗原特异性相互作用中提供结构支持和功能。抗体或抗体的抗原结合片段的抗原结合特异性是抗体特异性结合特定抗原的能力。
抗体的抗原结合特异性由v区的结构特征决定。可变性在可变结构域的110个氨基酸跨度上并非均匀分布。反而,v区由具有15-30个氨基酸的称为框架区(fr)的相对不变伸展区组成,所述伸展区通过各自为9-12个氨基酸长的称为“高变区”(hvr)的极具可变性的较短区分开。天然重链和轻链的可变结构域各包含四个fr,主要采用由形成环连接的三个高变区连接的β-折叠构型,并且在一些情况下,形成β-折叠结构的一部分。各链的高变区由fr紧密靠近地结合在一起,并且与来自其它链的高变区一起有助于形成抗体的抗原结合位点(参见kabat等,sequencesofproteinsofimmunologicalinterest,第5版.publichealthservice,nationalinstitutesofhealth,bethesda,md.(1991))。虽然恒定结构域并不直接参与抗体与抗原结合,但展现各种效应器功能,诸如抗体参与抗体依赖性细胞毒性(adcc)。
每个v区通常包含三个hvr,例如,互补决定区(“cdr”,各自含有“高变环”)和四个框架区。因此,抗体结合位点(以实质性亲和力结合特定的所期望抗原需要的最小结构单位)通常将包括三个cdr,并且其间散布有至少三个,优选四个框架区以保持和呈现为适当构象的cdr。经典的四链抗体具有由vh和vl结构域协作定义的抗原结合位点。某些抗体,诸如骆驼和鲨鱼抗体缺乏轻链,并且仅依赖于由重链形成的结合位点。可制备单结构域工程化的免疫球蛋白,其中结合位点仅由重链或轻链形成,而不存在vh与vl之间的协作。
术语“可变”是指这样的事实,可变结构域的某些部分在抗体间的序列上广泛不同,并且用于各特定抗体对它的特定抗原的结合和特异性。然而,可变性并非在抗体的整个可变结构域中均匀分布。在轻链与重链可变结构域中,所述可变性集中在三个称为高变区的区段中。可变结构域的更高度保守的部分称为框架区(fr)。天然重链和轻链的可变结构域各包含四个fr,主要采用由形成环连接的三个高变区连接的β-折叠构型,并且在一些情况下,形成β-折叠结构的一部分。各链的高变区由fr紧密靠近地结合在一起,并且与来自其它链的高变区一起有助于形成抗体的抗原结合位点(参见kabat等,sequencesofproteinsofimmunologicalinterest,第5版.publichealthservice,nationalinstitutesofhealth,bethesda,md.(1991))。虽然恒定结构域并不直接参与抗体与抗原结合,但展现各种效应器功能,诸如抗体参与抗体依赖性细胞毒性(adcc)。
术语“高变区”(hvr)当在本文中使用时是指抗体的负责抗原结合的氨基酸残基。高变区可包含来自“互补决定区”或“cdr”的氨基酸残基(例如,vl中的大约残基24-34(l1),50-56(l2)和89-97(l3),以及vh中的大约31-35b(h1),50-65(h2)和95-102(h3)左右(kabat等,sequencesofproteinsofimmunologicalinterest,第5版,publichealthservice,nationalinstitutesofhealth,bethesda,md.(1991))和/或来自“高变环”的那些残基(例如,vl中的残基26-32(l1),50-52(l2)和91-96(l3),以及vh中的26-32(h1),52a-55(h2)和96-101(h3)(chothia和leskj.mol.biol.196:901-917(1987))。
“框架”或“fr”残基是除如本文所定义的高变区残基以外的那些可变结构域残基。
如本文所用,“t细胞依赖性双特异性”抗体或“tdb”是被设计为结合在细胞上表达的靶抗原,并且诸如通过结合在t细胞上表达的t细胞受体复合物亚基(例如cd3ε)而结合t细胞的双特异性抗体。
“抗体片段”包含完整抗体的一部分,优选地包含其抗原结合区。抗体片段的实例包括fab,fab',f(ab')2和fv片段;双抗体;串联双抗体(tadb),线性抗体(例如,美国专利号5,641,870,实施例2;zapata等,proteineng.8(10):1057-1062(1995));单臂抗体,单一可变结构域抗体,微型抗体,单链抗体分子;由抗体片段形成的多特异性抗体(例如,包括但不限于db-fc,tadb-fc,tadb-ch3,(scfv)4-fc,二-scfv,双-scfv或串联(二,三)-scfv);以及双特异性t细胞衔接器(bite)。
木瓜蛋白酶消化抗体产生两个称为“fab”片段的相同抗原结合片段,各自具有单个抗原结合位点和残余“fc”片段,其名称反映其易于结晶的能力。胃蛋白酶处理产生f(ab')2片段,其具有两个抗原结合位点且仍能够交联抗原。
“fv”是含有完全抗原识别和抗原结合位点的最小抗体片段。这个区由一个重链可变结构域与一个轻链可变结构域紧密,非共价缔合形成的二聚体构成。在此构型中,每个可变结构域的三个高变区相互作用以将抗原结合位点限定在vh-vl二聚体的表面上。总之,六个高变区赋予抗体抗原结合特异性。然而,甚至单一可变结构域(或仅包含对抗原具有特异性的三个高变区的一半fv)具有识别和结合抗原的能力,尽管与整个结合位点相比,处于较低的亲和力下。
fab片段也含有轻链的恒定域和重链的第一恒定域(ch1)。fab’片段因在重链ch1结构域的羧基端添加少量残基(包括一个或多个来自抗体铰链区的半胱氨酸)而不同于fab片段。fab'-sh在本文中表示恒定域的半胱氨酸残基携带至少一个游离硫醇基的fab'。f(ab')2抗体片段最初以之间具有铰链半胱氨酸的fab'片段对形式产生。抗体片段的其它化学偶联也是已知的。
来自任何脊椎动物物种的抗体(免疫球蛋白)的“轻链”可基于其恒定域的氨基酸序列指定为两种明显不同类型(称为卡帕(κ)和拉姆达(λ))中的一种。
取决于其重链的恒定域的氨基酸序列,抗体可归属于不同的类别。存在五种主要类别的完整抗体:iga,igd,ige,igg以及igm,并且这些类别中的几种可进一步划分成亚类(同种型),例如,igg1,igg2,igg3,igg4,iga以及iga2。对应于不同抗体类别的重链恒定域分别称为α,δ,ε,γ以及μ。不同类别的免疫球蛋白的亚基结构和三维构型是熟知的。
“单链fv”或“scfv”抗体片段包含抗体的vh和vl结构域,其中这些结构域存在于单个多肽链中。在一些实施方案中,fv多肽进一步在vh结构域与vl结构域之间包含多肽接头,使得scfv能够形成为抗原结合所需的结构。关于scfv的综述,参见plückthuninthepharmacologyofmonoclonalantibodies,第113卷,rosenburgandmoore编,springer-verlag,newyork,第269-315页(1994)。
术语“双抗体”是指具有两个抗原结合位点的小抗体片段,所述片段包含于同一多肽链(vh-vl)中与轻链可变结构域(vl)连接的重链可变结构域(vh)。通过使用太短而不允许在相同链上的两个结构域之间配对的接头,迫使所述结构域与另一链的互补结构域配对并产生两个抗原结合位点。微型双抗体更充分描述于例如ep404,097;wo93/11161;和hollinger等,proc.natl.acad.sci.usa,90:6444-6448(1993)中。
术语“多特异性抗体”以最广义使用,并且具体涵盖具有多表位特异性的抗体。此类多特异性抗体包括但不限于包含重链可变结构域(vh)和轻链可变结构域(vl)的抗体(其中vhvl单元具有多表位特异性),具有两个或更多个vl和vh结构域的抗体(其中每个vhvl单元结合不同的表位),具有两个或更多个单一可变结构域的抗体(其中每个单一可变结构域结合不同的表位),全长抗体,抗体片段(诸如fab,fv,dsfv,scfv),双抗体,双特异性双抗体,三抗体,三功能抗体,共价或非共价连接的抗体片段。“多表位特异性”是指特异性结合至相同或不同靶标上的两个或更多个不同表位的能力。“单特异性”是指结合仅一个表位的能力。根据一个实施方案,多特异性抗体是以5μm至0.001pm,3μm至0.001pm,1μm至0.001pm,0.5μm至0.001pm或0.1μm至0.001pm的亲和力结合每个表位的igg抗体。
措辞“单结构域抗体”(sdab)或“单一可变结构域(svd)抗体”通常是指其中单一可变结构域(vh或vl)可赋予抗原结合的抗体。换句话说,单一可变区不需要与另一可变区相互作用以识别靶抗原。单结构域抗体的实例包括衍生自骆驼(美洲驼和骆驼)和软骨鱼(例如,护士鲨)的那些和衍生自人和小鼠抗体的重组方法的那些(nature(1989)341:544-546;devcompimmunol(2006)30:43-56;trendbiochemsci(2001)26:230-235;trendsbiotechnol(2003):21:484-490;wo2005/035572;wo03/035694;febslett(1994)339:285-290;wo00/29004;wo02/051870)。
本文所用的术语“单克隆抗体”是指由实质上均质抗体的群体获得的抗体,即除可在产生单克隆抗体期间出现的可能变体(所述变体一般以少量存在)之外,构成所述群体的抗体个体是相同的和/或结合相同表位。与通常包括针对不同决定簇(表位)的不同抗体的多克隆抗体制剂不同,每个单克隆抗体针对抗原上的单一决定簇。除特异性外,单克隆抗体的优势在于它们不会受到其它免疫球蛋白的污染。修饰语“单克隆”指示抗体是从实质上均质的抗体群体获得的特性,且不应解释为需要通过任何特定方法来产生所述抗体。例如,待根据本文提供的方法使用的单克隆抗体可通过最初由kohler等,nature256:495(1975)描述的杂交瘤方法制备,或可通过重组dna方法(参见例如,美国专利号4,816,567)制备。“单克隆抗体”也可使用例如clackson等,nature352:624-628(1991)和marks等,j.mol.biol.222:581-597(1991)中描述的技术从噬菌体抗体文库分离。
本文中的单克隆抗体明确包括“嵌合”抗体(免疫球蛋白),其中一部分重链和/或轻链与衍生自特定物种或属于特定抗体类别或子类的抗体中的相应序列相同或同源,而所述链的剩余部分与衍生自另一物种或属于另一抗体类别或子类的抗体中的相应序列相同或同源;以及所述抗体的片段,只要其展现所期望生物活性即可(美国专利号4,816,567;morrison等,proc.natl.acad.sci.usa81:6851-6855(1984))。本文中感兴趣的嵌合抗体包括包含衍生自非人灵长类动物(例如旧世界猴(诸如狒狒,恒河猴或食蟹猴)的可变结构域抗原结合序列和人恒定区序列的“灵长类化”抗体(美国专利号5,693,780)。
“人源化”形式的非人(例如鼠类)抗体是含有衍生自非人免疫球蛋白的最小序列的嵌合抗体。人源化抗体大部分是人类免疫球蛋白(接受者抗体),其中来自接受者的高变区的残基经来自如小鼠,大鼠,兔或非人类灵长类动物的非人类物种(供体抗体)的高变区的具有所需特异性,亲和力和能力的残基替换。在有些情况下,所述人免疫球蛋白的构架区(fr)残基由相应非人残基替换。另外,人源化抗体可包含在受体抗体中或在供体抗体中没有见到的残基。进行这些修饰以进一步精制抗体性能。通常,所述人源化抗体将包含至少一个且通常两个可变结构域的基本全部,其中全部或基本全部的高变环对应于非人免疫球蛋白的那些高变环且全部或基本全部的fr是除了如上所述的fr取代之外的人免疫球蛋白序列的那些fr。所述人源化抗体任选还将包含免疫球蛋白恒定区的至少一部分,通常是人免疫球蛋白的免疫球蛋白恒定区的至少一部分。更多细节参见jones等,nature321:522-525(1986);riechmann等,nature332:323-329(1988);以及presta,curr.op.struct.biol.2:593-596(1992)。
出于本文的目的,“完整抗体”是包含重链和轻链可变结构域以及fc区的抗体。恒定域可为天然序列恒定域(例如人天然序列恒定域)或其氨基酸序列变体。优选地,完整抗体具有一种或多种效应器功能。
“天然抗体”通常是约150,000道尔顿的异四聚糖蛋白,包含两条相同轻(l)链和两条相同重(h)链。每一条轻链都借助一个共价二硫键连接到一条重链,但不同免疫球蛋白同种型的重链间二硫键的数量不同。各重链和轻链还具有规律间隔的链内二硫桥。各重链在一端具有可变结构域(vh),继而为多个恒定结构域。各轻链在一端具有可变结构域(vl)且在它的另一端具有恒定域;轻链的恒定域与重链的第一恒定域对准,且轻链可变结构域与重链的可变结构域对准。据悉,具体的氨基酸残基形成了轻链可变结构域与重链可变结构域之间的界面。
“裸抗体”是未与异源分子(诸如,细胞毒性部分或放射性标记物)缀合的抗体(如本文所定义的)。
在一些实施方案中,抗体“效应器功能”是指可归因于抗体fc区(天然序列fc区或氨基酸序列变体fc区)并且随着抗体同种型而变化的那些生物学活性。抗体效应器功能的实例包括:c1q结合和补体依赖性细胞毒性;fc受体结合;抗体依赖性细胞介导的细胞毒性(adcc);吞噬;下调细胞表面受体。
“抗体依赖性细胞介导的细胞毒性”和“adcc”是指细胞介导的反应,其中表达fc受体(fcr)的非特异性细胞毒性细胞(例如天然杀伤(naturalkiller,nk)细胞,嗜中性白细胞和巨噬细胞)识别靶细胞上的结合抗体且随后导致靶细胞裂解。用于介导adcc的初级细胞nk细胞仅表达fcγriii,而单核细胞表达fcγri,fcγrii及fcγriii。fcr在造血细胞上的表达概述于ravetch和kinet,annu.rev.immunol9:457-92(1991)的第464页上的表3中。为了评估感兴趣的分子的adcc活性,可进行体外adcc测定,诸如美国专利号5,500,362或5,821,337中所述的测定。用于此类测定的有用效应细胞包括外周血单核细胞(pbmc)和天然杀伤(nk)细胞。另选地或另外地,感兴趣的分子的adcc活性可例如在动物模型,诸如clynes等,proc.natl.acad.sci.(usa)95:652-656(1998)中公开的动物模型中进行体内评估。
“人效应细胞”是表达一个或多个fcr并且执行效应器功能的白细胞。在一些实施方案中,所述细胞至少表达fcγriii并且执行adcc效应器功能。介导adcc的人白细胞的实例包括外周血单核细胞(pbmc),天然杀伤(nk)细胞,单核细胞,细胞毒性t细胞和嗜中性粒细胞;其中pbmc和nk细胞是优选的。
“补体依赖性细胞毒性”或“cdc”是指分子在补体存在下裂解靶标的能力。补体活化途径通过使补体系统的第一成分(c1q)结合与同源抗原复合的分子(例如多肽(例如抗体))而启动。为了评估补体活化,可执行cdc测定,例如gazzano-santoro等,j.immunol.methods202:163(1996)中描述。
术语“fc受体”或“fcr”用于描述结合于抗体fc区的受体。在一些实施方案中,fcr是天然序列人fcr。此外,优选的fcr是结合igg抗体的(γ受体)并且包括fcγri,fcγrii及fcγriii子类的受体,包括这些受体的等位基因变体和可变剪接形式。fcγrii受体包括fcγriia(“活化受体”)和fcγriib(“抑制受体”),所述受体具有主要在其胞质域方面不同的类似氨基酸序列。活化受体fcγriia在其胞质域中含有免疫受体基于酪氨酸的活化基序(itam)。抑制受体fcγriib在其胞质域中含有免疫受体基于酪氨酸的抑制基序(itim)。(参见
“污染物”是指与所需多肽产物不同的物质。在本发明的一些实施方案中,污染物包括多肽的电荷变体。在本发明的一些实施方案中,污染物包括抗体或抗体片段的电荷变体。在本发明的其它实施方案中,所述污染物包括但不限于:宿主细胞材料,诸如chop;浸出蛋白a;核酸;所需多肽的变体,片段,聚集体或衍生物;另一种多肽;内毒素;病毒污染物;细胞培养基组分等。在一些实例中,污染物可以是来自例如但不限于细菌细胞(诸如大肠杆菌细胞),昆虫细胞,原核细胞,真核细胞,酵母细胞,哺乳动物细胞,禽细胞,真菌细胞等的宿主细胞蛋白质(hcp)。
如本文所用,术语“免疫粘附素”指代将异源多肽的结合特异性与免疫球蛋白恒定结构域的效应器功能组合的抗体样分子。在结构上,免疫粘附素包含不同于抗体的抗原识别和结合位点(即,是“异源的”)的具有所需结合特异性的氨基酸序列和免疫球蛋白恒定结构域序列的融合。免疫粘附素分子的粘附素部分通常是至少包含受体或配体的结合位点的连续氨基酸序列。免疫粘附素中的免疫球蛋白恒定结构域序列可从诸如以下各项的任何免疫球蛋白获得:igg-1,igg-2,igg-3或igg-4亚型,iga(包括iga-1和iga-2),ige,igd或igm。
如本说明书中使用的“报告物分子”意指通过其化学性质提供可分析鉴定信号的分子,所述信号允许检测抗原结合的抗体。这种类型测定中最常用的报告物分子是酶,荧光团或含有放射性核素的分子(即放射性同位素)和化学发光分子。
如本文所用,“基本上相同”表示值或参数没有显著效果的改变。例如,如果离子强度没有显著变化,则色谱流动相在柱出口处的离子强度基本上与流动相的初始离子强度相同。例如,柱出口处的在初始离子强度的10%,5%或1%内的离子强度基本上与初始离子强度相同。
本文中对“约”某一个值或参数的提及包括(以及描述)针对所述值或参数本身的变量。例如,关于“约x”的描述包括“x”的描述。
除非上下文另有明确规定,否则在本文和附加的权利要求书中使用的单数形式“一个”,“或”和“所述”包括复数指示物。应理解,本文中描述的本发明的方面和变型包括“由方面和变型组成”和/或“基本上由方面和变型组成”。
ii.基于细胞的报告物测定法
本发明提供基于细胞的测定法来检测在靶细胞存在下tdb介导的t细胞活化和/或测定tdb的效力,其中该tdb的一种抗原结合片段结合tcr复合物亚基(诸如cd3亚基,例如cd3ε)并活化t细胞且另一种抗原结合片段结合该靶细胞上的靶抗原。格外地,该基于细胞的测定法对于检测组合物中的tdb,量化组合物中tdb的量,测定tdb的特异性,和确定细胞群体是否表达靶抗原是有用的。
a.t细胞活化
tdb的作用机制是特异性消减靶抗原表达性细胞。tdb对t细胞受体(tcr)复合物亚基或tcs(诸如cd3ε)和在靶细胞的表面上表达的靶抗原的同时结合导致tcr簇集,从而引起t细胞活化和靶细胞的细胞毒性消减。临床上已经有许多tdb(αcd3/αcd19,αcd3/αcd20,αcd3/αher2;degastgcetal.,1995,cancerimmunolimmunother.40(6):390-396;buhmannretal.,2009,bonemarrowtransplant43(5):383-397;chanjketal.,2006,clincancerres12(6):1859-1867),而且正在评估新型式的tdb样双特异性以改善临床疗效(chamespandbatyd,2009,mabs1(6):539-547;fournierpandschirrmacherv,2013,biodrugs27(1):35-53)。tdb双特异性能够活化cd4+和cd8+t细胞谱系二者,前提是存在正确的靶表达性细胞。cd4+t细胞的活化会导致诱导细胞因子基因表达(il-2等),从而引起其它免疫细胞的募集和活化,包括cd8+t细胞的扩充和增殖。cd8+ctl活化源自经由tdb介导的细胞桥接与靶细胞形成免疫学突触样结构,从而引起诱导穿孔素和粒酶(a,b,c;取决于ctl亚型)的转录,脱粒,和穿孔素和粒酶穿过靶和效应细胞之间的‘免疫学突触’样界面的局限性释放,并且导致对靶细胞的杀伤(pores-fernando,pores-fernandoat,zweifacha,2009,immunolrev231(1):160-173;pipkinmeetal.,2010,immunolrev235(1):55-72)。效应细胞介导的细胞杀伤是一种相对缓慢的过程,需要突触稳定化数个小时且需要转录依赖性活化prf1基因和粒酶基因以确保完全细胞杀伤。或者,ctl介导的靶细胞杀伤也已经显示通过fas介导的凋亡发生(pardojetal.,2003,intimmunol15(12):1441-1450)。prf1,grb和fas介导的细胞杀伤机制的转录调节依赖于位于介导b细胞消减所需要的基因的启动子内的nfat,nfκb和stat增强子元件(pipkinmeetal.,2010,immunolrev235(1):55-72;pardojetal.,2003,intimmunol15(12):1441-1450)。靶和效应细胞之间的相互作用(免疫学突触)的强度依赖于来自其的信号传导也是稳定化和维持靶和效应细胞之间的相互作用所必需的其它共刺激性分子(krogsgaardmetal.,2003,seminimmunol15(6):307-315;pattuvetal.,2013,frontimmunol4:411;kliegeryetal.,2014,eurjimmunol44(1):58-68;schwartzjcetal.,2002,natimmunol3(5):427-434)。因此,经由使用报告物基因测定法来监测靶基因的转录诱导是用于观察tdb对t细胞的活化的一种作用机制(moa)反射性备选测定系统。
t细胞活化需要细胞表面蛋白质和信号传导分子在抗原呈递细胞的接触位点处的空间和动力学重组,以形成免疫学突触。tcr和共刺激性受体(cd28,cd40,icos,等)和配体的活化和信号传导的协调调节t细胞活化所需要的持续时间和信号传导。在抗原呈递细胞(apc)的表面上作为mhc/肽复合物呈递的抗原可受到t细胞的表面上的tcr识别。mhc和tcr簇集启动可引起t细胞活化的信号传导途径的募集和活化,这依赖于在调节t细胞活化中发挥关键作用的共刺激性和免疫调控性受体的表达。结合tcr复合物亚基(诸如cd3ε)的抗体(okt3;brownwm,2006,curropininvestigdrugs7:381-388;ferrancetal.,1993expnephrol1:83-89)可通过交联tcr诱导t细胞活化并由此模拟tcr在免疫学突触处的簇集,并且已经在临床上使用,而且作为替代活化剂用于体外研究tcr信号传导很多年。在没有共刺激的情况下通过抗cd3抗体发生的tcr簇集弱活化t细胞,但是仍然引起t细胞活化和有限的细胞因子转录和释放。已经显示抗cd3介导的信号传导活化数种转录因子,包括nfat,ap1,和nfκb(mfetal.,1995,jleukocbiol57:767-773;shapirovsetal.,1998,jimmunol161(12):6455-6458;pardojetal.,2003,intimmunol15(12):1441-1450)。共刺激经由调控信号传导来调节细胞因子释放的水平和类型,这影响细胞因子表达的转录调节和t细胞活化应答的性质(shannonmfetal.,1995,jleukocbiol57:767-773)。tdb簇集t细胞的细胞表面上的tcr,作为t细胞和靶抗原表达性细胞之间形成的桥的结果。在t细胞系中测试驱动可能由t细胞活化转录诱导的报告物基因表达的转录调控性元件,以确定哪些事件在靶细胞存在和缺失下由tdb活化。
b.报告物分子
报告物测定法是通过监测细胞中报告物表达的诱导实现刺激的生物学表征的一种分析方法。刺激引起对导致通常包括调控基因转录的细胞应答的细胞内信号传导途径的诱导。在一些例子中,细胞信号传导途径的刺激经由调节和募集转录因子至引起蛋白质生成的rna转录启动所需要的dna的上游非编码区导致对基因表达的调控。需要响应刺激而控制基因转录和翻译来引发大多数生物学应答,诸如细胞增殖,分化,存活和免疫应答。dna的这些非编码区(也称作增强子)含有特定序列,它们是调节基因转录的效率和因此由细胞响应刺激而生成的蛋白质的量和类型的转录因子的识别元件。在报告物测定法中,使用标准分子生物学方法将响应于刺激的增强子元件和最小启动子工程化改造成驱动报告物基因的表达。然后将dna转染入含有特异性响应刺激的所有机制的细胞中,并测量报告物基因转录,翻译,或活性的水平作为生物学应答的替代量度。
在一些方面,本发明提供检测tdb介导的t细胞活化的方法,其通过使包含tcs特异性(诸如cd3亚基特异性,例如cd3ε特异性)抗原结合片段和靶抗原特异性抗原结合片段的tdb与细胞群体接触,该细胞群体包含a)包含可操作连接至响应于t细胞活化的启动子和/或增强子的编码报告物的核酸;和b)在它们的表面上呈递该靶抗原的靶细胞,使得报告物的表达指示t细胞的活化。报告物分子可以是可针对其开发测定法以测量由细胞响应刺激而生成的该分子的量的任何分子。例如,报告物分子可以是由响应于刺激(例如t细胞活化)的报告物基因编码的报告物蛋白。报告物分子的常用例子包括但不限于作为底物催化的副产物发出能实验测量的光的发光蛋白(诸如萤光素酶)。萤光素酶是一类衍生自许多来源的发光蛋白质,而且包括萤火虫萤光素酶(来自物种photinuspyralis),来自海洋三色堇(renillareniformis)的海肾萤光素酶,叩头虫萤光素酶(来自pyrearinustermitilluminans),海洋桡足动物水蚤萤光素酶(来自gaussiaprinceps),和深海虾纳米萤光素酶(来自细角刺虾(oplophorusgracilirostris))。萤火虫萤光素酶催化萤光素氧化成氧化萤光素,导致发射一光子的光,而其它萤光素酶(诸如海肾)通过催化腔肠素氧合而发出光。可使用不同的滤光器系统来读取由不同萤光素酶形式和变体发出的光的波长,这便于多路复用。发光的量与细胞中表达的萤光素酶的量成比例,而且萤光素酶基因已经用作灵敏的报告物来定量评估刺激引发生物学应答的效力。报告物基因测定法已经用于广泛目的许多年,包括基础研究,hts筛选,和关于效力(broganjetal.,2012,radiatres177(4):508-513;miraglialjetal.,2011,combchemhighthroughputscreen14(8):648-657;nakajimayandohmiyay,2010,expertopindrugdiscovery5(9):835-849;parekhbsetal.,2012,mabs4(3):310-318;svobodovakandcajthamlt,2010,applmicrobiolbiotechnol88(4):839-847)。
在一些实施方案中,本发明提供基于细胞的测定法来检测包含可操作连接至响应于t细胞活化的启动子和/或增强子的编码报告物的核酸的t细胞中tdb介导的t细胞活化。在一些实施方案中,报告物构建物包含萤光素酶。在一些实施方案中,该萤光素酶是萤火虫萤光素酶(例如来自物种photinuspyralis),来自海洋三色堇的海肾萤光素酶(例如来自物种renillareniformis),叩头虫萤光素酶(例如来自物种pyrearinustermitilluminans),海洋桡足动物水蚤萤光素酶(例如来自物种gaussiaprinceps)或深海虾纳米萤光素酶(例如来自物种细角刺虾)。在一些实施方案中,萤光素酶在工程化t细胞中的表达指示tdb对t细胞的活化。在其它方面,报告物构建物编码β-葡糖醛酸糖苷酶(gus);荧光蛋白,诸如绿色荧光蛋白(gfp),红色荧光蛋白(rfp),蓝色荧光蛋白(bfp),黄色荧光蛋白(yfp)或其变体;氯霉素乙酰基转移酶(cat);β-半乳糖苷酶;β-内酰胺酶;或分泌型碱性磷酸酶(seap)。
在一些实施方案中,有提供包含可操作连接至响应于t细胞活化的控制序列(包含启动子和/或增强子)的编码报告物分子(例如报告物蛋白,诸如萤光素酶)的核酸的工程化t细胞。启动子和/或增强子序列可选自任何本领域已知响应于t细胞活化的那些。在一些实施方案中,该核酸稳定整合入t细胞基因组中。
在一些实施方案中,有提供包含在可操作连接至一种或多种t细胞活化响应性增强子元件的最小启动子控制下的编码报告物分子的核酸的工程化t细胞。在一些实施方案中,该最小启动子是胸苷激酶(tk)最小启动子,来自巨细胞病毒(cmv)的最小启动子,sv40衍生的启动子,或最小延伸因子1α(ef1α)启动子。在一些实施方案中,该最小启动子是最小tk启动子。在一些实施方案中,该最小启动子是最小cmv启动子。在一些实施方案中,该t细胞活化响应性增强子元件是nfat(活化的t细胞的核因子)增强子,ap-1(fos/jun)增强子,nfat/ap1增强子,nfκb增强子,foxo增强子,stat3增强子,stat5增强子或irf增强子。在一些实施方案中,该t细胞活化响应性增强子元件排列成串联重复(诸如任何约2,3,4,5,6,7,8,或更多个串联重复)。该t细胞活化响应性增强子元件可放置于该报告物编码序列的5'或3'。在一些实施方案中,该t细胞活化响应性增强子元件位于该最小启动子5'的位点。在一些实施方案中,该t细胞活化响应性增强子元件是nfκb增强子。在一些实施方案中,该报告物分子是萤光素酶,诸如萤火虫或海肾萤光素酶。在一些实施方案中,该核酸稳定整合入t细胞基因组中。
c.细胞
在一些实施方案中,有提供检测tdb介导的t细胞活化的方法,其通过使包含tcs特异性(诸如cd3特异性,例如cd3ε特异性)抗原结合片段和靶抗原特异性抗原结合片段的tdb与细胞群体接触,该细胞群体包含a)包含可操作连接至响应于t细胞活化的启动子和/或增强子的编码报告物的核酸的t细胞;和b)在它们的表面上呈递该靶抗原的靶细胞,使得报告物的表达指示t细胞的活化。在一些实施方案中,该t细胞是cd8+t细胞。在还有其它实施方案中,该t细胞是cd4+/cd8+t细胞。在一些实施方案中,该cd4+和/或cd8+t细胞展现选自由ifn-γ,tnf-α和白介素组成的组的细胞因子的释放升高。在一些实施方案中,该t细胞群体是永生化t细胞群体(例如永生化t细胞系)。在一些实施方案中,该t细胞群体是表达tcr/cd3ε的永生化cd4+和/或cd8+细胞群体。在一些实施方案中,该t细胞是jurkat细胞。在一些实施方案中,该t细胞是ctll-2t细胞。
在一些实施方案中,本发明的t细胞包含t细胞受体。t细胞受体作为数种蛋白质的复合物存在。t细胞受体自身由两条分开的肽链构成,它们由独立的t细胞受体α和β(tcrα和tcrβ)基因编码。该复合物中的其它蛋白质包括cd3蛋白:cd3ε,cd3γ,cd3δ和cd3ζ。cd3蛋白作为cd3εγ和cd3εδ异二聚体和cd3ζ同二聚体发现。cd3ζ同二聚体容许信号传导复合物在这些蛋白质周围聚集。在一些实施方案中,该tdb的一种臂结合t细胞受体复合物。在一些实施方案中,该tdb结合cd3。在一些实施方案中,该tdb结合cd3ε亚基。
在一些实施方案中,本发明提供包含t细胞的组合物,其供基于细胞的测定法中使用以检测和/或量化tdb介导的t细胞活化。在一些实施方案中,该组合物的t细胞是cd4+t细胞。在一些实施方案中,该组合物的t细胞是cd8+t细胞。在还有其它实施方案中,该组合物的t细胞是cd4+/cd8+t细胞。在一些实施方案中,该组合物的t细胞是永生化t细胞。在一些实施方案中,该组合物的t细胞是jurkat细胞。在一些实施方案中,该组合物的t细胞是ctll-2t细胞。在一些实施方案中,该组合物的t细胞包含响应于t细胞活化的报告物构建物。在一些实施方案中,该报告物构建物包含编码萤光素酶的多核苷酸。在一些实施方案中,该萤光素酶是萤火虫萤光素酶,海肾萤光素酶,或纳米萤光素酶。在一些实施方案中,编码报告物(例如萤光素酶)的多核苷酸可操作连接至t细胞活化响应性调节元件(例如t细胞活化响应性启动子和/或增强子)。在一些实施方案中,该响应于t细胞活化的启动子和/或增强子是nfat启动子,ap-1启动子,nfκb启动子,foxo启动子,stat3启动子,stat5启动子或irf启动子。
在一些实施方案中,本发明提供用可操作连接至响应于t细胞活化的控制序列(包含启动子和/或增强子)的编码报告物分子的t细胞活化报告物构建物工程化改造的t细胞的组合物。在一些实施方案中,该报告物分子是萤光素酶,荧光蛋白(例如gfp,yfp,等),碱性磷酸酶,或β半乳糖苷酶。在一些实施方案中,该萤光素酶是萤火虫萤光素酶,海肾萤光素酶,或纳米萤光素酶。在一些实施方案中,该响应于t细胞活化的启动子和/或增强子是nfat启动子,ap-1启动子,nfκb启动子,foxo启动子,stat3启动子,stat5启动子或irf启动子。在一些实施方案中,该响应于t细胞活化的增强子包含来自nfat,ap-1,nfκb,foxo,stat3,stat5和irf中任一项或多项的t细胞响应性增强子元件。在一些实施方案中,t细胞的组合物包含cd4+t细胞和/或cd8+t细胞。在一些实施方案中,该t细胞是jurkat细胞或ctll-2细胞。在一些实施方案中,该t细胞是包含可操作连接至nfκb启动子的编码萤光素酶的多核苷酸的jurkat细胞。
在一些实施方案中,报告效应细胞是jurkat-dualtm细胞(invivogen)。jurkat-dualtm细胞包含在5个拷贝的共有nf-κb转录响应元件和3个拷贝的c-rel结合位点控制下的luciatm分泌型萤光素酶基因。该细胞还包含在isg54最小启动子和5个干扰素刺激的响应元件控制下的分泌型胚胎碱性磷酸酶(seap)基因。
d.tdb介导的t细胞活化测定法,及其用途
在一些方面,本发明提供用于检测由tdb介导的t细胞活化的方法,其中该tdb包含靶抗原结合片段和tcs结合片段(诸如cd3结合片段),该方法包括使包含该tdb的组合物与细胞群体接触,该细胞群体包含a)包含可操作连接至响应于t细胞活化的启动子和/或增强子的编码报告物的核酸的t细胞;和b)表达该靶抗原的靶细胞,其中该报告物的表达指示存在tdb介导的t细胞活化。在一些实施方案中,该报告物是萤光素酶,荧光蛋白,碱性磷酸酶,β内酰胺酶,或β半乳糖苷酶。在一些实施方案中,该萤光素酶是萤火虫萤光素酶,海肾萤光素酶,或纳米萤光素酶。在一些实施方案中,该响应于t细胞活化的启动子和/或增强子是nfat启动子,ap-1启动子,nfκb启动子,foxo启动子,stat3启动子,stat5启动子或irf启动子。在一些实施方案中,该响应于t细胞活化的启动子和/或增强子包含来自nfat,ap-1,nfκb,foxo,stat3,stat5和irf中任一项或多项的t细胞活化响应性元件。在一些实施方案中,该细胞群体中的t细胞是cd4+t细胞或cd8+t细胞。在一些实施方案中,该细胞群体中的t细胞是jurkatt细胞或ctll-2t细胞。在一些实施方案中,该tcs结合片段是cd3结合片段。在一些实施方案中,该cd3结合片段是cd3ε结合片段。在一些实施方案中,该靶抗原在该靶细胞的表面上表达。在一些实施方案中,该靶抗原是cd4,cd8,cd18,cd19,cd11a,cd11b,cd20,cd22,cd34,cd40,cd79α(cd79a),cd79β(cd79b),egf受体,her2受体,her3受体,her4受体,fcrh5,cll1,lfa-1,mac1,p150,95,vla-4,icam-1,vcam,αv/β3整联蛋白,vegf,flk2/flt3受体;肥胖(ob)受体;mpl受体;ctla-4;蛋白c,br3,c-met,组织因子,β7,tenb2,steap,或跨膜肿瘤相关抗原(taa)。在一些实施方案中,a)该靶抗原是her2受体且该靶细胞是bt-474细胞,b)该靶抗原是her2受体且该靶细胞是skbr3细胞,c)该靶抗原是cd20且该靶细胞是wil2-s细胞,或d)该靶抗原是cd79b且该靶细胞是bjab细胞。在一些实施方案中,该细胞群体中t细胞对靶细胞的比是约1:1,约1:2,约1:3,约1:4,约1:5,约1:6,约1:7,约1:8,约1:9,或约1:10。在一些实施方案中,该细胞群体中t细胞对靶细胞的比是约1:4。在一些实施方案中,该细胞群体范围为约1×103至约1×106。在一些实施方案中,该细胞群体是约1×104至约5×104。
在一些实施方案中,该细胞群体与以约0.01ng/ml至约5000ng/ml,约0.05ng/ml至约5000ng/ml,约0.1ng/ml至约5000ng/ml,约0.5ng/ml至约5000ng/ml,约1ng/ml至约5000ng/ml,约5ng/ml至约5000ng/ml,约10ng/ml至约5000ng/ml,约0.01ng/ml至约4000ng/ml,约0.01ng/ml至约3000ng/ml,约0.01ng/ml至约2000ng/ml,约0.01ng/ml至约1000ng/ml,约0.01ng/ml至约500ng/ml,约0.01ng/ml至约100ng/ml,约0.01ng/ml至约50ng/ml,约0.01ng/ml至约10ng/ml,约0.01ng/ml至约5ng/ml,约0.1ng/ml至约1000ng/ml,约0.5ng/ml至约1000ng/ml,约1ng/ml至约100ng/ml,约1ng/ml至约1000ng/ml,或约5ng/ml至约5000ng/ml任一的浓度范围包含该tdb的组合物接触。
在一些实施方案中,在使该细胞与该组合物接触之后大于约1小时,2小时,3小时,4小时,5小时,6小时,7小时,8小时,9小时,10小时,12小时,16小时,20小时,或24小时任一之后检测该报告物。在一些实施方案中,在使该细胞与该组合物接触之后约1小时和约24小时,约1小时和约12小时,约1小时和约8小时,约1小时和约6小时,约1小时和约4小时,约1小时和约2小时,约4小时和约24小时,约4小时和约12小时,约4小时和约8小时,约8小时和约24小时,约8小时和约12小时,约16小时和约24小时,约16小时和约20小时,或约20小时和约24小时任一之间检测该报告物。
在一些方面,本发明提供用于检测组合物中的tdb的方法,其中该tdb包含靶抗原结合片段和tcs结合片段(诸如cd3结合片段),该方法包括使该组合物与细胞群体接触,该细胞群体包含a)包含可操作连接至响应于t细胞活化的启动子和/或增强子的编码报告物的核酸的t细胞;和b)表达该靶抗原的靶细胞,其中该报告物的表达指示该组合物中存在该tdb。在一些实施方案中,该报告物是萤光素酶,荧光蛋白,碱性磷酸酶,β内酰胺酶,或β半乳糖苷酶。在一些实施方案中,该萤光素酶是萤火虫萤光素酶,海肾萤光素酶,或纳米萤光素酶。在一些实施方案中,该响应于t细胞活化的启动子和/或增强子是nfat启动子,ap-1启动子,nfκb启动子,foxo启动子,stat3启动子,stat5启动子或irf启动子。在一些实施方案中,该响应于t细胞活化的启动子和/或增强子包含来自nfat,ap-1,nfκb,foxo,stat3,stat5和irf中任一项或多项的t细胞活化响应性元件。在一些实施方案中,该细胞群体中的t细胞是cd4+t细胞或cd8+t细胞。在一些实施方案中,该细胞群体中的t细胞是jurkatt细胞或ctll-2t细胞。在一些实施方案中,该tcs结合片段是cd3结合片段。在一些实施方案中,该cd3结合片段是cd3ε结合片段。在一些实施方案中,该靶抗原在该靶细胞的表面上表达。在一些实施方案中,该靶抗原是cd4,cd8,cd18,cd19,cd11a,cd11b,cd20,cd22,cd34,cd40,cd79α(cd79a),cd79β(cd79b),egf受体,her2受体,her3受体,her4受体,fcrh5,cll1,lfa-1,mac1,p150,95,vla-4,icam-1,vcam,αv/β3整联蛋白,vegf,flk2/flt3受体;肥胖(ob)受体;mpl受体;ctla-4;蛋白c,br3,c-met,组织因子,β7,tenb2,steap,或跨膜肿瘤相关抗原(taa)。在一些实施方案中,a)该靶抗原是her2受体且该靶细胞是bt-474细胞,b)该靶抗原是her2受体且该靶细胞是skbr3细胞,c)该靶抗原是cd20且该靶细胞是wil2-s细胞,或d)该靶抗原是cd79b且该靶细胞是bjab细胞。在一些实施方案中,该细胞群体中t细胞对靶细胞的比是约1:1,约1:2,约1:3,约1:4,约1:5,约1:6,约1:7,约1:8,约1:9,或约1:10。在一些实施方案中,该细胞群体中t细胞对靶细胞的比是约1:4。在一些实施方案中,该细胞群体范围为约1×103至约1×106。在一些实施方案中,该细胞群体是约1×104至约5×104。
在一些实施方案中,该细胞群体与以约0.01ng/ml至约5000ng/ml,约0.05ng/ml至约5000ng/ml,约0.1ng/ml至约5000ng/ml,约0.5ng/ml至约5000ng/ml,约1ng/ml至约5000ng/ml,约5ng/ml至约5000ng/ml,约10ng/ml至约5000ng/ml,约0.01ng/ml至约4000ng/ml,约0.01ng/ml至约3000ng/ml,约0.01ng/ml至约2000ng/ml,约0.01ng/ml至约1000ng/ml,约0.01ng/ml至约500ng/ml,约0.01ng/ml至约100ng/ml,约0.01ng/ml至约50ng/ml,约0.01ng/ml至约10ng/ml,约0.01ng/ml至约5ng/ml,约0.1ng/ml至约1000ng/ml,约0.5ng/ml至约1000ng/ml,约1ng/ml至约100ng/ml,约1ng/ml至约1000ng/ml,或约5ng/ml至约5000ng/ml任一的浓度范围包含该tdb的组合物接触。
在一些实施方案中,在使该细胞与该组合物接触之后大于约1小时,2小时,3小时,4小时,5小时,6小时,7小时,8小时,9小时,10小时,12小时,16小时,20小时,或24小时任一之后检测该报告物。在一些实施方案中,在使该细胞与该组合物接触之后约1小时和约24小时,约1小时和约12小时,约1小时和约8小时,约1小时和约6小时,约1小时和约4小时,约1小时和约2小时,约4小时和约24小时,约4小时和约12小时,约4小时和约8小时,约8小时和约24小时,约8小时和约12小时,约16小时和约24小时,约16小时和约20小时,或约20小时和约24小时任一之间检测该报告物。
在一些方面,本发明提供用于量化组合物中tdb的量的方法,其中该tdb包含靶抗原结合片段和tcs结合片段(诸如cd3结合片段),该方法包括使该组合物与细胞群体接触,该细胞群体包含a)包含可操作连接至响应于t细胞活化的启动子和/或增强子的编码报告物的核酸的t细胞;和b)表达该靶抗原的靶细胞,并将作为抗体浓度的函数的该报告物的表达与通过使该t细胞和靶细胞群体与不同浓度的纯化的参照tdb接触生成的标准曲线关联。在一些实施方案中,该报告物是萤光素酶,荧光蛋白,碱性磷酸酶,β内酰胺酶,或β半乳糖苷酶。在一些实施方案中,该萤光素酶是萤火虫萤光素酶,海肾萤光素酶,或纳米萤光素酶。在一些实施方案中,该响应于t细胞活化的启动子和/或增强子是nfat启动子,ap-1启动子,nfκb启动子,foxo启动子,stat3启动子,stat5启动子或irf启动子。在一些实施方案中,该响应于t细胞活化的启动子和/或增强子包含来自nfat,ap-1,nfκb,foxo,stat3,stat5和irf中任一项或多项的t细胞活化响应性元件。在一些实施方案中,该细胞群体中的t细胞是cd4+t细胞或cd8+t细胞。在一些实施方案中,该细胞群体中的t细胞是jurkatt细胞或ctll-2t细胞。在一些实施方案中,该tcs结合片段是cd3结合片段。在一些实施方案中,该cd3结合片段是cd3ε结合片段。在一些实施方案中,该靶抗原在该靶细胞的表面上表达。在一些实施方案中,该靶抗原是cd4,cd8,cd18,cd19,cd11a,cd11b,cd20,cd22,cd34,cd40,cd79α(cd79a),cd79β(cd79b),egf受体,her2受体,her3受体,her4受体,fcrh5,cll1,lfa-1,mac1,p150,95,vla-4,icam-1,vcam,αv/β3整联蛋白,vegf,flk2/flt3受体;肥胖(ob)受体;mpl受体;ctla-4;蛋白c,br3,c-met,组织因子,β7,tenb2,steap,或跨膜肿瘤相关抗原(taa)。在一些实施方案中,a)该靶抗原是her2受体且该靶细胞是bt-474细胞,b)该靶抗原是her2受体且该靶细胞是skbr3细胞,c)该靶抗原是cd20且该靶细胞是wil2-s细胞,或d)该靶抗原是cd79b且该靶细胞是bjab细胞。在一些实施方案中,该细胞群体中t细胞对靶细胞的比是约1:1,约1:2,约1:3,约1:4,约1:5,约1:6,约1:7,约1:8,约1:9,或约1:10。在一些实施方案中,该细胞群体中t细胞对靶细胞的比是约1:4。在一些实施方案中,该细胞群体范围为约1×103至约1×106。在一些实施方案中,该细胞群体是约1×104至约5×104。
在一些实施方案中,该标准曲线是通过使该细胞群体与处于范围为约0.01ng/ml至约5000ng/ml的多种浓度的纯化的参照tdb接触生成的。在一些实施方案中,纯化的参照tdb的多种浓度包括约0.01ng/ml,0.1ng/ml,1ng/ml,10ng/ml,100ng/ml,150ng/ml,200ng/ml,250ng/ml,500ng/ml,750ng/ml,1μg/ml,2.5μg/ml,5μg/ml,10μg/ml,25μg/ml,50μg/ml,100μg/ml,250μg/ml,或500μg/ml任一。在一些实施方案中,参照tdb的多种浓度是约3,4,5,6,7,8,9,10或大于10种浓度。
在一些实施方案中,在使该细胞与该组合物接触之后大于约1小时,2小时,3小时,4小时,5小时,6小时,7小时,8小时,9小时,10小时,12小时,16小时,20小时,或24小时任一之后检测该报告物。在一些实施方案中,在使该细胞与该组合物接触之后约1小时和约24小时,约1小时和约12小时,约1小时和约8小时,约1小时和约6小时,约1小时和约4小时,约1小时和约2小时,约4小时和约24小时,约4小时和约12小时,约4小时和约8小时,约8小时和约24小时,约8小时和约12小时,约16小时和约24小时,约16小时和约20小时,或约20小时和约24小时任一之间检测该报告物。
在一些方面,本发明提供用于测定由tdb介导的t细胞活化的效力的方法,其中该tdb包含靶抗原结合片段和tcs结合片段(诸如cd3结合片段),该方法包括使包含该tdb的组合物与细胞群体接触,该细胞群体包含a)包含可操作连接至响应于t细胞活化的启动子和/或增强子的编码报告物的核酸的t细胞;和b)表达该靶抗原的靶细胞,并将作为抗体浓度的函数的该报告物的表达与通过使该细胞群体与不同浓度的参照tdb接触生成的标准曲线关联,由此获得由该tdb介导的t细胞活化的效力的相对度量。在一些实施方案中,该报告物是萤光素酶,荧光蛋白,碱性磷酸酶,β内酰胺酶,或β半乳糖苷酶。在一些实施方案中,该萤光素酶是萤火虫萤光素酶,海肾萤光素酶,或纳米萤光素酶。在一些实施方案中,该响应于t细胞活化的启动子和/或增强子是nfat启动子,ap-1启动子,nfκb启动子,foxo启动子,stat3启动子,stat5启动子或irf启动子。在一些实施方案中,该响应于t细胞活化的启动子和/或增强子包含来自nfat,ap-1,nfκb,foxo,stat3,stat5和irf中任一项或多项的t细胞活化响应性元件。在一些实施方案中,该细胞群体中的t细胞是cd4+t细胞或cd8+t细胞。在一些实施方案中,该细胞群体中的t细胞是jurkatt细胞或ctll-2t细胞。在一些实施方案中,该tcs结合片段是cd3结合片段。在一些实施方案中,该cd3结合片段是cd3ε结合片段。在一些实施方案中,该靶抗原在该靶细胞的表面上表达。在一些实施方案中,该靶抗原是cd4,cd8,cd18,cd19,cd11a,cd11b,cd20,cd22,cd34,cd40,cd79α(cd79a),cd79β(cd79b),egf受体,her2受体,her3受体,her4受体,fcrh5,cll1,lfa-1,mac1,p150,95,vla-4,icam-1,vcam,αv/β3整联蛋白,vegf,flk2/flt3受体;肥胖(ob)受体;mpl受体;ctla-4;蛋白c,br3,c-met,组织因子,β7,tenb2,steap,或跨膜肿瘤相关抗原(taa)。在一些实施方案中,a)该靶抗原是her2受体且该靶细胞是bt-474细胞,b)该靶抗原是her2受体且该靶细胞是skbr3细胞,c)该靶抗原是cd20且该靶细胞是wil2-s细胞,或d)该靶抗原是cd79b且该靶细胞是bjab细胞。在一些实施方案中,该细胞群体中t细胞对靶细胞的比是约1:1,约1:2,约1:3,约1:4,约1:5,约1:6,约1:7,约1:8,约1:9,或约1:10。在一些实施方案中,该细胞群体中t细胞对靶细胞的比是约1:4。在一些实施方案中,该细胞群体范围为约1×103至约1×106。在一些实施方案中,该细胞群体是约1×104至约5×104。
在一些实施方案中,该细胞群体与以约0.01ng/ml至约5000ng/ml,约0.05ng/ml至约5000ng/ml,约0.1ng/ml至约5000ng/ml,约0.5ng/ml至约5000ng/ml,约1ng/ml至约5000ng/ml,约5ng/ml至约5000ng/ml,约10ng/ml至约5000ng/ml,约0.01ng/ml至约4000ng/ml,约0.01ng/ml至约3000ng/ml,约0.01ng/ml至约2000ng/ml,约0.01ng/ml至约1000ng/ml,约0.01ng/ml至约500ng/ml,约0.01ng/ml至约100ng/ml,约0.01ng/ml至约50ng/ml,约0.01ng/ml至约10ng/ml,约0.01ng/ml至约5ng/ml,约0.1ng/ml至约1000ng/ml,约0.5ng/ml至约1000ng/ml,约1ng/ml至约100ng/ml,约1ng/ml至约1000ng/ml,或约5ng/ml至约5000ng/ml任一的浓度范围包含该tdb的组合物接触。
在一些实施方案中,该标准曲线是通过使该细胞群体与处于范围为约0.01ng/ml至约5000ng/ml的多种浓度的纯化的参照tdb接触生成的。在一些实施方案中,纯化的参照tdb的多种浓度包括约0.01ng/ml,0.1ng/ml,1ng/ml,10ng/ml,100ng/ml,150ng/ml,200ng/ml,250ng/ml,500ng/ml,750ng/ml,1μg/ml,2.5μg/ml,5μg/ml,10μg/ml,25μg/ml,50μg/ml,100μg/ml,250μg/ml,或500μg/ml任一。在一些实施方案中,参照tdb的多种浓度是约3,4,5,6,7,8,9,10或大于10种浓度。
在一些实施方案中,在使该细胞与该组合物接触之后大于约1小时,2小时,3小时,4小时,5小时,6小时,7小时,8小时,9小时,10小时,12小时,16小时,20小时,或24小时任一之后检测该报告物。在一些实施方案中,在使该细胞与该组合物接触之后约1小时和约24小时,约1小时和约12小时,约1小时和约8小时,约1小时和约6小时,约1小时和约4小时,约1小时和约2小时,约4小时和约24小时,约4小时和约12小时,约4小时和约8小时,约8小时和约24小时,约8小时和约12小时,约16小时和约24小时,约16小时和约20小时,或约20小时和约24小时任一之间检测该报告物。
在一些方面,本发明提供用于测定由tdb介导的t细胞活化的特异性的方法,其中该tdb包含靶抗原结合片段和tcs结合片段(诸如cd3结合片段),该方法包括a)使包含该tdb的组合物与如下细胞群体接触,该细胞群体包含i)包含可操作连接至响应于t细胞活化的启动子和/或增强子的编码报告物的核酸的t细胞;和ii)不表达该靶抗原的测试细胞;并b)使包含该tdb的组合物与如下细胞群体接触,该细胞群体包含i)包含可操作连接至响应于t细胞活化的启动子和/或增强子的编码报告物的核酸的t细胞;和ii)表达该靶抗原的靶细胞,并比较部分a)中在该测试细胞存在下该报告物的表达与部分b)中在靶细胞存在下该报告物的表达,其中该测试细胞对该靶细胞的该报告物的表达的比指示该tdb对该靶细胞的特异性。在一些实施方案中,该报告物是萤光素酶,荧光蛋白,碱性磷酸酶,β内酰胺酶,或β半乳糖苷酶。在一些实施方案中,该萤光素酶是萤火虫萤光素酶,海肾萤光素酶,或纳米萤光素酶。在一些实施方案中,该响应于t细胞活化的启动子和/或增强子是nfat启动子,ap-1启动子,nfκb启动子,foxo启动子,stat3启动子,stat5启动子或irf启动子。在一些实施方案中,该响应于t细胞活化的启动子和/或增强子包含来自nfat,ap-1,nfκb,foxo,stat3,stat5和irf中任一项或多项的t细胞活化响应性元件。在一些实施方案中,该细胞群体中的t细胞是cd4+t细胞或cd8+t细胞。在一些实施方案中,该细胞群体中的t细胞是jurkatt细胞或ctll-2t细胞。在一些实施方案中,该tcs结合片段是cd3结合片段。在一些实施方案中,该cd3结合片段是cd3ε结合片段。在一些实施方案中,该靶抗原在该靶细胞的表面上表达。在一些实施方案中,该靶抗原是cd4,cd8,cd18,cd19,cd11a,cd11b,cd20,cd22,cd34,cd40,cd79α(cd79a),cd79β(cd79b),egf受体,her2受体,her3受体,her4受体,fcrh5,cll1,lfa-1,mac1,p150,95,vla-4,icam-1,vcam,αv/β3整联蛋白,vegf,flk2/flt3受体;肥胖(ob)受体;mpl受体;ctla-4;蛋白c,br3,c-met,组织因子,β7,tenb2,steap,或跨膜肿瘤相关抗原(taa)。在一些实施方案中,a)该靶抗原是her2受体且该靶细胞是bt-474细胞,b)该靶抗原是her2受体且该靶细胞是skbr3细胞,c)该靶抗原是cd20且该靶细胞是wil2-s细胞,或d)该靶抗原是cd79b且该靶细胞是bjab细胞。在一些实施方案中,步骤a)的细胞群体中t细胞对测试细胞的比和/或步骤b)的细胞群体中t细胞对靶细胞的比是约1:1,约1:2,约1:3,约1:4,约1:5,约1:6,约1:7,约1:8,约1:9或约1:10。在一些实施方案中,步骤a)的细胞群体中t细胞对测试细胞的比和/或步骤b)的细胞群体中t细胞对靶细胞的比是约1:4。在一些实施方案中,步骤a)和/或b)的细胞群体范围为约1×103至约1×106。在一些实施方案中,步骤a)和/或b)的细胞群体范围为约1×104至约5×104。
在一些实施方案中,步骤a)的t细胞和测试细胞群体和步骤b)的t细胞和靶细胞群体与以约0.01ng/ml至约5000ng/ml,约0.05ng/ml至约5000ng/ml,约0.1ng/ml至约5000ng/ml,约0.5ng/ml至约5000ng/ml,约1ng/ml至约5000ng/ml,约5ng/ml至约5000ng/ml,约10ng/ml至约5000ng/ml,约0.01ng/ml至约4000ng/ml,约0.01ng/ml至约3000ng/ml,约0.01ng/ml至约2000ng/ml,约0.01ng/ml至约1000ng/ml,约0.01ng/ml至约500ng/ml,约0.01ng/ml至约100ng/ml,约0.01ng/ml至约50ng/ml,约0.01ng/ml至约10ng/ml,约0.01ng/ml至约5ng/ml,约0.1ng/ml至约1000ng/ml,约0.5ng/ml至约1000ng/ml,约1ng/ml至约100ng/ml,约1ng/ml至约1000ng/ml,或约5ng/ml至约5000ng/ml任一的浓度范围包含该tdb的组合物接触。
在一些实施方案中,在使该细胞与该组合物接触之后大于约1小时,2小时,3小时,4小时,5小时,6小时,7小时,8小时,9小时,10小时,12小时,16小时,20小时,或24小时任一之后检测该报告物。在一些实施方案中,在使该细胞与该组合物接触之后约1小时和约24小时,约1小时和约12小时,约1小时和约8小时,约1小时和约6小时,约1小时和约4小时,约1小时和约2小时,约4小时和约24小时,约4小时和约12小时,约4小时和约8小时,约8小时和约24小时,约8小时和约12小时,约16小时和约24小时,约16小时和约20小时,或约20小时和约24小时任一之间检测该报告物。
在一些方面,本发明提供用于确定测试细胞群体是否表达靶抗原的方法,该方法包括a)使该测试细胞群体与t细胞群体接触,其中该t细胞包含可操作连接至响应于t细胞活化的启动子和/或增强子的编码报告物的核酸;并b)使该t细胞和测试细胞群体与该tdb接触,其中该tdb包含靶抗原结合片段和tcs结合片段(诸如cd3结合片段),其中该报告物的表达指示存在由该测试细胞表达的该靶抗原。在一些实施方案中,该报告物是萤光素酶,荧光蛋白,碱性磷酸酶,β内酰胺酶,或β半乳糖苷酶。在一些实施方案中,该萤光素酶是萤火虫萤光素酶,海肾萤光素酶,或纳米萤光素酶。在一些实施方案中,该响应于t细胞活化的启动子和/或增强子是nfat启动子,ap-1启动子,nfκb启动子,foxo启动子,stat3启动子,stat5启动子或irf启动子。在一些实施方案中,该响应于t细胞活化的启动子和/或增强子包含来自nfat,ap-1,nfκb,foxo,stat3,stat5和irf中任一项或多项的t细胞活化响应性元件。在一些实施方案中,该t细胞群体是cd4+t细胞或cd8+t细胞群体。在一些实施方案中,该t细胞群体是jurkatt细胞或ctll-2t细胞群体。在一些实施方案中,该tcs结合片段是cd3结合片段。在一些实施方案中,该cd3结合片段是cd3ε结合片段。在一些实施方案中,该靶抗原在该靶细胞的表面上表达。在一些实施方案中,该靶抗原是cd4,cd8,cd18,cd19,cd11a,cd11b,cd20,cd22,cd34,cd40,cd79α(cd79a),cd79β(cd79b),egf受体,her2受体,her3受体,her4受体,fcrh5,cll1,lfa-1,mac1,p150,95,vla-4,icam-1,vcam,αv/β3整联蛋白,vegf,flk2/flt3受体;肥胖(ob)受体;mpl受体;ctla-4;蛋白c,br3,c-met,组织因子,β7,tenb2,steap,或跨膜肿瘤相关抗原(taa)。在一些实施方案中,该测试细胞群体是肿瘤细胞,免疫细胞或血管细胞群体。在一些实施方案中,该测试细胞群体不包含t细胞。在一些实施方案中,t细胞对测试细胞的比是约1:1,约1:2,约1:3,约1:4,约1:5,约1:6,约1:7,约1:8,约1:9或约1:10。在一些实施方案中,t细胞对测试细胞的比是约1:4。在一些实施方案中,该测试细胞和t细胞群体包含约1×103至约1×106个细胞。在一些实施方案中,该测试细胞和t细胞群体包含约1×104至约5×104个细胞。
在一些实施方案中,该测试细胞和t细胞群体与以约0.01ng/ml至约5000ng/ml,约0.05ng/ml至约5000ng/ml,约0.1ng/ml至约5000ng/ml,约0.5ng/ml至约5000ng/ml,约1ng/ml至约5000ng/ml,约5ng/ml至约5000ng/ml,约10ng/ml至约5000ng/ml,约0.01ng/ml至约4000ng/ml,约0.01ng/ml至约3000ng/ml,约0.01ng/ml至约2000ng/ml,约0.01ng/ml至约1000ng/ml,约0.01ng/ml至约500ng/ml,约0.01ng/ml至约100ng/ml,约0.01ng/ml至约50ng/ml,约0.01ng/ml至约10ng/ml,约0.01ng/ml至约5ng/ml,约0.1ng/ml至约1000ng/ml,约0.5ng/ml至约1000ng/ml,约1ng/ml至约100ng/ml,约1ng/ml至约1000ng/ml,或约5ng/ml至约5000ng/ml任一的浓度范围包含该tdb的组合物接触。
在一些实施方案中,在使该细胞与该组合物接触之后大于约1小时,2小时,3小时,4小时,5小时,6小时,7小时,8小时,9小时,10小时,12小时,16小时,20小时,或24小时任一之后检测该报告物。在一些实施方案中,在使该细胞与该组合物接触之后约1小时和约24小时,约1小时和约12小时,约1小时和约8小时,约1小时和约6小时,约1小时和约4小时,约1小时和约2小时,约4小时和约24小时,约4小时和约12小时,约4小时和约8小时,约8小时和约24小时,约8小时和约12小时,约16小时和约24小时,约16小时和约20小时,或约20小时和约24小时任一之间检测该报告物。
e.测定法开发
下面是开发基于细胞的测定法来检测tdb介导的t细胞活性的一种例示性但非限制性方法。
dna构建物:使用慢病毒来生成用于评估tdb双特异性抗体的效力的稳定报告t细胞系。构建慢病毒载体,其在受nfat(活化的t细胞的核因子),ap-1(fos/jun),nfat/ap1,nfκb,foxo,stat3/5,或irf的dna识别元件调节的最小tk启动子控制下表达报告物基因萤火虫萤光素酶,海肾萤光素酶,或纳米萤光素酶。用于生成稳定报告细胞系的慢病毒表达盒可以是第三代自灭活双顺反子载体,其在组成性启动子/增强子(ef1α或sv40)控制下表达各种抗生素选择标记以能够生成稳定细胞系。所使用的报告慢病毒载体是自可商购获得的载体pcdh.mcs.ef1a.puro(sbibiosciences;目录号cd510b-1)修饰的。启动子修饰包括去除cmv最小启动子和用各种增强子元件(nfat,nfκb,等)替代,添加来自prk5.cmv.萤光素酶的最小核心rna聚合酶启动子(tata盒)(osakagetal.,1996,jpharmsci1996,85:612-618)和替代来自内部dna的不同选择盒(来自prk5.tk.neo的新霉素抗性基因,来自prk5.tk.hygro的潮霉素抗性基因;和来自prk5.tk.杀稻瘟菌素的杀稻瘟菌素抗性基因)。由于并入设计成使启动子/增强子串扰最小化的dna的非编码区段,用于选择的组成性启动子对增强子元件的活化的影响是极小的。将来自prk5.cmv.萤光素酶(osaka,1996)的萤火虫萤光素酶克隆入经修饰慢病毒亲本载体的hindiii-noti位点中。其它发光蛋白(包括海肾萤光素酶和纳米萤光素酶)也可亚克隆入hindiii-noti位点中。可获得(pcmv.vsv-g)或生成(pcmv.hivδ,pcmv.rev)用于自293s(293悬浮适应细胞系)细胞的瞬时转染生成病毒原液的慢病毒包装构建物(pcmv.hivδ,pcmc.vsv-g,和pcmv.rev)。hiv菌株mn(nakamuragretal.,1993,jvirol67(10):6179-6191)可用于生成pcmv.hivδ包装载体且含有用于通过删除灭活hiv病毒包膜的内部ecori部分消化删除和出于安全目的对5'和3'ltr的修饰。通过rt-pcr自pcmv.hivδ转染的293s细胞rna克隆hivrev,并引入prk5.tk.neo的clai-xho位点中。使用vsv-g生成慢病毒报告物的准型(pseudotype)(用vsv-g替代hivenv)能够感染任何细胞类型。在stbl2感受态细胞(lifetechnologies,目录号10268-019)中扩增慢病毒表达质粒和包装构建物,并使用qiagenmaxiprep试剂盒(目录号12662)纯化dna。所有dna构建物均通过dna测序来确认。
报告物基因测定法细胞系开发:使用jurkatcd4+t细胞系(dsmz,目录号acc282)和ctll-2cd8+t细胞系(lifetechnologies,目录号k1653)来评估报告物基因测定法监测由tdb活化t细胞的可行性。构建慢病毒载体,其在受nfat(活化的t细胞的核因子),ap-1(fos/jun),nfat/ap1,nfκb,foxo,stat3,5,和irf的dna识别元件调节的最小tk启动子控制下表达报告物基因萤火虫萤光素酶,海肾萤光素酶,或纳米萤光素酶。通过瞬时转染293s细胞生成报告物基因病毒原液并用vsv-g生成准型,浓缩,并使用标准方法滴定(naldiniletal.,1996,science272:263-267)。通过旋转接种(spinoculation)以10的moi用慢病毒报告物病毒原液感染jurkatctll-2细胞,并在3天后针对抗生素抗性选择感染细胞。2周后,生成稳定池并评估对纯化的tdb的响应。使用评估拷贝数和整合的qpcr方法来证明所有稳定池稳定感染了报告物构建物。在这些实验的基础上,建立jurkat/nfκb-萤光素酶和jurkat/nfat-萤光素酶的有限稀释以实现单细胞克隆和单一稳定报告细胞系的生成。
t细胞活化测定法的开发和评估:为了量化tdb介导的t细胞活化的效力,将对与jurkat/nfκb-萤火虫萤光素酶效应细胞和靶细胞群体一起温育的多种稀释度的tdb测试样品观察到的萤光素酶活性的量与对参照tdb观察到的萤光素酶活性比较。自通过使用该参照tdb生成的标准曲线确定该测试tdb样品的相对效力。
iii.非基于细胞的报告物测定法
本发明在一些方面提供非基于细胞的测定法来检测靶抗原和tcs(诸如cd3亚基)的同时tdb结合,其中该tdb的一种抗原结合片段结合该靶抗原且另一种抗原结合片段结合该tcs。该tdb对t细胞受体(tcr)复合物亚基(诸如cd3亚基,例如cd3ε)和在靶细胞的表面上表达的靶抗原的同时结合导致tcr簇集,引起t细胞活化和靶细胞的细胞毒性消减。这些非基于细胞的测定法充当t细胞活化的替代度量。
在一些实施方案中,本发明提供检测tdb对靶抗原和tcs(诸如cd3亚基)的同时结合的方法,其中该tdb的一种抗原结合片段结合该靶抗原上的第一表位且另一种抗原结合片段结合该tcs上的第二表位,该方法包括实施基于elisa的桥接结合测定法,其使用固定化的该靶抗原或其包含该第一表位的片段,和生物素和该tcs或其包含该第二表位的片段的缀合物。在一些实施方案中,该第一表位局限于该靶抗原的细胞外部分和/或该第二表位局限于该tcs的细胞外部分。
在一些实施方案中,本发明提供检测tdb对靶抗原和tcs(诸如cd3亚基)的同时结合的方法,其中该tdb的一种抗原结合片段结合该靶抗原上的第一表位且另一种抗原结合片段结合该tcs上的第二表位,该方法包括a)将该靶抗原或其包含该第一表位的片段固定化至固相;b)将该tdb与固定化至该固相的该靶抗原或其包含该第一表位的片段一起温育;c)将该tdb与报告物分子和该tcs或其包含该第二表位的片段的缀合物(生物素-tcs缀合物)一起温育;d)任选将该报告物-tcs缀合物与检测该报告物分子所需要的附属分子一起温育;e)去除未结合至该固相的分子(诸如通过清洗);并f)使用检测剂检测结合至该固相的该报告物分子,由此检测该tdb对该靶抗原和该tcs的同时结合。在一些实施方案中,本发明提供检测tdb对靶抗原和tcs(诸如cd3亚基)的同时结合的方法,其中该tdb的一种抗原结合片段结合该靶抗原上的第一表位且另一种抗原结合片段结合该tcs上的第二表位,该方法包括a)将该靶抗原或其包含该第一表位的片段固定化至固相;b)将该tdb与固定化至该固相的该靶抗原或其包含该第一表位的片段一起温育;c)将该tdb与生物素和该tcs或其包含该第二表位的片段的缀合物(生物素-tcs缀合物)一起温育;d)将该生物素-tcs缀合物与链霉亲合素-hrp缀合物一起温育;e)去除未结合至该固相的分子(诸如通过清洗);并f)使用检测剂检测结合至该固相的hrp,由此检测该tdb对该靶抗原和该tcs的同时结合。各温育步骤之间可包括清洗步骤以去除未结合至该固相的分子。在一些实施方案中,温育步骤独立进行约1小时,2小时,3小时,4小时,5小时,6小时,7小时,8小时,9小时,10小时,12小时,16小时,20小时,24小时,或更久任一,包括这些值之间的任何范围。在一些实施方案中,该tcs是cd3亚基。在一些实施方案中,该cd3亚基是cd3ε。在一些实施方案中,该靶抗原在细胞的表面上表达。在一些实施方案中,该靶抗原是cd4,cd8,cd18,cd19,cd11a,cd11b,cd20,cd22,cd34,cd40,cd79α(cd79a),cd79β(cd79b),egf受体,her2受体,her3受体,her4受体,fcrh5,cll1,lfa-1,mac1,p150,95,vla-4,icam-1,vcam,αv/β3整联蛋白,vegf,flk2/flt3受体;肥胖(ob)受体;mpl受体;ctla-4;蛋白c,br3,c-met,组织因子,β7,tenb2,steap,或跨膜肿瘤相关抗原(taa)。在一些实施方案中,该第一表位局限于该靶抗原的细胞外部分和/或该第二表位局限于该tcs的细胞外部分。
在一些实施方案中,温育步骤中包括的该tdb处于约0.01ng/ml至约100μg/ml,约0.05ng/ml至约100μg/ml,约0.1ng/ml至约100μg/ml,约0.5ng/ml至约100μg/ml,约1ng/ml至约100μg/ml,约5ng/ml至约100μg/ml,约10ng/ml至约100μg/ml,约0.01ng/ml至约50μg/ml,约0.01ng/ml至约10μg/ml,约0.01ng/ml至约1μg/ml,约0.01ng/ml至约100ng/ml,约0.01ng/ml至约50ng/ml,约0.01ng/ml至约10ng/ml,约0.01ng/ml至约0.1ng/ml,约0.01ng/ml至约0.05ng/ml,约0.01ng/ml至约0.05ng/ml,约0.1ng/ml至约1μg/ml,约0.5ng/ml至约1μg/ml,约1ng/ml至约100ng/ml,约1ng/ml至约1μg/ml,或约5ng/ml至约5μg/ml任一的浓度范围。
在一些实施方案中,本发明提供量化tdb对靶抗原和tcs(诸如cd3亚基)的同时结合的方法,其中该tdb的一种抗原结合片段结合该靶抗原上的第一表位且另一种抗原结合片段结合该tcs上的第二表位,该方法包括a)将该靶抗原或其包含该第一表位的片段固定化至固相;b)将该tdb与固定化至该固相的该靶抗原或其包含该第一表位的片段一起温育;c)将该tdb与报告物和该tcs或其包含该第二表位的片段的缀合物(例如生物素-tcs缀合物)一起温育;d)任选将该报告物-tcs缀合物与附属报告物分子一起温育;e)去除未结合至该固相的分子(诸如通过清洗);f)使用检测剂检测结合至该固相的报告物;并g)通过比较该检测剂的信号强度与使用参照tdb生成的标准来确定该tdb的相对效力。在一些实施方案中,本发明提供量化tdb对靶抗原和tcs(诸如cd3亚基)的同时结合的方法,其中该tdb的一种抗原结合片段结合该靶抗原上的第一表位且另一种抗原结合片段结合该tcs上的第二表位,该方法包括a)将该靶抗原或其包含该第一表位的片段固定化至固相;b)将该tdb与固定化至该固相的该靶抗原或其包含该第一表位的片段一起温育;c)将该tdb与生物素和该tcs或其包含该第二表位的片段的缀合物(生物素-tcs缀合物)一起温育;d)将该生物素-tcs缀合物与链霉亲合素-hrp缀合物一起温育;e)去除未结合至该固相的分子(诸如通过清洗);f)使用检测剂检测结合至该固相的hrp;并g)通过比较该检测剂的信号强度与使用参照tdb生成的标准来确定该tdb的相对效力。在一些实施方案中,比较信号强度包括为该tdb和该参照tdb中每一项生成剂量-响应曲线,并确定自该曲线推导的ec50值之间的比。各温育步骤之间可包括清洗步骤以去除未结合至该固相的分子。在一些实施方案中,温育步骤独立进行约1小时,2小时,3小时,4小时,5小时,6小时,7小时,8小时,9小时,10小时,12小时,16小时,20小时,24小时,或更久任一,包括这些值之间的任何范围。在一些实施方案中,该tcs是cd3亚基。在一些实施方案中,该cd3亚基是cd3ε。在一些实施方案中,该靶抗原在细胞的表面上表达。在一些实施方案中,该靶抗原是cd4,cd8,cd18,cd19,cd11a,cd11b,cd20,cd22,cd34,cd40,cd79α(cd79a),cd79β(cd79b),egf受体,her2受体,her3受体,her4受体,fcrh5,cll1,lfa-1,mac1,p150,95,vla-4,icam-1,vcam,αv/β3整联蛋白,vegf,flk2/flt3受体;肥胖(ob)受体;mpl受体;ctla-4;蛋白c,br3,c-met,组织因子,β7,tenb2,steap,或跨膜肿瘤相关抗原(taa)。在一些实施方案中,该第一表位局限于该靶抗原的细胞外部分和/或该第二表位局限于该tcs的细胞外部分。
在一些实施方案中,温育步骤中包括的该tdb处于约0.01ng/ml至约100μg/ml,约0.05ng/ml至约100μg/ml,约0.1ng/ml至约100μg/ml,约0.5ng/ml至约100μg/ml,约1ng/ml至约100μg/ml,约5ng/ml至约100μg/ml,约10ng/ml至约100μg/ml,约0.01ng/ml至约50μg/ml,约0.01ng/ml至约10μg/ml,约0.01ng/ml至约1μg/ml,约0.01ng/ml至约100ng/ml,约0.01ng/ml至约50ng/ml,约0.01ng/ml至约10ng/ml,约0.01ng/ml至约0.1ng/ml,约0.01ng/ml至约0.05ng/ml,约0.01ng/ml至约0.05ng/ml,约0.1ng/ml至约1μg/ml,约0.5ng/ml至约1μg/ml,约1ng/ml至约100ng/ml,约1ng/ml至约1μg/ml,或约5ng/ml至约5μg/ml任一的浓度范围。
在一些实施方案中,来自该参照tdb的标准曲线是通过温育范围为约0.01ng/ml至100μg/ml任一的多种浓度的该参照tdb生成的。在一些实施方案中,参照tdb的多种浓度包括约0.01ng/ml,0.1ng/ml,1ng/ml,10ng/ml,100ng/ml,250ng/ml,500ng/ml,1μg/ml,2.5μg/ml,5μg/ml,10μg/ml,25μg/ml,50μg/ml,100μg/ml,250μg/ml,或500μg/ml任一。在一些实施方案中,参照tdb的多种浓度是约3,4,5,6,7,8,9,10或大于10种浓度。
iv.试剂盒
在本发明的一些方面,提供了供牵涉包含靶抗原结合片段和tcs结合片段(诸如cd3结合片段)的tdb的各种方法中使用的试剂盒或制品,其包含装有包含如本文中描述的包含可操作连接至响应于t细胞活化的启动子和/或增强子的编码报告物的核酸的工程化t细胞的组合物的容器,而且任选提供关于其使用的用法说明书。在一些实施方案中,该试剂盒进一步包含装有参照tdb测定标准品(已知浓度的纯化的tdb)的容器,和/或装有tdb对照的容器。在一些实施方案中,该试剂盒进一步包含装有包含表达该靶抗原的靶细胞的组合物的容器。在一些实施方案中,该报告物是萤光素酶,荧光蛋白,碱性磷酸酶,β内酰胺酶,或β半乳糖苷酶。在一些实施方案中,该萤光素酶是萤火虫萤光素酶,海肾萤光素酶,或纳米萤光素酶。在一些实施方案中,该响应于t细胞活化的启动子和/或增强子是nfat启动子,ap-1启动子,nfκb启动子,foxo启动子,stat3启动子,stat5启动子或irf启动子。在一些实施方案中,该响应于t细胞活化的启动子和/或增强子包含来自nfat,ap-1,nfκb,foxo,stat3,stat5和irf中任一项或多项的t细胞活化响应性元件。在一些实施方案中,该工程化t细胞是cd4+t细胞或cd8+t细胞。在一些实施方案中,该工程化t细胞是jurkatt细胞或ctll-2t细胞。在一些实施方案中,该tcs结合片段是cd3结合片段。在一些实施方案中,该cd3结合片段是cd3ε结合片段。在一些实施方案中,该靶抗原在该靶细胞的表面上表达。在一些实施方案中,该靶抗原是cd4,cd8,cd18,cd19,cd11a,cd11b,cd20,cd22,cd34,cd40,cd79α(cd79a),cd79β(cd79b),egf受体,her2受体,her3受体,her4受体,fcrh5,cll1,lfa-1,mac1,p150,95,vla-4,icam-1,vcam,αv/β3整联蛋白,vegf,flk2/flt3受体;肥胖(ob)受体;mpl受体;ctla-4;蛋白c,br3,c-met,组织因子,β7,tenb2,steap,或跨膜肿瘤相关抗原(taa)。在一些实施方案中,a)该靶抗原是her2受体且该靶细胞是bt-474细胞,b)该靶抗原是her2受体且该靶细胞是skbr3细胞,c)该靶抗原是cd20且该靶细胞是wil2-s细胞,或d)该靶抗原是cd79b且该靶细胞是bjab细胞。该容器装有配制剂,而且该容器上或与该容器关联的标签可指示关于使用的用法说明书。该制品可进一步包括从商业和使用者立场看想要的其它材料,包括其它缓冲剂,稀释剂,培养器皿,用于检测报告物分子的试剂,和印有关于使用的用法说明书的包装插页。
在本发明的一些方面,提供了试剂盒或制品,其包含装有包含与生物素缀合的tcs(诸如cd3亚基)或其片段的组合物的容器,而且任选提供关于其使用的用法说明书。在一些实施方案中,该tcs是cd3亚基。在一些实施方案中,该cd3亚基是cd3ε。在一些实施方案中,该试剂盒进一步提供靶抗原或其片段。在一些实施方案中,该靶抗原在细胞的表面上表达。在一些实施方案中,该靶抗原是cd4,cd8,cd18,cd19,cd11a,cd11b,cd20,cd22,cd34,cd40,cd79α(cd79a),cd79β(cd79b),egf受体,her2受体,her3受体,her4受体,fcrh5,cll1,lfa-1,mac1,p150,95,vla-4,icam-1,vcam,αv/β3整联蛋白,vegf,flk2/flt3受体;肥胖(ob)受体;mpl受体;ctla-4;蛋白c,br3,c-met,组织因子,β7,tenb2,steap,或跨膜肿瘤相关抗原(taa)。在一些实施方案中,该试剂盒进一步提供参照tdb测定标准品(已知浓度的纯化的tdb)和/或tdb对照。该容器装有配制剂,而且该容器上或与该容器关联的标签可指示关于使用的用法说明书。该制品可进一步包括从商业和使用者立场看想要的其它材料,包括其它缓冲剂,稀释剂,培养器皿,用于检测报告物分子的试剂,和印有关于使用的用法说明书的包装插页。
vi.多肽
通常使用重组技术产生待使用本文所述的方法分析的多肽。用于产生重组蛋白的方法描述于例如,美国专利号5,534,615和4,816,567中,所述专利特定地通过援引并入本文。在一些实施方案中,感兴趣的蛋白质在cho细胞中产生(参见,例如wo94/11026)。在一些实施方案中,感兴趣的多肽在大肠杆菌细胞中产生。参见,例如,美国专利号5,648,237;美国专利号5,789,199和美国专利号5,840,523,其描述了用于优化表达和分泌的翻译起始区(tir)和信号序列。还参见charlton,methodsinmolecularbiology,第248卷(b.k.c.lo编,humanapress,totowa,n.j.,2003),第245-254页,其描述了抗体片段在大肠杆菌中的表达。当使用重组技术时,多肽可在细胞内,在周质空间中产生,或直接分泌到培养基中。
可从培养基或从宿主细胞裂解液回收多肽。可通过各种物理或化学手段(诸如冻融循环,超声处理,机械破碎或细胞裂解剂)来破坏多肽表达中采用的细胞。如果多肽在细胞内产生,那么作为第一个步骤,例如通过离心或超滤去除微粒状碎片(宿主细胞或裂解的片段)。carter等,bio/technology10:163-167(1992)描述了用于分离分泌到大肠杆菌周质空间的多肽的程序。简而言之,在约30分钟内将细胞浆在乙酸钠(ph3.5),edta和苯甲基磺酰氟(pmsf)存在下解冻。可通过离心去除细胞碎片。当多肽被分泌至培养基中时,通常首先使用可商购获得的多肽浓缩过滤器(例如amicon或milliporepellicon超滤单元)浓缩来自此类表达系统的上清液。可在任何前述步骤中纳入蛋白酶抑制剂(如pmsf)以抑制蛋白水解并且可纳入抗生素以防止外来污染物的生长。
在一些实施方案中,包含多肽和一种或多种污染物的组合物中的所述多肽在通过本发明方法分析之前已经纯化或部分纯化。例如,所述方法的多肽在来自亲和色谱法,阳离子交换色谱法,阴离子交换色谱法,混合模式色谱法和疏水作用色谱法的洗脱液中。在一些实施方案中,多肽在来自蛋白质a色谱法的洗脱液中。
可通过本发明的方法分析的多肽的实例包括但不限于免疫球蛋白,免疫粘附素,抗体,酶,激素,融合蛋白,含fc的蛋白,免疫缀合物,细胞因子和白细胞介素。
(a)抗体
在本文所述的任何方法的一些实施方案中,在通过本文所述的方法分析多肽和包含所述多肽的制剂的任何方法中使用的多肽是抗体。在一些实施方案中,所述多肽是t细胞依赖性双特异性(tdb)抗体。
抗体的分子靶标包括cd蛋白及其配体,诸如但不限于:(i)cd3,cd4,cd8,cd19,cd11a,cd20,cd22,cd34,cd40,cd79α(cd79a)和cd79β(cd79b);(ii)erbb受体家族成员,诸如egf受体,her2,her3或her4受体;(iii)细胞粘附分子,诸如lfa-1,mac1,p150,95,vla-4,icam-1,vcam和αv/β3整联蛋白,包括其α或β亚基(例如,抗cd11a,抗cd18或抗cd11b抗体);(iv)生长因子,诸如vegf;ige;血型抗原;flk2/flt3受体;肥胖(ob)受体;mpl受体;ctla-4;蛋白c,br3,c-met,组织因子,β7等;(v)细胞表面和跨膜肿瘤相关抗原(taa),诸如美国专利号7,521,541中所述的那些,以及(vi)其它靶标,诸如fcrh5,lypd1,tenb2和steap。在一些实施方案中,所述抗体是抗cd20/抗cd3抗体。示例性双特异性抗体提供于表1中。
表1:示例性抗体
其它示例性抗体包括选自但不限于以下各项的那些:抗雌激素受体抗体,抗孕酮受体抗体,抗p53抗体,抗her-2/neu抗体,抗egfr抗体,抗组织蛋白酶d抗体,抗bcl-2抗体,抗e-钙粘蛋白抗体,抗ca125抗体,抗ca15-3抗体,抗ca19-9抗体,抗c-erbb-2抗体,抗p-糖蛋白抗体,抗cea抗体,抗成视网膜细胞瘤蛋白抗体,抗ras癌蛋白抗体,抗路易斯x抗体,抗ki-67抗体,抗pcna抗体,抗cd3抗体,抗cd4抗体,抗cd5抗体,抗cd7抗体,抗cd8抗体,抗cd9/p24抗体,抗cd10抗体,抗cd11a抗体,抗cd11c抗体,抗cd13抗体,抗cd14抗体,抗cd15抗体,抗cd19抗体,抗cd20抗体,抗cd22抗体,抗cd23抗体,抗cd30抗体,抗cd31抗体,抗cd33抗体,抗cd34抗体,抗cd35抗体,抗cd38抗体,抗cd41抗体,抗lca/cd45抗体,抗cd45ro抗体,抗cd45ra抗体,抗cd39抗体,抗cd100抗体,抗cd95/fas抗体,抗cd99抗体,抗cd106抗体,抗泛素抗体,抗cd71抗体,抗c-myc抗体,抗细胞角蛋白抗体,抗波形蛋白抗体,抗hpv蛋白抗体,抗κ轻链抗体,抗λ轻链抗体,抗黑素体抗体,抗前列腺特异性抗原抗体,抗s-100抗体,抗tau抗原抗体,抗纤维蛋白抗体,抗角蛋白抗体,抗tebb2抗体,抗steap抗体,和抗tn-抗原抗体。
(i)单克隆抗体
在一些实施方案中,抗体是单克隆抗体。单克隆抗体是从大致上均质抗体群体获得的,即除在产生单克隆抗体期间出现的可能变体(此类变体一般以少量存在)之外,构成所述群体的抗体个体是相同的和/或结合相同表位。因此,修饰语“单克隆”表明抗体的特征不是离散或多克隆抗体的混合物。
例如,单克隆抗体可使用最初由kohler等,nature256:495(1975)描述的杂交瘤方法制备,或者可通过重组dna方法(美国专利号4,816,567)制备。
在杂交瘤方法中,使小鼠或其它适当的宿主动物(诸如仓鼠)如本文所述那样免疫以得到产生或能够产生将特异性结合用于免疫的多肽的抗体的淋巴细胞。另选地,可体外免疫淋巴细胞。然后,使用合适的融合剂(诸如聚乙二醇)使淋巴细胞与骨髓瘤细胞融合以形成杂交瘤细胞(goding,monoclonalantibodies:principlesandpractice,第59-103页(academicpress,1986))。
接种所制备的杂交瘤细胞,并使之在优选含有一种或多种抑制未融合的亲本骨髓瘤细胞生长或存活的物质的合适的培养基中生长。例如,如果亲本骨髓瘤细胞缺乏酶次黄嘌呤鸟嘌呤磷酸核糖基转移酶(hgprt或hprt),那么用于杂交瘤的培养基通常将包括次黄嘌呤,氨基蝶呤和胸苷(hat培养基),所述物质阻止缺乏hgprt的细胞的生长。
在一些实施方案中,骨髓瘤细胞是那些有效融合,支持通过所选择的抗体产生细胞的稳定高水平抗体产生,且对培养基(诸如hat培养基)敏感的骨髓瘤细胞。在一些实施方案中,在这些细胞系中,骨髓瘤细胞细胞系是鼠类骨髓瘤细胞系,诸如源自可以从salkinstitutecelldistributioncenter,sandiego,californiausa获得的mopc-21和mpc-11小鼠肿瘤的细胞系和可以从americantypeculturecollection,rockville,marylandusa获得的sp-2或x63-ag8-653细胞。人骨髓瘤和小鼠-人异源骨髓瘤细胞系还被描述用于人单克隆抗体的产生(kozbor,j.immunol.,133:3001(1984);brodeur等,monoclonalantibodyproductiontechniquesandapplications第51-63页(marceldekker,inc.,newyork,1987))。
测定杂交瘤细胞生长所处的培养基中针对抗原的单克隆抗体的产生。在一些实施方案中,通过免疫沉淀法或通过体外结合测定(如放射免疫测定(ria)或酶联免疫吸附测定(elisa))来测定杂交瘤细胞产生的单克隆抗体的结合特异性。
单克隆抗体的结合亲和力可例如通过munson等,anal.biochem.107:220(1980)的斯卡查德分析来确定。
在鉴定产生具有所需特异性,亲和力和/或活性的抗体的杂交瘤细胞之后,可通过限制稀释程序对克隆进行亚克隆并且通过标准方法(goding,monoclonalantibodies:principlesandpractice,第59-103页(academicpress,1986))进行培养。适用于这个目的培养基包括例如d-mem或rpmi-1640培养基。此外,杂交瘤细胞可作为动物体内的腹水肿瘤在体内生长。
由亚克隆分泌的单克隆抗体通过常规免疫球蛋白纯化程序(例如像多肽a-琼脂糖,羟基磷灰石色谱法,凝胶电泳,透析或亲和色谱法)从培养基,腹水或血清适当地分离。
编码单克隆抗体的dna容易分离并且使用常规程序(例如,通过使用能够特异性结合至编码鼠科抗体的重链和轻链的基因的寡核苷酸探针)来测序。在一些实施方案中,杂交瘤细胞充当这种dna的来源。一旦分离,dna可安置于表达载体中,然后转染至否则不产生免疫球蛋白多肽的宿主细胞(诸如大肠杆菌细胞,猿cos细胞,中国仓鼠卵巢(cho)细胞或骨髓瘤细胞)中,以获得单克隆抗体在重组宿主细胞中的合成。关于编码抗体的dna在细菌中的重组表达的综述包括skerra等,curr.opinioninimmunol.5:256-262(1993)和plückthun,immunol.revs.,130:151-188(1992)。
在另一个实施方案中,抗体或抗体片段可从使用mccafferty等,nature348:552-554(1990)中描述的技术产生的抗体噬菌体文库分离。clackson等,nature352:624-628(1991)和marks等,j.mol.biol.222:581-597(1991)分别描述了使用噬菌体文库分离鼠和人抗体。随后的出版物描述通过链替换(chainshuffling)(marks等,bio/technology10:779-783(1992)),以及组合感染和体内重组作为构建非常大的噬菌体文库的策略(waterhouse等,nuc.acids.res.21:2265-2266(1993))生成高亲和性(nm范围)的人抗体。因此,这些技术为用于分离单克隆抗体的传统单克隆抗体杂交瘤技术的适宜供选方案。
还可修饰dna,例如通过取代人重链和轻链恒定结构域的编码序列代替同源鼠科序列(美国专利号4,816,567;morrison等,proc.natlacad.sci.usa81:6851(1984)),或将非免疫球蛋白多肽的编码序列的全部或一部分共价连接至免疫球蛋白编码序列。
通常,此类非免疫球蛋白多肽取代抗体的恒定结构域,或者它们取代抗体的一个抗原结合位点的可变结构域以产生嵌合二价抗体,其包括具有针对抗原的特异性的一个抗原结合位点和具有针对不同抗原的特异性的另一个抗原结合位点。
在本文所述的任何方法的一些实施方案中,抗体是iga,igd,ige,igg或igm。在一些实施方案中,抗体是igg单克隆抗体。
(ii)人源化抗体
在一些实施方案中,抗体是人源化抗体。人源化非人抗体的方法已在本领域中描述。在一些实施方案中,人源化抗体具有从非人来源引入其中的一个或多个氨基酸残基。这些非人氨基酸残基通常被称为“输入”残基,其通常取自“输入”可变结构域。人源化可基本上按照winter和合作者的方法(jones等,nature321:522-525(1986);riechmann等,nature332:323-327(1988);verhoeyen等,science239:1534-1536(1988)),通过用高变区序列取代人抗体的对应序列来进行。因此,此类“人源化”抗体是嵌合抗体(美国专利号4,816,567),其中实质性小于完整的人可变结构域已被来自非人物种的对应序列取代。实际上,人源化抗体通常是人抗体,其中一些高变区残基和可能一些fr残基被来自啮齿动物抗体中的类似位点的残基取代。
用于制备人源化抗体的人可变结构域轻链与重链二者的选择对降低抗原性来说是非常重要的。根据所谓的“最佳拟合”方法,针对已知的人可变域序列的整个文库筛选啮齿动物抗体的可变结构域的序列。然后接受与啮齿动物的序列最接近的人序列作为人源化抗体的人框架区(fr)(sims等,j.immunol.151:2296(1993);chothia等,j.mol.biol.196:901(1987))。另一种方法使用衍生自轻链或重链可变区的特定亚组的所有人抗体的共有序列的特定框架区。相同的构架可以用于几种不同的人源化抗体(carter等,proc.natl.acad.sci.usa89:4285(1992);presta等,j.immunol.151:2623(1993))。
还重要的是,抗体被人源化成保留对抗原的高亲和力和其它有利的生物学特性。为了实现这一目标,在所述方法的一些实施方案中,使用亲本序列和人源化序列的三维模型通过亲本序列和各种概念上人源化的产物的分析方法制备人源化抗体。三维免疫球蛋白模型通常是可用的并且是本领域技术人员熟悉的。可用计算机程序来说明和展示所选择的候选免疫球蛋白序列的可能的三维构象结构。这些展示的检查允许分析残基在候选免疫球蛋白序列的功能中的可能作用,即分析影响候选免疫球蛋白结合其抗原的能力的残基。以这种方式,可从接受者和输入序列中选择并并入fr残基,从而实现所需的抗体特征,诸如增加的对靶抗原的亲和力。通常,高变区残基直接且最实质上地涉及影响抗原结合。
(iii)人抗体
在一些实施方案中,抗体是人抗体。作为人源化的替代方案,可产生人抗体。例如,现在有可能产生在不存在内源性免疫球蛋白产生的情况下在免疫之后能够产生人抗体的全谱的转基因动物(例如,小鼠)。例如,已经描述了在嵌合和种系突变小鼠中抗体重链连接区(jh)基因的纯合子删除导致完全抑制内源性抗体产生。人种系免疫球蛋白基因阵列在这种种系突变小鼠中的转移将导致在抗原激发后产生人抗体。参见例如,jakobovits等,proc.natl.acad.sci.usa90:2551(1993);jakobovits等,nature362:255-258(1993);bruggermann等,yearinimmuno.7:33(1993);和美国专利号5,591,669;5,589,369;和5,545,807。
另选地,噬菌体展示技术((mccafferty等,nature348:552-553(1990))可用于从未免疫供体的免疫球蛋白可变(v)结构域基因全集中体外产生人抗体和抗体片段。根据此技术,将抗体v结构域基因框内克隆到丝状噬菌体(诸如m13或fd)的主要或次要外壳多肽基因中,并且在噬菌体颗粒的表面上展示为功能性抗体片段。因为丝状颗粒含有噬菌体基因组的单链dna拷贝,所以基于抗体的功能特性进行选择也导致选择编码呈现所述特性的抗体的基因。因此,噬菌体模拟b细胞的一些特性。可在各种形式下进行噬菌体展示,对于它们的综述,参见例如,johnson,kevins.和chiswell,davidj.,currentopinioninstructuralbiology3:564-571(1993)。v基因片段的几个来源可用于噬菌体展示。clackson等,nature352:624-628(1991)从衍生自免疫小鼠脾脏的v基因小随机组合文库中分离了一系列不同的抗噁唑酮抗体。可构建来自未免疫的人供体的v基因全集,并且可基本上按照由marks等,j.mol.biol.222:581-597(1991)或griffith等,emboj.12:725-734(1993)描述的技术分离针对一系列不同抗原(包括自身抗原)的抗体。还可参见美国专利号5,565,332和5,573,905。
还可由体外活化的b细胞来产生人抗体(参见美国专利5,567,610和5,229,275)。
(iv)抗体片段
在一些实施方案中,抗体是抗体片段。已经开发了各种技术用于产生抗体片段。传统上,这些片段通过完整抗体的蛋白水解消化而产生(参见例如,morimoto等,journalofbiochemicalandbiophysicalmethods24:107-117(1992)和brennan等,science229:81(1985))。然而,现在可由重组宿主细胞直接产生这些片段。例如,可从上面讨论的抗体噬菌体文库中分离抗体片段。另选地,fab'-sh片段可直接从大肠杆菌中回收并且化学偶联以便形成f(ab)2片段(carter等,bio/technology10:163-167(1992))。根据另一种方法,f(ab')2片段可直接从重组宿主细胞培养物中分离。用于产生抗体片段的其它技术对于熟练从业人员将为明显的。在其它实施方案中,所选择的抗体为单链fv片段(scfv)。参见wo93/16185;美国专利号5,571,894;和美国专利号5,587,458。例如,抗体片段还可以是“线性抗体”,例如,如美国专利5,641,870中所述。此类线性抗体片段可以是单特异性的或双特异性的。
在一些实施方案中,提供了本文所述抗体的片段。在一些实施方案中,抗体片段是抗原结合片段。在一些实施方案中,抗原结合片段选自由以下各项组成的组:fab片段,fab’片段,f(ab’)2片段,scfv,fv和双抗体。
(v)双特异性抗体
在一些实施方案中,抗体是双特异性抗体。双特异性抗体是具有针对至少两个不同表位的结合特异性的抗体。示例性双特异性抗体可结合两个不同表位。另选地,双特异性抗体结合臂可与结合白细胞上的触发分子(诸如t细胞受体分子(例如cd2或cd3))或igg的fc受体(fcγr)(诸如fcγri(cd64),fcγrii(cd32)和fcγriii(cd16))的臂组合,从而将细胞防御机制集中到细胞。双特异性抗体可制备成全长抗体或抗体片段(例如f(ab')2双特异性抗体)。在一些实施方案中,抗体是t细胞依赖性双特异性(tdb)抗体。在一些实施方案中,tdb包含靶抗原结合片段和t细胞受体结合片段。在一些实施方案中,tdb包含靶抗原结合片段和cd3结合片段。在一些实施方案中,tdb包含靶抗原结合片段和cd3ε结合片段。
制备双特异性抗体的方法在本领域中是已知的。全长双特异性抗体的传统生产是基于两个免疫球蛋白重链-轻链对的共同表达,其中两个链具有不同特异性(millstein等,nature305:537-539(1983))。由于免疫球蛋白重链和轻链的随机分配,这些杂交瘤(四价体瘤)产生10种不同抗体分子的潜在混合物,其中仅一种具有正确的双特异性结构。通常由亲和色谱法步骤完成的正确分子的纯化是相当麻烦的,并且产物产率低。wo93/08829和traunecker等,emboj.,10:3655-3659(1991)中公开了类似的程序。
根据不同的方法,具有所需结合特异性(抗体-抗原结合位点)的抗体可变结构域融合至免疫球蛋白恒定结构域序列。在一些实施方案中,所述融合是与包含铰链区,ch2区和ch3区的至少一部分的免疫球蛋白重链恒定结构域。在一些实施方案中,含有轻链结合所必需的位点的第一重链恒定区(ch1)存在于融合体的至少一种中。将编码免疫球蛋白重链融合和(如果需要的话)免疫球蛋白轻链的dna插入单独表达载体,并且共同转染至合适的宿主生物中。当在构建中使用的三条多肽链的不等比率提供最佳产率时,这在实施方案中提供了调节三种多肽片段的相互比例的大的灵活性。然而,当相等比率的至少两个多肽链的表达导致高产率或当所述比率没有特定意义时,可将两个或所有三个多肽链的编码序列插入一个表达载体中。
在此方法的一些实施方案中,双特异性抗体由在一个臂中具有第一结合特异性的杂合免疫球蛋白重链和在另一个臂中的杂合免疫球蛋白重链-轻链对(提供第二结合特异性)组成。据发现这种不对称结构有利于从不需要的免疫球蛋白链组合中分离所需的双特异性化合物,因为免疫球蛋白轻链在仅一半双特异性分子中的存在提供了容易的分离方式。这种方法在wo94/04690中公开。关于产生双特异性抗体的更多细节,参见例如,suresh等,methodsinenzymology121:210(1986)。
根据在美国专利号5,731,168中描述的另一种方法,一对抗体分子之间的界面可经过工程化以便将从重组细胞培养物回收的异二聚体的比例最大化。在一些实施方案中,界面包含抗体恒定结构域的ch3结构域的至少一部分。在此方法中,第一抗体分子的界面的一个或多个小氨基酸侧链用更大侧链(例如,酪氨酸或色氨酸)来替换。在第二抗体分子的界面上通过将大氨基酸侧链用更小的氨基酸侧链(例如,丙氨酸或苏氨酸)来替换而产生具有与大侧链相同或相似的尺寸的补偿性“腔穴”。这提供了增加异二聚体的产率超过其它不需要的最终产物如同二聚体的机制。
双特异性抗体包括交联或“异源缀合物”抗体。举例来说,异源缀合物中的一个抗体可偶联至亲合素,另一个抗体可连接至生物素。例如,此类抗体已经被提出用于将免疫系统细胞靶向不需要的细胞(美国专利号4,676,980),并且用于治疗hiv感染(wo91/00360,wo92/200373和ep03089)。异源缀合物抗体可使用任何便利的交联方法来制成。合适交联剂在本领域中是熟知的,并且与许多交联技术一起在美国专利号4,676,980中公开。
用于从抗体片段产生双特异性抗体的技术也已经在文献中描述。例如,可使用化学连接来制备双特异性抗体。brennan等,science229:81(1985)描述了一种方法,其中完整抗体被蛋白水解裂解以产生f(ab')2片段。在二硫醇络合剂亚砷酸钠的存在下,这些片段被还原,以稳定邻近的二硫醇并且防止分子间二硫化物形成。然后将产生的fab'片段转化为硫代硝基苯甲酸(tnb)衍生物。然后通过用巯基乙胺还原将fab'-tnb衍生物中的一种再转化为fab'-硫醇,并且将其与等摩尔量的其它fab'-tnb衍生物混合以形成双特异性抗体。所产生的双特异性抗体可用作选择性固定酶的试剂。
也已描述直接自重组细胞培养物制备和分离双特异性抗体片段的各种技术。举例而言,已使用亮氨酸拉链产生双特异性抗体。kostelny等,j.immunol.148(5):1547-1553(1992)。来自fos和jun蛋白的亮氨酸拉链肽通过基因融合连接至两种不同抗体的fab'部分。抗体同二聚体在铰链区被还原以形成单体,然后再氧化以形成抗体异二聚体。此方法也可以用于产生抗体同二聚体。由hollinger等,proc.natl.acad.sci.usa90:6444-6448(1993)描述的“双抗体”技术已经提供了制备双特异性抗体片段的另选机制。这些片段包括通过接头连接至轻链可变结构域(vl)的重链可变结构域(vh),所述接头太短而不允许同一链上的两个域之间配对。因此,一个片段的vh和vl结构域被迫与另一个片段的互补vl和vh结构域配对,从而形成两个抗原结合位点。也已报道通过使用单链fv(sfv)二聚体制备双特异性抗体片段的另一策略。参见gruber等,j.immunol.152:5368(1994)。
涵盖具有超过两个价态的抗体。例如,可制备三特异性抗体。tutt等,j.immunol.147:60(1991)。
(v)多价抗体
在一些实施方案中,抗体是多价抗体。与二价抗体相比,多价抗体可由表达抗体所结合的抗原的细胞来更快地内在化(和/或异化)。本文提供的抗体可以是具有三个或更多个抗原结合位点的多价抗体(例如,四价抗体)(不同于igm类),其可通过重组表达编码抗体的多肽链的核酸容易地产生。多价抗体可包含二聚化域和三个或更多个抗原结合位点。优选的二聚化结构域包括fc区或铰链区(或由所述区组成)。在这种情况下,抗体将包含fc区和在fc区的氨基末端的三个或更多个抗原结合位点。本文优选的多价抗体包含三个至约八个(但优选四个)抗原结合位点(或由所述抗原结合位点组成)。多价抗体包含至少一条多肽链(并且优选两条多肽链),其中多肽链包含两个或更多个可变结构域。例如,多肽链可包括vd1-(x1)n-vd2-(x2)n-fc,其中vd1是第一可变结构域,vd2是第二可变结构域,fc是fc区的一条多肽链,x1和x2代表氨基酸或多肽,并且n是0或1。例如,多肽链可包括:vh-ch1-柔性接头-vh-ch1-fc区链;或vh-ch1-vh-ch1-fc区链。本文的多价抗体优选地还包含至少两个(并且优选四个)轻链可变结构域多肽。本文的多价抗体可例如包含约2至约8个轻链可变结构域多肽。本文涵盖的轻链可变结构域多肽包含轻链可变结构域,并且任选地还包含cl结构域。在一些实施方案中,多价抗体包含t细胞结合片段。在一些实施方案中,多价抗体包含t细胞受体结合片段。在一些实施方案中,多价抗体包含cd3结合片段。在一些实施方案中,多价抗体包含cd3ε结合片段。
在一些实施方案中,抗体是多特异性抗体。多特异性抗体的实例包括但不限于包含重链可变结构域(vh)和轻链可变结构域(vl)的抗体(其中vhvl单元具有多表位特异性),具有两个或更多个vl和vh结构域的抗体(其中每个vhvl单元结合不同的表位),具有两个或更多个单个可变结构域的抗体(其中每个单个可变结构域结合不同的表位),全长抗体,抗体片段(诸如fab,fv,dsfv,scfv),双抗体,双特异性双抗体,三抗体,三功能抗体,共价或非共价连接的抗体片段。在一些实施方案中,所述抗体具有多表位特异性;例如,特异性结合相同或不同靶标上的两个或更多个不同表位的能力。在一些实施方案中,抗体是单特异性的;例如,仅结合一个表位的抗体。根据一个实施方案,多特异性抗体是以5μm至0.001pm,3μm至0.001pm,1μm至0.001pm,0.5μm至0.001pm或0.1μm至0.001pm的亲和力结合每个表位的igg抗体。
(vi)其它的抗体修饰
就效应器功能而言,可能需要修饰本文提供的抗体,例如,以便增强抗体的抗原依赖性细胞介导的细胞毒性(adcc)和/或补体依赖性细胞毒性(cdc)。这可通过在抗体的fc区中引入一个或多个氨基酸取代来实现。另选地或除此之外,可将半胱氨酸残基引入fc区中,从而允许在这个区中形成链间二硫键。由此产生的同二聚抗体可具有提高的内化能力和/或增强的补体介导的细胞杀死性和抗体依赖性细胞毒性(adcc)。参见caron等,j.expmed.176:1191-1195(1992)和shopes,b.j.,immunol.148:2918-2922(1992)。如wolff等,cancerresearch53:2560-2565(1993)中所述,还可使用异双功能交联剂制备具有增强的抗肿瘤活性的同二聚体抗体。另选地,可工程化具有双fc区的抗体且因此其可具有增强的补体介导的裂解和adcc能力。参见stevenson等,anti-cancerdrugdesign3:219-230(1989)。
为了增加抗体的血清半衰期,可如us2006/0067930中所述在抗体中进行氨基酸改变,该文献通过援引整体并入本文。
(b)多肽变体和修饰
本文所述的多肽(包括抗体)的氨基酸序列修饰可在纯化本文所述的多肽(例如,抗体)的方法中使用。
(i)变体多肽
“多肽变体”意指一种多肽,优选如本文所定义与多肽的全长天然序列,缺少信号肽的多肽序列,具有或不具有信号肽的多肽的胞外域具有至少约80%氨基酸序列同一性的活性多肽。此类多肽变体包括例如其中在全长天然氨基酸序列的n端或c端处添加或删除一个或多个氨基酸残基的多肽。通常,tat多肽变体将与全长天然序列多肽序列,缺少信号肽的多肽序列,具有或不具有信号肽的多肽的胞外域具有至少约80%氨基酸序列同一性,或者至少约85%,90%,95%,96%,97%,98%或99%中任一项的氨基酸序列同一性。任选地,变体多肽与天然多肽序列相比具有不超过一个的保守性氨基酸取代,或者与天然多肽序列相比具有不超过约2,3,4,5,6,7,8,9或10个中任一项的保守性氨基酸取代。
例如,当与全长天然多肽相比时,变体多肽可在n端或c端处被截短,或者可缺少内部残基。某些变体多肽可缺少对于所需生物活性不是必需的氨基酸残基。具有截短,删除和插入的这些变体多肽可通过许多常规技术中的任一种来制备。所需的变体多肽可以是化学合成的。另一种合适的技术涉及通过聚合酶链反应(pcr)分离和扩增编码所需变体多肽的核酸片段。定义核酸片段期望末端的寡核苷酸在pcr中的5'和3'引物处采用。优选地,变体多肽与本文公开的天然多肽共享至少一种生物学和/或免疫学活性。
氨基酸序列插入包括长度在一个残基至含有一百个或更多个残基的多肽的范围内的氨基末端和/或羧基末端融合,以及具有单个或多个氨基酸残基的序列内插入。末端插入的实例包括具有n末端甲硫氨酰基残基的抗体或融合至细胞毒性多肽的抗体。抗体分子的其它插入变体包括抗体的n末端或c末端与增加抗体的血清半衰期的酶或多肽的融合。
例如,可能期望改善多肽的结合亲和力和/或其它生物特性。通过将适当的核苷酸变化引入抗体核酸或通过肽合成制备多肽的氨基酸序列变体。此类修饰包括例如多肽的氨基酸序列内的残基的删除和/或插入和/或取代。可以进行删除,插入和取代的任何组合以得到最终构建物,前提条件是最终构建物具有所期望的特征。氨基酸变化还可改变多肽(例如,抗体)的翻译后加工,诸如改变糖基化位点的数目或位置。
通过比较多肽序列与同源已知多肽分子的序列并且使在高度同源性区中产生的氨基酸序列变化的数目最小化,可发现对于确定可插入,取代或删除哪个氨基酸残基而不会不利地影响所期望的活性的指导。
可用于鉴定多肽(例如,抗体)中作为诱变优选位置的某些残基或区域的方法称作“丙氨酸扫描诱变”,如由cunningham和wells,science244:1081-1085(1989)所描述。在此,鉴定残基或一组靶残基(例如,带电荷残基,诸如arg,asp,his,lys和glu)并且替换为中性或带负电荷氨基酸(最优选丙氨酸或聚丙氨酸)以影响氨基酸与抗原的相互作用。然后通过在取代位点处或针对取代位点引入另外或其它变体来推敲对取代展现功能敏感性的那些氨基酸位置。因此,虽然用于引入氨基酸序列变异的位点是预先确定的,但突变本身的性质不需要预先确定。例如,为了分析给定位点处的突变的性能,在靶密码子或区域处进行ala扫描或随机诱变,并且针对所需活性筛选表达的抗体变体。
另一种类型的变体是氨基酸取代变体。这些变体在抗体分子中有至少一个氨基酸残基被不同的残基替换。取代诱变最感兴趣的位点包括高变区,但也涵盖fr改变。保守性取代示于下表2中的标题“示例性取代”下。如果此类取代导致生物活性改变,则可以引入表2中命名为“取代”的或者如下文关于氨基酸类别进一步描述的更实质性改变,并且筛选产物。
表2
对多肽的生物学特性的实质性改变可通过选择在对维持以下方面的作用上显著不同的取代来实现:(a)取代区域中多肽骨架的结构,例如,呈折叠片或螺旋构象,(b)靶位点处分子的电荷或疏水性,或(c)侧链的体积。氨基酸可根据其侧链特性的相似性进行分组(在a.l.lehninger,biochemistrysecond编,第73-75页,worthpublishers,newyork(1975)中):
(1)非极性:ala(a),val(v),leu(l),ile(i),pro(p),phe(f),trp(w),met(m)
(2)不带电荷极性:gly(g),ser(s),thr(t),cys(c),tyr(y),asn(n),gln(q)
(3)酸性:asp(d),glu(e)
(4)碱性:lys(k),arg(r),his(h)
另选地,天然存在的残基可基于常见的侧链特性分成组:
(1)疏水性:正亮氨酸,met,ala,val,leu,ile;
(2)中性亲水性:cys,ser,thr,asn,gln;
(3)酸性:asp,glu;
(4)碱性:his,lys,arg;
(5)影响链取向的残基:gly,pro;
(6)芳族:trp,tyr,phe。
非保守性取代将需要将这些类别中的一类的成员更换成另一类别。
通常还可用丝氨酸取代不参与维持抗体正确构象的任何半胱氨酸残基,以改善分子的氧化稳定性并且防止异常交联。相反地,可将半胱氨酸键加入到多肽中以改善其稳定性(特别是在抗体为抗体片段(诸如fv片段)的情况下)。
特别优选类型的取代变体涉及取代亲本抗体(例如,人源化抗体)的一个或多个高变区残基。一般来讲,为进一步开发所选择的所得变体相对于产生它们的亲本抗体将具有改善的生物学特性。产生此类取代变体的便利方式涉及使用噬菌体展示的亲和力成熟。简而言之,使几个高变区位点(例如,6-7个位点)突变以在每个位点处产生所有可能的氨基酸取代。由此产生的抗体变体以单价方式从丝状噬菌体颗粒展示,作为与每个颗粒内包装的m13的基因iii产物的融合体。然后针对如本文所公开的生物活性(例如,结合亲和力)筛选噬菌体展示的变体。为了鉴定待修饰的候选高变区位点,可进行丙氨酸扫描诱变以鉴定对抗原结合有显著贡献的高变区残基。另选地或另外地,分析抗原-抗体复合物的晶体结构以鉴定抗体与靶标之间的接触点可能是有益的。此类接触残基和相邻残基是根据本文阐述的技术进行取代的候选者。一旦产生此类变体,则如本文所述对所述变体组进行筛选,并且可选择在一个或多个相关测定中具有优异特性的抗体用于进一步开发。
多肽的另一种类型的氨基酸变体改变抗体的原始糖基化模式。多肽可包含非氨基酸部分。例如,多肽可以是糖基化的。这种糖基化可在多肽在宿主细胞或宿主生物中表达期间自然发生,或者可以是由人工干预产生的有意的修饰。通过改变意指删除多肽中发现的一个或多个碳水化合物部分,和/或添加多肽中不存在的一个或多个糖基化位点。
多肽的糖基化通常是n-连接或o-连接的。n-连接是指碳水化合物部分与天冬酰胺残基的侧链连接。三肽序列天冬酰胺-x-丝氨酸和天冬酰胺-x-苏氨酸(其中x为除脯氨酸外的任何氨基酸)是用于碳水化合物部分至天冬酰胺侧链的酶连接的辨别序列。因此,在多肽中存在这些三肽序列的任何一个产生一个潜在的糖基化位点。o-连接的糖基化是指糖n-乙酰半乳糖胺,半乳糖或木糖之一与羟氨基酸连接,最常见的是丝氨酸或苏氨酸,但也可使用5-羟基脯氨酸或5-羟基赖氨酸。
向多肽添加糖基化位点通过改变氨基酸序列以使其含有上述三肽序列中的一个或多个来方便地实现(对于n-连接的糖基化位点)。改变还可通过向原始抗体的序列添加一个或多个丝氨酸或苏氨酸残基或者用一个或多个丝氨酸或苏氨酸残基取代来进行(对于o-连接的糖基化位点)。
去除存在于多肽上的碳水化合物部分可通过化学或酶促方式或通过编码作为糖基化靶标的氨基酸残基的密码子的突变取代来实现。多肽上的碳水化合物部分的酶促裂解可通过使用多种内切糖苷酶和外切糖苷酶来实现。
其它修饰包括谷氨酰胺酰和天冬酰胺酰残基分别至对应的谷氨酰和天冬氨酰残基的脱酰胺化;脯氨酸和赖氨酸的羟基化;丝氨酰或苏氨酰残基的羟基的磷酸化;赖氨酸,精氨酸和组氨酸侧链的α-氨基的甲基化;n末端胺的乙酰化和任何c末端羧基的酰胺化。
(ii)嵌合多肽
本文所述的多肽可以形成包含融合至另一种异源多肽或氨基酸序列的多肽的嵌合分子的方式被修饰。在一些实施方案中,嵌合分子包括多肽与提供抗标签抗体可选择性结合的表位的标签多肽的融合体。表位标签通常位于多肽的氨基末端或羧基末端处。此类表位标签形式的多肽的存在可使用针对标签多肽的抗体来检测。另外,提供表位标签使得能够使用抗标签抗体或结合至表位标签的另一种类型的亲和基质通过亲和纯化容易地纯化多肽。
在另选实施方案中,嵌合分子可包括多肽与免疫球蛋白或免疫球蛋白的特定区的融合体。嵌合分子的二价形式被称为“免疫粘附素”。
如本文所用,术语“免疫粘附素”指代将异源多肽的结合特异性与免疫球蛋白恒定结构域的效应器功能组合的抗体样分子。在结构上,免疫粘附素包含不同于抗体的抗原识别和结合位点(即,是“异源的”)的具有期望结合特异性的氨基酸序列和免疫球蛋白恒定结构域序列的融合。免疫粘附素分子的粘附素部分通常是至少包含受体或配体的结合位点的连续氨基酸序列。免疫粘附素中的免疫球蛋白恒定结构域序列可从诸如以下各项的任何免疫球蛋白获得:igg-1,igg-2,igg-3或igg-4亚型,iga(包括iga-1和iga-2),ige,igd或igm。
ig融合优选地包括在ig分子内的至少一个可变区的位置处可溶(跨膜结构域删除或失活)形式的多肽的取代。在特别优选的实施方案中,免疫球蛋白融合体包含igg1分子的铰链,ch2和ch3或铰链,ch1,ch2和ch3区。
(iii)多肽缀合物
在多肽制剂中使用的多肽可缀合至细胞毒性剂(诸如化学治疗剂),生长抑制剂,毒素(例如,细菌,真菌,植物或动物来源的酶活性毒素或其片段)或放射性同位素(即,放射缀合物)。
可使用适用于产生此类缀合物的化学治疗剂。此外,可使用的酶活性毒素及其片段包括白喉毒素a链,白喉毒素的非结合活性片段,外毒素a链(来自绿脓杆菌(pseudomonasaeruginosa)),蓖麻毒素a链,相思豆毒素a链,蒴莲根毒素a链,α-帚曲菌素,油桐(aleuritesfordii)蛋白,石竹素(dianthin)蛋白,美洲商陆(phytolacaamericana)蛋白(papi,papii和pap-s),苦瓜(momordicacharantia)抑制剂,泻果素,巴豆毒素,肥皂草(sapaonariaofficinalis)抑制剂,白树毒素(gelonin),丝裂吉菌素(mitogellin),局限曲菌素(restrictocin),酚霉素(phenomycin),伊诺霉素(enomycin)和单端孢霉烯(tricothecene)。多种放射性核素可用于产生放射缀合的多肽。实例包括212bi,131i,131in,90y和186re。多肽和细胞毒性剂的缀合物可使用多种双官能蛋白偶联剂,诸如n-琥珀酰亚胺基-3-(2-吡啶基二硫醇)丙酸酯(spdp),亚氨基硫烷(it),亚氨酸酯的双官能衍生物(诸如二亚胺代己二酸二甲酯hcl),活性酯(诸如辛二酸二琥珀酰亚胺基酯),醛(诸如戊二醛),双-叠氮化合物(诸如双(对叠氮苯甲酰基)己二胺),双-重氮衍生物(诸如双-(对重氮苯甲酰基)-乙二胺),二异氰酸酯(诸如甲苯2,6-二异氰酸酯)和双-活性氟化合物(诸如1,5-二氟-2,4-二硝基苯)来制备。例如,可如vitetta等,science238:1098(1987)中所述的那样制备蓖麻毒素免疫毒素。碳-14标记的1-异硫氰酸苄基-3-甲基二亚乙基三胺五乙酸(mx-dtpa)是用于将放射性核苷酸与多肽缀合的示例性螯合剂。
本文还涵盖多肽与一种或多种小分子毒素(诸如卡里奇霉素,美登木素,单端孢菌烯(trichothene)和cc1065)以及这些毒素的具有毒素活性的衍生物的缀合物。
美登木素是通过抑制微管蛋白聚合来起作用的有丝分裂抑制剂。美登木素最初是从东非灌木齿叶美登木(maytenusserrata)分离。随后,发现某些微生物也产生美登木素,诸如美登醇和c-3美登醇酯。还涵盖合成美登醇及其衍生物和类似物。本领域已知许多用于制备多肽-美登木素缀合物的连接基团,包括例如美国专利号5,208,020中公开的那些。连接基团包括如上所述专利中公开的二硫化物基团,硫醚基团,酸不稳定基团,光不稳定基团,肽酶不稳定基团或酯酶不稳定基团,优选二硫化物基团和硫醚基团。
接头可连接至美登木素分子的不同位置处,这取决于连接的类型。例如,可通过使用常规偶联技术与羟基反应来形成酯键。反应可发生在具有羟基的c-3位置,经羟甲基修饰的c-14位置,经羟基修饰的c-15位置和具有羟基的c-20位置处。在优选的实施方案中,在美登醇或美登醇类似物的c-3位置处形成键。
另一种感兴趣的缀合物包含缀合至一个或多个卡奇霉素分子的多肽。卡奇霉素家族的抗生素能够在低于皮摩尔的浓度下产生双链dna断裂。对于卡奇霉素家族的缀合物的制备,参见例如,美国专利号5,712,374。可使用的卡奇霉素的结构类似物包括但不限于γ1i,α2i,α3i,n-乙酰基-γ1i,psag和θ1i。可以缀合抗体的另一种抗肿瘤药物是为抗叶酸剂的qfa。卡奇霉素与qfa均具有细胞内作用位点,并且不容易穿过质膜。因此,通过多肽(例如,抗体)介导的内化来细胞摄取这些试剂极大地提高了它们的细胞毒性效应。
可缀合至本文所述的多肽的其它抗肿瘤剂包括:bcnu,链佐星(streptozoicin),长春新碱和5-氟尿嘧啶,统称为ll-e33288复合物的试剂家族以及埃斯波霉素。
在一些实施方案中,多肽可以是多肽与具有溶核活性的化合物(例如,核糖核酸酶或dna内切核酸酶,诸如脱氧核糖核酸酶;dna酶)之间的缀合物。
在另一实施方案中,多肽(例如,抗体)可缀合至“受体”(诸如链霉亲和素)以用于肿瘤预靶向中,其中向患者施用多肽受体缀合物,随后使用清除剂从循环除去未结合的缀合物且接着施用缀合至细胞毒性剂(例如放射性核苷酸)的“配体”(例如亲合素)。
在一些实施方案中,多肽可缀合至将前药(例如,肽基化学治疗剂)转变成活性抗癌药物的前药活化酶。免疫缀合物的酶组分包括能够以这样的方式作用于前药以便将其转化成更具活性的细胞毒性形式的任何酶。
可用的酶包括但不限于:可用于将含磷酸酯前药转变成游离药物的碱性磷酸酶;可用于将含硫酸酯前药转变成游离药物的芳基硫酸酯酶;可用于将无毒5-氟胞嘧啶转变成抗癌药物5-氟尿嘧啶的胞嘧啶脱氨酶;可用于将含肽前药转变成游离药物的蛋白酶,诸如沙雷氏菌(serratia)蛋白酶,嗜热菌蛋白酶,枯草杆菌蛋白酶,羧基肽酶和组织蛋白酶(诸如组织蛋白酶b和l);可用于转变含有d-氨基酸取代基的前药的d-丙氨酰基羧基肽酶;可用于将糖基化前药转变成游离药物的碳水化合物切割酶,诸如β-半乳糖苷酶和神经氨酸酶;可用于将经β-内酰胺衍生化的药物转变成游离药物的β-内酰胺酶;和可用于将在其胺氮处分别经苯氧乙酰基或苯基乙酰基衍生化的药物转变成游离药物的青霉素酰胺酶,诸如青霉素v酰胺酶或青霉素g酰胺酶。另选地,可使用具有酶活性的抗体(本领域中也称为“抗体酶”(abzyme))将前药转变成游离的活性药物。
(iv)其它
多肽的另一种类型的共价修饰包括将多肽连接至多种非蛋白质聚合物(例如,聚乙二醇,聚丙二醇,聚氧化烯或聚乙二醇和聚丙二醇的共聚物)中的一种。多肽还可被俘获在例如通过凝聚技术或通过界面聚合(分别为例如羟甲基纤维素或明胶-微胶囊和聚(甲基丙烯酸甲酯)微胶囊)制备的微胶囊中,胶态药物递送系统(例如脂质体,白蛋白微球体,微乳剂,纳米颗粒和纳米胶囊)中,或粗乳液中。此类技术公开于remington'spharmaceuticalsciences,第18版,gennaro,a.r编,(1990)。
vii.获得在制剂和方法中使用的多肽
在本文所述的分析方法中使用的多肽可使用本领域熟知的方法(包括重组方法)获得。以下部分提供有关这些方法的指导。
(a)多核苷酸
如本文可互换使用的“多核苷酸”或“核酸”是指具有任何长度的核苷酸的聚合物,并且包括dna和rna。
编码多肽的多核苷酸可从任何来源获得,包括但不限于从认为拥有多肽mrna并且以可检测的水平表达的组织制备的cdna文库。因此,编码多肽的多核苷酸可方便地从由人组织制备的cdna文库中获得。编码多肽的基因还可从基因组文库或通过已知的合成程序(例如,自动核酸合成)获得。
例如,多核苷酸可编码整个免疫球蛋白分子链,诸如轻链或重链。完整的重链不仅包含重链可变区(vh),而且还包含重链恒定区(ch),其通常将包含三个恒定结构域:ch1,ch2和ch3;和“铰链”区。在某些情况下,恒定区的存在是所期望的。在一些实施方案中,多核苷酸编码tdb的一个或多个免疫球蛋白分子链。
可由多核苷酸编码的其它多肽包括抗原结合抗体片段,诸如单结构域抗体(“dab”),fv,scfv,fab’和f(ab')2以及“微型抗体”。微型抗体(通常)是ch1和ck或cl结构域已被切除的二价抗体片段。由于微型抗体小于常规抗体,它们应该在临床/诊断用途中实现更好的组织渗透性,但它们是二价的,因此应该比单价抗体片段(诸如dab)保留更高的结合亲和力。因此,除非上下文另外指出,否则本文使用的术语“抗体”不仅涵盖整个抗体分子,还涵盖上面讨论类型的抗原结合抗体片段。优选地,编码多肽中存在的每个框架区相对于对应的人受体框架将包含至少一个氨基酸取代。因此,例如,相对于受体框架区,所述框架区可总共包含3,4,5,6,7,8,9,10,11,12,13,14或15个氨基酸取代。
本说明书中公开的所有特征可以任何组合结合。本说明书中公开的每个特征可被替换为用于相同,等同或相似目的的其它特征。因此,除非另有明确规定,否则所公开的每个特征仅是一系列通用等效或类似特征的一个实例。
本发明的更多详情由以下非限定性实施例说明。本说明书中所有参考文献的公开内容通过援引明确地并入本文。
实施例
下文实施例仅仅意图是本发明的例示,因此不应视为以任何方式限制本发明。提供下面的实施例和详述作为示例而非作为限制。
实施例1:t细胞活化测定法
已经开发了一种t细胞活化测定法来测定t细胞依赖性双特异性(tdb)抗体关于在靶细胞存在下活化t细胞的效力和特异性。一种例示性示意图见图2。由于tdb是二价且双特异性的,一种臂是对tcr复合物亚基特异性的且另一种臂是对靶抗原特异性的,引起t细胞活化的tcr的交联只能在靶细胞和t细胞二者受到tdb结合时发生。通过含有抗cd3的tdb实现的tcr介导的交联活化t细胞信号转导级联,引起转录因子(包括nfat和nfκb)的磷酸化和核定位,导致靶基因诸如细胞因子或细胞杀死剂(诸如fas,粒酶b和穿孔素)的转录诱导(brown,wm,2006,curropininvestigdrugs7:381-388;ferran,cetal.,1993,expnephrol1:83-89;shannon,mfetal.,1995,jleukocbiol57:767-773;shapiro,1998;pardo,jetal.,2003,intimmunol15(12):1441-1450)。在ap1,nfat,或nfκb的转录控制下的报告物基因(诸如萤火虫萤光素酶)已经用于监测信号传导途径的tcr活化和t细胞活化(shannon,mfetal.,1995,jleukocbiol57:767-773;shapiro,1998)。为了评估tdb是否能在体外活化t细胞,用重组tcr响应性报告物基因慢病毒储液(ap1-萤光素酶,nfat-萤光素酶,或nfκb-萤光素酶)感染jurkatt细胞(dsmz,acc282)并分离报告t细胞的稳定池。为了初步评估报告t细胞对于测定结合的适合性,将它们用10μg/ml纯化的抗cd3同二聚体(它能在靶细胞缺失下交联tcr受体)处理4小时。jurkat/ap1萤光素酶,jurkat/nfat萤光素酶,和jurkat/nfκb萤光素酶稳定池在用纯化的抗cd3同二聚体刺激后显示萤光素酶的剂量依赖性诱导。将发光响应(萤光素酶报告物基因活性)绘图,自jurkat/nfκb萤光素酶稳定池观察到最高响应(图3a)。对通过有限稀释分离的jurkat/nfκb萤光素酶稳定克隆筛选它们对10μg/ml纯化的抗cd3同二聚体的响应。与其它tcr响应元件相比,jurkatt细胞nfκb萤光素酶池对抗cd3同二聚体展现最高的响应,并选择用于进一步调查(图3b)。
为了测定这个克隆对αcd20/αcd3tdb或抗cd3同二聚体的相对响应,在cd20表达性靶细胞系存在下用渐增浓度的αcd20/αcd3tdb或抗cd3同二聚体处理jurkat/nfκb萤光素酶克隆2细胞系,并将萤光素酶活性绘图(图4a)。在补充有10%胎牛血清的rpmi1640培养基中将细胞用αcd20/αcd3tdb或cd3同二聚体刺激4小时。在共刺激性靶细胞存在下,纯化的αcd20/αcd3tdb比纯化的抗cd3同二聚体活性高1000倍。如通过萤光素酶转录的nfκb依赖性活化测量的,在靶细胞缺失下,甚至在高水平的tdb下,αcd20/αcd3tdb在这种细胞系中并不导致t细胞活化,指示该测定法对于检测tdb对靶和效应细胞的同时结合的特异性(图4b)。使用t细胞活化的其它量度,对工程化jurkat/nfκb萤光素酶克隆2报告物基因细胞系观察到的t细胞活化响应与使用自供体外周血单个核细胞(pbmc)分离的人t细胞观察到的t细胞活化响应相当,指示使用报告物基因监测t细胞活化响应是相当的(表3)。使用jurkat/nfκb萤光素酶克隆2细胞系(jurkat-nfκbluc)来开发和优化用于检测tdb介导的t细胞活化的基于细胞的测定方法。
表3
实施例2:检测tdb介导的t细胞活化的定量方法
已经开发了一种灵敏且定量的平台tdb基于细胞的测定法,通过测量在靶细胞存在下对t细胞活化的诱导来测定含有抗cd3的tdb的效力。该tdbt细胞活化测定法如下检测在靶细胞存在下tdb对t细胞的活化:使用工程化t细胞报告物基因细胞系jurkat-nfκbluc测量tcr交联诱导的rel/nfκb信号传导途径的活化。活化的nfκb易位至细胞核,结合至合成启动子中的8个nfκb响应元件并驱动萤光素酶的转录。
在该测定法中,制备抗cd20/cd3(或抗her2/cd3或抗cd79b/cd3)测定标准品,对照,和测试样品的稀释液,并将50μl添加至96孔测定板。然后在冷冻细胞与新鲜培养细胞相当的评估之后使用ready-to-use(r-to-u)冷冻细胞或培养细胞制备靶细胞(分别用于αcd20/cd3,αher2/cd3,和αcd79b/cd3的wil2-s,bt-474或skbr3,和bjab细胞)和jurkatnfkb报告细胞。组合等体积的4.0x105个细胞/ml靶细胞稀释液和1.6x106个细胞/mljurkatnfkb细胞稀释液以制备细胞混合物,其中靶:效应(t:e)细胞比为1:4。将50μl混合靶和jurkatnfkbluc细胞添加至测定板中的每一份tdb稀释液。对基于αher2/cd3和αcd79b/cd3细胞的测定法以及包括参照和对照tdb的测定法使用相同的t:e比。在靶细胞通过tdb缀合至jurkatnfkbluct细胞报告细胞系之后,活化的nfκb易位至细胞核,结合至合成启动子中的8个nfκb响应元件并驱动萤光素酶的转录。4-5小时测定温育后,使用发光读板仪测量由每一份样品诱导的萤光素酶活性的量(图5)。如下自使用4p分析自tdb参照标准品生成的发光的标准曲线确定对照和测试样品的相对效力:
使用4参数对数曲线拟合程序为标准品,对照和样品生成分开的曲线。方程是:
y=((a-d)/(1+(x/c)^b))+d
其中:x=自变量
a=零剂量响应(下渐近线=la)
b=斜率
c=ec50,ng/ml
d=最大剂量响应(上渐近线=ua)
如下确定标准曲线(st)和每一种测试项(ta)(对照或样品)曲线的倍数响应:
响应的幅度=ua/la
报告值。
如下检查st和每一条ta曲线之间的相似性:
测试平行性。使用下面的方程确定斜率比:
使用下面的方程确定下渐近线百分比差异(lad):
使用下面的方程确定上渐近线百分比差异(uad):
使用约束4-p平行曲线计算测试项的效力。
对于st和ta,使用下面的方程生成约束曲线:
其中:x=自变量
a=共同下渐近线
b=共同斜率
cst=标准ec50值
d=共同上渐近线
ρ=测试项的相对效力(相对效力是st的ec50对ta的ec50的比)
为对照和样品计算效力,以%相对效力表述:
效力=ρ×参照材料的活性
cd69(c型凝集素蛋白)和cd25(il-2受体)是t细胞活化的标志物(shipkova,m,2012,clinchimacta413:1338-49和ziegler,sfetal.,1994,stemcells12(5):465-465),而且通过流式细胞术评估添加αcd20/cd3tdb后24小时它们在t细胞的表面上的诱导。cd69和cd25细胞表面表达响应与αcd20/αcd3tdb一起的温育以剂量依赖性方式升高(图6a和6b),而且剂量-响应曲线与通过测量来自jurkatnfkbluct细胞报告细胞系的萤光素酶信号观察到的关联较好(图7),证明萤光素酶测量是使用jurkatnfkbluc细胞的tdb基于细胞的测定法中的t细胞活化的有关读出。
使用基于elisa的桥接结合测定法评估tdb与它的靶的同时结合的量。一种例示性示意图见图8。tcr复合物亚基和靶抗原的胞外域(ecd)通过tdb的桥接是代表tdb的作用机制的一种本质相互作用。使用该测定法检测抗her2/cd3tdb变体的不同亲和力(图9),和经受热压力条件的抗her2/cd3样品(40℃2周和4周,见图10a)。在关于抗her2/cd3的tdb桥接结合测定法中,使用her2ecd(cr#156)作为板上的包被材料。16-72小时后,清洗板,然后将αher2/cd3tdb在测定稀释剂中温育1-2小时。清洗后,将生物素化的cd3ε肽温育1-2小时,接着是链霉亲合素-hrp温育。最后的清洗后,使用检测剂测量缀合至板的hrp的量。观察到桥接结合测定法和tdb基于细胞的测定法之间的强关联(r2=0.9976)(图10b),进一步支持tdb基于细胞的测定法作为tdb效力的度量的用途。
桥接测定法
材料
包被材料:her2ecd(cr#156)
包被缓冲液:无cacl2和mgcl2的dulbecco氏磷酸盐缓冲盐水,gibco目录号14190
测定稀释剂/检测稀释缓冲液:pbs+0.5%bsa+0.05%ps20
清洗缓冲液:pbs+0.05%ps20
检测:链霉亲合素-hrp
包被板
1.将包被试剂在包被缓冲液中稀释至4μg/ml。
2.用100μl包被全部96个孔。
3.用板密封器密封。
4.于2-8℃温育16-72小时。
测定规程
1.使用清洗程序“auto”将板用清洗缓冲液清洗6次(即运行两个循环的auto程序)。
2.每个孔使用200μlad封闭板。密封并在摇动中于25℃温育1-2小时。
3.在ad中制备aher2tdbab。
4.封闭后,像步骤1一样将板清洗6次。
5.对每一个孔添加100ul稀释的aher2tdb。在摇动中于25℃温育1小时10分钟。
6.重复步骤1。
7.制备cd3e肽(16聚物),终浓度:1μg/mlcd3e肽。
8.对每一个孔添加100μl。温育1小时。
9.重复步骤1。
10.添加链霉亲合素-hrp,终浓度2ng/ml,并于25℃温育1小时。
11.重复步骤1。
12.对孔添加100μlsurebluereserve。显色直至最佳颜色显现,之后用100μl0.6n硫酸停止反应。
15.读取od450/650。
实施例3:抗fcrh5/抗cd3抗体的分析
使用实施例2中描述的测定法测量抗fcrh5/抗cd3tbd的效力。在该测定法中,制备抗fcrh5/cd3测定标准品,对照,和测试样品的稀释液并将50μl添加至96孔测定板。然后制备靶细胞(fcrh5表达性ejm细胞)和jurkatnfkb报告细胞,其中在冷冻细胞与新鲜培养细胞相当的评估之后使用ready-to-use(r-to-u)冷冻细胞或培养细胞。组合等体积的4.0x105个细胞/ml靶细胞稀释液和1.6x106个细胞/mljurkatnfkb细胞稀释液以制备细胞混合物,其中靶:效应(t:e)细胞比为1:4。将50μl混合靶和jurkatnfkbluc细胞添加至测定板中的每一份tdb稀释液。对参照和对照tdb使用相同的t:e比。4-5小时测定温育后,使用发光读板仪测量由每一份样品诱导的萤光素酶活性的量(图11)。自使用实施例2中描述的4p分析自tdb参照标准品生成的发光的标准曲线确定对照和测试样品的相对效力。
使用实施例2中描述的基于elisa的桥接结合测定法评估抗fcrh5/cd3tdb与它的靶的同时结合的量。在用于抗fcrh5/cd3的tdb桥接结合测定法中,使用域9fcrh5ecd作为板上的包被材料。16-72小时后,清洗板,然后将αfcrh5/cd3tdb在测定稀释剂中温育1-2小时。清洗后,将生物素化的cd3ε肽温育1-2小时,接着是链霉亲合素-hrp温育。最后的清洗后,使用检测剂测量缀合至板的hrp的量(图12)。
序列表
<110>李浩英(lee,hoyoung)
g·姜(jiang,guoying)
p·y·王(wong,pinyee)
k·卡蕾(carey,kendall)
<120>用于测定t细胞依赖性双特异性抗体的方法
<130>146392036240
<140>未指派
<141>随本文
<150>62/286,862
<151>2016-01-25
<160>40
<170>fastseqforwindowsversion4.0
<210>1
<211>5
<212>prt
<213>人工序列
<220>
<223>合成构建物
<400>1
asntyrtyrilehis
15
<210>2
<211>17
<212>prt
<213>人工序列
<220>
<223>合成构建物
<400>2
trpiletyrproglyaspglyasnthrlystyrasnglulysphelys
151015
gly
<210>3
<211>10
<212>prt
<213>人工序列
<220>
<223>合成构建物
<400>3
aspsertyrserasntyrtyrpheasptyr
1510
<210>4
<211>17
<212>prt
<213>人工序列
<220>
<223>合成构建物
<400>4
lysserserglnserleuleuasnserargthrarglysasntyrleu
151015
ala
<210>5
<211>7
<212>prt
<213>人工序列
<220>
<223>合成构建物
<400>5
trpalaserthrarggluser
15
<210>6
<211>8
<212>prt
<213>人工序列
<220>
<223>合成构建物
<400>6
thrglnserpheileleuargthr
15
<210>7
<211>5
<212>prt
<213>人工序列
<220>
<223>合成构建物
<400>7
sertyrtyrilehis
15
<210>8
<211>17
<212>prt
<213>人工序列
<220>
<223>合成构建物
<400>8
trpiletyrprogluasnaspasnthrlystyrasnglulysphelys
151015
asp
<210>9
<211>10
<212>prt
<213>人工序列
<220>
<223>合成构建物
<400>9
aspglytyrserargtyrtyrpheasptyr
1510
<210>10
<211>17
<212>prt
<213>人工序列
<220>
<223>合成构建物
<400>10
lysserserglnserleuleuasnserargthrarglysasntyrleu
151015
ala
<210>11
<211>7
<212>prt
<213>人工序列
<220>
<223>合成构建物
<400>11
trpthrserthrarglysser
15
<210>12
<211>8
<212>prt
<213>人工序列
<220>
<223>合成构建物
<400>12
lysglnserpheileleuargthr
15
<210>13
<211>5
<212>prt
<213>人工序列
<220>
<223>合成构建物
<400>13
glytyrthrmetasn
15
<210>14
<211>17
<212>prt
<213>人工序列
<220>
<223>合成构建物
<400>14
leuileasnprotyrlysglyvalserthrtyrasnglnlysphelys
151015
asp
<210>15
<211>13
<212>prt
<213>人工序列
<220>
<223>合成构建物
<400>15
serglytyrtyrglyaspserasptrptyrpheaspval
1510
<210>16
<211>11
<212>prt
<213>人工序列
<220>
<223>合成构建物
<400>16
argalaserglnaspileargasntyrleuasn
1510
<210>17
<211>7
<212>prt
<213>人工序列
<220>
<223>合成构建物
<400>17
tyrthrserargleugluser
15
<210>18
<211>9
<212>prt
<213>人工序列
<220>
<223>合成构建物
<400>18
glnglnglyasnthrleuprotrpthr
15
<210>19
<211>119
<212>prt
<213>人工序列
<220>
<223>合成构建物
<400>19
gluvalglnleuvalglnserglyalagluvallyslysproglyala
151015
servallysvalsercyslysalaserglytyrthrphethrasntyr
202530
tyrilehistrpvalargglnalaproglyglnglyleuglutrpile
354045
glytrpiletyrproglyaspglyasnthrlystyrasnglulysphe
505560
lysglyargalathrleuthralaaspthrserthrserthralatyr
65707580
leugluleuserserleuargsergluaspthralavaltyrtyrcys
859095
alaargaspsertyrserasntyrtyrpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
<210>20
<211>112
<212>prt
<213>人工序列
<220>
<223>合成构建物
<400>20
aspilevalmetthrglnserproaspserleualavalserleugly
151015
gluargalathrileasncyslysserserglnserleuleuasnser
202530
argthrarglysasntyrleualatrptyrglnglnlysproglygln
354045
proprolysleuleuiletyrtrpalaserthrarggluserglyval
505560
proaspargpheserglyserglyserglythraspphethrleuthr
65707580
ileserserleuglnalagluaspvalalavaltyrtyrcysthrgln
859095
serpheileleuargthrpheglyglnglythrlysvalgluilelys
100105110
<210>21
<211>119
<212>prt
<213>人工序列
<220>
<223>合成构建物
<400>21
gluvalglnleuvalglnserglyalagluvallyslysproglyala
151015
servallysvalsercyslysalaserglyphethrphethrsertyr
202530
tyrilehistrpvalargglnalaproglyglnglyleuglutrpile
354045
glytrpiletyrprogluasnaspasnthrlystyrasnglulysphe
505560
lysaspargvalthrilethralaaspthrserthrserthralatyr
65707580
leugluleuserserleuargsergluaspthralavaltyrtyrcys
859095
alaargaspglytyrserargtyrtyrpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
<210>22
<211>112
<212>prt
<213>人工序列
<220>
<223>合成构建物
<400>22
aspilevalmetthrglnserproaspserleualavalserleugly
151015
gluargalathrileasncyslysserserglnserleuleuasnser
202530
argthrarglysasntyrleualatrptyrglnglnlysproglygln
354045
serprolysleuleuiletyrtrpthrserthrarglysserglyval
505560
proaspargpheserglyserglyserglythraspphethrleuthr
65707580
ileserserleuglnalagluaspvalalavaltyrtyrcyslysgln
859095
serpheileleuargthrpheglyglnglythrlysvalgluilelys
100105110
<210>23
<211>122
<212>prt
<213>人工序列
<220>
<223>合成构建物
<400>23
gluvalglnleuvalgluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglytyrserphethrglytyr
202530
thrmetasntrpvalargglnalaproglylysaspleuglutrpval
354045
alaleuileasnprotyrlysglyvalserthrtyrasnglnlysphe
505560
lysaspargphethrileservalasplysserlysasnthralatyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alaargserglytyrtyrglyaspserasptrptyrpheaspvaltrp
100105110
glyglnglythrleuvalthrvalserser
115120
<210>24
<211>107
<212>prt
<213>人工序列
<220>
<223>合成构建物
<400>24
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserglnaspileargasntyr
202530
leuasntrptyrglnglnlysproglylysalaprolysleuleuile
354045
tyrtyrthrserargleugluserglyvalproserargphesergly
505560
serglyserglythrasptyrthrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglnglnglyasnthrleuprotrp
859095
thrpheglyglnglythrlysleugluleulys
100105
<210>25
<211>10
<212>prt
<213>人工序列
<220>
<223>合成构建物
<400>25
glytyrthrphethrsertyrasnmethis
1510
<210>26
<211>17
<212>prt
<213>人工序列
<220>
<223>合成构建物
<400>26
alailetyrproglyasnglyaspthrsertyrasnglnlysphelys
151015
gly
<210>27
<211>13
<212>prt
<213>人工序列
<220>
<223>合成构建物
<400>27
valvaltyrtyrserasnsertyrtrptyrpheaspval
1510
<210>28
<211>10
<212>prt
<213>人工序列
<220>
<223>合成构建物
<400>28
argalaserserservalsertyrmethis
1510
<210>29
<211>7
<212>prt
<213>人工序列
<220>
<223>合成构建物
<400>29
alaproserasnleualaser
15
<210>30
<211>9
<212>prt
<213>人工序列
<220>
<223>合成构建物
<400>30
glnglntrpserpheasnproprothr
15
<210>31
<211>122
<212>prt
<213>人工序列
<220>
<223>合成构建物
<400>31
gluvalglnleuvalgluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglytyrthrphethrsertyr
202530
asnmethistrpvalargglnalaproglylysglyleuglutrpval
354045
glyalailetyrproglyasnglyaspthrsertyrasnglnlysphe
505560
lysglyargphethrileservalasplysserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alaargvalvaltyrtyrserasnsertyrtrptyrpheaspvaltrp
100105110
glyglnglythrleuvalthrvalserser
115120
<210>32
<211>107
<212>prt
<213>人工序列
<220>
<223>合成构建物
<400>32
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserserservalsertyrmet
202530
histrptyrglnglnlysproglylysalaprolysproleuiletyr
354045
alaproserasnleualaserglyvalproserargpheserglyser
505560
glyserglythraspphethrleuthrileserserleuglnproglu
65707580
aspphealathrtyrtyrcysglnglntrpserpheasnproprothr
859095
pheglyglnglythrlysvalgluilelysarg
100105
<210>33
<211>5
<212>prt
<213>人工序列
<220>
<223>合成构建物
<400>33
aspthrtyrilehis
15
<210>34
<211>17
<212>prt
<213>人工序列
<220>
<223>合成构建物
<400>34
argiletyrprothrasnglytyrthrargtyralaaspservallys
151015
gly
<210>35
<211>11
<212>prt
<213>人工序列
<220>
<223>合成构建物
<400>35
trpglyglyaspglyphetyralametasptyr
1510
<210>36
<211>11
<212>prt
<213>人工序列
<220>
<223>合成构建物
<400>36
argalaserglnaspvalasnthralavalala
1510
<210>37
<211>7
<212>prt
<213>人工序列
<220>
<223>合成构建物
<400>37
seralaserpheleutyrser
15
<210>38
<211>9
<212>prt
<213>人工序列
<220>
<223>合成构建物
<400>38
glnglnhistyrthrthrproprothr
15
<210>39
<211>120
<212>prt
<213>人工序列
<220>
<223>合成构建物
<400>39
gluvalglnleuvalgluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglypheasnilelysaspthr
202530
tyrilehistrpvalargglnalaproglylysglyleuglutrpval
354045
alaargiletyrprothrasnglytyrthrargtyralaaspserval
505560
lysglyargphethrileseralaaspthrserlysasnthralatyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
serargtrpglyglyaspglyphetyralametasptyrtrpglygln
100105110
glythrleuvalthrvalserser
115120
<210>40
<211>107
<212>prt
<213>人工序列
<220>
<223>合成构建物
<400>40
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserglnaspvalasnthrala
202530
valalatrptyrglnglnlysproglylysalaprolysleuleuile
354045
tyrseralaserpheleutyrserglyvalproserargphesergly
505560
serargserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglnglnhistyrthrthrpropro
859095
thrpheglyglnglythrlysvalgluilelys
100105
- 还没有人留言评论。精彩留言会获得点赞!