用于诱导神经干细胞的分化和保护的组合物及使用该组合物诱导神经再生的方法与流程
本发明涉及诱导神经再生的方法,其包括向有需要的患者施用mek1/2抑制剂,以及涉及用于上述方法的包含mek1/2抑制剂的组合物。在本发明中,mek1/2抑制剂通过将神经干细胞分化为神经元、通过保护神经干细胞和神经元免受β-淀粉样蛋白的细胞毒性或通过以上的两者诱导神经再生。此外,本发明涉及保护神经元免受神经元丢失或损伤的方法,其包括施用mek1/2抑制剂,以及涉及用于上述方法的包含mek1/2抑制剂的组合物。此外,本发明涉及预防和治疗有需要的患者的由于神经元丢失或损伤导致的神经退行性疾病的方法,其包括施用mek1/2抑制剂,以及涉及用于上述方法的包含mek1/2抑制剂的组合物。
背景技术
神经退行性疾病如阿尔茨海默氏病(alzheimer’sdisease,ad)和帕金森氏病(parkinson’sdisease,pd)多见于老年人群中,并且患者数量随着社会老龄化以指数增长。此外,在年轻人中早发型神经退行性疾病的报道并非不常见。因此,人们有极大的兴趣来开发有助于阻止疾病进展或恢复受损脑组织的治疗。
尚未确定此类神经退行性疾病的确切原因。根据目前已知的情况,脑中的特定位置(如海马体或黑质)中的神经元细胞受损伤,从而产生在减少数量的神经元细胞中的缺陷型神经网络,这导致神经退行性疾病的各种症状。
在各个领域中都在研究以寻找治疗。迄今为止,与症状缓解相关的药物包括美金刚(memantine,nmda受体拮抗剂)、l-dopa(多巴胺模拟药物)等。其它药物还限于短期作用或已发现在持续使用的情况下具有副作用,使得难以期望它们提供除了症状暂时缓解之外的治疗。因此,急需针对神经退行性疾病的原因的基础治疗。
神经干细胞(nsc)和神经祖细胞(npc),即能够分化为神经细胞的细胞,存在于成体脑中。神经干细胞存在于侧脑室的室管膜下区和海马体的齿状回中,并且在整个动物一生期间通过神经干细胞的分化和增殖在该区域中发生神经形成(zhao等人(2008)mechanismsandfunctionalimplicationsofadultneurogenesis.cell132:645-660)。
由于在神经退行性疾病中发生脑神经元细胞损伤和丢失,所以通过nsc和npc的刺激来用正常功能的神经元替换经损伤或经丢失的神经元可以是神经退行性疾病的基础治疗。这种治疗方法包括干细胞治疗方法,其中将nsc和npc从患者体内分离、体外刺激以分化为神经元,然后移植回患者体内。然而,从患者分离nsc和npc后将它们移植回患者体内存在困难。此外,经移植的nsc和npc在脑中快速地失去活性,因此需要重复移植。作为一个替代方案,替代将神经干细胞移植至患者体内,最近已经提出通过使用药物刺激nsc和npc分化以在患者脑中产生神经元的方法(davies等人(2015)stemistry:thecontrolofstemcellsinsituusingchemistry.j.med.chem.58:2863-2894)。
β-淀粉样蛋白(aβ)是一种36-43个氨基酸的肽,其由β-分泌酶和γ-分泌酶裂解淀粉样前体蛋白(app),即1型整合膜蛋白产生。β-淀粉样蛋白(aβ)聚集为可溶性β-淀粉样蛋白(aβ)寡聚体,然后经由原纤丝形成不溶性aβ纤丝而在脑中最终累积为淀粉样斑块。aβ在脑中的沉积与突触损伤、神经元损伤和脑萎缩相关,并且最终导致记忆和认知功能的损伤,即两种非常典型的阿尔茨海默氏病(ad)症状。在各种形式的aβ中,可溶性aβ寡聚体,特别是三聚体和四聚体,被认为是最具毒性形式的aβ,其与神经元失调和突触损伤相关(murakami,(2014)conformation-specificantibodiestotargetamyloidβoligomersandtheirapplicationtoimmunotherapyforalzheimer’sdisease.biosci.biotechnol.biochem.78(8):1293-1305;jana等人(2016)membrane-boundtetramerandtrimeraβoligomericspeciescorrelatewithtoxicitytowardsculturedneurons.jneurochem.136(3):594-608)。
因此,保护神经元免受aβ,特别是寡聚形式的aβ,被认为是ad治疗的潜在靶标。然而,ad患者已经历了显著的神经元损伤,因此除了神经保护之外,需要通过内源性神经干细胞分化导致的神经再生来用于ad的基础治疗。
mek(丝裂原激活的蛋白激酶激酶;也被称为map2k或mapkk)是map激酶(丝裂原激活的蛋白激酶;mapk)信号转导途径(在本文中写作‘mapk/erk途径’)的成员,其遵循ras-raf-mek-erk的顺序。当各种信号传导分子如生长因子、激素、细胞因子等结合至细胞膜受体并激活受体酪氨酸激酶时,蛋白rasgtp酶被激活,这导致细胞质raf募集至细胞膜。经激活的raf磷酸化并依序激活mek和erk,并且经激活的erk继而易位到核中以激活各种转录因子。然后这些转录因子结合至各种基因的启动子,以控制细胞增殖、分化和存活。因为mapk/erk信号转导途径在肿瘤细胞中被超激活,将所述激酶视为重要的靶标以抑制癌症和其它增殖性疾病中的疾病进展。
已知mek家族中存在7种蛋白(mek1-mek7),并且在这些蛋白中仅mek1和mek2参与ras-raf-mek-erk途径的信号转导。尽管mek1和mek2由不同的基因编码,在c-末端催化激酶结构域和大部分n-末端调控区内它们共有高的同一性(80%)。尽管mek1和mek2的致癌形式已见于人类癌症中,但已知mek的组成性激活显示出导致细胞转化。此外,mek还可由其它致癌基因激活。因此,已经研究了mek1和mek2的抑制作为抗癌药物开发的靶标。然而,尚不清楚mek1和mek2及mapk/erk途径对成体神经干细胞的增殖和分化起什么作用。
此外,有研究结果指示在阿尔茨海默氏病(ad)患者脑中的mapk/erk途径与aβ或τ蛋白之间存在联系。不幸的是,尚不清楚ad治疗是需要该信号传导途径的激活还是抑制,以及该信号转导途径的控制是否可能与ad治疗相关联。
存在有关以下的报道:在极早期阿尔茨海默氏病患者中的mapk/erk途径的蛋白表达水平增加(arendt等人(1995)increasedexpressionandsubcellulartranslocationofthemitogen-activatedproteinkinasekinaseandmitogen-activatedproteinkinaseinalzheimer’sdisease.neuroscience68(1):5-18;gartner等人(1999)elevatedexpressionofp21rasisanearlyeventinalzheimer’sdiseaseandprecedesneurofibrillarydegeneration.neuroscience91(1);1-5),在阿尔茨海默氏病患者脑中的erk1/2和mek1/2与τ的高度磷酸化之间存在相关性(pei等人(2002)up-regulationofmitogen-activatedproteinkinaseserk1/2andmek1/2isassociatedwiththeprogressionofneurofibrillarydegenerationinalzheimer'sdisease.brainresmolbrainres.109(1-2):45-55),以及在表达淀粉样前体蛋白(app)的b103细胞(小鼠神经母细胞瘤细胞)中增加的ras表达和erk1/2激活(chaput等人(2012)silac-basedproteomicanalysistoinvestigatedtheimpactofamyloidprecursorproteinexpressioninneuronal-likeb103cells.electrophoresis33(24):3728-3737)。
同时,其它研究已显示当激活erk1/2时,由aβ诱导的细胞凋亡受到抑制并且aβ累积减少(guerra等人(2004)plasmamembraneoestrogenreceptormediatesneuroprotectionagainstβ-amyloidtoxicitythroughactivationofraf-1/mek/erkcascadeinseptal-derivedcholinergicsn56cells.j.neurochem.91:99-109;watson等人(2005)macrophageinflammatorythroughactivationofmitogen-activatedproteinkinaseanphosphatidylinositol3-kinasesignalingpathway.molecularpharmacology67(3):757-765;mills等人(1997)regulationofamyloidprecursorproteincatabolisminvolvesthemitogen-activatedproteinkinasesignaltransductionpathway.j.neurosci.17:9415-9422)。此外,已经报道erk1/2降低了从app产生aβ的γ-分泌酶的活性,并且在氧化应激条件下降低了bace1(β-分泌酶1)的表达和活性(tamagno等人(2009)jnkanderk1/2pathwayshaveadualoppositeeffectontheexpressionofbace1.neurobiologyofaging30:1563-1573)。
因此,对与神经退行性疾病(如阿尔茨海默氏病)相关的mapk/erk途径调控及mek抑制的作用存在相互矛盾的观点,其尚未被清楚地阐明。
技术实现要素:
技术问题
本发明的发明人将提供用抑制mek1和mek2两者的化合物通过将神经干细胞分化为神经元以及保护神经干细胞和神经元免受aβ来诱导神经再生的方法。此外,本发明人将提供用抑制mek1和mek2两者的化合物来保护神经元免受神经元丢失或损伤的方法,以及预防或治疗由于神经元丢失或损伤导致的神经退行性疾病的方法。
技术方案
本发明人已经发现抑制mek1和mek2两者的化合物(本文被称为“mek1/2抑制剂”),特别是由[式1]表示的化合物可有效地诱导神经干细胞分化为神经元;更特别地,其保护神经干细胞和神经元免受β-淀粉样蛋白,同时其诱导神经干细胞分化为神经元。
[式1]
本发明的一方面涉及包含[式1]的化合物的诱导神经干细胞分化的组合物。该组合物不引发神经干细胞中的癌性生长。
诱导神经干细胞分化的组合物甚至在β-淀粉样蛋白的存在下诱导神经干细胞分化为神经元。
由诱导神经干细胞分化的组合物诱导神经元分化可为抑制mek1和mek2两者的结果。
本组合物可包含除[式1]的化合物之外的特异性mek1/2抑制剂。该组合物甚至在β-淀粉样蛋白的存在下诱导神经干细胞分化为神经元。
本发明的另一方面涉及使用诱导神经干细胞分化的组合物将神经干细胞分化为神经元的方法。
分化方法可由以下组成:用诱导神经干细胞分化的组合物处理神经干细胞,并允许1至7天用于分化完成。
本发明的另一方面涉及[式1]的化合物,其用于诱导神经干细胞分化,特别是用于保护神经干细胞和神经元,及将神经干细胞分化为神经元,甚至在β-淀粉样蛋白的存在下。本发明的又一方面涉及特异性mek1/2抑制剂,其用于诱导神经干细胞分化,特别是用于保护神经干细胞和神经元,及将神经干细胞分化为神经元,甚至在β-淀粉样蛋白的存在下。
本发明的另一方面涉及用于诱导神经干细胞体外分化为神经元的试剂盒。该试剂盒可包括诱导神经干细胞分化的组合物、培养基、板、涂覆溶液和用于培养细胞所需要的添加剂如生长因子等。
本发明的另一方面涉及诱导神经再生的方法,其包括向有需要的患者施用特异性mek1/2抑制剂。在本发明中,mek1/2抑制剂通过将神经干细胞分化为神经元、通过保护神经干细胞和神经元免受β-淀粉样蛋白的细胞毒性或通过以上的两者诱导神经再生。用于该方法的最优选的mek1/2抑制剂是[式1]的化合物。本发明的另一方面涉及特异性mek1/2抑制剂,特别是[式1]的化合物,用于诱导神经再生。
本发明的另一方面涉及保护神经元免受神经元丢失或损伤的方法,其包括向有需要的患者施用特异性mek1/2抑制剂。用于该方法的最优选的mek1/2抑制剂是[式1]的化合物。本发明的另一方面涉及特异性mek1/2抑制剂,特别是[式1]的化合物,其用于保护神经元免受神经元丢失或损伤。
本发明的另一方面涉及用于预防或治疗神经退行性疾病的包含[式1]的化合物作为其活性成分的药物组合物,或使用[式1]的化合物预防或治疗神经退行性疾病的方法。
神经退行性疾病涉及在各个系统(如运动控制、认知、知觉、感觉功能和自主神经系统)中由于神经元功能的丢失或降低导致的功能性病症。神经退行性疾病的实例包括:痴呆、阿尔茨海默氏病(ad)、血管性痴呆、老年性痴呆、额颞叶痴呆(ftd)、路易体痴呆(lewybodydementia,lbd)、帕金森氏病(pd)、多系统萎缩症(msa)、皮质基底变性(cbd)、进行性核上性麻痹(psp)、亨廷顿氏病(huntington’sdisease,hd)、肌萎缩侧索硬化(als,卢·格里克病(lou-gehrig’sdisease))、原发性侧索硬化(pls)、进行性延髓麻痹(pbp)、进行性肌萎缩(pma)、假性延髓麻痹、遗传性痉挛性截瘫(hsp)、小脑性共济失调、克罗伊茨费尔特-雅各布病(creutzfeldt-jakobdisease,cjd)、多发性硬化(ms)、格林-巴利综合征(guillain-barrésyndrome,gbs)等。
所述药物组合物或方法可包括或使用除了[式1]的化合物之外的其他特异性mek1/2抑制剂。
本发明的另一方面涉及用于预防和治疗神经退行性疾病的[式1]的化合物。此外,其涉及用于预防和治疗神经退行性疾病的特异性mek1/2抑制剂。
本发明的另一方面涉及筛选诱导神经干细胞分化为神经元且在神经退行性疾病模拟的环境如阿尔茨海默氏病中保护它们的化合物的方法。根据本发明的筛选方法包括以下步骤:
1)用诱导神经元损伤的物质如β-淀粉样蛋白(特别是以其寡聚形式)、mptp(1-甲基-4-苯基-1,2,3,6-四氢吡啶)、鱼藤酮(rotenone)、羟多巴胺(oxidopamine)、谷氨酸(glutamate)、lps(脂多糖)、s100b(s100钙结合蛋白b)处理从成年小鼠分离的神经干细胞;
2)将测试材料添加至用以上诱导神经元损伤的物质处理的神经干细胞;和
3)通过形态分析检测神经干细胞的分化或死亡。
以下将详细地描述本发明的各个方面和实施方案。
如在本发明的本文中所用,“神经干细胞”是指具有以未分化的状态持续增殖的能力(自我更新)和从一种干细胞分化为各种神经元和神经胶质细胞的能力(多能性)。神经干细胞是动物来源的。术语动物不仅是指人和灵长类动物,但还意在包括诸如牛、猪、绵羊、马、小鼠、大鼠、猫等的动物,且优选人类。在一些情况下,术语“神经干细胞”用于包括“神经祖细胞”。
如在本发明的本文中所用,术语“分化”是指细胞发育为特化细胞。更特别地,其是指其中通过细胞分裂、细胞增殖和生长使细胞的结构或功能变为特化的现象,且是指细胞和组织的结构(形态)或功能的变化以执行它们所分配的任务。神经干细胞的分化在母细胞不对称分裂为具有不同性质的两种细胞之后进行。子细胞之一与作为干细胞保留的母细胞相同,而另一细胞则分化为特化细胞。这种不对称分裂过程伴随神经干细胞分化的事实,表示“神经干细胞的分化”包含“增殖”的含义。
如在本发明的本文中所用,术语“增殖”是指细胞分裂和增殖的现象。这特别是指通过细胞分裂导致的相同类型细胞的增加,通过完全相同形式细胞的再生导致的细胞数增加。
如在本发明的本文中所用,术语“保护”是指预防细胞免受有害外部刺激的损伤,使得神经干细胞可在不经历细胞死亡的情况下增殖或分化,并且经分化的神经元可在细胞毒性因子特别是β-淀粉样蛋白的存在下存活。关于ad,在本发明中的术语“保护”包括通过降低脑中的aβ(1-42)/aβ(1-40)比率来保护神经干细胞和神经元免受由β-淀粉样蛋白导致的损伤的方面(majid等人(2015)pharmacologictreatmentwithhistonedeacetylase6inhibitor(acy-738)recoversalzheimer’sdiseasephenotypeinamyloidprecursorprotein/presenilin1(app/ps1)mice.alzheimersdement.170-181;borchelt等人(1996)familialalzheimer’sdisease-linkedpresenilin1variantselevateaβ1–42/1–40ratioinvitroandinvivo.neuron.17:1005–1013)。
如在本发明的本文中所用,术语“预防”是指通过施用本发明的药物组合物来抑制或延缓神经退行性疾病进展的所有活动。“治疗”是指缓解疑似或诊断的神经退行性患者中的症状或改善疾病状态的所有活动。
本发明的一方面涉及诱导神经干细胞分化的组合物,其包含表示为[式1]的化合物。
[式1]
以上表示为[式1]的化合物的通用名是曲美替尼,,且其化学名是n-(3-{3-环丙基-5-[(2-氟-4-碘苯基)氨基]-6,8-二甲基-2,4,7-三氧代-3,4,6,7-四氢吡啶并[4,3-d]嘧啶-1(2h)-基}苯基)乙酰胺。其公开于wo2005/121142的实施例4-1中,申请人是日本烟草公司(japantobaccoinc)。[式1]的化合物抑制mek1和mek2两者,在mapk/erk(丝裂原激活的蛋白激酶/胞外调控的激酶)信号转导途径中erk的上游组分。该化合物用作针对黑素瘤和非小细胞癌症的癌症药物。在本发明中,其以游离碱或药学上可接受的盐或溶剂化物的形式使用。可能的溶剂化物的实例是水合物、二甲亚砜、乙酸、乙醇、硝基甲烷、氯苯、1-戊醇、异丙醇、乙二醇、3-甲基-1-丁醇等。
特别地,本发明的一方面涉及包含[式1]的化合物的组合物,其保护神经干细胞和神经元并且使神经干细胞分化为神经元。β-淀粉样蛋白在脑中以淀粉样斑块累积,且与突触损伤、神经元损伤和脑萎缩相关,且已知最终引起阿尔茨海默氏病、记忆和认知失调的典型症状。因此,保护神经干细胞和神经元免受β-淀粉样蛋白并同时通过内源性神经干细胞的分化来再生神经元,可构成阿尔茨海默氏病的基础治疗。
由42个氨基酸组成的aβ(1-42)比aβ(1-40)具有更高倾向形成聚集物,以及具有更高倾向形成更具毒性的三聚物或四聚物,且因此被认为与阿尔茨海默氏病的病理状态强相关。因此,可甚至在aβ(1-42)特别是aβ(1-42)寡聚体的存在下,保护且分化神经干细胞的组合物是优选的。
如在测试实施例中所示,出于寻找诱导小鼠神经干细胞分化为神经元的组合物的目的,本发明人已确认[式1]的化合物非常有效地诱导从小鼠胚胎或成体脑分离的神经干细胞分化为神经元。
神经干细胞具有分化为各种神经元或神经胶质细胞如少突细胞、星形胶质细胞和小神经胶质细胞的能力。[式1]的化合物将神经干细胞大部分分化为神经元,并且限制分化为神经胶质细胞。因此,[式1]的化合物可有效地诱导神经元产生(神经形成),从而允许在具有神经元损伤的神经退行性疾病患者脑中用这些“新”神经元替代受损伤的神经元,且可用作促进神经的再生或神经再生的药物。
根据本发明的特定实例,本发明人通过刺激阿尔茨海默氏病患者的脑环境的寡聚aβ-体外处理实验已确定,[式1]的化合物保护免受神经干细胞或神经元的死亡,且诱导神经干细胞分化为神经元(图2)。
此外,本发明的一方面涉及包含抑制mek1和mek2两者的特定化合物的诱导神经干细胞分化的组合物。在本发明中,抑制mek1和mek2两者的化合物,也被称为“mek1/2抑制剂”。“mek1/2抑制剂”优选具有以nm水平计的ic50值,并且mek1和mek2的ic50值的差异小于10×、优选小于5×。mek1和2的ic50可通过参考文献中的方法测量,如[yamaguchi等人(2011)internationaljournalofoncology39:23-31]。可用于本发明中的mek1/2抑制剂是诱导神经干细胞分化为神经元并同时保护神经干细胞和神经元免受毒性材料如aβ的化合物。可用于本发明中的mek1/2抑制剂的实例如下:曲美替尼、皮马瑟替(pimasertib,as703026)、azd8330、比尼替尼(binimetinib,mek162,arry-162,arry-438162)、瑞美替尼(refametinib,rdea119,bay86-9766)、pd318088、pd0325901、ro5126766。
如下列出了优选的mek1/2抑制剂的化学结构和它们的ic50值,以及描述测量ic50值的方法的参考文献:
[表1]
此外,本发明的一方面涉及组合物,其包含用于将神经干细胞分化为神经元并同时保护神经干细胞和神经元免受β-淀粉样蛋白特别是寡聚aβ(1-42)形式的mek1/2抑制剂。
使用mek1或mek2的选择性抑制剂,而不是抑制mek1和mek2两者的mek1/2抑制剂是不可取的,因为其诱导神经干细胞分化的活性较弱。例如,考比替尼(cobimetinib)是mek1-选择性抑制剂,其显示出针对mek1的选择性是针对mek2的选择性的100x或更佳(mek1ic50=0.95nm,mek2ic50=199nm;分子2017;22:1551)。不像mek1/2抑制剂,考比替尼甚至在10μm的高浓度下不诱导小鼠成体神经干细胞的分化,无论处理或不处理β-淀粉样蛋白(实施例7)。
此外,mek1和mek2两者的抑制参与诱导nsc分化为神经元且保护nsc和神经元的事实,通过实施例5中的实验得以确认。这些实验使用shrna(短发夹rna)抑制mek1和mek2表达,并且使用具有组成型活性mek1(camek1)和组成型活性mek2(camek2)的质粒以激活mek1和mek2表达(实施例5)。
然而,并非所有的mek1/2抑制剂显示出相同的作用。例如,mek1/2抑制剂u0126、pd184352和bi847325显示出较弱的诱导神经干细胞(nsc)分化为神经元的作用或引起的细胞毒性,使得它们不适合用作本发明的诱导神经干细胞分化的组合物(图10a和图10c)。因此,诱导nsc分化为神经元的活性或者nsc和神经元保护活性可不同,这取决于该化合物除了其mek1/2抑制活性之外所具有的不同的独特性质。在本发明中,显示出诱导nsc分化为神经元的活性或者nsc和神经元保护活性的mek1/2抑制剂是曲美替尼、皮马瑟替(as703026)、azd8330、比尼替尼、瑞美替尼、pd318088、pd0325901和ro5126766。
特别地,[式1]的化合物(曲美替尼)显示了甚至当与可用于本发明中的其它mek1/2抑制剂比较时,针对aβ显著较优的分化和保护能力。例如,[式1]的化合物显示了相比as703026,在100x或更高的更低浓度下针对aβ的显著较优的分化和保护能力。[式1]的化合物的该作用显著优于仅所预测的其mek1/2抑制活性的作用。
[式1]的化合物从未用于诱导神经干细胞分化为神经元的目的,且已被仅作为通过atp非竞争性结合来抑制mek1和mek2两者活性的mek1/2抑制剂,以及作为黑素瘤和非小细胞癌症治疗药物。
本发明的另一方面涉及使用[式1]的化合物或其它mek1/2抑制剂来诱导ncs分化为神经元的方法。
如对于本发明中公开的方法,神经干细胞可根据已知的方法分离自胚胎或成体脑。可替代地,神经干细胞可购自市场,或可通过本领域已知的任何常规方法培养。对于上述内容无特定限制。在随后的实施例部分,使用从14.5日小鼠胚胎的额叶和8周龄小鼠的室管膜下区分离的神经干细胞。
在分化前,可将神经干细胞接种至培养基中并在37℃下培养。培养基可为无特定限制的补充有任何生长因子的无血清培养基。培养基可为例如,达尔伯克氏改良型伊格尔培养基(dulbecco’smodifiedeagle’smedium)/营养混合液f12(dmem/f12)(1:1),其添加有选自以下的一种或多种培养基组分:90-110μm腐胺、20-40nm亚硒酸盐、10-30nm黄体酮、1.0-2.0mg/mld-(+)葡萄糖、20-30μg/ml胰岛素、0.05-0.2mg/ml脱铁转铁蛋白(apo-transferrin)、0.3-0.6mmglutamax、50-150iu/ml青霉素和50-150μg/ml链霉素,并且进一步添加选自以下的生长因子:10-30ng/mlbfgf、10-30ng/mlegf或其混合物。
可在补充有生长因子的n2培养基[达尔伯克氏改良型伊格尔培养基(dmem/f12(1:1),其补充有100μm腐胺、30nm亚硒酸盐、20nm黄体酮、1.55mg/mld-(+)-葡萄糖、25μg/ml胰岛素、0.1mg/ml脱铁转铁蛋白、0.5mmglutamax、100iu/ml青霉素和100μg/ml链霉素)]中培养神经干细胞,以获得未分化的神经干细胞。
经培养的神经干细胞分化为神经元,涉及用包含[式1]的化合物的诱导分化的组合物处理神经干细胞,然后根据本领域已知的方法使其分化。例如,将本发明的诱导神经干细胞分化的组合物添加至含有经培养的神经干细胞的培养基,并且在37℃下诱导分化。
神经干细胞通过分化过程在以上提及的各种培养条件(如,培养基组分的含量和数量和培养时间段)下分化为神经元。培养条件不特别地限于以上提及的条件。优选地,培养温度为35℃至40℃,在此温度下可诱导神经干细胞的分化。如果培养温度低于35℃或超过40℃,神经干细胞在分化为神经元之前经历细胞死亡。
在添加包含[式1]的化合物的诱导神经干细胞分化的组合物之前,优选的是确保神经干细胞培养物中足够浓度的细胞。此外,为了观察培养基中的变化如细胞增殖、分化或死亡,优选通过上述方法,在7天或更少的培养时间段内,用包含[式1]的化合物的诱导神经干细胞分化的组合物处理神经干细胞。为此,神经干细胞的培养时间段优选为至少1天至最多7天以确保足够浓度的细胞。
如对于[式1]的化合物的浓度,优选将其以1nm至20μm的浓度添加至神经干细胞。如果浓度小于1nm则诱导神经干细胞分化的能力降低,如果其大于20μm则细胞细胞毒性变成了问题。对于添加化合物,通常将神经干细胞接种至板孔中以覆盖高达70-80%的孔表面。例如,将1x105个细胞/孔接种到12孔板中,5x105个细胞/孔接种到6孔板中。
此外,如随后在实施例部分将解释的,优选使用浓度为10nm至10μm,更优选10nm至100nm的[式1]的化合物。如果浓度小于10nm,则诱导分化花费的时间增加,这是不经济的。然而,如果其大于10μm,则作为活性成分的[式1]的化合物变得过量,并且在随后的体内施用后,mek1和mek2的抑制可变得太强,可影响许多胞内信号传导途径,从而可引起许多不良反应。
在添加包含作为mek1和mek2两者的抑制剂的[式1]化合物的诱导神经干细胞分化的组合物至神经干细胞培养物之后,完成分化过程花费1至7天,优选约3至5天。
发明有益效果
当将本发明的诱导神经干细胞分化的组合物施加至神经退行性疾病患者时,其诱导患者脑中的神经干细胞分化为神经元,且允许损伤或丢失的神经元被“新制备的”神经元替代。即,本发明的组合物通过从神经干细胞进行神经形成来诱导神经的再生或神经再生。因此,该组合物可用于预防或治疗神经退行性疾病。在本发明中,“神经形成”表示从神经干细胞产生神经元,且“神经的再生”或“神经再生”表示通过神经形成来进行的由于神经元细胞死亡而退化的神经系统的组织和功能再生。此外,本发明的组合物可通过保护神经干细胞或神经元免受β-淀粉样蛋白寡聚体来发挥治疗或预防作用。
此外,本发明的应用可广泛地用作检测药物效果或开发用于神经退行性疾病的新型药物的众多研究的材料。
附图说明
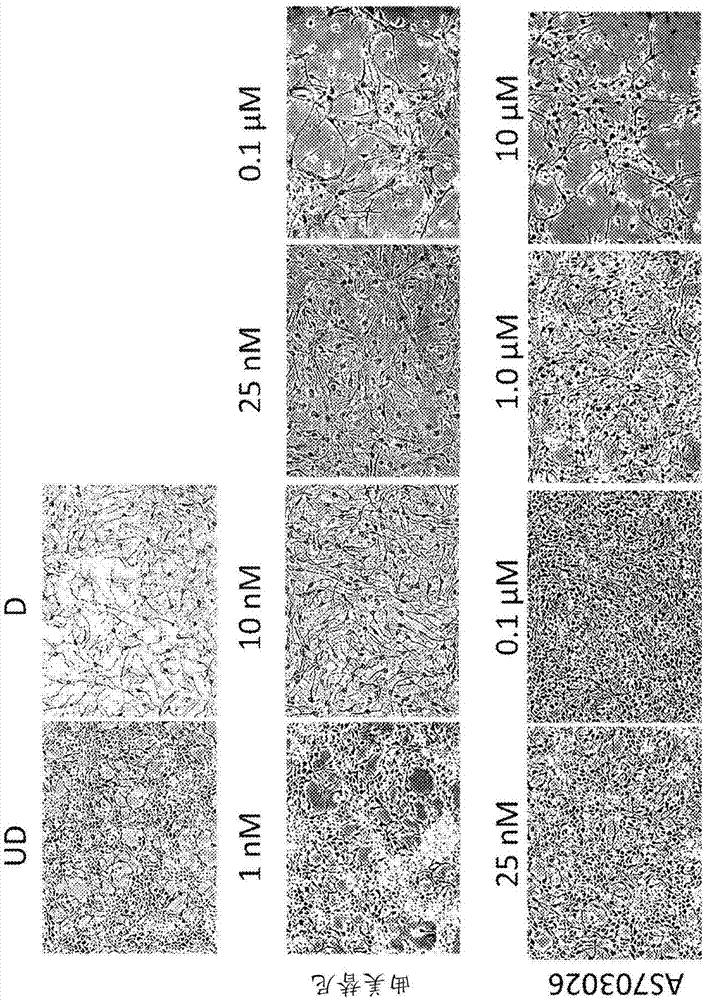
图1是实施例1的形态分析,其中当用各种浓度的曲美替尼和皮马瑟替(as703026)处理时,通过相差显微术(phase-contractmicroscopy)观察到小鼠胚胎神经干细胞分化为神经元。ud和d分别是从实施例1步骤1a获得的未分化的小鼠胚胎神经干细胞,以及从步骤1b获得的分化的小鼠胚胎神经干细胞,它们未用任何测试材料处理。
图2是实施例2的形态分析,其中下行显示了用10μm寡聚的β-淀粉样蛋白(aβ1-42)处理的小鼠成体神经干细胞的结果,并且上行显示了未用β-淀粉样蛋白处理的神经干细胞。ud和d分别是未用任何测试材料处理的从实施例2步骤1a获得的未分化的小鼠成体神经干细胞,以及从步骤1b获得的分化的小鼠成体神经干细胞。曲美替尼(10nm)、曲美替尼(100nm)、美金刚(5μm)、美金刚(10μm)和as703026(10μm)是当用相应浓度的各种测试材料处理从实施例2步骤1a获得的未分化的小鼠成体神经干细胞时所获得的结果。
图3是根据比较实施例1,用10μm寡聚的β-淀粉样蛋白处理(下行)或未处理(上行)的小鼠胚胎14.5天神经干细胞的细胞形态分析的比较。ud(未分化的)和d(分化的)分别是未用任何测试材料处理的从比较实施例1步骤1获得的未分化的和分化的小鼠胚胎神经干细胞。曲美替尼(100nm)、美金刚(10μm)和as703026(10μm)是当用相应浓度的各测试材料处理从比较实施例1步骤中获得的未分化的小鼠胚胎神经干细胞时所获得的结果。
图4是实施例3的荧光显微术图像。在第一行中,ud和d分别是未用任何测试材料处理的未分化的和分化的胚胎神经干细胞。第二行和第三行是用相应浓度的曲美替尼和as703026处理的细胞的图像。蓝色点代表用dapi染色的细胞核,并且具有红色的长而细小分枝的细胞代表用罗丹明-偶联的tuj1染色的神经元。
图5显示了实施例4-1的结果,其显示了在用各种浓度的曲美替尼和as703026处理的小鼠胚胎神经干细胞中,神经元-特异性标志物tuj1(图5a)和多巴胺能神经元标志物th(图5b)的相对mrna表达水平。
图6是实施例4-2的结果的一部分,其显示了在用各种浓度的曲美替尼处理的小鼠胚胎神经干细胞中,多巴胺能神经元标志物th(图6a)、胆碱能神经元标志物chat(图6b)、运动神经元标志物isl1(图6c)和gaba能神经元标志物gad1(图6d)的相对mrna表达水平。
图7是实施例4-2的结果的一部分,其显示了在用10nm曲美替尼(tra)和10μmas703026(as)处理的小鼠成体神经元干细胞中,神经元标志物tuj1(图7a)、胆碱能神经元标志物chat(图7b)和多巴胺能神经元标志物th(图7c)的相对mrna表达水平。
图8a是实施例5-1的结果,其通过rt-pcr确认了多巴胺能神经元标志物th的表达的存在或不存在,以分析其中mek1或者mek1和mek2两者的表达受抑制的小鼠胚胎神经干细胞分化为神经元的能力。
图8b是实施例5-1的结果的一部分,其显示了其中mek1或mek2或者mek1和mek2两者的表达受到shmek1和shmek2抑制的小鼠胚胎神经干细胞中tuj1和th的相对mrna表达水平,并且通过蛋白质印迹确认了tuj1和th蛋白的存在或不存在。
图8c是实施例5-2的结果的一部分,其显示了其中mek1或mek2或者mek1和mek2两者的表达被camek1和camek2激活的小鼠胚胎神经干细胞中tuj1和th的相对mrna表达水平,并且通过蛋白质印迹确认了tuj1和th蛋白的存在或不存在。
图9是实施例5-3的结果,其显示了在其中mek1或mek2或者mek1和mek2两者的表达均被shmek1和shmek2抑制的aβ-处理或未处理的小鼠成体神经干细胞中,如通过相差显微术所见的细胞形态观察结果(图9a),以及神经元标志物tuj1的相对mrna表达水平的分析(图9b)。
图10是实施例6的结果,其显示了在用0.1μm、1.0μm和10μm浓度的mek1/2抑制剂曲美替尼、azd8330、pd184352、瑞美替尼、pd318088、比尼替尼和as703026处理的小鼠胚胎神经干细胞中,如通过相差显微术所见的细胞形态观察结果(图10a),以及tuj1的相对mrna表达水平(图10b)。图10c是用pd0325901、ro5126766、bi847325和u0126处理的小鼠成体神经干细胞的相差显微术观察结果(图10c)。
图11是实施例7的结果,其显示了如经aβ-处理的或未处理的小鼠成体神经干细胞通过相差显微术所见的细胞形态观察结果,所述神经干细胞然后用mek1/2抑制剂曲美替尼(0.1μm)、as703026(10μm)、azd8330(1μm)、pd318088(1μm)、比尼替尼(10μm)、瑞美替尼(1μm)、pd0325901(10μm)、ro5126766(10μm)和考比替尼(10μm)(相比mek2,已知考比替尼为mek1的选择性抑制剂)进行处理。用“-“标记的行是未用β-淀粉样蛋白处理的细胞,且用“aβ1-42”标记的行是用10μmβ-淀粉样蛋白处理的细胞。
图12是实施例8的结果的一部分,其显示了施用曲美替尼的5xfad小鼠的体感皮质的切片中的neun免疫组织化学染色(图12a)。图12b显示了施用曲美替尼的小鼠中neun染色细胞与仅施用媒介物的对照相比的定量细胞数比率(图12b)。
图13是实施例8的结果的一部分,其显示了施用曲美替尼的5xfad小鼠的运动皮质的切片中的neun免疫组织化学染色(图13a)。图13b显示了施用曲美替尼的小鼠中neun染色细胞与仅施用媒介物的对照相比的定量细胞数比率(图13b)。
图14是实施例8的结果的一部分,其显示了施用曲美替尼的5xfad小鼠的海马体下托的切片中的neun免疫组织化学染色(图14a)。图14b显示了施用曲美替尼的小鼠中neun染色细胞与仅施用媒介物的对照相比的定量细胞数比率(图14b)。
图15是实施例9-1的结果,其显示了施用曲美替尼的5xfad小鼠的体感皮质的切片中的tuj1免疫组织化学染色。在图片中,用箭头(→)标记的部分表示用tuj1染色的细胞,且用箭头状物(▼)标记的部分表示由β-淀粉样蛋白聚集形成的斑块。
图16是实施例9-2和9-3的结果,其显示了施用曲美替尼的5xfad小鼠的海马体齿状回的切片中的尼氏(nissl)、neun、dcx和brdu染色(图16a)和brdu-标记的细胞的定量(图16b)。在图16a中,用箭头(→)标记的部分表示用dcx染色的细胞,且用箭头状物(▼)标记的部分表示用brdu标记的细胞。
图17是实施例10的结果,其显示了施用曲美替尼的5xfad小鼠的海马体下托和体感皮质的切片中的tunel(末端脱氧核苷酸转移酶dutp缺口末端标记)染色(一种细胞凋亡的指标)。用箭头(→)表示已经经历细胞凋亡并显示绿色荧光的海马体下托中的细胞。
图18是实施例11的结果,其显示了施用曲美替尼的5xfad小鼠的小脑切片中的通过tuj1和钙结合蛋白染色的浦肯野细胞(purkinjecells)。显示了每组的两张(tuj1染色)或三张(钙结合蛋白染色)幻灯片图片。
图19是实施例12的结果,其使用施用曲美替尼的5xfad小鼠的脑半球,通过蛋白质印迹来验证perk蛋白的存在或不存在(图19a);图19b是perk蛋白水平的定量(图19b)。
图20是实施例13的结果,其使用施用曲美替尼的5xfad小鼠的大脑半球,通过elisa(酶联免疫吸附测定)显示了aβ40和aβ42的定量及比率(aβ42/aβ40)。
附图的图表中的星号(*)标记,通过统计t-检验结果表示如下:*:p<0.05,**:p<0.01,***:p<0.005。
发明的实施最佳方式
当用本发明的[式1]的化合物处理神经干细胞时,本发明人看到神经元标志物tuj1中表达水平增加,并且所有以下物质中表达水平增加:多巴胺能神经元标志物th、gaba能神经元标志物gad1、运动神经元标志物isl1和胆碱能神经元标志物chat(实施例4)。这表示[式1]的化合物可以将神经干细胞分化成各种类型的神经元,如多巴胺能神经元、gaba能神经元、胆碱能神经元和运动神经元。因此,[式1]的化合物可用于治疗由各种神经元丢失或损伤导致的各种神经退行性疾病。例如,帕金森氏病通常与多巴胺能神经元丢失有关,运动神经元疾病如卢·格里克病/als、进行性延髓麻痹(pbp)、进行性肌萎缩(pma)、原发性侧索硬化(pls)、假性延髓麻痹(pba)和遗传性痉挛性截瘫(hsp)均与运动神经元丢失有关,以及痴呆如阿尔茨海默氏病、血管性痴呆和老年性痴呆通常与胆碱能神经元丢失有关。此外,亨廷顿氏病通常与基底神经节纹状体中gaba能中型多棘神经元的丢失有关。
特别地,因为[式1]的化合物允许神经干细胞分化为神经元并同时保护它们免受aβ(即阿尔茨海默氏病的主要神经病理学特征),所以它可以有效地应用于治疗阿尔茨海默氏病。
本发明人已经确认,[式1]的化合物增加了表达人阿尔茨海默氏基因的阿尔茨海默氏小鼠模型(5xfad)中下托和脑皮质层5的区域中的神经元数目(实施例8)。5xfad小鼠携带app(淀粉样前体蛋白)和早老素(psen1)的基因突变,已知其导致人类家族性阿尔茨海默氏病,以及在下托和脑皮质层5中累积高水平的淀粉样沉积并伴随着这些区域中的神经元丢失。[式1]的化合物增加5xfad小鼠模型中神经元数目的发现,支持[式1]的化合物在体内诱导神经干细胞分化为神经元以增加神经元数目和/或保护神经元免受类β-淀粉样蛋白的事实。
此外,当与对照相比时,[式1]的化合物增加了5xfad小鼠的脑皮质的各区域,特别是运动皮质和体感皮质区中的神经元数目(实施例8,图12、13)。这显示了[式1]的化合物可用于治疗由此区域中的神经元丢失导致的运动神经元疾病如als。
此外,当与对照相比时,[式1]的化合物增加了5xfad小鼠小脑中浦肯野细胞(purkinjecells)的轴突分枝或保守的轴突结构(实施例11,图18)。这显示了[式1]的化合物可用于治疗由小脑浦肯野细胞丢失或损伤导致的小脑性共济失调。
[式1]的化合物产生新神经元(神经形成)、保护神经元,或者两者兼有,并且通过这一点具有诱导神经的再生或神经再生的作用。如实施例9的结果所示,[式1]的化合物增加了在阿尔茨海默模型小鼠(5xfad)的体感皮质区中的神经元标志物tuj1(在神经形成过程中的神经元标志物)的表达,增加了在齿状回的颗粒下区(sgz)中2型或3型形状的细胞(特别在神经形成期间出现)的数目(在图16中的尼氏和neun染色结果),并增加了由brdu染色的表达dcx的未成熟神经元细胞和分裂细胞的数目(图16)。这些结果支持曲美替尼诱导了小鼠的脑皮质和海马体齿状回中的神经形成。
此外,如在5xfad小鼠中通过tunel测定法所检测,[式1]的化合物减少了死亡细胞数目(实施例10,图17),增加了小脑浦肯野细胞的轴突分枝或保守的轴突结构(实施例11,图18),并减少了5xfad小鼠脑组织中aβ(1-42)/aβ(1-40)的比率(实施例13,图20)。这显示了[式1]的化合物可以在神经元损伤和丢失发生的环境中通过保护神经元并改善它们的条件或活性,而在神经再生中发挥作用。
因此,本发明的另一方面涉及包含[式1]的化合物作为活性成分的用于预防和治疗神经退行性疾病的药物组合物,还涉及使用[式1]的化合物预防和治疗神经退行性疾病的方法,以及涉及用于预防和治疗神经退行性疾病的[式1]的化合物。在本发明中,可以使用将nsc分化成神经元并同时保护它们免受诸如aβ的毒性物质的其它mek1/2抑制剂来替代[式1]的化合物,但是特别优选使用[式1]的化合物。
如上所提及,神经退行性疾病表示由神经元的结构和功能逐渐丢失所导致的精神和身体的功能退化。特别地,它包括选自以下的病症:痴呆、阿尔茨海默氏病、血管性痴呆、老年性痴呆、额颞叶痴呆、路易体痴呆、帕金森氏病、多系统萎缩、皮质基底变性、进行性核上性麻痹、亨廷顿氏病、卢·格里克病/als、原发性侧索硬化、脊髓性肌萎缩、进行性延髓麻痹(pbp)、进行性肌萎缩(pma)、假性延髓麻痹、遗传性痉挛性截瘫(hsp)、小脑性共济失调、克罗伊茨费尔特-雅各布病、多发性硬化症、格林-巴利综合征等。
特别地,因为[式1]的化合物即使在比以前用于其抗癌活性的浓度更低的浓度下也显示出显著的诱导分化作用和保护神经作用,所以其可以用比用于癌症治疗的剂量更低的剂量安全施用。当使用[式1]的化合物作为癌症药物时,推荐剂量为每天2mg,并且如果因副作用需要更低的剂量,则将剂量降至每天一次1.5mg,然后降至每天一次1mg。在本发明中,我们确认了[式1]的化合物在5xfad小鼠实验中在低至0.1mg/kg/天的剂量下显示出诱导神经干细胞分化的活性。当将这个剂量针对60kg人调整转换时,其转化为0.48mg/天(journalofbasicandclinicalpharmacy,7(2),27-31,2016)。
在本申请中,术语'包含作为活性成分'表示包括足够的所述成分以抑制与本发明相关的神经退行性疾病。
可将本发明的预防性或治疗性组合物制成本领域常用的制剂,例如口服药物或肠胃外药物如注射剂。
本发明的药物组合物可以包含药物制剂中常用的适合载体、赋形剂和稀释剂,并且可被配制成以下形式:口服制剂如粉剂、颗粒剂、片剂、胶囊剂、悬浮剂、乳剂、糖浆剂、气雾剂等,或局部制剂、栓剂、贴剂和无菌注射溶液。
可包含在本发明的组合物中的载体、赋形剂和稀释剂为:乳糖、右旋糖、蔗糖、山梨糖醇、甘露糖醇、木糖醇、赤藓糖醇、麦芽糖醇、淀粉、阿拉伯胶、海藻酸盐、明胶、磷酸钙、硅酸钙、纤维素、甲基纤维素、微晶纤维素、交联羧甲基纤维素钠、羟丙基甲基纤维素、聚乙烯吡咯烷酮、水、羟苯甲酸甲酯、羟苯甲酸丙酯、滑石、硬脂酸镁、月桂基硫酸钠、胶体二氧化硅、交联羧甲基纤维素钠、矿物油等。
将通常使用的稀释剂和赋形剂如填充剂、增量剂、粘合剂、润湿剂、崩解剂和表面活性剂用于药物制剂。用于口服施用的固体制剂包括片剂、丸剂、粉剂、颗粒剂、胶囊剂等。通过向本发明的组合物中加入至少一种赋形剂如淀粉、碳酸钙、蔗糖、乳糖或明胶来制备固体制剂。除了简单的赋形剂之外,还使用诸如硬脂酸镁和滑石的润滑剂。用于口服施用的液体制剂包括混悬剂、内用液体、乳剂、糖浆剂等,并且除了常用的简单稀释剂如水和液体石蜡之外,它们可以包含各种赋形剂如润湿剂、甜味剂、香料、防腐剂等。用于肠胃外施用的制剂包括无菌水溶液、非水溶液、混悬剂、乳剂、冷冻干燥制剂、栓剂和贴剂。对于非水溶液和混悬剂,可以使用丙二醇、聚乙二醇、诸如橄榄油的植物油和诸如油酸乙酯的可注射酯。witepsol、macrogol、tween61、可可脂、月桂酸脂、甘油明胶等可用于栓剂基质。
本发明的组合物可以口服或胃肠外施用,并可以是全身或局部施用。
本发明的治疗性组合物的推荐剂量可以根据患者状况、患者体重、疾病严重程度、药物形式、施用途径、治疗时间段等变化,并且可以相应地由本领域技术人员确定。例如,本发明的组合物可以用0.0001至10g/kg、优选0.001至8mg/kg的剂量每天施用一次。所述剂量可以是每天一次或分成每天若干次。优选地,[式1]的化合物可以用0.1mg至10mg、0.1mg至5mg、0.1mg至2mg、0.1mg至1mg、0.1mg至0.5mg、0.25mg至2mg、0.25mg至1mg、0.25mg至0.5mg、0.5mg至2mg、0.5mg至1mg范围内的剂量每天施用一次。例如,[式1]的化合物可以用0.1mg、0.125mg、0.25mg、0.5mg、0.75mg、1mg、1.5mg或2mg的剂量每天施用一次。
在本发明的另一方面,本发明公开了筛选在神经退行性疾病模拟环境(如阿尔茨海默氏病)中诱导神经干细胞分化为神经元并同时保护nsc和神经元的材料的方法。筛选方法利用诱导神经元损伤的物质如β-淀粉样蛋白、mptp(1-甲基-4-苯基-1,2,3,6-四氢吡啶)、鱼藤酮、羟多巴胺、谷氨酸、lps(脂多糖)和s100b(s100钙结合蛋白b)以及源自小鼠的神经干细胞,并包括以下步骤:
1)用诱导神经元损伤的物质如β-淀粉样蛋白(特别是呈其寡聚形式)、mptp(1-甲基-4-苯基-1,2,3,6-四氢吡啶)、鱼藤酮、羟多巴胺、谷氨酸、lps(脂多糖)、s100b(s100钙结合蛋白b)处理从成年小鼠分离的神经干细胞;
2)将测试材料添加至用以上诱导神经元损伤的物质处理的神经干细胞;和
3)通过形态分析检测神经干细胞的分化或死亡。
在该筛选方法中,优选地,使用源自小鼠的神经干细胞。使用来自动物(如小鼠)的神经干细胞,其相比人类神经干细胞具有更简单的细胞培养方法和更少争议的伦理问题的优势。人类神经干细胞培养需要频繁的培养基替代和昂贵的生长因子,而小鼠神经干细胞培养不需要。人类神经干细胞培养各需要7天才能进行细胞扩增和分化过程,而小鼠神经干细胞培养需要3-4天进行扩增,并且只需很短的时间进行分化,从而允许更快的筛选速度。
可从小鼠成体脑中分离神经干细胞并培养使用。从第8周至第12周小鼠,例如从第8周小鼠的室管膜下区分离小鼠成体神经干细胞。通常从妊娠12至16天的小鼠胚胎的额叶中分离小鼠神经干细胞。与小鼠成体神经干细胞相比,小鼠胚胎神经干细胞具有更强的干细胞性,这将使它们更有可能抵御毒性环境。然而,本发明人观察到当用β-淀粉样蛋白处理小鼠胚胎神经干细胞时,与试验材料是否加入无关,所有细胞都死亡且没有观察到神经元分化(比较实施例1,图3)。相比之下,从小鼠成体脑分离的神经干细胞显示出对β-淀粉样蛋白具有更强的耐受性,因此被认为更适用于在ad模拟环境中筛选诱导神经干细胞分化的材料。因此,我们使用成年小鼠的神经干细胞作为本发明的方法。
可将从成年小鼠分离的神经干细胞以未分化状态接种于培养基中,并在37℃下培养。用于神经干细胞的培养基可以是补充有任何生长因子的无血清培养基,但是当首先从成年小鼠分离和培养神经干细胞时优选补充有生长因子的ipm培养基,然后当在神经球形成之后分离和培养单细胞时优选n2培养基。ipm培养基是neurobasal培养基,其可包含1-4%b27补充剂、0.5-2%glutamax、100iu/ml青霉素和100μg/ml链霉素。n2培养基是达尔伯克氏改良型伊格尔培养基/营养混合物f12(dmem/f12)(1:1),其还可以含有一种或多种选自以下的培养基组分:90-110μm腐胺、20-40nm亚硒酸盐、10-30nm黄体酮、1.0-2.0mg/mld-(+)-葡萄糖、20-30μg/ml胰岛素、0.05-0.2mg/ml脱铁转铁蛋白、0.3-0.6mmglutamax、50-150iu/ml青霉素和50-150μg/ml链霉素。n2培养基可补充有选自以下的生长因子:10-30ng/mlbfgf、10-30ng/mlegf及其混合物。生长因子起着维持神经干细胞处于未分化状态的作用。为了精确确定试验材料对诱导神经干细胞分化的活性,应将测试材料添加至由抑制分化的生长因子来维持在未分化状态的神经干细胞。
在本发明的筛选方法中,可以使用商购的β-淀粉样蛋白,例如可从gibco(waltham,ma)获得的β-淀粉样蛋白。优选使用人类来源的β-淀粉样蛋白。β-淀粉样蛋白的最常见形式是由40个氨基酸组成的aβ(1-40),以及由42个氨基酸组成的aβ(1-42)。在这两者中aβ(1-42)具有更强的形成聚集物特别是高毒性的三聚体和四聚体的倾向,并因此被认为更加与阿尔茨海默氏病的病理状态密切相关(dahlgren等人(2002)oligomericandfibrillarspeciesofamyloid-βpeptidesdifferentiallyaffectneuronalviability,j.biol.chem.277(35):32046-32053;k.murakami(2014)conformation-specificantibodiestotargetamyloid-βoligomersandtheirapplicationtoimmunotherapyforalzheimer’sdisease,biosci.biotechnol.biochem.78(8):1293-1305)。因此,在本发明的筛选方法中,优选使用aβ(1-42)特别是aβ(1-42)的寡聚形式。
在本发明的筛选方法中,β-淀粉样蛋白的寡聚形式应该是小于24、优选12或更少的β-淀粉样蛋白单体的寡聚体,更优选主要由β-淀粉样蛋白四聚体和三聚体组成的混合物且几乎没有β-淀粉样蛋白原纤丝或纤丝。本发明中aβ(1-42)的寡聚形式可以通过参考文献[dahlgren等人(2002)oligomericandfibrillarspeciesofamyloid-βpeptidesdifferentiallyaffectneuronalviability,j.biol.chem.277(35):32046-32053]中公开的方法制备。特别地,将aβ(1-42)溶于六氟异丙醇(hfip)中,真空干燥,并将干燥的肽以5mm的浓度再悬浮于dmso中。加入dmem/f12(无酚红),并将肽浓度调节至100μm,然后在4℃下培养24小时。
在本发明的筛选方法中,mptp是一种神经毒素mpp+(1-甲基-4-苯基吡啶鎓)的前体药物。mpp+通过破坏大脑黑质中的多巴胺能神经元而引起帕金森氏病(pd)的永久症状。
鱼藤酮,一种通过抑制细胞中线粒体复合物1的活性而导致黑质中多巴胺能神经元变性的物质,已知产生pd的病理特征。
羟多巴胺,也被称为6-羟基多巴胺(6-ohda)或2,4,5-三羟基苯乙胺,是一种神经毒性化合物,被研究人员用来选择性破坏脑中的多巴胺能神经元和去甲肾上腺素能神经元。据认为,羟基多巴胺通过多巴胺能和去甲肾上腺素能再摄取转运蛋白进入神经元。为了选择性损伤多巴胺能神经元,它还与选择性去甲肾上腺素再摄取抑制剂如脱甲丙咪嗪一起使用。
谷氨酸用作中枢神经系统(cns)中的主要兴奋性神经递质,但已知当以高浓度存在时损伤神经元并导致细胞死亡。谷氨酸的兴奋性毒性不仅与急性cns损伤如局部缺血或创伤性脑损伤有关,而且还与慢性神经退行性疾病如als、多发性硬化症、pd等有关。
lps(脂多糖)是一种革兰氏阴性细菌的细胞表面的组分,并且例如可以使用从鼠伤寒沙门氏菌(salmonellatyphimurium,sigma,st.louis,mo)分离的脂多糖。lps在动物中引发强烈的免疫响应,并通过在神经系统中激活小神经胶质细胞导致炎性响应。由于过度激活的小神经胶质细胞引起的炎症物质的分泌,可以干扰免疫系统的稳态,并导致cns自身免疫性疾病相关的神经退行性疾病如多发性硬化症、ad和pd。
s100b是一种由星形胶质细胞表达并分泌的钙结合蛋白。它对神经元的发育和维持具有神经营养活性,并影响大脑的正常认知功能。然而,异常高水平的s100b将激活神经胶质并导致对神经元有害的神经炎症响应。
在本发明的筛选方法中,在添加测试材料之前,用诱导神经元损伤的物质如β-淀粉样蛋白处理神经干细胞。在之前公布的实验中,在添加β-淀粉样蛋白之前的某个时间,将神经干细胞首先用测试材料处理,以观察测试材料的神经保护作用(j.koreanneurol.assoc.21(2):174-182,2003)。这种方法并没有反映在β-淀粉样蛋白已经存在于阿尔茨海默氏病患者脑中之后,向阿尔茨海默氏病患者施用药物的实际治疗情况。神经干细胞首先应该用β-淀粉样蛋白处理,然后如在本发明中所进行那样添加测试材料,以便在治疗开始的时间点更接近地模拟阿尔茨海默氏病患者的脑环境。
将神经干细胞用β-淀粉样蛋白处理并进一步与每天添加的生长因子一起培养后,将试验材料添加到神经干细胞中。用测试材料处理神经干细胞后,可以通过在处理后的最早、12小时和最近48-72小时的形态分析来确定测试材料是否具有诱导神经干细胞分化的活性。
形态分析使用相差显微镜来观察和确定细胞的形态。如从图2上部的经标记的ud(未分化的)和d(分化的)可见,分化的(d)神经干细胞可以与未分化的(ud)神经干细胞明显地区分开来。在未分化的细胞中,细胞体宽,神经突如轴突和树突的形状难以辨别,并且由于细胞不断分裂,细胞总数很高。在分化的细胞中,细胞体小且圆,而神经突细且长。
用于本发明的筛选方法中的神经干细胞与正常或癌细胞系相比是相对脆弱的细胞,并且敏感地响应于测试材料的毒性。如果测试材料显示出细胞毒性,则可以在显微镜下看到死细胞,从而可能在确定诱导分化的活性的同时确定细胞毒性。
根据本发明的筛选方法,可以在模拟阿尔茨海默氏病患者的脑环境的环境中筛选具有诱导神经干细胞分化的活性的物质,特别是存在β-淀粉样蛋白的寡聚形式(即已知与神经丢失密切相关的形式)的环境。这使得本发明的筛选方法适用于筛选可用于阿尔茨海默氏病的基础治疗的候选材料。此外,所述筛选方法是方便的,因为它允许通过检测细胞形态来确定细胞是否分化,而不需要额外的实验分析。此外,当使神经干细胞在没有生长因子的培养基中自然分化时,至少花费48小时,之后可以观察到细胞形态的变化。在用具有高效诱导分化的活性的材料处理细胞的情况下,它们的作用可以最早在处理后12小时以及最晚在处理后48-72小时观察到,尽管细胞培养基中存在抑制分化的生长因子。以这种方式,所述筛选方法是快速且有效的,因为测试材料的毒性也可以在诱导分化作用的同时被确定。
此外,本发明涉及可用于进行上述筛选方法的试剂盒。该试剂盒可包括源自成年小鼠的神经干细胞、诱导神经元损伤的物质(如β-淀粉样蛋白、mptp、鱼藤酮、羟多巴胺、谷氨酸、lps或s100b)、生长因子、培养基、用于细胞培养的补充剂和细胞培养板(涂覆或具有单独的涂覆溶液)。
参考以下实施例将更详细地解释本发明。然而,这些实施例不应被解释为限制或限定本发明的范围和公开内容。应理解,基于包括以下实施例的本发明教导,本领域技术人员可以容易地实施本发明的其它实施方案(其实验结果没有明确呈现)。此类修改和变化旨在落入所附权利要求的范围内。
实施例
实施例1:[式1]的化合物在小鼠胚胎神经干细胞中诱导nsc分化的能力
步骤1:培养小鼠胚胎神经干细胞
步骤1a:培养未分化状态的小鼠胚胎神经干细胞
将神经干细胞从14.5日小鼠胚胎的脑中分离,用在n2培养基中的10ng/ml人碱性成纤维细胞生长因子(bfgf)(peprotech,princeton,ng,目录号100-18b)和20ng/ml人表皮生长因子(egf)(peprotech,目录号af-100-15)处理,并在25cm2烧瓶(nunc,pittsburgh,pa)中的混悬液中培养4天。2天后观察到神经球的形成。
为了分离单细胞,前一天通过用15μg/ml聚-l-鸟氨酸(sigma,st.louis,mo,目录号p2533)溶液处理各孔并在37℃下孵育过夜用于涂覆来准备6-孔板。单细胞分离当天,去除聚-l-鸟氨酸溶液,用pbs洗涤板三次,并添加10μg/ml纤连蛋白(gibco,waltham,ma,目录号33016015)溶液并在37℃下孵育2小时用于涂覆。当板准备完成后,将神经球用trypletryple(gibco目录号12604013)处理,分离成单细胞,并且计数并制备成每200~300μl培养溶液(n2培养基,具有10ng/mlbfgf和20ng/mlegf)包含4~5x105个细胞。正好在接种之前,将涂覆溶液吸出来,并且在板干燥之前将单细胞均匀地接种到培养板中。使细胞附着于板约1分钟,并在检查细胞充分附着后,将另外1.5ml培养基(n2培养基,具有10ng/mlbfgf和20ng/mlegf)添加至细胞并在37℃孵育箱中培养。
n2培养基的组成如下:
达尔伯克氏改良型伊格尔培养基(dmem)/f12(1:1)(gibco,目录号11320033),100μm腐胺(sigma,目录号51799),30nm亚硒酸盐(sigma目录号s5261),20nm黄体酮(sigma目录号p0130),1.55mg/mld-(+)-葡萄糖(sigma,目录号g8270),25μg/ml胰岛素(gibco,目录号12585014),0.1mg/ml脱铁转铁蛋白(sigma目录号t1147),0.5mmglutamax(gibco,目录号a1286001),100iu/ml青霉素(gibco,目录号15140122),100μg/ml链霉素(gibco,目录号15140122)。
步骤1b:在不抑制分化的情况下培养神经干细胞
当将神经干细胞分离成单细胞并接种时,除了添加bfgf和egf之外,根据步骤1a中的程序培养小鼠胚胎神经干细胞。
步骤2:添加测试材料
每天将不同浓度的[式1]的化合物(在下文中也称为曲美替尼)(medchemexpress,monmouthjunction,nj,目录号hy-10999a)和as703026(皮马瑟替)(selleckchem,houston,tx,目录号s1475)添加至如步骤1a所述培养的小鼠胚胎神经干细胞中,并培养4天。
步骤3:形态分析
培养4天后,通过相差显微术观察细胞形态,且结果示于图1中。
在图1中,ud(未分化的)是在步骤1a中获得的未分化的小鼠胚胎nsc,其中细胞未经任何测试材料处理。d(分化的)是步骤1b中获得的分化的小鼠胚胎nsc,其中细胞未经任何测试材料处理。ud组的未分化的nsc具有宽的细胞体,神经突形状难以区分,并且由于持续的细胞分裂,与d组相比细胞总数更高。d组的分化的细胞具有更小的圆形细胞体且神经突长而细小,使其易于与ud组细胞区分。
如图1所示,在低浓度的10nm、25nm和100nm(0.1μm)下,[式1]的化合物(曲美替尼)容易地诱导了nsc分化为神经元。as703026-处理组需要1.0μm(即比曲美替尼的浓度高100倍的浓度)用于启动神经元分化。
总之,这些结果表明,[式1]的化合物(曲美替尼)诱导nsc分化为神经元,并且即使在非常低的浓度(10nm和更高)下也可以看到这种作用。这表明[式1]的化合物可用于组合物和方法中,所述组合物和方法用于分化以诱导nsc分化为神经元,并用于治疗神经退行性疾病。
实施例2:[式1]的化合物在小鼠成体nsc中诱导nsc分化的能力(筛选可以诱导nsc分化为神经元并同时保护它们的物质的方法)
步骤1:培养小鼠成体nsc
步骤1a:培养未分化状态的小鼠成体nsc
将nsc从8周小鼠脑的室管膜下区分离,用在ipm培养基中的20ng/ml人碱性成纤维细胞生长因子(bfgf)和20ng/ml人表皮生长因子(egf)处理,并在24孔板中作为混悬液培养7天。4天后观察到神经球的形成。
在分离单细胞前两天,通过用10μg/ml聚-l-鸟氨酸溶液处理各孔并在室温下孵育过夜用于涂覆来准备6-孔板。第二天,去除聚-l-鸟氨酸溶液,并将板用无菌三重蒸馏水洗涤三次。接着,添加0.5mg/ml层粘连蛋白(roche,upperbavaria,germany,目录号11243217001)溶液,并在37℃下孵育过夜用于涂覆。当板准备完成后,将神经球用0.025%胰蛋白酶-edta处理,分离成单细胞,并且计数并制备成每200~300μl培养溶液包含4~5x105个细胞。使用的培养溶液是n2培养基(补充有20ng/mlbfgf和20ng/mlegf)。正好在接种之前,将涂覆溶液吸出来,并且在板干燥之前将单细胞均匀地接种到培养板中。使细胞附着于板约1分钟,并在检查细胞充分附着后,将另外1.5ml培养基(n2培养基,具有20ng/mlbfgf和20ng/mlegf)添加至细胞,并在37℃孵育箱中培养24小时。
ipm和n2培养基的组成如下:
ipm培养基:neurobasal培养基(gibco,目录号21103049),b27补充剂(gibco,目录号a3582801),glutamax,100iu/ml青霉素,100μg/ml链霉素。
n2培养基:达尔伯克氏改良型伊格尔培养基(dmem)/f12(1:1),100μm腐胺,30nm亚硒酸盐,20nm黄体酮,1.55mg/mld-(+)-葡萄糖,25μg/ml胰岛素,0.1mg/ml脱铁转铁蛋白,0.5mmglutamax,100iu/ml青霉素,100μg/ml链霉素。
步骤1b:在不抑制分化的情况下培养神经干细胞
在将神经干细胞分离成单细胞并接种时,除了添加bfgf和egf之外,根据步骤1a的程序培养小鼠成体神经干细胞。
步骤2:β-淀粉样蛋白处理
在步骤1中改变培养的nsc的培养基后,将每个孔用10μmβ-淀粉样蛋白(aβ)(gibco,目录号03112)处理。未用β-淀粉样蛋白处理的孔留作阴性对照。
购买gibco氏(waltham,ma)人aβ(1-42)用于β-淀粉样蛋白(aβ),并按照以下方法产生寡聚体。首先,将β-淀粉样蛋白溶于100%hfip(1,1,1,3,3,3-六氟-2-丙醇)(sigma,目录号105228)中以获得1mg/ml的浓度,并在室温下涡旋1小时。然后,将其在speedvac真空离心干燥仪中干燥10分钟,其后加入dmso(sigma,目录号d2650)以使浓度达到5mm,然后在室温下轻微涡旋10分钟。添加dmem/f12(无酚红)(gibco,目录号21041025),使终浓度为100μm。将溶液在4℃下孵育24小时,然后添加到培养的细胞中。
步骤3:添加测试材料
在用β-淀粉样蛋白处理后,立即将10nm、100nm曲美替尼,5μm、10μm美金刚(sigma,目录号m9292),以及10μmas703026(皮马瑟替)添加至细胞培养物。将ncs与每天添加的egf、bfgf、β-淀粉样蛋白和测试材料一起培养4天。
步骤4:形态分析
培养4天后,通过相差显微术观察细胞形态,且结果示于图2中。
在图2中,上行是未用β-淀粉样蛋白处理的小鼠成体nsc,且下行是用10μmβ-淀粉样蛋白处理的nsc。ud(未分化的)是在步骤1a中获得的未分化的小鼠成体nsc,其中细胞未经任何测试材料处理。d(分化的)是在步骤1b中获得的分化的小鼠成体nsc,其中细胞未经任何测试材料处理。在上行的aβ未处理组中,ud组的未分化的nsc具有宽的细胞体,神经突形状难以区分,并且由于持续的细胞分裂,与d组相比细胞总数更高。d组的分化细胞具有更小的圆形细胞体且神经突长而细小,使其易于与ud组细胞区分。
无论是否处理β-淀粉样蛋白,曲美替尼-处理组都能够在10nm和100nm的低浓度下容易地诱导nsc分化为神经元。无论是否处理β-淀粉样蛋白,as703026-处理组需要比曲美替尼的浓度高得多的浓度10μm用于神经元分化。两种材料在这些浓度下均未引发细胞毒性,从而确认它们是适用于阿尔茨海默氏病(ad)的候选物。
此外,在用目前用于缓解ad症状的药物美金刚处理的组中,未观察到nsc分化为神经元,相反,观察到神经干细胞的死亡。美金刚是参与谷氨酸信号转导的nmda受体拮抗剂,且致力于促进ad患者中神经元信号转导正常化。这种机制不能通过恢复损伤的神经元为ad提供基础治疗。美金刚不诱导nsc分化但导致细胞死亡的发现,确认了它不能用作痴呆的基础治疗。
比较实施例1:β-淀粉样蛋白处理对小鼠胚胎神经干细胞的作用
步骤1:培养小鼠胚胎nsc
如实施例1,步骤1a和1b中所述培养细胞。
步骤2:用β-淀粉样蛋白处理
使用与实施例2,步骤2相同的方法,用β-淀粉样蛋白处理如上述步骤1所述培养的小鼠胚胎nsc。
步骤3:添加测试材料
用β-淀粉样蛋白处理后,立即添加100nm曲美替尼、10μm美金刚和10μmas703026(皮马瑟替)。将ncs与每天添加的egf、bfgf、β-淀粉样蛋白和测试材料一起培养4天。
步骤4:形态分析
培养4天后,通过相差显微术观察细胞形态,且结果示于图3中。
在图3中,上行是未用β-淀粉样蛋白处理的小鼠胚胎nsc,且下行是用β-淀粉样蛋白处理的nsc。ud(未分化的)是未分化的小鼠胚胎nsc(未经任何测试材料处理),并且d(分化的)是分化的小鼠胚胎nsc(未经任何测试材料处理)。在aβ-处理组中,无论是否添加测试材料,所有细胞均死亡,且因此无法确定测试材料的作用。
实施例3:免疫细胞化学分析
为了在实施例1中再次确认nsc分化为神经元,进行tuj1和dapi(4’,6-二脒基-2-苯基吲哚)标记的免疫细胞化学染色。tuj1(神经元特异性iii类β-微管蛋白)是神经元特异性标志物蛋白,其缀合至罗丹明而显示荧光红色,而dapi结合至细胞dna并将细胞核染色为荧光蓝。
将如实施例1所述培养的胚胎nsc接种于含盖玻片的24-孔板中,并连续4天用各浓度的曲美替尼和as703026处理。去除培养基并用pbs洗涤细胞。用10%甲醛(sigma目录号ht501128)在室温下固定10分钟后,将它们再次用pbs洗涤。将它们用0.2%tritonx-100(sigma,目录号93443)在室温下透化15分钟,用pbs洗涤,并用10%bsa(sigma,目录号a2153)+1%正常山羊血清(vectorlab,burlingame,ca,目录号s1000)在室温下孵育1小时。将抗-tuj1抗体(cellsignaling,danvers,ma,目录号4466)以1:200的比率在1%bsa+1%正常山羊血清中稀释并添加到细胞中,并在4℃下孵育过夜。将溶液去除,用pbs洗涤,并在室温下与在1%bsa+1%正常山羊血清中以1:200比率稀释的二抗(罗丹明-缀合的抗体)一起孵育1小时。然后,将细胞用pbs洗涤,与5μg/mldapi(sigma,目录号d9542)一起孵育5分钟,再次用pbs洗涤,并固定在载玻片上用于用荧光显微镜分析。结果示于图4中。如图4所示,用1.0μmas703026处理的组显示出红色的长而细小神经突的图像,表明神经元分化在该浓度下出现,尽管仅至边际程度。在低于该浓度的浓度(0.1μm)下,未观察到分化。
相反,用曲美替尼处理的组,甚至在非常低的10nm浓度下,显示出越来越活跃的分化活性。至于细胞的形态,在10nm曲美替尼处理的细胞中可见到增加数量的显示细长神经突的神经元。
实施例4:mrna表达的相对水平的分析
实施例4-1:由[式1]的化合物在小鼠胚胎nsc中诱导的tuj1和thmrna表达的分析
为了确定在实施例1中nsc分化为哪种类型的细胞,通过定量rt-pcr(qrt-pcr)来分析神经元特异性标志物tuj1和多巴胺能神经元标志物th(酪氨酸羟化酶)的mrna表达。
步骤1:rna分离
在实施例1中完成形态分析后,去除每个处理组细胞的培养基,并将
步骤2.逆转录
测量rna浓度后,将各组rna调整至2μg,并使用逆转录试剂盒(invitrogen,目录号28025013)进行实验。将无菌三重蒸馏水、1pm寡聚dt和1mmdntp添加至rna中,并在65℃下孵育5分钟。这之后添加5x第一链缓冲液、10mmdtt和m-mlv逆转录酶,并在42℃下孵育1小时,然后在72℃下孵育15分钟,并在4℃下孵育30分钟。将合成的cdna储存于-20℃。
步骤3:qrt-pcr
通过混合1μlcdna(以上合成)、1pm引物、三重蒸馏水和rotor-gene
[表2]
结果示于图5中。图5a、5b是3轮实验后各组的相对mrna表达水平的平均值。术语相对mrna表达水平表示,为了使每个组的总rna水平归一化,将每个分化标志物的mrna表达水平除以gapdh的表达水平(其表达水平在所有细胞中相当恒定),然后将每种测试材料的值与每个组中对照(未分化的nsc)的值进行比较。
如图5所示,曲美替尼处理组在10nm、25nm和100nm的浓度下,显示出高水平的神经元特异性标志物tuj1和多巴胺能神经元标志物th表达。这个结果表明曲美替尼有效地诱导nsc分化为神经元,特别是分化为多巴胺能神经元。此外,曲美替尼在1nm的极低浓度下发挥其诱导分化的作用。这表明根据本发明的组合物可以用于治疗神经退行性疾病。
10μm(10000nm)as703026产生的结果与25nm曲美替尼的结果相当,这表明曲美替尼在比as703026的浓度低400倍(或更多)的浓度下诱导nsc分化成神经元。
实施例4-2:由[式1]的化合物在小鼠胚胎和成体nsc中诱导的th、chat、isl1和gad1mrna表达的分析
为了确定[式1]的化合物是否诱导nsc分化为除多巴胺能神经元之外的细胞类型,通过qrt-pcr测定胆碱能神经元标志物chat(胆碱乙酰转移酶)、运动神经元标志物isl1(islet1)和gaba能神经元标志物gad1(谷氨酸脱羧酶1)的mrna表达。
如实施例1所述培养神经干细胞,并在添加1nm、10nm、25nm和100nm曲美替尼2天后,分离rna并检测所述分化标志物。mrna表达由与实施例4-1相同的方法测定,并且所用的引物示于表3中。
结果示于图6中。
[表3]
如图6所示,所有测试的神经元标志物、多巴胺能神经元标志物th、胆碱能神经元标志物chat、运动神经元标志物isl1和gaba能神经元标志物gad1的表达,均随着添加的曲美替尼的浓度增加。这表明曲美替尼可以用于治疗由各种类型的神经元损伤导致的神经退行性疾病。
为了确定在小鼠成体nsc中是否发生相同的作用,将10nm曲美替尼和10μmas703026各自添加至如实施例2步骤,1a中所述培养的小鼠成体nsc持续2天,并且通过qrt-pcr来分析神经标志物tuj1、多巴胺能神经元标志物th和胆碱能神经元标志物chat的mrna表达水平。
该结果示于图7中。曲美替尼增加了成体nsc中tuj1、th和chat的表达,就像它在胚胎nsc中一样。值得注意的是,曲美替尼在比as703026低1000倍的浓度下,展现出更强的诱导nsc分化为神经元的作用。
实施例5:通过控制神经干细胞中的mek1和mek2表达来检测诱导nsc分化的能力
实施例5-1:抑制小鼠胚胎神经干细胞中的mek1、mek2表达
检测与mek1和mek2的表达水平相关的诱导nsc分化为神经元的能力。以下方法用于产生其中mek1和mek2表达受控制的细胞。
首先,为了产生其中mek1和mek2表达受抑制的细胞,使用抑制mek1和mek2表达的相应shrna。特别地,将如实施例1,步骤1a所述培养的小鼠胚胎nsc接种至板中,并培养24小时。然后使用阳离子脂质体(invitrogen,目录号18324010),将1μg/mlshrna-mek1(ccgggccatccaacattctagtgaactcgagttcactagaatgttggatggcttttt)或shrna-mek2(ccggcctccgagagaagcaccagatctcgagatctggtgcttctctcggaggtttttg)转染到细胞中,以产生其中mek1或mek2或两者的表达受抑制的nsc。
4小时后,将这些转染细胞的培养基用n2培养基替换,再培养4天,然后用实施例4-1中的方法提取rna。通过逆转录pcr(rt-pcr)来分析诱导nsc分化为神经元的能力。特别地,通过逆转录将rna转化为cdna,然后添加ex-taqdna聚合酶(sgbio,kyunggido,korea)和引物以在t100tm热循环仪(bio-rad,hercules,ca)中进行pcr。通过以下进行pcr:在95℃下孵育5分钟,然后重复25-35个循环的反应,其中1个循环由以下组成:在95℃下孵育30秒,在55~62℃下孵育30秒,以及在72℃下孵育30秒。通过在2%琼脂糖凝胶上进行凝胶电泳,然后通过图像分析仪las-3000(fujifilm,tokyo,japan)分析凝胶电泳来检测pcr结果。
在本实施例以及实施例5-2和5-3中,用于rt-pcr和qrt-pcr的引物示于表4中。
[表4]
结果示于图8a中。如图8a所示,与其中仅mek2表达受抑制的nsc(shmek1-,shmek2+)相比,在通过转染shmek1和shmek2两者来抑制mek1和mek2两者的nsc(shmek1+,shmek2+)中多巴胺神经元标志物th的表达显著增加。
为了再次检测仅抑制mek1或mek2、或抑制mek1和mek2两者的作用,通过qrt-pcr和蛋白质印迹来检测诱导nsc分化为神经元的作用。用上述方法产生其中仅mek1或mek2受抑制的nsc,以及其中mek1和mek2两者受抑制的nsc。4小时后,将转染细胞的培养基用n2培养基替代,再培养4天,并使用实施例4-1中的方法进行qrt-pcr。结果示于图8b的图表中。如图8b的图表所示,与当仅mek1或mek2相比时,当mek1和mek2表达两者受抑制时神经元标志物tuj1和th的表达显著增加。
进行蛋白质印迹以检测诱导nsc分化为神经元的作用是否随着抑制mek1和mek2表达不仅在mrna而且在蛋白质水平方面可见。
通过以下方法对每组细胞进行蛋白质印迹:在将其中mek1和mek2表达受抑制的nsc培养4天后,去除培养基,添加ripa缓冲液(0.05mtrishclph7.4(sigma,目录号t3253),0.15mnacl(ducsan,目录号7647-14-5),0.25%脱氧胆酸(sigma,目录号d6750),1%np-40(usb,waltham,ma,目录号19628),1mmedta(sigma,目录号eds),1mmpmsf(acrosorganics,geel,belgium,目录号215740050),1mm原钒酸钠(biolabs,ipswich,ma,目录号p0758l),1mm氟化钠(sigma,目录号s7920),蛋白酶抑制剂(sigma,目录号p83430))至冰上的板中,并用刮刀(scraper)收集细胞。在冰上孵育10分钟后,在4℃下以13000rpm离心后收集上清液。测量蛋白质浓度,添加样品缓冲液(0.25mtris-hclph6.8,0.05%sds(amersco,solon,oh,目录号227),50%甘油(ducsan,目录号56-81-5),0.25mdtt(invitrogen,目录号r0861),0.5mg/mlbpb(bio-rad,hercules,ca,目录号161-0404),并将样品在100℃下煮沸10分钟,然后在-20℃下储存。
将10~20μg蛋白样品上样到8~12%sds-page凝胶上,分离并转移到硝酸纤维素膜上,然后用5%脱脂乳在室温下封闭1小时。将针对tuj1、th(cellsignaling,目录号2792)、mek1/2(santacruz,dallas,tx,目录号sc-292838)和erk(santacruz,目录号sc-135900)的抗体,各自在含有tris缓冲盐水(tbs)的0.1%tween20(sigma,目录号p1379)中制备,并与所述膜在室温下孵育2小时,或在4℃下孵育过夜,然后将其在室温下与辣根过氧化物酶-缀合的二抗孵育1小时。用光敏设备检测蛋白表达,且结果示于图8b的底图中。如图8b所示,神经元标志物tuj1和多巴胺神经元标志物th中的mrna和蛋白的表达水平,在其中使用shmek1和shmek2两者来抑制mek1和mek2表达(shmek1+,shmek2+)的nsc中显著增加。
相反,相比具有mek1和mek2两者抑制的nsc,在其中仅mek1或mek2表达受抑制nsc的情况下可见tuj1和th的表达水平更低。
实施例5-2:在小鼠胚胎神经干细胞中诱导camek1和camek2表达
为了检测与mek1和mek2的激活有关的诱导nsc分化为神经元的作用,将具有mek1和mek2的组成型表达突变的组成型活性mek1(camek1)质粒和组成型活性mek2(camek2)质粒分别用于实验。特别地,将如实施例1,步骤1a所述培养的小鼠胚胎nsc接种于板中,并孵育24小时。然后,使用阳离子脂质体将1μg/mlcamek1和camek2转染到细胞中,以产生其中表达camek1或camek2、或表达两者的nsc。4小时后,将这些转染细胞的培养基用不含egf或bfgf的n2培养基替换,再培养4天,提取rna和蛋白,并进行定量rt-pcr(qrt-pcr)和蛋白质印迹。通过这些实验,检测了mek1和mek2激活对诱导nsc分化为神经元作用的影响,并显示于图8c中。
与图8b相反,图8c显示了当mek1和mek2在另外的诱导分化的环境中被激活时,抑制ncs的分化。通过qrt-pcr和蛋白质印迹显示出,神经元标志物tuj1和多巴胺能神经元标志物th的mrna和蛋白表达受到抑制。相比其中只有一个被激活,在mek1和mek2激活的情况下tuj1和th的表达显著更低。
实施例5-3:小鼠成体神经干细胞中mek1和mek2的抑制
进行以下实验以确定mek1和mek2的抑制是否诱导小鼠成体nsc中nsc的分化,以及在存在β-淀粉样蛋白的条件下该作用是否相同。
将如实施例2,步骤1a所述培养的小鼠成体nsc接种至板中,并培养24小时。然后使用阳离子脂质体(invitrogen)将1μg/mlshrna-mek1(ccgggccatccaacattctagtgaactcgagttcactagaatgttggatggcttttt)或shrna-mek2(ccggcctccgagagaagcaccagatctcgagatctggtgcttctctcggaggtttttg)转染至该细胞中,以产生其中mek1或mek2、或两者的表达受抑制的nsc。
4小时后,将这些转染细胞的培养基用n2培养基或用10μmβ-淀粉样蛋白处理的n2培养基替换,再培养2天,并在显微镜下观察细胞形态。使用实施例4中的方法提取rna,进行qrt-pcr,并分析诱导nsc分化为神经元的作用。
结果示于图9中。
如图9a所示,相比其中仅转染shmek1或shmek2中一个的nsc,更容易在其中mek1和mek2表达均受shmek1和shmek2两者转染所抑制的nsc中诱导分化。在aβ-处理细胞的情况下,在其中mek1和mek2两者均未受抑制的组中细胞死亡,但在其中mek1或mek2、或mek1和mek2两者均受抑制的组中,没有发生细胞死亡,但发生了分化的诱导。
此外,如图9b所示,神经元标志物tuj1的表达在其中通过shmek1和shmek2两者(shmek1+shmek2)的处理抑制了mek1和mek2表达的nsc中显著增加。相反,相比其中mek1和mek2两者均受抑制的情况,在其中mek1或mek2表达受抑制的(shmek1,shmek2)nsc中神经元标志物tuj1的表达如同诱导nsc分化为神经元的作用一样是低的。在aβ-处理的细胞的情况下,在其中mek1或mek2受抑制的nsc中可见一些保护作用和诱导分化作用,但在其中mek1和mek2表达均受抑制的nsc中,保护作用和分化-诱导作用显著更高。
根据这些结果,揭示了成体nsc中mek1和mek2的抑制不仅诱导nsc的分化,而且证明也有针对β-淀粉样蛋白的保护作用。
实施例6:其它mek1/2抑制剂诱导nsc分化的作用
为了测试曲美替尼以外的其它mek1/2抑制剂是否证明有诱导nsc分化的作用和保护作用,用每种测试材料处理小鼠胚胎nsc。特别地,将如实施例1,步骤1a所述培养的小鼠胚胎nsc使用0.1μm、1.0μm和10μm浓度的相应mek1/2抑制剂azd8330(selleckchem,目录号2134)、pd184352(selleckchem,目录号s1020)、瑞美替尼(selleckchem,目录号s1089)、pd318088(selleckchem,目录号s1568)、比尼替尼(selleckchem,目录号s7007)和as703026处理并孵育。为了比较,还用相同浓度的曲美替尼处理nsc。在培养的第2天,通过相差显微术观察细胞形态,且结果示于图10a中。图10b是每组细胞中tuj1mrna表达的分析。
如图10a和10b所示,azd8330、瑞美替尼、pd318088、比尼替尼和as703026均诱导分化,尽管以不同浓度开始。azd8330、瑞美替尼和pd318088展现出在1.0μm下开始的分化形态,而比尼替尼和as703026开始于10μm。通过rt-pcr检测神经元分化标志物tuj1的表达,还显示出它们在相同浓度下诱导分化。与其它化合物相比,即使在0.1μm的低浓度下曲美替尼也显示出优良的诱导nsc分化的作用。相反,pd184352在0.1μm下仅显示较弱的诱导nsc分化的作用,并且在1.0μm和10μm下,所有细胞都死亡。
此外,将如实施例2,步骤1a所培养的小鼠成体nsc用各种浓度的其它mek1/2抑制剂pd0325901(selleckchem,目录号s1036)、ro5126766(selleckchem,目录号s7170)、bi847325(selleckchem,目录号s7843)和u0126(a.g.scientific,sandiego,ca,目录号u-102)处理,并检测它们诱导nsc分化的作用。pd0325901,特别地,在用测试材料处理后,在培养的第2天通过相差显微术观察细胞形态。结果示于图10c中。如图10c所示,pd0325901显示出0.1μm下开始的诱导分化作用,而ro5126766在1.0μm下开始。特别地,pd0325901显示出优良的诱导作用,因为它在0.1μm至10μm的广泛浓度范围内诱导了分化。相反,bi847325仅在0.1μm下显示出较弱的诱导分化作用,并且在1.0μm和10μm下,所有细胞都死亡。当用更低浓度的bi847325(1.0nm和10nm)处理时,细胞增殖似乎受到一定程度的抑制,并且未观察到诱导分化作用。u0126在0.1μm和1.0μm下显示出细胞增殖抑制,并且在10μm下显示出细胞细胞毒性。此外,u0126在2.5μm下未显示出任何明确的诱导分化作用,并因此未能在所有测试浓度下显示出任何诱导nsc分化的作用。
这些结果揭示并非所有以前已知的mek1/2抑制剂都能有效诱导nsc分化。根据实施例5的结果,很明显mek1和mek2抑制涉及nsc分化的诱导。然而,认为每种mek1/2抑制剂的不同特性影响其诱导nsc分化的能力,导致实施例6中所见的差异。
实施例7:在细胞细胞毒性因子的存在下其它mek1/2抑制剂诱导nsc分化的作用
将如实施例2,步骤1a中所述培养的成体nsc,如实施例2,步骤2中所述用10μmβ-淀粉样蛋白处理以产生细胞毒性环境,之后以导致实施例6中大部分诱导分化作用的浓度添加mek1/2抑制剂as703026(10μm)、azd8330(1μm)、pd318088(1μm)、比尼替尼(10μm)、瑞美替尼(1μm)、pd0325901(10μm)和ro5126766(10μm)并培养。为了比较,包括0.1μm曲美替尼处理组和10μm考比替尼(称为相比mek2的mek1选择性抑制剂)处理组以及每种测试化合物的β-淀粉样蛋白未处理组。在培养的第二天通过相差显微术观察细胞形态,并且结果示于图11中。
在图11中,标记有"-"的行是未用β-淀粉样蛋白处理的小鼠成体nsc组,并且标记有“aβ1-42”的行是用10μmβ-淀粉样蛋白处理的组。在其中由10μmβ-淀粉样蛋白处理导致细胞毒性的条件下,显示以诱导大部分分化的每种最佳浓度添加as703026、azd8330、pd318088、比尼替尼、瑞美替尼、pd0325901和ro5126766,提供了细胞保护并诱导了nsc的分化。相反,添加考比替尼(一种已知相比mek2,对mek1更具选择性的抑制剂),甚至在10μm的高浓度下也不诱导成体nsc的分化,无论是否添加β-淀粉样蛋白。
实施例8:检测阿尔茨海默氏病小鼠模型中神经元数目的增加
通过这些先前的实验,显示在抑制mek1和mek2两者的化合物中,某些化合物诱导nsc分化为神经元并保护nsc和神经元免受β-淀粉样蛋白,特别地曲美替尼显示出较强的作用。还为了确认在神经退行性疾病小鼠模型中的这一发现,使用5xfad小鼠(一种显示最常见的神经退行性疾病形式ad的症状的动物模型)检测曲美替尼的神经再生作用和治疗作用。5xfad小鼠展现出神经元的神经元病变、变性和细胞死亡,特别是在脑的体感皮质层5和下托(oakley等人(2006)intraneuronalbeta-amyloidaggregates,neurodegeneration,andneuronlossintransgenicmicewithfivefamilialalzheimer'sdiseasemutations:potentialfactorsinamyloidplaqueformation.jneurosci.26(40):10129-10140)。
将曲美替尼以0.1mg/kg和1.0mg/kg的剂量口服施用给12个月龄的5xfad(b6sjl-tg(appswfllon,psen1*m146l*l286v)6799vas/mmjax)ad模型小鼠,连续28天,而将媒介物(4%dmso+玉米油)以相同方法(7只小鼠/组)施用给对照组小鼠。为了稍后进行的brdu染色,在最后5天将50mg/kgbrdu(sigma,目录号b5002)添加至每日剂量。然后麻醉小鼠并用pbs灌注以取出脑。在从每组的3只小鼠取出的脑中,将一半的脑组织(半球)立即储存在深冻冰箱中,用于稍后进行的蛋白质印迹和elisa实验。将另一半半球加上每组另外3个取出的小鼠脑,置于4℃的10%福尔马林溶液中1天,随后接着进行处理步骤以使石蜡良好地渗入脑组织中。将脑组织依次浸入70%、80%、95%、100%酒精中各1小时进行脱水,然后浸入二甲苯3次,每次1小时进行透明,并通过置于液体石蜡中2次、每次1小时以包埋于石蜡中。在这些程序之后,将石蜡包埋的脑组织(石蜡块)切成5μm的切片,固定在载玻片上,并在室温下储存。在免疫组织化学染色之前,将载玻片上的组织依次浸入二甲苯、100%酒精、90%酒精、80%酒精、70%酒精、50%酒精和然后水中进行再水合,每次5分钟。置于柠檬酸钠(10mm,ph6)(sigma,s4641)缓冲液中之后,在120℃下进行抗原修复过程15分钟,用10%bsa(牛血清白蛋白)封闭,并与抗神经元标志物neun(cellsignaling,目录号24307)一起在4℃下孵育1天。第二天,将载玻片与抗-兔抗体(vectorlab,目录号pi-1000)一起在室温下孵育1小时,然后用dab染色进行染色,以分析脑中的神经元分布。
由于已知5xfad小鼠在脑皮质层5和海马体下托中具有广泛的神经元损伤,因此首先检测这些脑区域。
图12是脑皮质中的体感皮质的矢状切面的分析结果。如图12a所示,在施用媒介物(4%dmso+玉米油)的5xfad小鼠(对照,第一左图)中,由于脑皮质层5中的神经元相当大的损伤,neun(阳性)染色的细胞数目减少。相比之下,施用0.1mg/kg和1.0mg/kg曲美替尼的5xfad小鼠显示出用neun染色的神经元数目显著增加。图12b指示neun染色的细胞数目,其经计数并表示为体感皮质层5区域中每单位面积细胞数目的百分比。从每只小鼠的3个区域采集区域样品,每组3只小鼠,因此计数的细胞数目来自总共9个区域。计算并显示了相比施用媒介物的组,施用曲美替尼的组中neun染色的细胞数目的百分比。
图13是小鼠脑皮质中运动皮质的冠状切面的分析结果。如图13a所示,施用媒介物的5xfad小鼠(对照)显示出运动皮质层5中的广泛神经元损伤,具有减少数目的neun染色的神经元,而曲美替尼组又显示出神经元数目显著增加,与体感皮质的结果一样。图13b指示neun染色的细胞数目,其经计数并表示为运动皮质层5区域中每单位面积的细胞数目的百分比。从每只小鼠的6个区域采集区域样品,每组3只小鼠,因此计数的细胞数目来自总共18个区域。计算并显示了相比施用媒介物的组,施用曲美替尼的组中neun染色的细胞数目的百分比。计算并显示了施用曲美替尼的组中neun染色细胞的数量与施用媒介物的组相比的百分比。
图14是小鼠海马体下托的矢状切面的分析结果。如图14a所示,施用媒介物的5xfad小鼠(对照)显示出海马体下托中显著少量的用神经元标志物neun染色的神经元,而施用曲美替尼的组再一次显示出神经元数目显著增加,与脑皮质的结果一样。图14b指示neun染色的细胞数目,其经计数并表示为图14a所示的海马体下托的虚线区域中每单位面积的细胞数目的百分比。从每只小鼠的3个区域采集区域样品,每组3只小鼠,因此计数的细胞数目来自总共9个区域。计算并显示了相比施用媒介物的组,施用曲美替尼的组中neun染色的细胞数目的百分比。通过上述实验,显示出曲美替尼具有增加5xfad小鼠的脑皮质层5和海马体下托中的神经元数目的作用。
实施例9:检测阿尔茨海默氏病小鼠模型中的神经形成
为了确定如实施例8中所示的施用曲美替尼的5xfad小鼠的脑皮质层5和海马体下托中,神经元数目的增加是否是由曲美替尼的神经形成作用引起的,用在整个nsc分化为神经元过程中出现的各种细胞标志物进行免疫组织化学分析。
dcx(双皮质素),一种在神经前体细胞中表达的蛋白,主要在迁移或分化神经元中表达,并表明该细胞是在神经形成过程中未成熟的神经元。tuj1(神经元-特异性iii类β微管蛋白),一种在活跃分裂的神经前体细胞或新产生的未成熟有丝分裂期后神经元中表达的蛋白质,表明该细胞是在神经形成过程中的神经元。因此,通过经由免疫组织化学染色检测dcx或tuj1的存在,可以确定神经形成通过nsc分化为神经元发生。
brdu(5-溴脱氧胞苷),一种核碱基胸苷的类似物,在分裂细胞的dna合成期间替代胸苷,从而允许通过免疫组织化学染色检测在神经形成期间的分裂细胞。
实施例9-1:检测大脑的体感皮质中的tuj1表达
将抗-tuj1抗体添加至实施例8中的5xfad小鼠的脑组织载玻片,并在4℃下孵育1天,之后将组织载玻片通过与异硫氰酸荧光素(fitc)-二抗(invitrogen,目录号a21121)在室温下一起孵育1小时进行荧光染色。图15显示了脑皮质的体感皮质的荧光显微术图像。在图15中,用箭头(→)标记的区域表示用tuj1染色的细胞,并且用箭头状物(▼)标记的区域表示由β-淀粉样蛋白聚集形成的斑块。斑块存在于媒介物-处理组和曲美替尼-处理组中。然而,与媒介物-处理组相比,0.1mg/kg曲美替尼-处理组特别地显示出用tuj1染色的细胞数目显著增加,尽管类似水平的β-淀粉样蛋白斑块存在于样品中。
实施例9-2:检测海马体齿状回中的nissl、neun和dcx表达
当神经形成在齿状回的颗粒下区(sgz)中被激活时,发生不对称细胞分裂,并且因此在最初产生2型细胞。2型细胞具有含非典型核的小体细胞,较短且为水平朝向,并且表达巢蛋白或dcx。3型细胞是经历从2型细胞进一步分化的细胞,并且也被称为成神经细胞。3型细胞是神经元而不是神经胶质细胞谱系中的分化早期阶段的细胞。3型细胞位置距齿状回的颗粒下区的颗粒层较近,并且与2型细胞不同,从水平朝向变为垂直朝向形状。2型和3型细胞存在于齿状回的颗粒下区表明神经形成正在发生。
尼氏染色(nisslstaining),其对神经元的尼氏体(nisslbody)染色,是一种显示神经元在脑中的分布和情况的方法。实施例8的载玻片上的脑组织通过依次浸入二甲苯、100%、90%、80%、70%、50%酒精,然后水中各5分钟进行再水合。将0.1%甲酚紫(sigma,目录号c5042)溶液在室温下放置15分钟后,将它们通过依次浸入80%、90%、100%酒精和二甲苯中脱水。将盖玻片放在载玻片上,并检测神经元。
通过与dcx染色相同的如实施例8中所述的方法进行neun染色,但使用抗-dcx抗体(santacruz,目录号sc271390)替代抗-neun抗体。
结果示于图16a中。根据施用曲美替尼的5xfad小鼠中的尼氏和neun染色,显示出特别是具有在神经形成期间出现的2型或3型细胞形态的细胞数目,在颗粒下区域(sgz)中和在比齿状回的sgz更靠近颗粒区的区域中显著增加。此外,还见到存在也被dcx染色的未成熟神经元(在图16中标记为“dcx”的栏中用箭头(→)标记),从而确认神经形成出现在施用曲美替尼的小鼠中的海马体齿状回中。
实施例9-3:海马体齿状回区中的brdu染色
必须进行神经干细胞的不对称分裂以使神经形成发生,并将其通过以下实验检测。
将施用brdu的5xfad小鼠(如实施例8中所述,在处死前连续5天每天施用50mg/kgbrdu)的脑组织载玻片再水合,置于1.5mhcl(盐酸)中,并在37℃下孵育30分钟。将载玻片用含有0.5%bsa(牛血清白蛋白)、0.3%tritonx-100和10%正常山羊血清的溶液封闭,并在4℃下与抗-brdu抗体(cellsignaling,目录号5292)一起孵育1天。第二天通过将载玻片与异硫氰酸荧光素(fitc)-二抗在室温下孵育1小时进行免疫荧光染色,之后用荧光显微镜检测海马体齿状回区域的染色。
结果显示在图16a的用“brdu”标记的栏中。由箭头状物(▼)标记的细胞是brdu标记的细胞。与施用媒介物的组相比,施用曲美替尼的5xfad小鼠显示出齿状回中brdu染色的细胞数目增加。图16b显示了brdu标记的细胞数目,其再次显示施用曲美替尼的组显示brdu染色的细胞数目增加。图16b对来自总共9个区域(每组3只小鼠和每只小鼠3个区域)的细胞数目进行定量,并且平均值显示在图表中。
根据这些结果,揭示出曲美替尼在ad小鼠模型中通过nsc分化来诱导神经形成。这表明曲美替尼不仅可以用作ad的基础治疗,而且还可用于治疗和预防由脑皮质中特别是运动皮质中的神经元损伤或丢失引起的疾病。
实施例10:ad小鼠模型中的神经保护活性
为了确定曲美替尼是否在5xfad小鼠的脑皮质和海马体下托中具有神经保护作用,进行免疫组织化学tunel(末端脱氧核苷酸转移酶dutp缺口末端标记)测定以检测细胞细胞凋亡。tunel测定对片段化dna的3’-羟基末端进行染色,从而允许检测组织中经历细胞凋亡的细胞。
将实施例8中描述的矢状脑组织载玻片再水合,并用tunel测定试剂盒(promega,wisconsin,usa,目录号g3250)染色。特别地,将脑组织载玻片用20μg/ml蛋白酶k溶液透化10分钟,用平衡缓冲液孵育10分钟,然后在37℃下与tdt溶液孵育1小时。观察到体感皮质和下托区的染色,这些区域已知在5xfad小鼠中显示出显著的细胞死亡。还在正常成年小鼠脑的组织载玻片上进行tunel测定(作为对照)以确认染色适当完成。
结果示于图17中。在正常小鼠(图17中标记为“正常小鼠”)中没有观察到绿色荧光染色,因为没有发生细胞凋亡。然而,在5xfad小鼠的体感皮质(图17中标记为“皮质”的行)和下托(图17中标记为“下托”的行)中,许多细胞中观察到绿色荧光。在图17中,将染色的细胞在下托中用箭头(→)标记;在体感皮质中,由于许多细胞被染色,没有进行分开的标记。在施用曲美替尼的5xfad小鼠的情况下,相比施用媒介物的组,体感皮质和下托中tunel染色的细胞数目显著更低。
这些结果表明曲美替尼在ad小鼠模型中对神经元死亡具有保护作用。
实施例11:ad小鼠模型中的小脑浦肯野细胞保护
将实施例8所述的(5xfad小鼠的)脑组织载玻片与抗-tuj1和抗-钙结合蛋白抗体(cellsignaling,目录号13176)在4℃下一起孵育1天,并用异硫氰酸荧光素(fitc)-二抗或罗丹明-二抗在室温下染色1小时。图18中显示了浦肯野细胞层的免疫荧光图像。显示了每个处理组的两个用于tuj1染色的载玻片和三个用于钙结合蛋白染色的载玻片。
如图18所示,媒介物-处理组的浦肯野细胞展示出细小的突出轴突,其显示出在中间被切断的模式。相反,曲美替尼-施用组,特别是0.1mg/kg曲美替尼-处理组,当与媒介物处理的对照比较时,展现出具有增加的轴突树枝状或至少具有保守的轴突结构的浦肯野细胞。
已知小脑在感官再认知的整合及运动移动的调控和控制中发挥重要作用。小脑中最显著的细胞浦肯野细胞是脑中最大的细胞之一,并且通过复杂的轴突树枝状,它们彼此形成突触并延伸深入到小脑的核中以调控和控制运动肌肉。上述实验结果表明,曲美替尼保护浦肯野细胞并增加小脑中轴突的树枝状,可能提供治疗由小脑中的浦肯野细胞的丢失或损伤导致的疾病如小脑性共济失调。
实施例12:ad小鼠模型中曲美替尼对mek活性的抑制
由于神经退行性疾病治疗药物作用于中枢神经系统,因此它们是否可以穿过血脑屏障以作用于大脑的问题是重要的。在mek1/2抑制剂中,已知诸如as703026的化合物能有效穿过bbb并抑制mek,并减少小鼠脑中磷酸化erk的表达(shaw等人(2012)evaluationofbrainpharmacokineticsasapotentialdifferentiationfactorforthemekinhibitors,msc2015103andpimasertib.abstractlb-456,americanassociationforcancerresearchannualmeeting,chicago,il)。为了确认mek1/2抑制剂曲美替尼当向5xfad小鼠po施用时进入大脑以产生上述实验结果,在脑组织中测量了perk的表达水平。
将储存于深冻冰箱中的来自实施例8的5xfad小鼠脑半球(每组3只小鼠)置于液氮中,并在用液氮填充的研钵中研磨。将粉末分成6份,放入新管中,并放回深冻冰箱中。将其中一个管取出并用于如实施例5-2所述的蛋白质印迹。用移液管将该粉末小心地混悬在ripa缓冲液中,在冰上孵育10分钟,以13000rpm,4℃离心并收集上清液。测量蛋白质浓度后,添加样品缓冲液(0.25mtris-hclph6.8,0.05%sds,50%甘油,0.25mdtt,0.5mg/mlbpb),在100℃下煮沸10分钟,并储存于-20℃下。将10μg蛋白样品上样到10%sds-page凝胶上,经受电泳,转移到硝酸纤维素膜上,并用5%脱脂乳在室温下封闭1小时。使用于含有0.1%tween20的tris缓冲盐水(tbs)中的抗-perk(cellsignaling,目录号4370)和抗-erk抗体进行蛋白质印迹,将它们在室温下孵育1小时,随后之后与辣根过氧化物酶-缀合的二抗一起在室温下孵育1小时。用光敏成像系统检测蛋白条带(图19a)。为了定量perk表达的变化,通过密度测量法测量perk和erk的表达水平,并且将perk的表达水平针对erk的表达水平归一化。图19b显示了曲美替尼-处理组相对于媒介物-处理组的perk归一化表达水平。
如图19所示,施用0.1mg/kg和1.0mg/kg曲美替尼的小鼠的脑中,perk的蛋白水平显著低于媒介物组的蛋白水平。
这一发现表明,曲美替尼的po施用导致曲美替尼递送至大脑,随后抑制mek活性并降低perk的表达,通过其神经形成和神经保护表现出来。
实施例13:ad小鼠模型中的β-淀粉样蛋白沉积的减少
由于ad的主要病理特征是aβ沉积,因此检测曲美替尼减少aβ沉积的能力。使用实施例12中获得的5xfad小鼠脑半球的磨碎粉末,通过elisa(酶联免疫吸附测定)定量aβ(1-40)和aβ(1-42)的量。使用elisa试剂盒(invitrogen,ma,目录号khb3442)按如下进行测定:首先,将小鼠脑粉末用移液管小心混悬于5m胍-hcl溶液中,以16000xg(rpm)4℃离心并收集上清液。在测量蛋白浓度后,添加稀释缓冲液以获得于100μl溶液中的30~50μg蛋白。向96-孔板中添加各100μl抗-aβ(1-40)和aβ(1-42)抗体,在室温下孵育2小时,然后去除并用洗涤缓冲液洗涤4次。添加各100μl的hrp-缀合的二抗并在室温下孵育30分钟。然后去除溶液并用洗涤缓冲液再次洗涤4次。将100μl由小鼠脑粉末制备的蛋白添加至孔中,在黑暗中孵育30分钟,并添加100μl终止溶液以终止反应。然后,用elisa读板仪在450nm下测量化学发光反应。参考标准浓度转换吸光度并测定每种蛋白的浓度。计算参考蛋白总量(30~50μg)的aβ(1-40)和aβ(1-42)的量,然后计算参考aβ(1-40)量的aβ(1-42)量。获得每个组的3只小鼠测量结果的平均值,且示于图20中。如图20所示,相比媒介物-处理组,曲美替尼-处理组中aβ(1-42)/aβ(1-40)的量减少。
这一发现表明,在ad动物模型中,曲美替尼降低了具有形成毒性寡聚体或聚集物的强烈倾向的aβ特别是aβ(1-42)形式的量,并且以这种方式可为神经元提供保护。
- 还没有人留言评论。精彩留言会获得点赞!