用于治疗真菌感染的给药方案的制作方法
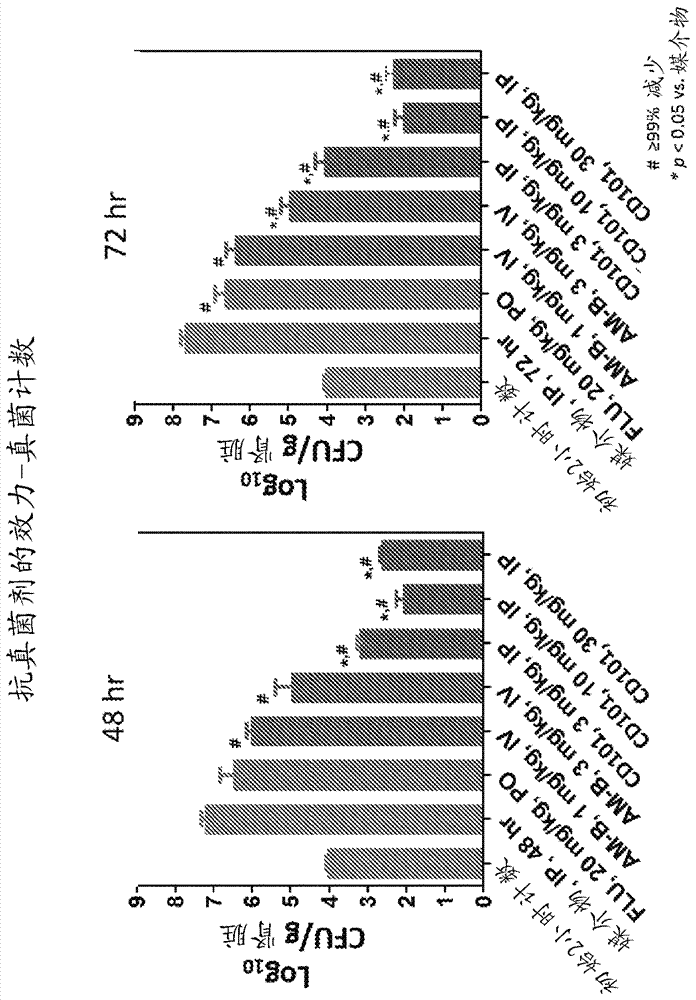
本公开涉及治疗真菌感染的领域。由念珠菌引起的全身性感染是严重且危及生命的感染,其代表了重大的公共健康问题,特别是在高度脆弱的患者群体(诸如老年人、手术后、危重疾病和其他具有严重医疗病况的住院患者)中。由于对现有抗真菌药物的抗性渐增,迫切需要开发新的和更有效的抗真菌剂来治疗这些严重感染。thecentersfordiseasecontrolandprevention最近警告,氟康唑抗性的念珠菌有可能对公共健康构成严重威胁。然而,自2007年以来,没有新的抗真菌剂被批准用于治疗念珠菌血症。因此,需要念珠菌和其他真菌感染的新的治疗。发明概述我们已经发现用于施用cd101(一种广谱抗真菌剂,其针对念珠菌属的野生型和唑类抗性和棘白菌素抗性的菌株具有优异的活性)的给药方案。第一方面是治疗主体中的真菌感染的方法,该方法由以下步骤组成:(a)静脉内施用400±25mg的盐或中性形式的cd101的第一剂量;(b)静脉内施用200±25mg的盐或中性形式的cd101的第二剂量,和(c)任选地静脉内施用200±25mg的盐或中性形式的cd101的第三剂量。在该方法中,第一剂量在第1天施用,第二剂量在第7天和第9天之间(例如,在第8天)施用,且第三剂量,如果施用,在第14天和第16天之间(例如,在第15天)施用。第二方面是通过如下治疗主体中的真菌感染的方法:(a)静脉内施用包括400±25mg的盐或中性形式的cd101的第一剂量,(b)静脉内施用包括200±25mg的盐或中性形式的cd101的第二剂量,(c)静脉内施用包括200±25mg的盐或中性形式的cd101的第三剂量,和(d)任选地静脉内施用包括200±25mg的盐或中性形式的cd101的第四剂量。在该方法中,第一剂量在第1天施用,第二剂量在第7天和第9天之间(例如,在第8天)施用,第三剂量在第14天和第16天之间(例如,在第15天)施用,且第四剂量,如果施用,在第21天和第23天之间(例如,在第22天)施用。在第二方面的一些实施方案中,该方法进一步包括任选地静脉内施用包括200±25mg的盐或中性形式的cd101的第五剂量,其中第五剂量,如果施用,在第28天和第30天之间(例如,在第29天)施用。在进一步实施方案中,所述方法进一步包括任选地静脉内施用包括200±25mg的盐或中性形式的cd101的第六剂量,其中第六剂量,如果施用,在第35天和第37天之间(例如,在第36天)施用。在一些实施方案中,第一剂量是400mg的盐或中性形式的cd101,且第二和第三剂量各自为200mg的盐或中性形式的cd101。第三方面是治疗主体中的真菌感染的方法,该方法由以下步骤组成:(a)静脉内施用400±25mg的盐或中性形式的cd101的第一剂量;(b)静脉内施用400±25mg的盐或中性形式的cd101的第二剂量,和(c)任选地静脉内施用400±25mg的盐或中性形式的cd101的第三剂量。在该方法中,第一剂量在第1天施用,第二剂量在第7天和第9天之间(例如,在第8天)施用,且第三剂量,如果施用,在第14天和第16天之间(例如,在第15天)施用。第四方面是通过如下治疗主体中的真菌感染的方法:(a)静脉内施用包括400±25mg的盐或中性形式的cd101的第一剂量,(b)静脉内施用包括400±25mg的盐或中性形式的cd101的第二剂量,(c)静脉内施用包括400±25mg的盐或中性形式的cd101的第三剂量,和(d)任选地静脉内施用包括400±25mg的盐或中性形式的cd101的第四剂量。在该方法中,第一剂量在第1天施用,第二剂量在第7天和第9天之间(例如,在第8天)施用,第三剂量在第14天和第16天之间(例如,在第15天)施用,且第四剂量,如果施用,在第21天和第23天之间(例如,在第22天)施用。在第四方面的一些实施方案中,该方法进一步包括任选地静脉内施用包括400±25mg的盐或中性形式的cd101的第五剂量,其中第五剂量,如果施用,在第28天和第30天之间(例如,在第29天)施用。在进一步实施方案中,所述方法进一步包括任选地静脉内施用包括400±25mg的盐或中性形式的cd101的第六剂量,其中第六剂量,如果施用,在第35天和第37天之间(例如,在第36天)施用。在一些实施方案中,第一、第二和第三剂量各自为400mgcd101或其盐或中性形式。在一些实施方案中,施用盐或中性形式的cd101,直至实现真菌根除、临床体征和症状的改善和/或临床治愈,如通过本领域已知的标准测试所确定。在一些实施方案中,将真菌根除定义为一种阴性血液培养物。在一些实施方案中,将真菌根除定义为以≥12小时间隔抽取的两种阴性血液培养物且不间插有阳性血液培养物,并且对真菌感染没有抗真菌疗法的改变。在一些实施方案中,施用盐或中性形式的cd101,直至主体没有真菌感染的症状,诸如发烧、咳嗽、呼吸短促、体重减轻、盗汗、心动过速、呼吸急促、低血压和/或体温过低,如通过医生所确定。在第一和方面的一些实施方案中,如果在第15天在主体中尚未实现真菌根除和/或临床治愈,则施用包括200±25mg(例如,200mg)的盐或中性形式的cd101的第三剂量。在第一和第二方面的其他实施方案中,如果已经在主体中实现真菌根除和/或临床治愈,则不施用包括200±25mg(例如,200mg)的盐或中性形式的cd101的第三剂量。在第一和第二方面的其他实施方案中,如果在第15天主体表现出真菌感染的症状,则施用包括200±25mg(例如,200mg)的盐或中性形式的cd101的第三剂量。在第三和第四方面的一些实施方案中,如果在第15天在主体中未实现真菌根除和/或临床治愈,则施用包括400±25mg(例如,400mg)的盐或中性形式的cd101的第三剂量。在第三和第四方面的其他实施方案中,如果在第15天在主体中实现真菌根除和/或临床治愈,则不施用包括400±25mg(例如,400mg)的盐或中性形式的cd101的第三剂量。在第三和第四方面的其他实施方案中,如果在第15天主体表现出真菌感染的症状,则施用包括400±25mg(例如,400mg)的盐或中性形式的cd101的第三剂量。在一些实施方案中,真菌根除通过一种阴性血液培养物来确定。在一些实施方案中,通过以≥12小时间隔抽取的两种阴性血液培养物且不间插有阳性血液培养物来确定真菌根除。在一些实施方案中,真菌感染的症状包括发烧、咳嗽、呼吸短促、体重减轻、盗汗、心动过速、呼吸急促、低血压和/或体温过低。在第一至第四方面的其他实施方案中,所述真菌感染是念珠菌感染(例如,白色念珠菌(candidaalbicans)、光滑念珠菌(c.glabrata)、都柏林念珠菌(c.dubliniensis)、克鲁斯念珠菌(c.krusei)、近平滑念珠菌(c.parapsilosis)、热带念珠菌(c.tropicalis)、拟平滑念珠菌(c.orthopsilosis)、吉利蒙念珠菌(c.guilliermondii)、皱褶念珠菌(c.rugosa)、耳念珠菌(c.auris)、葡萄牙念珠菌(c.lusitaniae)或其他念珠菌属种的感染)。念珠菌感染包括念珠菌血症、侵袭性念珠菌病、口咽念珠菌病、食道念珠菌病、粘膜念珠菌病、生殖器念珠菌病、外阴阴道念珠菌病、胃肠道念珠菌病、直肠念珠菌病、肝念珠菌病、肾念珠菌病、肺念珠菌病、脾念珠菌病、耳霉菌病、骨髓炎、脓毒性关节炎和心血管念珠菌病。在一些实施方案中,心血管念珠菌病是心内膜炎。在一些实施方案中,粘膜念珠菌病是眼念珠菌病、耳念珠菌病或口念珠菌病。在第五方面,本公开的特征在于将cd101施用于主体的方法,其中所述方法由以下组成:(a)静脉内施用包含400±25mg的盐或中性形式的cd101的第一剂量,(b)静脉内施用包含200±25mg的盐或中性形式的cd101的第二剂量,和(c)任选地静脉内施用包含200±25mg的盐或中性形式的cd101的第三剂量,其中第一剂量在第1天施用,第二剂量在第7天和第9天之间(例如,在第8天)施用,且第三剂量,如果施用,在第14天和第16天之间(例如,在第15天)施用。在第五方面的一些实施方案中,第一剂量是400mg的盐或中性形式的cd101,且第二和第三剂量各自为200mg的盐或中性形式的cd101。在第六方面,本公开的特征在于将cd101施用于主体的方法,其中所述方法由以下组成:(a)静脉内施用包括400±25mg的盐或中性形式的cd101的第一剂量,(b)静脉内施用包括200±25mg的盐或中性形式的cd101的第二剂量,(c)静脉内施用包括200±25mg的盐或中性形式的cd101的第三剂量,和(d)任选地静脉内施用包括200±25mg的盐或中性形式的cd101的第四剂量,其中第一剂量在第1天施用,第二剂量在第7天和第9天之间(例如,在第8天)施用,第三剂量在第14天和第16天之间(例如,在第15天)施用,且第四剂量,如果施用,在第21天和第23天之间(例如,在第22天)施用。在第六方面的一些实施方案中,第一剂量是400mg的盐或中性形式的cd101,且第二、第三和第四剂量各自为200mg的盐或中性形式的cd101。在第六方面的一些实施方案中,该方法进一步包括任选地静脉内施用包括200±25mg的盐或中性形式的cd101的第五剂量,其中第五剂量,如果施用,在第28天和第30天之间(例如,在第29天)施用。在进一步实施方案中,所述方法进一步包括任选地静脉内施用包括200±25mg的盐或中性形式的cd101的第六剂量,其中第六剂量,如果施用,在第35天和第37天之间(例如,在第36天)施用。在第七方面,本公开的特征在于将cd101施用于主体的方法,其中所述方法由以下组成:(a)静脉内施用包含400±25mg的盐或中性形式的cd101的第一剂量,(b)静脉内施用包含400±25mg的盐或中性形式的cd101的第二剂量,和(c)任选地静脉内施用包含400±25mg的盐或中性形式的cd101的第三剂量,其中第一剂量在第1天施用,第二剂量在第7天和第9天之间(例如,在第8天)施用,且第三剂量,如果施用,在第14天和第16天之间(例如,在第15天)施用。在第七方面的一些实施方案中,第一、第二和第三剂量各自为400mgcd101或其盐或中性形式。在第八方面,本公开的特征在于将cd101施用于主体的方法,其中所述方法由以下组成:(a)静脉内施用包括400±25mg的盐或中性形式的cd101的第一剂量,(b)静脉内施用包括400±25mg的盐或中性形式的cd101的第二剂量,(c)静脉内施用包括400±25mg的盐或中性形式的cd101的第三剂量,和(d)任选地静脉内施用包括400±25mg的盐或中性形式的cd101的第四剂量,其中第一剂量在第1天施用,第二剂量在第7天和第9天之间(例如,在第8天)施用,第三剂量在第14天和第16天之间(例如,在第15天)施用,且第四剂量,如果施用,在第21天和第23天之间(例如,在第22天)施用。在第八方面的一些实施方案中,第一、第二、第三和第四剂量各自为400mgcd101或其盐或中性形式。在第八方面的一些实施方案中,该方法进一步包括任选地静脉内施用包括400±25mg的盐或中性形式的cd101的第五剂量,其中第五剂量,如果施用,在第28天和第30天之间(例如,在第29天)施用。在进一步实施方案中,所述方法进一步包括任选地静脉内施用包括400±25mg的盐或中性形式的cd101的第六剂量,其中第六剂量,如果施用,在第35天和第37天之间(例如,在第36天)施用。在任何上述方面的实施方案中,盐或中性形式的cd101经30至180分钟(例如,经30±5分钟、60±5分钟、90±5分钟、120±5分钟、150±5分钟、180±5分钟、30±10分钟、60±10分钟、90±10分钟、120±10分钟、150±10分钟或180±10分钟)的时间段内施用。在任何上述方面的实施方案中,盐或中性形式的cd101作为水性药物组合物(例如,具有4.0至8的ph的药物组合物)施用。在任何上述方面,cd101的盐是cd101乙酸盐。在本文所述方法的一些实施方案中,将盐或中性形式的cd101施用2-12剂量(例如,2-3剂量)。如本文所用,术语“静脉内施用”或“静脉内地施用”是指静脉内快速浓注(bolusinjection)或输注药物至主体。“足够的量”意指增加药物口服生物利用度所需的添加剂的量。“真菌感染”意指致病性真菌侵袭宿主。例如,感染可以包括正常存在于人体中或人体上的真菌的过度生长或正常不存在于人体中或人体上的真菌生长。更通常,真菌感染可以是其中真菌群体的存在正损害宿主身体的任何情形。因此,当过量的真菌群体存在于人体中或人体上,或当真菌群体的存在损害人的细胞或其他组织时,人正“患有”真菌感染。如本文所用,术语“药物抗性真菌感染”是指用药物(例如,抗真菌药物)治疗难治的真菌感染。在此类感染中,引起感染的真菌对用一种或多种抗真菌药物的治疗具有抗性(例如,真菌的抗真菌药物抗性菌株(例如,念珠菌属的抗真菌药物抗性菌株))。抗真菌药物包括但不限于棘白菌素类、多烯化合物、氟胞嘧啶和唑类化合物。真菌感染可以由属例如念珠菌属(例如,白色念珠菌、光滑念珠菌和耳念珠菌)或曲霉属(例如烟曲霉)中的真菌引起。在一些实施方案中,真菌感染也可以是皮肤真菌感染。如本文所用,术语“棘白菌素抗性真菌感染”是指用棘白菌素治疗难治的真菌感染。在此类感染中,引起感染的真菌对用一种或多种棘白菌素的治疗具有抗性。一种或多种棘白菌素是环状脂肽,其通过抑制1,3-β-d-葡聚糖合酶酶复合物来抑制细胞壁中葡聚糖的合成。术语“棘白菌素-抗性真菌感染”中提及的一种或多种棘白菌素包括米卡芬净、卡泊芬净和阿尼芬净,但不包括cd101或其盐或中性形式。因此,使用本公开的方法,cd101或其盐或中性形式可用于治疗米卡芬净抗性、卡泊芬净抗性和/或阿尼芬净抗性真菌感染。如本文所用,术语“多烯抗性真菌感染”是指用多烯化合物治疗难治的真菌感染。在此类感染中,引起感染的真菌对用一种或多种多烯化合物的治疗具有抗性。多烯化合物是插入真菌膜、结合真菌膜中的麦角甾醇和结构相关的甾醇并破坏膜结构完整性、因此引起细胞组分从引起感染的真菌泄漏的化合物。多烯化合物通常包括具有三至八个共轭碳-碳双键的大内酯环,且还可以含有糖部分和芳族部分。多烯化合物的实例包括但不限于67-121-a、67-121-c、两性霉素b、arenomvcinb、金菌素(aurenin)、金色制霉素a、aureotuscin、制假丝菌素、金鸡纳素(chinin)、去甲氧基雷帕霉素、制皮菌素a、制皮菌素b、dj-400-b1、dj-400-b2、elizabethin、优洛杀菌素a、优洛杀菌素b、菲律平(filipin)i、菲律平ii、菲律平iii、菲律平iv、制霉色基素(fungichromin)、gannibamycin、哈霉素(hamycin)、来佛林(levorin)a2、烯霉素、光明霉素、七烯枝菌素(mycoheptin)、防霉红菌素(mycoticin)a、防霉红菌素b、游霉素、制霉菌素a、制霉菌素a3、帕曲星a、帕曲星b、表霉素(perimycin)a、匹马菌素、polifunginb、雷帕霉素、rectilavendomvcin、龟裂霉素(rimocidin)、roflamycoin、四霉素a、四霉素b、四烯菌素a和四烯菌素b。如本文所用,术语“氟胞嘧啶抗性真菌感染”是指用合成抗真菌药物氟胞嘧啶治疗难治的真菌感染。氟胞嘧啶的商标名是ancobon®。如本文所用,术语“唑类抗性真菌感染”是指用唑类化合物治疗难治的真菌感染。在此类感染中,引起感染的真菌对用一种或多种唑类化合物的治疗具有抗性。术语“唑类抗性的真菌感染”中提及的唑类化合物是含有唑基的抗真菌化合物,所述唑基是具有至少一个n和一个或多个选自n、o或s的杂原子的五元杂环。抗真菌唑类化合物通过与酶14α-去甲基化酶结合而发挥功能并破坏、抑制和/或防止其天然功能。酶14α-去甲基化酶是细胞色素p450酶,其在羊毛甾醇转化为麦角甾醇(真菌细胞壁中的必需成分)之前催化从羊毛甾醇中除去c-14α-甲基基团。因此,通过抑制14α-去甲基化酶,麦角甾醇的合成被抑制。唑类化合物的实例包括但不限于,vt-1161、vt-1598、氟康唑、阿巴康唑、联苯苄唑、布康唑、克霉唑、益康唑、艾氟康唑(efinaconazole)、芬替康唑(fenticonazole)、艾沙康唑(isavuconazole)、异康唑(isoconazole)、伊曲康唑(itraconazole)、酮康唑(ketoconazole)、卢立康唑(luliconazole)、咪康唑(miconazole)、奥莫康唑(omoconazole)、奥昔康唑(oxiconazole)、泊沙康唑(posaconazole)、普拉康唑(pramiconazole)、雷夫康唑(ravuconazole)、舍他康唑(sertaconazole)、硫康唑(sulconazole)、特康唑(terconazole)、噻康唑(tioconazole)和伏立康唑(voriconazole)。如本文所用,术语“抗真菌疗法”是指使用抗真菌药物治疗真菌感染。用于抗真菌疗法中的抗真菌药物包括但不限于棘白菌素类、多烯化合物、氟胞嘧啶、唑类化合物、enfumafungin和scy-078、apx001。如本文所述,本公开的一个方面是治疗用抗真菌疗法治疗失败的主体中的真菌感染的方法。在本公开的该方面中用于抗真菌疗法中的抗真菌药物不包括cd101或其盐或中性形式。如本文所用,术语“棘白菌素疗法”是指使用棘白菌素(诸如,米卡芬净、卡泊芬净和阿尼芬净,但不是化合物1的盐,或其中性形式)治疗真菌感染。如本文所述,在一些实施方案中,可以向用棘白菌素疗法治疗失败的主体施用化合物1的盐或其中性形式,以治疗真菌感染。在一些实施方案中,如果真菌感染用棘白菌素疗法治疗失败,则可以向具有真菌感染的主体施用cd101或其盐或中性形式。如本文所用,术语“多烯疗法”是指使用多烯化合物治疗真菌感染。如本文所述,在一些实施方案中,可以向用多烯疗法治疗失败的主体施用cd101或其盐或中性形式以治疗真菌感染。在一些实施方案中,如果真菌感染用多烯疗法治疗失败,则可以向具有真菌感染的主体施用cd101或其盐或中性形式。如本文所用,术语“唑类疗法”是指使用唑类化合物治疗真菌感染。抗真菌唑类化合物的实例包括但不限于,vt-1161、vt-1598、氟康唑、阿巴康唑、联苯苄唑、布康唑、克霉唑、益康唑、艾氟康唑(efinaconazole)、芬替康唑(fenticonazole)、艾沙康唑(isavuconazole)、异康唑(isoconazole)、伊曲康唑(itraconazole)、酮康唑(ketoconazole)、卢立康唑(luliconazole)、咪康唑(miconazole)、奥莫康唑(omoconazole)、奥昔康唑(oxiconazole)、泊沙康唑(posaconazole)、普拉康唑(pramiconazole)、雷夫康唑(ravuconazole)、舍他康唑(sertaconazole)、硫康唑(sulconazole)、特康唑(terconazole)、噻康唑(tioconazole)和伏立康唑(voriconazole)。如本文所述,在一些实施方案中,可以向用唑类疗法治疗失败的主体施用cd101或其盐或中性形式以治疗真菌感染。在一些实施方案中,如果真菌感染用唑类疗法治疗失败,则可以向具有真菌感染的主体施用cd101或其盐或中性形式。如本文所用,术语“1,3-β-d-葡聚糖合酶酶复合物”是指负责合成1,3-β-d-葡聚糖(真菌细胞壁中的必需组分)的多亚基酶复合物。突变体1,3-β-d-葡聚糖合酶酶复合物是指在酶复合物的一个或多个亚基中具有一个或多个突变的1,3-β-d-葡聚糖合酶酶复合物。在一些实施方案中,一个或多个突变在fks基因(fks1、fks2、fks3)(其编码1,3-β-d-葡聚糖合酶酶复合物的催化亚基)中。“有效的”量意指治疗或预防感染或与感染有关的疾病所需药物的量。用于实践本文所述的方法的治疗性或预防性治疗由微生物感染引起或由微生物感染所致的病况的药物的有效量取决于施用方式、主体的年龄、体重,和一般健康状况而变化。最终,主治医师将决定适当的量和剂量方案。这种量被称为“有效的”量。如本文所用,术语“cd101盐”是指式1化合物的盐。cd101具有(以下)结构,其中cd101的叔铵离子正电荷用呈其盐形式的负抗衡离子(例如,乙酸根)平衡。如本文所用,术语“cd101中性形式”包括cd101的两性离子形式,其中式1的化合物不具有净正电荷或负电荷。相对于cd101或cd101的盐,两性离子在碱性介质(例如,ph9)中以更高比例存在。在一些实施方案中,两性离子也可以其盐形式存在。如本文所用,术语“盐”是指任何药学上可接受的盐,诸如非毒性酸加成盐、金属盐或金属络合物,通常用于制药工业。酸加成盐的实例包括有机酸,诸如乙酸、乳酸、棕榈酸、马来酸、柠檬酸、胆酸、癸酸、辛酸、月桂酸、戊二酸、葡糖醛酸、甘油酸、乙醇酸、乙醛酸、异柠檬酸、异戊酸、乳酸、苹果酸、草酰乙酸、草酰琥珀酸、丙酸、丙酮酸、抗坏血酸、琥珀酸、苯甲酸、棕榈酸、辛二酸、水杨酸、酒石酸、甲磺酸、甲苯磺酸和三氟乙酸;和无机酸,诸如盐酸、氢溴酸、硫酸,和磷酸。代表性的碱或碱土金属盐包括钠、锂、钾、钙和镁等。如本文所用,每个剂量中的量是指如果cd101呈其盐形式,则不包括负抗衡离子(例如,乙酸根)的cd101(上面显示的式1)的量。“剂量”意指施用于主体的cd101的量。“主体”或“患者”意指人。“临床治愈”是指在基线存在的念珠菌血症和/或侵袭性念珠菌病的大多数或所有临床体征和症状的完全消退,且没有可归因于念珠菌血症和/或侵袭性念珠菌病的新体征/症状或并发症。如本文所用的,术语“治疗”指施用药物组合物用于预防和/或治疗性目的。“预防疾病”指预防性治疗尚未生病,但易得病,或另外处于罹患特定疾病的风险中的主体。“治疗疾病”或使用“治疗性治疗”指对已经罹患疾病的主体施用治疗以改善或稳定主体的病况。因此,在权利要求书和实施方案中,治疗是向主体施用用于治疗性或者预防性目的。如本文所用,术语“突变体预防浓度”或“mpc”是指足以抑制所有但非常罕见的自发突变体发展的药物浓度。mic和mpc之间的药物浓度范围代表突变体选择窗口,其中最有可能发生从头发生的突变体。使药物浓度的持续时间最大化超过mpc的治疗方案由此使治疗过程期间的抗性发展的可能性最小化。体内抗性菌株的选择主要发生在落在mic和mpc值之间的药物浓度的范围内。因此,导致血浆药物浓度超过mpc的剂量范例在治疗过程期间在预防从头发生的突变体的发展中更合意且有效(参见,例如,drlica等人,j.antimicrob.chemother.52:11-17,2003)。目前批准的卡泊芬净、米卡芬净和阿尼芬净的治疗方案涉及每日一次给药,其水平使得cmax在治疗期间的任何时间点都不可能等于或超过mpc。对于cd101对白色念珠菌和光滑念珠菌测定的mpc为16µg/ml(参见实施例2)。基于体内药代动力学数据的cd101总血浆浓度的建模允许我们计算出c101≥150mg的iv施用足以生成超过16μg/ml的浓度。对于其他菌株和/或真菌物种,产生血浆突变体预防浓度的给药方案可以是这样的给药方案,其中血浆浓度超过20μg/ml、24μg/ml、30μg/ml或36μg/mlcd101或其盐或中性形式有可能以超过mpc的水平给药,且因此具有比现有批准的棘白菌素治疗方案更强的突变体预防能力。除了在操作实施例中或另有说明之外,本文所用的表示成分量或反应条件的所有数字应理解为在所有情况下均由术语“约”修饰。如本文所用,术语“约”表示±5%的偏差。本公开的其他特征和优点从以下详细描述、附图和权利要求书中将变得显而易见。附图简述图1是显示通过周和最小抑制浓度(mic)分层的两种cd101给药方案的pk-pd目标实现(targetattainment)的柱状图。图2是显示用不同的接种物密度的唑类抗性白色念珠菌菌株r357感染的小鼠的肾脏负荷的柱状图。图3显示用于评估cd101、两性霉素b和氟康唑在白色念珠菌r357感染模型中的效力的实验方案的概要。图4a和4b是显示cd101、两性霉素b(am-b)和氟康唑(flu)对用唑类抗性白色念珠菌菌株r357感染的小鼠中的肾脏负荷的影响的柱状图。图5是显示经剂量1mg/kg、4mg/kg和16mg/kg的cd101的pk的散点图。图6是显示不同分级方案中真菌密度(log10cfu)的净变化vs.cd101的不同总剂量的散点图。图7是显示在不同分级方案中由2mg/kg总剂量的cd101引起的真菌密度(log10cfu)从基线减少的变化的条形图。图8是显示相对于分级的cd1012mg/kg方案的mic的模拟游离药物浓度时间概况的线图。图9是显示用烟曲霉(aspergillusfumigatus)感染并用2mg/kgcd101(iv或ip)处理的小鼠中随时间的存活百分比的图。图10是显示各种抗真菌剂针对耳念珠菌临床分离株的活性的表。详述提供了通过向主体施用配制为水性组合物的盐或中性形式的cd101的静脉内输注来治疗有需要的主体中的真菌感染的方法。cd101cd101是一种半合成的棘白菌素,其抑制1,3-β-d-葡聚糖的合成,所述1,3-β-d-葡聚糖是念珠菌属的酵母形式的真菌细胞壁和曲霉菌菌丝的活跃细胞生长的区域的主要组分。1,3-β-d-葡聚糖的合成取决于1,3-β-d-葡聚糖合酶(其中催化亚基由fks1、fks2和fks3基因编码的酶复合物)的活性。该酶的抑制导致念珠菌属的快速、浓度依赖性的杀真菌活性。cd101的结构如上所述。疗法本文描述的治疗方案和药物组合物可用于治疗或预防真菌感染。待治疗的真菌感染可以是选自以下的感染:头癣、体癣、脚癣、甲癣、甲真菌病(perionychomycosis)、花斑癣(pityriasisversicolor)、鹅口疮、阴道念珠菌病、呼吸道念珠菌病、胆道念珠菌病、食管念珠菌病、尿道念珠菌病、系统性念珠菌病、粘膜皮肤念珠菌病、毛霉菌病、副球孢子菌病、北美芽生菌病、组织胞浆菌病、球孢子菌病、孢子丝菌病、真菌性鼻窦炎或慢性鼻窦炎。例如,所治疗的感染可以是念珠菌属种(例如,白色念珠菌、光滑念珠菌、都柏林念珠菌、克鲁斯念珠菌、近平滑念珠菌、热带念珠菌、拟平滑念珠菌、吉利蒙念珠菌、皱褶念珠菌、耳念珠菌、葡萄牙念珠菌或其他念珠菌属种)的感染。在一些实施方案中,真菌感染可以是抗真菌药物抗性真菌感染,其是用抗真菌药物治疗难治的真菌感染。在此类感染中,引起感染的真菌对用一种或多种抗真菌药物的治疗具有抗性(例如,真菌的抗真菌药物抗性菌株(例如,念珠菌属的抗真菌药物抗性菌株))。抗真菌药物包括但不限于唑类化合物、棘白菌素类、多烯化合物和氟胞嘧啶。例如,棘白菌素抗性真菌感染是指用棘白菌素治疗难治的真菌感染。在此类感染中,引起感染的真菌对用一种或多种棘白菌素的治疗具有抗性。一种或多种棘白菌素是环状脂肽,其通过抑制1,3-β-d-葡聚糖合酶酶复合物来抑制细胞壁中葡聚糖的合成。术语“棘白菌素抗性真菌感染”中提及的一种或多种棘白菌素包括米卡芬净、卡泊芬净和阿尼芬净,但不包括盐或中性形式的cd101。因此,使用本公开的方法,盐或中性形式的cd101可用于治疗米卡芬净抗性、卡泊芬净抗性和/或阿尼芬净抗性真菌感染。抗真菌药物抗性真菌感染也可以是唑类抗性真菌感染,其是指用唑类化合物治疗难治的真菌感染。在此类感染中,引起感染的真菌对用一种或多种唑类化合物的治疗具有抗性。术语“唑类抗性的真菌感染”中提及的唑类化合物是含有唑基的抗真菌化合物,所述唑基是具有至少一个n和一个或多个选自n、o或s的杂原子的五元杂环。抗真菌唑类化合物通过与酶14α-去甲基化酶结合而发挥功能并破坏、抑制和/或防止其天然功能。酶14α-去甲基化酶是细胞色素p450酶,其在羊毛甾醇转化为麦角甾醇(真菌细胞壁中的必需成分)之前催化从羊毛甾醇中除去c-14α-甲基基团。因此,通过抑制14α-去甲基化酶,麦角甾醇的合成被抑制。唑类化合物的实例包括但不限于,vt-1161、vt-1598、氟康唑、阿巴康唑、联苯苄唑、布康唑、克霉唑、益康唑、艾氟康唑、芬替康唑(fenticonazole)、艾沙康唑(isavuconazole)、异康唑(isoconazole)、伊曲康唑(itraconazole)、酮康唑(ketoconazole)、卢立康唑(luliconazole)、咪康唑(miconazole)、奥莫康唑(omoconazole)、奥昔康唑(oxiconazole)、泊沙康唑(posaconazole)、普拉康唑(pramiconazole)、雷夫康唑、舍他康唑(sertaconazole)、硫康唑(sulconazole)、特康唑(terconazole)、噻康唑(tioconazole)和伏立康唑(voriconazole)。抗真菌药物抗性真菌感染也可以是多烯抗性真菌感染,其是指用多烯化合物治疗难治的真菌感染。在此类感染中,引起感染的真菌对用一种或多种多烯化合物的治疗具有抗性。多烯化合物是插入真菌膜、结合真菌膜中的麦角甾醇和结构相关的甾醇并破坏膜结构完整性、因此引起细胞组分从引起感染的真菌泄漏的化合物。多烯化合物通常包括具有三至八个共轭碳-碳双键的大内酯环,且还可以含有糖部分和芳族部分。多烯化合物的实例包括但不限于67-121-a、67-121-c、两性霉素b、arenomvcinb、金菌素(aurenin)、金色制霉素a、aureotuscin、制假丝菌素、金鸡纳素、去甲氧基雷帕霉素、制皮菌素a、制皮菌素b、dj-400-b1、dj-400-b2、elizabethin、优洛杀菌素a、优洛杀菌素b、菲律平(filipin)i、菲律平ii、菲律平iii、菲律平iv、制霉色基素(fungichromin)、gannibamycin、哈霉素(hamycin)、来佛林(levorin)a2、烯霉素、光明霉素、七烯枝菌素、防霉红菌素(mycoticin)a、防霉红菌素b、游霉素、制霉菌素a、制霉菌素a3、帕曲星a、帕曲星b、表霉素a、匹马菌素、polifunginb、雷帕霉素、rectilavendomvcin、龟裂霉素(rimocidin)、roflamycoin、四霉素a、四霉素b、四烯菌素a和四烯菌素b。抗真菌药物抗性真菌感染也可以是氟胞嘧啶抗性真菌感染,其是指用合成抗真菌药物氟胞嘧啶治疗难治的真菌感染。氟胞嘧啶的商标名是ancobon®。念珠菌感染可以由念珠菌属中真菌的抗真菌药物抗性菌株(诸如,白色念珠菌、近平滑念珠菌、光滑念珠菌、吉利蒙念珠菌、克鲁斯念珠菌、葡萄牙念珠菌、耳念珠菌、热带念珠菌或其他念珠菌属种的抗真菌药物抗性菌株)引起。在一些实施方案中,念珠菌感染可以由念珠菌属中真菌的唑类抗性菌株(诸如,白色念珠菌、近平滑念珠菌、光滑念珠菌、吉利蒙念珠菌、克鲁斯念珠菌、葡萄牙念珠菌、耳念珠菌、热带念珠菌或其他念珠菌属种的唑类抗性菌株)引起。在一些实施方案中,真菌的唑类抗性菌株是白色念珠菌,例如白色念珠菌r357菌株。唑类抗性白色念珠菌r357菌株在基因erg11中含有突变(例如,白色念珠菌erg11(caerg11))。caerg11基因编码酶14α-去甲基化酶,其为唑类抗真菌化合物的靶标。导致氨基酸取代的caerg11基因中的突变改变唑类化合物结合并抑制14α-去甲基化酶的能力,从而导致抗性。在一些实施方案中,唑类抗性白色念珠菌r357菌株具有caerg11表达的增加,例如表达相对于野生型菌株为2-15倍(例如,3-15、4-15、5-15、6-15、7-15、8-15、9-15、10-15、11-15、12-15、13-15或14-15倍)。在一些实施方案中,唑类抗性白色念珠菌r357菌株在caerg11基因中具有一个或多个导致一个或多个氨基酸取代(例如,d116e、d153e和/或e266d)的突变。在一些实施方案中,唑类抗性白色念珠菌r357菌株在cdr1或mdr1表达中没有显著变化。表1显示三种唑类化合物(两性霉素b、卡泊芬净和cd101)对唑类抗性白色念珠菌r357菌株的抑制百分比和mic值以及如clsi(clinicalandlaboratorystandardsinstitute)分类的白色念珠菌r357菌株对所列化合物的敏感性状态(s:敏感;r:抗性)。表1抗真菌剂端点(%抑制)mic(µg/ml)敏感性(clsi)氟康唑50%>64r伏立康唑50%>64r泊沙康唑50%>64两性霉素b100%0.5s卡泊芬净50%0.25scd10150%0.125可通过本文所述的治疗方案和药物组合物治疗或预防的耳念珠菌的临床分离株描述于实施例部分(例如,实施例9)且还描述于lee等人,jclinmicrobiol.49:3139-42,2011,kathuria等人,jclinmicrobiol.53:1823-30,2015,和vallabhaneni等人,mmwrmorbmortalwklyrep.65:1234-1237,2016,其各自以其整体通过引用并入本文。例如,kathuria的图2描述了耳念珠菌的临床分离株,其显示于表2中。表2可以施用本文描述的治疗方案和药物组合物以在有需要的主体中预防真菌感染。例如,在免疫受损主体(例如患有癌症,患有hiv/aids,或服用免疫抑制剂的主体中)中或在经历长期抗生素疗法的主体中,主体可以接受预防性治疗,同时准备进行侵入性医疗程序(例如准备手术,诸如接受移植物、干细胞疗法、移植、假体、接受长期或频繁的静脉导管插入,或在重症监护病房接受治疗)。或者,可以施用本文描述的治疗方案和药物组合物以治疗主体的血流感染或器官感染(例如肺、肾或肝的感染)。提出以下实施例以便提供给本领域普通技术人员如何实施、制备和评估本文请求保护的方法和化合物的完全公开内容和描述,并意欲纯粹例举本公开内容而不意欲进行限制。实施例实施例1:将cd101施用于健康成人主体临床研究已经显示,cd101作为最高达400mg的单个剂量和最高达400mg的多个剂量是安全的且被良好耐受。在第一项研究中,将cd101通过iv注射施用于健康成人主体。在该研究中,将4个群组(各自8个主体(6个活性剂,2个安慰剂))中的主体随机化以接受单次iv剂量的经60(±5)分钟输注的cd101或安慰剂(生理盐水)。评价的cd101的剂量水平遵循递增的单剂量方案(50、100、200或400mg)。将总共32个主体随机化,且31个主体完成所有研究评价。一个主体由于与安全性或耐受性无关的个人原因而提前退出。主体主要是白人(97%),西班牙裔(94%),且近似等同地代表男性和女性(分别为53%和47%)。对于整体ae,没有严重不良事件(sae)、严重不良事件(ae)或剂量-反应关系。大多数ae是轻微的,并且所有ae在研究结束时完全消退。在任何剂量下都没有由于临床显著的血液学或临床化学实验室异常导致的药物相关的ae。此外,没有与心电图(ecg)、生命体征或体检发现相关的安全问题。还进行通过iv注射施用于健康成人主体的cd101的第二项研究。在该研究中,将3个群组(各自8个主体(6个活性剂,2个安慰剂))中的主体随机化以接受多个iv剂量的经60(±5)分钟输注的cd101或安慰剂(生理盐水)。评价的cd101的剂量水平遵循递增的多剂量方案(100mg×2剂量,200mg×2剂量或400mg×3剂量)。将总共24个主体随机化,且所有主体都完成该研究。主体主要是白人(88%),西班牙裔或拉丁裔(88%),且具有27.208kg/m2的平均体重指数(bmi)和42.8岁的平均年龄。等同地代表男性和女性(各50%)。没有sae或严重的ae。大多数ae是轻微的,并且所有相关的ae在研究结束时完全消退。cd101组中的四个主体经历轻微的短暂输注反应,其特征在于脸红、感到温暖、恶心和胸闷。这些输注反应主要与400mg剂量群组相关,并且在第三剂量中最常见。这些反应在输注开始的数分钟内发生,并在数分钟内消失,且不中断或停止研究药物输注。在任何剂量下都没有由于临床显著的血液学或临床化学实验室异常导致的药物相关的ae。此外,没有与ecg、生命体征或体检发现相关的安全问题。实施例2:cd101的临床药理学如下所述,对于最多达400mg的剂量,cd101的药代动力学已在健康主体中充分表征3周。单次递增剂量药代动力学首先对于在施用单剂量研究药物后的各个时间点获得自每个群组中接受cd101的主体的cd101的浓度,通过分析血浆和尿液样品来确定药代动力学。cd101的血浆pk通常在50、100、200和400mgcd101剂量后充分表征。随着cd101剂量增加,对cd101的暴露增加(表3)。如所预期,在所有剂量的输注开始后近似1小时,在输注结束时观察达到cmax的时间(即,tmax)。cd101的消除似乎是多相的。auc和cmax以剂量成比例的方式增加,并且总体清除率在整个剂量水平下是相似的,其中在收集血浆的整个第一周,t1/2值>80小时(当并入来自后来收集时间的数据时,计算出127-146小时的较长终点t1/2)。跨越cd101剂量的总体清除率为近似4ml/min,表明跨越所研究的剂量的cd101的线性动力学。分布容积(vz和vss)范围为33至48l。在所有剂量水平下的尿液中排泄的剂量分数为<1%,表明cd101排泄中肾清除率的较小贡献。表3.施用50、100、200和400mg1-小时静脉内输注cd101后血浆cd101暴露的概述auc0-168=从时间0至168小时的曲线下面积;c144=输注开始后144小时的血浆浓度;cmax=最大血浆浓度;t1/2=半衰期。多次递增剂量药代动力学对于在施用cd101后的各个时间点获得自每个群组中接受cd101的主体的cd101的浓度,通过分析血浆和尿液样品来确定药代动力学。cd101的血浆pk也在2或3个每周剂量的cd101后充分表征:100mg(第1天/第8天),200mg(第1天/第8天)和400mg(第1天/第8天/第15天)。第一剂量后的暴露与sad研究中观察到的暴露非常相当,其中auc和cmax通常以剂量成比例方式增加(表4)。累积很小,范围为如通过最后/第一剂量的cmax比率所测量的14%至34%(或1.14至1.34)和如通过最后/第一剂量的auc0-168比率所测量的30%至55%(或1.30至1.55)。表4.施用100mg(第1天/第8天)、200mg(第1天/第8天)和400mg(第1天/第15天)每周1-小时静脉内输注cd101后血浆cd101暴露的概述auc0-168=从时间0至168小时的曲线下面积;cmax=最大血浆浓度。使用来自上述研究的数据来开发群体pk模型以描述iv施用单次和多次每周一次剂量后cd101浓度的时间进程。简而言之,经由iv输注和一阶线性消除使用具有0-阶药物输入的4室模型最好地描述数据。为了解释结构pk参数和主体体重之间的关系,使用标准异计系数(清除项的幂为0.75,且体积项的幂为1.0)将模型中的所有参数按比例缩放至主体体重。该模型以非常小的偏差和优异的精度拟合观察到的数据。进行蒙特卡罗模拟以使用各种探索性给药方案评价pk-药效动力学(pd)目标实现的概率。选择两种给药方案用于进一步研究(表5)。对于2000个假设患者,模拟每次剂量后时间0至168小时的cd101浓度-时间曲线下的每周无药物面积(fauc0-168);使用患者人口统计学特征的数据库模拟患者体重,且假设血浆蛋白结合为99.1%。小鼠中的白色念珠菌感染的非临床研究已经显示,10的cd101fauc0-168:mic比率已经与感染肾脏中的真菌负荷的2-log降低相关。因此,将该值10选择为蒙特卡罗模拟的兴趣pk-pd目标。预计两种方案(400mg/400mg/400mg和400mg/200mg/200mg)提供最高达0.5mg/l的mic的足够的pk-pd目标实现(基于来自sentry2014的监测数据,对于白色念珠菌和光滑念珠菌,3个稀释步骤高于0.06的mic90)。此外,由于重复剂量的累积,预期400mgiv每周一次方案在治疗的第2周和第3周在1mg/l的mic实现较高的pk-pd目标实现,且因此预期提供超过针对病原体的第一周疗法的额外益处,其中mic≥1mg/ml。2种所选方案的pk-pd目标实现显示于表5和图1中。表5.cd101方案的预测药代动力学-药效动力学目标实现,通过周和最小抑制浓度分层mic=最小抑制浓度。a.通过每周剂量定义的方案(例如,400/200/200代表第一剂量为400mg,随后两次剂量为200mgiv,每周一次)。b.阴影细胞表明pk-pd目标实现高于90%。实施例3:具有念珠菌血症和/或侵袭性念珠菌病的主体的治疗具有念珠菌血症和/或侵袭性念珠菌病的主体接受cd101注射(第1天和第8天各400mg,且第15天任选剂量400mg;或第1天、第8天和第15天各400mg,且第22天任选剂量400mg;或第1天、第8天、第15天和第22天各400mg,且第29天任选剂量400mg;或第1天、第8天、第15天、第22天和第29天各400mg,且第36天任选剂量400mg;或第1天400mg且第8天200mg,且第15天任选剂量200mg;第1天400mg且第8天和第15天各200mg,且第22天任选剂量200mg;第1天400mg且第8天、第15天和第22天各200mg,且第29天任选剂量200mg;第1天400mg且第8天、第15天、第22天和第29天各200mg,且第36天任选剂量200mg)。念珠菌血症和/或侵袭性念珠菌病的真菌学诊断通过在施用第一剂量之前从收集时间起96小时内念珠菌属阳性的≥1血液培养物来建立。cd101作为无菌溶液或作为冻干制剂提供。将数个小瓶的cd101注射液用生理盐水在输液袋中稀释。在第1天、第8天和任选第15天通过iv输注经60(±5)分钟施用cd101。在一些实施方案中,cd101注射液作为无菌水性产品或用于在输注前稀释(例如,在氯化钠0.9%中)的冻干产品提供。在一些实施方案中,将一个或多个小瓶的水性cd101在输液袋中稀释。cd101经30至180分钟(例如,经30±5分钟、60±5分钟、90±5分钟、120±5分钟、150±5分钟、180±5分钟、30±10分钟、60±10分钟、90±10分钟、120±10分钟、150±10分钟或180±10分钟)的时间段施用。实施例4:在唑类抗性白色念珠菌r357感染后的感染的评价从冷冻工作储备物中获得唑类抗性白色念珠菌r357并在室温下解冻。将储备物的0.1ml等分试样转移至sabouraud琼脂(sa)板并在35-37℃下孵育过夜。将培养物重悬浮于1ml冷pbs(>2.0x109cfu/ml,od6203.0-3.2)中并用pbs稀释至5x106、5x105、5x104和5x103cfu/ml的靶标接种物量。通过将稀释液铺板至sa板、随后孵育20-24小时来确定实际菌落计数。使用重量为22±2g的雄性icr(instituteofcancerresearch)小鼠(每组n=3)的组。通过在白色念珠菌感染前4天(第-4天)150mg/kg和1天(第-1天)100mg/kg的环磷酰胺的两次腹膜内注射诱导免疫抑制。在第0天,用r357悬浮液静脉内接种动物(0.2ml/小鼠)。在接种后2小时和72小时通过co2窒息使动物安乐死。实验设计的概述显示于表6中。表6.实验设计收获成对的肾并称重。将收获的肾在1ml无菌pbs(ph7.4)中匀浆,并制备10倍稀释液,并分别铺板在sa板上再孵育20-24小时,且然后计算肾中的真菌计数(cfu/g)。来自不同接种物密度的唑类抗性白色念珠菌菌株r357的肾真菌负荷显示于图2中。实施例5:两性霉素b、氟康唑和cd101在白色念珠菌r357的播散性感染模型中的效力材料测试物品将cd101溶解于含有0.9%nacl中的10%dmso和1%tween20的媒介物中(参见下面的配制表)。两性霉素b和氟康唑呈粉末形式。将两性霉素b溶解于0.9%nacl中。将氟康唑溶解于水(wfi:注射用水)中。测试物品的概述显示于表7中。表7.测试物品a:这基于目视观察(s:可溶的;ss:微溶的;i:不溶的(悬浮或沉淀)。b:将测试物品保持在棕色的管或小瓶中,或用铝箔覆盖。c:4℃:新鲜制备并储存在冰箱中或保存在冰上;et:新鲜制备并储存在20-25℃之间。生物体.将白色念珠菌菌株r357冷冻保存为在-70℃下储存的一次性冷冻工作储备培养物。动物.使称重为22±2g的雄性icr小鼠在使用前适应3天,并证实健康良好。3或5只动物的空间分配为27x20x14cm。将所有动物都维持在具有受控温度(20-24℃)、湿度(30%-70%)和12小时光/暗循环的卫生环境中。使其自由获得无菌标准实验室饮食和高压灭菌自来水。通常根据“guideforthecareanduseoflaboratoryanimals:第八版”(nationalacademypress,washington,d.c.,2011)进行这项工作的所有方面,包括圈养、实验和动物处置。化学品.两性霉素b粉末(cat#a-9528,sigma,usa),bacto琼脂(cat#214040,bddifco,usa),环磷酰胺(cat#c-0768,sigma,usa),二甲基亚砜(cat#1.02931.1000,merck,germany),氟康唑粉末(cat#f8929,sigma-aldrich,usa),fluidsabouraud培养基(cat#264210,bddifco,usa),磷酸盐缓冲盐水(pbs)(cat#p4417,sigma,usa),氯化钠(cat#s7653,sigma-aldrich,usa),tween20(cat#p-7949,sigma,usa)和注射用水(wfi)(tai-yu,taiwan)。设备.生物安全柜(nuaire,usa),吸收式微孔板阅读器(tecan,infinitef50,usa),离心机(model5922,kubota,japan),单独通风笼(ivc,36miniisolatorsystems)(tecniplast,italy),层流(tsao-hsin,taiwan),定轨摇动培养箱(firstekscientific,taiwan),pipetman(rainin,usa),polytron均质器(kinematica,switzerland)和超低温冰箱(nuaire,usa)。方法从冷冻工作储备物中获得唑类抗性白色念珠菌(r357)菌株并在室温下解冻。将0.1ml等分试样储备物转移至sabouraud琼脂(sa)板并在35-37℃下孵育过夜。将培养物重悬浮于1ml冷pbs(>2.0x109cfu/ml,od6203.0-3.2)中并用pbs稀释至5x105cfu/ml。通过将稀释液铺板至sa板、随后孵育20-24小时来确定实际菌落计数。实际接种物计数为7.05x105cfu/ml。使用称重为22±2g的雄性icr小鼠组(每组n=5)。通过在白色念珠菌感染前4天(第-4天)150mg/kg和1天(第-1天)100mg/kg的环磷酰胺的两次腹膜内注射诱导免疫抑制。在第0天,将动物以1.41x105cfu/0.2ml/小鼠白色念珠菌(r357)静脉内接种(0.2ml/小鼠)5个接种物量。通过腹膜内(ip)注射以3、10和30mg/kg施用cd101。通过静脉内(iv)注射以1和3mg/kg施用两性霉素b(am-b)。通过口服管饲法(po)以20mg/kg施用氟康唑(flu)。接种后2小时施用所有测试物品一次。所有组的给药体积都是10ml/kg。实验设计的概述显示于表8中。表8.实验设计在接种后48小时和72小时通过co2窒息使动物安乐死。收获成对的肾脏并称重。将收获的肾在1ml无菌pbs(ph7.4)中匀浆,并制备10倍稀释液并分别铺板至sa板上。计算肾中的真菌计数(cfu/g),并通过以下公式计算减少百分比:减少(%)=[(媒介物的cfu/g–处理的cfu/g)/(媒介物的cfu/g)]x100%实验方案的概要显示于图3中。图4a和4b分别显示感染后48或74小时测量的测试物品处理组的绝对真菌计数和真菌计数的差异。处理动物的真菌计数与感染后48或72小时测量的媒介物组中的那些相比减少99%或更多(≥99%,2-log)表明显著的抗微生物活性。单因素anova和随后的dunnett氏检验也应用于评价统计学显著性。用在感染后48和72小时以3、10和30mg/kgip的cd101处理组观察到显著的抗微生物作用(p<0.05)。在48和72小时时间点,用所有cd101处理组都观察到真菌计数减少2个对数。在感染后48和72小时,1和3mg/kgiv的两性霉素b处理后观察到显著效果。以3mg/kgiv的两性霉素b处理导致在72小时时间点计数减少两个对数。与媒介物对照组相比,在感染后48和72小时,以20mg/kgpo施用氟康唑引起菌落计数的中度减少(51%和84%),所述媒介物对照组用单因素anova和随后的dunnett氏检验分析(p>0.05)不显著。实施例6:cd101效力的药理学基础方法药代动力学研究。通过腹膜内(ip)注射给予健康雌性icr小鼠单剂量的cd101。研究以下剂量,每剂量3只小鼠:1、4和16mg/kg。在给药后0、1、3、6、12、24、48、72、96小时使用经验证的lc/ms测定法测定cd101血浆浓度,且定量下限为0.02μg/ml。剂量分级研究。在以100mg/kgip感染前通过给小鼠注射环磷酰胺治疗4天(-第4天)(150mg/kgip)和一天(-第1天),使称重为22±2g的雄性或雌性icr小鼠(每个方案和观察时间5只)中性粒细胞减少以进行研究。在感染后第+1天,+3天,+5天和+7天,每48小时用环磷酰胺剂量(100mg/kgip)使中性粒细胞减少症在研究的持续时间内维持。每只动物静脉内接种1×103cfu的白色念珠菌(c.albicans)(菌株r303,mic=0.125mg/l)。通过ip注射在感染后24小时施用cd101(或媒介物)。研究的剂量在表9中显示。表9.评估的cd101给药方案的概述在治疗开始后168小时(7天)处死小鼠。在施用媒介物后0、24和48小时处死对照组小鼠。无菌收获成对的肾脏,均质化并铺板用于菌落计数以确定真菌负荷(cfu/g)。药代动力学-药效学分析。使用从pk研究收集的数据,在s-adapt中开发pk模型。使用开发的pk模型,计算在剂量分级研究中施用的每种给药方案的浓度-时间曲线和auc0-168h值。使用99.1%的鼠蛋白结合值产生游离药物血浆浓度。探索log10cfu从治疗开始的变化与auc0-168h之间的关系。结果cd101在所研究的剂量范围(1至16mg/kgip)内表现出线性pk。4-隔室模型最好地描述pk数据。模型拟合显示在图5中。剂量分级研究的结果显示在图6中,其显示真菌在未治疗对照组中生长良好。无论cd1010.7和7mg/kg给药组内的分级方案如何,真菌密度(log10cfu)的净变化幅度都是类似的。然而,cd1012mg/kg组内的结果因分级方案而异。通过cd1012mg/kg组的分级方案,在168小时log10cfu从基线降低的变化显示在图7中。当每天递送2mg/kg的总剂量(0.29mg/kg/天)时,真菌密度(log10cfu)的净变化幅度与未治疗对照组类似。然而,当以单剂量递送2mg/kg时,在168小时从基线降低大于2-log10cfu。如图6中所示,2mg/kgx1和0.29mg/kg每日x7方案在168小时具有类似的累积cd101暴露。尽管具有影响效力的类似暴露,但这些方案显示出非常不同的效果。三种分级cd1012mg/kg给药方案的游离药物血浆浓度-时间曲线显示在图8中。所有三种方案显示出非常不同的暴露曲线。特别地,单剂量方案导致在治疗早期更大的cd101暴露。在施用cd1012mg/kg作为单剂量、每周两次和每日方案后,游离药物血浆auc0-24分别为0.0654、0.0303和0.00948mg·h/l。此外,单剂量的施用导致游离药物血浆浓度分别保持高于每周两次和每日方案的84和48小时的游离药物血浆浓度。具有类似总暴露但具有非常不同的暴露形状的三种cd101方案显示出显著不同的效力。这表明cd101auc的形状是效力的决定因素,前装载方案(frontloadedregimen)显示出更高的效力。无论cd1010.7和7mg/kg给药组的分级方案如何,真菌负荷的净变化幅度类似,但在2mg/kg组内不同。当每周给予一次时,与分为每周两次或每日方案的相同剂量比较,2mg/kg剂量显著更有效。实施例7:cd101在曲霉菌病和唑类抗性播散性念珠菌病的小鼠模型中的效力。方法使用唑类抗性念珠菌病和曲霉菌病的中性粒细胞减少小鼠模型中评估cd101的体内效力。从人血液中分离的白色念珠菌的唑类抗性菌株(r357;对氟康唑[flu]、伏立康唑和泊沙康唑具有抗性,但对两性霉素b[amb]和棘白菌素敏感)用于小鼠念珠菌病模型。将烟曲霉(aspergillusfumigatus)(atcc13073)的测试菌株用于小鼠曲霉菌病模型。通过环磷酰胺使小鼠中性粒细胞减少,且然后通过将白色念珠菌(105cfu/小鼠)或烟曲霉(104cfu/小鼠)注射入尾静脉来感染。在感染后2小时开始施用测试物品。在小鼠念珠菌病模型中,每组5只小鼠的组接受一个剂量的amb(3mg/kgiv)、flu(口服20mg/kg)或cd101(通过腹膜内施用[ip]3、10或30mg/kg)。在感染后72小时,使小鼠安乐死并测量肾组织中的白色念珠菌计数(cfu/g)。在小鼠曲霉菌病模型中,每组10只小鼠的组接受一个剂量的amb(2mg/kgip)或cd101(2mg/kgiv和ip)。每天监测存活10天。分别在念珠菌病和曲霉病模型中通过单因素anova、随后dunnett氏检验和fisher'sexact检验,评价媒介物和测试物品组之间的差异的显著性。结果与单一ip剂量后给药后贯穿至少72小时的媒介物相比,一个剂量的cd1013mg/kg产生白色念珠菌cfu的>99.9%(或>3-log;p<0.001)减少。amb显示相似但不太强的效力(cfu减少>99%或>2-log;p<0.05),而氟康唑不太有效(cfu减少83.9%或<2-log)。在曲霉菌病模型中,施用2mg/kgiv或ip的cd101显示与amb2mg/kgip相似的效力,两者均具有比媒介物显著更长的存活期(p<0.05;图9)。结论在唑类抗性念珠菌病的中性粒细胞减少小鼠模型中,单个剂量的cd1013mg/kg与媒介物相比产生白色念珠菌负荷的显著减少(p<0.001),表明效力如果不是更好的话,也与相同剂量的amb的效力相当。一个剂量的cd101也在曲霉菌病的小鼠模型中显示效力。这些数据支持持续开发cd101用于治疗由念珠菌属(包括唑类抗性菌株)和曲霉菌属引起的严重感染。实施例8:cd101针对念珠菌临床分离株的效力材料和方法生物体和抗真菌剂评估从日本、韩国、印度和centerformedicalmycology(n=14)获得的耳念珠菌临床分离株。使用以下由clinicalandlaboratorystandardsinstitute(clsi,文件m38-a2)批准用于酵母和霉菌的念珠菌qc菌株:近平滑念珠菌atcc22019,克鲁斯念珠菌atcc6258。测试化合物在用于mic测定前新鲜制备且包括:cd101、5-氟胞嘧啶(5fc)、两性霉素b(amb)、阿尼芬净(anid)、卡泊芬净(cas)、氟康唑(flu)、伊曲康唑(itra)、米卡芬净(mica)、泊沙康唑(posa)和伏立康唑(vori)。最小抑制浓度(mic)测定根据clsim38-a2方法进行的液体培养基微量稀释mic测定用于评估真菌菌株对所选抗真菌剂的敏感性。简而言之,将耳念珠菌菌株接铺板在sabouraud葡萄糖琼脂(sda)上,并在37℃下孵育2天。然后通过离心和生理盐水(0.85%nacl)洗涤来收获耳念珠菌细胞。使用血细胞计数器制备mic测定接种物。以50和/或100%抑制在孵育24和/或48小时后读取mic测定(图10)。为了检查接种物计数,将耳念珠菌工作分生孢子悬浮液的10倍稀释液铺板至sda培养基上。在测定菌落计数前,将接种物板在37℃下孵育2天。实施例9:cd101、卡泊芬净(cas)、米卡芬净(mica)和氟康唑(flu)针对耳念珠菌临床分离株的效力和fks1hs1序列分析本研究是确定临床耳念珠菌分离株对cd101、卡泊芬净(cas)、米卡芬净(mica)和氟康唑(flu)的体外敏感性,和分析fks1内热点1(hs1)的序列。材料和方法耳念珠菌分离株。在本研究中使用获得自universityofdelhi(delhi,india)的vpchestinstitute的三十八种耳念珠菌菌株(表10)。在测试前,使菌株在酵母提取物蛋白胨葡萄糖(ypd)琼脂板上生长。表10耳念珠菌抗真菌敏感性测试(afst)。根据clsi文件m27-a3(clsi,2008)中描述的指南,对每种菌株一式两份进行抗真菌敏感性测试。近平滑念珠菌atcc22019和克鲁斯念珠菌atcc6258用作质量控制菌株。cd101、cas、mica和flu作为标准粉末获得自其制造商,并通过将化合物溶解于水(cas,mica)或100%二甲基亚砜(dmso)(cd101,flu)中来制备储备溶液。fks1hs1pcr/测序.在t100热循环仪(bio-rad)中在30-μl反应体积中使用emeraldampmaxpcrmastermix(takara)实施fks1hs1pcr。pcr混合物含有1μl各引物:10µm的cspp_f2275(5’-aatgggctggtgctcaacat-3’)和cspp_r3070(5’-ccttcaatttcagatggaacttgatg-3’)。将轻触过测试单菌落的无菌牙签浸入pcr反应混合物中,且然后进行fks1hs1pcr。时间-温度概况包括在94℃下初始变性3分钟,随后35个循环的在94℃下30秒,在53℃下30秒和在72℃下90秒。扩增子在gelstarnucleicacidgelstain(lonza)染色的1%琼脂糖凝胶上显现,通过使用zrdna测序清洁试剂盒(zymoresearch)纯化,并通过genewiz测序。通过seqmanpro14(dnastarlasergene)分析测序结果。结果耳念珠菌抗真菌敏感性测试(afst)。cd11、cas、mica和flu的耳念珠菌分离株的mic(µg/ml)分布显示于表11中。所有耳念珠菌分离株(38种)都对氟康唑具有抗性。四(4)种分离株对所有测试的棘白菌素(cd101、cas,mica)都具有抗性。cd101表现出与mica相似的活性。fks1hs1pcr/测序.耳念珠菌分离株fks1hs1序列分析的结果显示于表11中。三十四(34)种棘白菌素敏感的分离株在fks1hs1区域内呈现野生型(wt)基因型。确定为棘白菌素抗性的四(4)种分离株(表11中的菌株#:16、25、27和30)在白色念珠菌中在等效于fks1hs1s645的位置表现出丝氨酸至苯丙氨酸的氨基酸取代。表11.耳念珠菌菌株的体外抗真菌敏感性概况和fks1hs1特征(*cas逆反效应(paradoxicaleffect)->16mg/l;**cas逆反效应丢失,无法读取mic,真菌生长减少<50%)结论高氟康唑抗性在耳念珠菌的临床分离株中是常见的。大多数耳念珠菌株对棘白菌素敏感。然而,大多数菌株在48小时时对卡泊芬净突破(breakthrough),但用cd101或其他棘白菌素则不是如此。这些耳念珠菌分离株中的棘白菌素抗性与fks1hs1区域内的氨基酸取代(丝氨酸至苯丙氨酸,等效于白色念珠菌s645的位置)相关。实施例10:cd101针对白色念珠菌和光滑念珠菌的体内药代动力学/药效动力学(pk/pd)评估方法使用4种白色念珠菌和3种光滑念珠菌菌株。mic通过clsi标准测定。在1、4、16和64mg/kg的ip剂量后,在三只小鼠的组中测定单剂量血浆pk。对于治疗研究,经由在第-4天、第-1天、第+2天和第+4天施用环磷酰胺使小鼠中性粒细胞减少。将小鼠用注射至侧尾静脉中的6.3±0.1cfu/ml(白色念珠菌)或6.2±0.2cfu/ml(光滑念珠菌)感染。治疗剂量范围为0.016–64mg/kg,在感染后2小时通过ip注射给予一次。实验持续时间为7天,此时无菌收获肾脏,用于cfu计数。emaxhill方程用于将剂量-反应数据建模为pk/pd指数auc/mic。测定每种分离株的静态和1-log杀伤剂量,以及相关的auc/mic值。结果白色念珠菌的cd101mic为0.008-0.06mg/l,且光滑念珠菌的cd101mic为0.06–0.5mg/l。单剂量血浆pk参数范围包括:cmax2.6-77mg/l,auc0-∞93-4046mg*h/l,t1/228-41h。观察到剂量依赖性的杀菌活性(cidalactivity),其中最大杀伤为超过2log10cfu/肾。使用经7天的平均24hauc来建模auc/mic数据并且很好地拟合治疗反应数据,其中白色念珠菌的r2为0.70,且光滑念珠菌的r2为0.86。静态剂量(sd)和1-log杀伤剂量以及相关的auc/mic值显示于表12中。表12结论cd101在中性粒细胞减少的鼠播散性念珠菌病模型中表明针对所选白色念珠菌和光滑念珠菌菌株的体内功效。与用其他棘白菌素的研究相似,auc/mic很好地拟合暴露-反应数据,而光滑念珠菌靶标在数值上低于白色念珠菌。在人药代动力学和mic分布的背景下,本研究中鉴定的pk/pd靶标可用于cd101的临床给药方案优化。其他实施方案本说明书中提及的所有出版物、专利和专利申请都通过引用并入本文,如同各个独立的出版物或专利申请具体地和单独地指明通过引用并入的程度一样。尽管已经结合其具体实施方案描述了本公开内容,应该理解,能够进行进一步修改,并且一般地遵循本公开的原理且包括此类在本公开所属领域已知的或常规的实践范围内的本公开的偏离,本申请意欲覆盖本公开的任何变化、用途或改变,并可适用于上文阐述的必要特征,并在权利要求书的范围内遵循。其他实施方案在权利要求内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1