用于流式细胞仪的紧凑检测模块的制作方法
本专利申请要求保护发明人mingyan等人于2016年7月25日提交的标题为compactdetectionmoduleforflowcytometers的美国临时专利申请no.62/366,580的权益,该申请出于所有意图和目的通过引用并入于此。
该专利申请还涉及davidvrane等人于2017年4月26日提交的标题为compactmulti-colorflowcytometer的申请no.15/498,397,其描述了可以使用紧凑检测模块的流式细胞仪,并且出于所有意图和目的通过引用并入于此。
本发明的实施方式总体上涉及流式细胞仪的检测模块。
背景技术:
流式细胞仪通常具有由一个或更多个激光器照明的观察孔。来自所述一个或更多个激光器的激光轰击穿过该孔的各种荧光标记微粒。荧光标记微粒通常是用不同的荧色物(flourochrome)(荧光染料(fluorescentdye))标记的样本中的各种生物细胞,可以对所述细胞进行分析以获得关于该样本的可以推广到整体的信息。流式细胞仪中的一个或更多个光学检测器被用于感测从穿过该孔的、被来自一个或更多个激光器的激光轰击的荧光标记微粒发射的荧光(fluorescence)(荧光(fluorescentlight))。
在来自荧光标记微粒发射的荧光到达每个检测器之前,可以设置一个或更多个不同的滤光器。滤光器被设置在发射荧光路径中,使得每个检测器仅看到与荧色物的预期荧光相关联的特定带宽的光。即,任何给定滤光器的带宽利用特定荧光染料的发射光谱中的峰值。这样,针对任何给定微粒,来自检测器的集总信号(collectivesignal)指示附着于微粒的一个或多个荧色物的类型。检测器从发射的荧光中检测到的信号允许对样本中的各种微粒进行快速且全面的细胞分类。
然而,发射光谱可以在染料之间交叠。这限制了可通过单个激光器和检测器在给定微粒上同时检测的不同荧色物的数量。因为发射带宽通常在30纳米(nm)至60nm之间的波长范围内,所以常规流式细胞仪通常可以检测每个激光线不超过四个或五个荧色物。增加激光器的数量提供了一种有利但昂贵的方法来增加可同时检测的荧色物的数量。
对所发射的荧光进行进一步复杂化检测的事实是,为给微粒着色而使用的许多染料在不同于和大于典型的30nm至60nm带宽范围的激光波长范围内被激发。这可能导致针对不同激光的检测器之间的信号串扰。
现有流式细胞术荧光检测系统通过增加准直透镜焦距来限制发散。然而,根据所需最终图像的尺寸,这导致更大直径的光束,其限制了检测器的数量,如六个检测器。在这些现有流式细胞术系统中,最终图像尺寸在将大尺寸光学成像(如800微米(micro-meter或micron)(μm))和宽带光(例如,波长为400nm-800nm)准直到直径小于3毫米(mm)的一组检测器中时受到光学像差的约束。
在另一流式细胞术系统中,针对处于一排的一组检测器的检测器链中的每个检测器,利用球形微镜对入射光进行重新成像。重新成像避免了上述流式细胞术系统的发散准直光问题。然而,检测器的数量受到由来自球形微镜的反射所带来的像差的限制。由于图像尺寸沿检测器链增加,因此为了增加检测器链中沿着该行的检测器通道数量,需要大面积检测器,从而导致体积庞大且昂贵的大型流式细胞仪。
光谱交叠发射光谱的分辨率对于增加可检测荧色物的数量也是重要的。可以使用检测器阵列,以基于跨多个波长的集总发射特征图(signature)来识别荧色物,从而增加可检测荧色物的数量。本质上,通过衍射光栅或者棱镜将整个荧光信号色度分散到检测器阵列中。以这种方式,整个发射光谱跨多个检测器离散化。可以使用光谱解卷积(离析(unmixing))来计算已知单个荧色物光谱对总的集总信号的贡献。然而,这种用于增加可检测荧色物数量的方法有两个主要限制。
色散部件/检测器阵列的连续线性特性不允许调节带宽以利用荧色物光谱的真实性质。因此,较宽带宽的识别有利于较长波长的荧色物,而忽视了具有压缩光谱的较短波长荧色物的细节。此外,来自其它激光的散射光(若存在的话)不可避免地被检测器阵列收集。这种散射光损害了检测器要检测的荧光信号。
因此,需要在流式细胞仪中进一步改进以增加可检测荧色物的数量并更好地分析样本中的荧色物标记微粒。
技术实现要素:
本发明的实施方式通过下面跟随的权利要求书来概括。
附图说明
本专利或申请文件包含按颜色实施的至少一个附图。具有彩图的该专利或专利申请公报的副本在请求并支付必需费用时由美国专利商标局提供。
图1是流式细胞仪系统的检测模块的框图。
图2a是具有连续通道重新成像的图像阵列的示意图。
图2b是具有交替信道重新成像的1f图像阵列的示意图。
图3是紧凑检测模块的示意图,该模块包括用于模块化流式细胞仪系统的16通道1f图像阵列。
图4a是在光纤直径上的不同点处离开的荧光的放大图。
图4b是用于将光信号转换成电信号的检测器的放大图。
图5是1f图像阵列的一部分的放大图。
图6是具有16通道1f图像阵列和16个检测器通道的模块化流式细胞仪系统中的检测模块的图。
图7a-7c是模块化流式细胞仪系统中的检测模块的不同图解视图,该系统具有一对8通道1f图像阵列和一对8检测器通道。
图8是具有球形微镜的1f图像阵列的立体图。
图9a-9b是图8的1f图像阵列的横截面图。
图10是具有凹矩形微镜的1f图像阵列的立体图。
图11是图10的1f图像阵列的一部分的顶侧视图。
图12是邻近成像块的安装块以及用于图6和图7a-7c的检测器模块的低成本薄外形检测器的立体图。
图13是模块化流式细胞术系统中的光学板组装件的俯视图。
具体实施方式
在本实施方式的下列详细描述中,阐述了许多具体细节,以便提供详尽的理解。然而,本领域技术人员显见的是,本实施方式可以在不需要这些具体细节的情况下来实践。在其它情况下,公知方法、过程、组件以及电路未被详细描述,以不使不必要地模糊本发明实施方式的各个方面。
本发明的实施方式包括用于具有紧凑的高度复用检测模块的流式细胞仪的方法、装置以及系统。
公开了一种具有针对荧光的紧凑检测模块的流式细胞仪,与现有流式细胞仪相比,其检测器数量增加,图像尺寸最小。每个检测器模块由至少一个激光器馈送。多个激光器可以由紧凑方式的多个检测器阵列支持。当光通过检测链传输时,通过仔细控制检测器阵列中的增量像差,可以增加检测器的数量。紧凑检测模块的紧凑尺寸通过微镜与滤光器之间的减小的距离以及仔细向下缩放来实现,从而沿着成像阵列中微镜和滤光器的行或链最小化图像劣化。
通过使用具有多个单独检测器和滤光器带宽的可调节进展的光学系统,可以克服现有限制。该光学系统使光谱配置点的集中度能够最佳地分辨用于标记由流式细胞仪分析的微粒的长波长染料和短波长染料两者的光谱。来自被激发微粒的荧光通过具有高数值孔径(na)的物镜成像到多模光纤中。离开多模光纤的宽带荧光被准直,然后耦合到(成像到)多个检测器中。离开多模光纤的宽带荧光的准直是一个挑战。
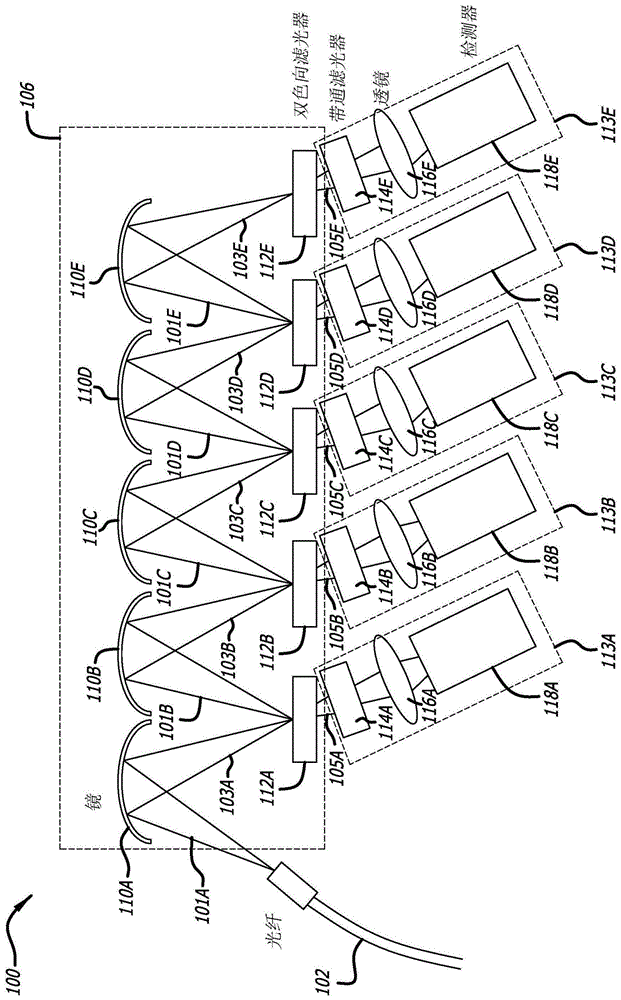
下面,参照图1,示出了流式细胞仪的检测模块100的功能框图。高级流式细胞仪可以包括多个检测模块。检测模块100是波长分解(de-multiplexing)系统。检测模块100在图像阵列106中连续地反射和重新成像来自光纤102的荧光输出101a。图像阵列106是机械图像阵列,其包括多个反射镜112a-112e以及通过机械安装悬浮在空中的对应多个长通双色向滤光器(dichroicfilter)110a-110e。通常,双色向滤光器是准确的滤色器,其被用于选择性地使一波长范围的彩色光中的光通过,同时反射其它波长的彩色光。另选地,所述多个长通双色向滤光器110a-110e可以是带通滤光器。
图像阵列106能够反射地重新成像光纤光点(spot)n次(其中,n大于2),同时保持该光纤光点在图像阵列末端的光学质量。重新成像是在诸如双色向滤光器110a-110e中的每一个的表面处重新创建具有一些像差的原始图像(重新成像(reimage))的功能。检测模块100还包括多个检测器通道113a-113e,所述通道分别包括多个物镜116a-116e以及皆与光连通的多个检测器118a-118e。可选地,所述多个检测器通道113a-113e还可以分别包括多个带通滤光器114a-114e,以确保所述多个检测器检测到各个希望波长范围。
在图像阵列106中,入射到第一镜110a上的光101a被该镜反射成反射光103a。来自第一镜110a的反射光103a穿过空气并入射到第一长通双色向滤光器112a上。来自第一镜110a的光103a被长通双色向滤光器112a分成连续光部分101b和穿过或透射光部分105a。连续光部分101b穿过空气并入射到该系列中的下一镜,即,镜110b。透射光部分105a耦合到第一检测器通道113a的第一带通滤光器114a中。透射光部分105a由带通滤光器114a清理,然后由物镜116a耦合到光学检测器118a中。对于图像阵列106中的每个级(检测器通道)重复该过程。
图像阵列106包括在每个长通双色向滤光器上重新成像五次的五个级。仍然希望包括更多数量的检测器。然而,经过超过5次的重新成像后,通过反射镜的光束畸变可以累积到其中最后的双色向滤光器处的图像质量变得高度劣化的程度。为了使图像阵列106中的镜与双色向滤光器之间的曲折来回的配置与更多数量的检测器一起正确地执行,希望最小化沿光路的图像劣化。
利用两种机制可以实现最小化检测模块中的图像劣化。如果图像阵列中每个反射镜的弯曲力(bendingpower)减小(例如,减小两倍-弯曲力的一半),则可以减少图像劣化。如果光束在图像阵列中被重新成像的次数减少(例如,减少一倍两倍-一半的次数),则可以进一步减少图像劣化。
减小镜子处的弯曲角度可减少所有类型的像差。由于像差随弯曲角度非线性地增加,因此从“快聚焦镜”切换到“慢聚焦镜”所获得的改善显著优于2x,从而允许保持通过更多反射的图像质量。通过减少光束在图像阵列中重新成像的次数,可以进一步改善入射在检测器链中的最后一个检测器上的图像质量。代替在针对每个检测器通道的每个双色向滤光器上重新成像,入射光可以每隔一个双色向滤光器和检测器通道(例如,奇数检测器通道)重新成像。
现在参照图2a-图2b来描述图像阵列106a-106b,其通过利用具有曲率半径不同的微镜的透明块来提供图像质量的改善。通常,图像阵列由每个检测通道的微镜阵列和相对的带通和/或双色向滤光器阵列组成。在每一种情况下,在一侧上的微镜m(n)、m(n)'的串行链或行与在相反侧上的双色向滤光器d(n)的串行链或行之间的透明块的厚度l相同。然而,微镜m(n)和m(n)'的焦距在图2a–图2b的图像阵列106a-106b中不同。
图2b中的微镜m(n)'的焦距f是l,而图2a中的微镜m(n)的焦距f是l的一半。图像阵列106b中的微镜m(n)'的较大焦距减小了沿反射镜串行链的成像中的弯曲角度和像差。而且,图像阵列106b是1f图像阵列,其具有给定透明块的厚度l和微镜m(n)'的焦距,以使在奇数双色向滤光器(如双色向滤光器d(3)、d(5)、d(7),到d(n))上发生重新成像。
在图2a–图2b中,光点a(1)到光点a(n)分别是双色向滤光器d(1)到d(n)上的光点尺寸(面积)。光点a(0)是多模光纤的光纤孔径,荧光从该光纤孔径输入到每个阵列106a-106b中。在图2a和图2b中,光纤孔径可以被认为是无限小的,以例示这两种设计的图像共轭特性。
图2a例示了具有多个微镜m(1)至m(n)和多个长通双色向滤光器d(1)至d(n)的图像阵列106a,其中n是大于一的整数值,表示检测器通道的数量。通过微镜m(1)的反射,聚焦在双色向滤光器d(1)处的光点a(1)处的光通过微镜m(1)的反射被重新成像,以将光聚焦在双色向滤光器d(2)处的光点a(2)处。微镜m(2)到m(n)中的每一个沿着串行链或行重复这一过程。图像阵列106a是2f图像阵列。
图2b例示了针对具有多个微镜m(1)'至m(n)'和多个长通双色向滤光器d(1)至d(n)的图像阵列106b的1f设计。微镜m(1)'到m(n)'具有与微镜m(1)到m(n)的曲率半径不同的曲率半径。1f图像阵列106b在检测器(例如,图1中的检测器118a-118e)处提供超过2f图像阵列106a的图像质量改善。
1f图像阵列106b中的微镜m(1)'到m(n)'链被设计成通过望远镜光学系统的特性沿着该链中继图像。例如,通过微镜m(1)'和m(2)'的望远镜效应,聚焦在双色向滤光器d(1)处的光点a(1)处的光被成像至双色向滤光器d(3)处的光点a(3)。偶数光点(光点a(2))是准直空间中的中间点。
所述多个长通双色向滤光器d(1)至d(n)可以另选为通带或带通滤光器,或者包括组合在一起的双色向滤光器和带通滤光器两者,以确保有限波长范围的光穿过。双色向滤光器使用薄膜干涉原理,也可以被称为干涉滤光器。针对每个通道,调谐带通或通带滤光器以将不同的所选波长范围(通带)的光透过至每个检测器,并将其余的光波长反射回微镜阵列中的微镜。
为了提供紧凑检测器模块,1f图像阵列106b由实心透明材料形成,参照图8和10进一步说明。用于图像阵列的透明成像块的实心透明材料可以是透明玻璃或透明塑料,例如,在透明材料中或其上形成镜子和双色向滤光器。
可以在相同厚度的实心透明材料、相同节距以及相同入射角的条件下,比较图像阵列106b的1f设计和图像阵列106a的2f设计。图像阵列106a和图像阵列106b中的相邻微镜之间的路径距离相似。在这种情况下,路径距离是其中考虑材料折射率的物理距离,而不是常规路径长度。然而,2f图像阵列106a中的微镜的焦距比图像阵列106b中的微镜的焦距短(一半)。换句话说,由于微镜中曲率半径的不同,因此1f图像阵列106b中的微镜的实际焦距是2f成像阵列106a中的微镜的焦距的两倍。较长的焦距会降低每次反射的弯曲力,这最小化了微镜反射中带来的像差。因此,1f图像阵列106b中的像差相比2f图像阵列106a的像差得到改善。
在2f图像阵列系统106a中,光纤孔径a(0)被成像至双色向滤光器d(1)处的光点a(1)。点a(2)处的图像是通过微镜m(1)反射的点a(1)的重新成像。继续通过阵列106a中的之字形光路,每个双色向滤光器d(n)处的每个光点a(n)由下一微镜m(n)成像至下一个双色向滤光器d(n+1)处的下一个光点a(n+1)。在该配置中,光点a(n)与微镜m(n)之间的路径距离是透明块的厚度l,其是微镜m(n)的焦距的2倍(两倍)。
在1f图像阵列系统106b中,来自光纤孔径a(0)的光通过输入通道成像至双色向滤光器d(1)处的光点a(1)。在图像阵列系统106b中,可以认为从微镜m(1)'到微镜m(2)'的光路形成放大倍率为1的等效望远镜。在这种情况下,通过微镜m(1)'和m(2)'的望远镜,光点a(1)成像至光点a(3),其中光点a(2)是准直空间中的中间光点。相邻的微镜m(3)'和m(4)'形成另一个望远镜,以将光点a(3)重新成像至光点a(5)。继续成像阵列106b中的之字形路径,奇数光点a(1)、a(3)、a(5)、…、a(2n+1)全部彼此共轭,而偶数光点a(2)、a(4)、a(6)、…、a(2n)是准直空间中的中间光点。在该配置中,光点a(n)与微镜m(n)'之间的路径距离是透明块的厚度l,其是微镜m(n)'的一倍焦距。
滤光器上的每个光点由一束光线形成。光束的角度分布由输入多模光纤102的数值孔径(na)和针对成像系统的成像阵列的输入通道确定。光点a(1)处的锥角与多模光纤102的数值孔径成比例。如果从光纤孔径a(0)到光点a(1)的图像放大倍率m是1到m的比率(其中,m大于1),那么光点a(1)处的锥角比光纤孔径a(0)处的锥角小m倍。
在图2a的2f图像阵列系统106a中,对于n的任何值来说,从任意光点a(n)到相邻光点a(n+1)的图像放大倍率等于1。在无视像差的情况下,对于所有检测器通道来说,图像阵列系统106a的双色向滤光器d(1)到d(n+1)处的光锥角是相同的。
下面,参照图2b,双色向滤光器d(1)与微镜m(1)'之间的距离是l。如果在1f图像阵列106b中通道总数n是偶数,则通过微镜m(1)'-m(2)'(考虑1x望远镜),光点a(1)成像至光点a(3),并且双色向滤光器d(2)处的光点a(2)处于准直空间中。光点a(2)处的准直光的一部分被双色向滤光器d(2)朝着微镜m(2)'反射。
因此,图像阵列106b在光点a(1)、a(3)、…、a(2k-1)、…到a(n-1)处具有奇数检测器通道,而在光点a(2)、a(4)、…、a(2k)、…到a(n)处具有偶数检测器通道,其中,1<k≤(n/2)。由于光点a(1)处于微镜m(1)'的前焦点,并且相邻微镜之间的路径距离是焦距的两倍,因此所有奇数光点a(1)、a(3)、a(5)、…、a(2n+1)是光纤孔径的图像(如图2b中光线会聚至奇数光点所示),而所有偶数光点a(2)、a(4)、a(6)、…、a(2n)位于准直空间中(如图2b中偶数光点处的平行光线所示)。因此,如图5所示,奇数检测器通道的奇数光点的锥角(奇数锥角cao)与偶数检测器通道的偶数光点的锥角(偶锥角cae)不同。
在1f图像阵列106b中,每个光学双色向滤光器d(1)到d(n)的中心波长和通带宽度彼此不同。设计每个光学双色向滤光器的中心波长和通带宽度,以优化染料荧光光谱的采样,从而更好地准确离析大量不同的染料。例如,假设光波长为400nm至800nm的荧光光谱和十六(16)通道检测模块,以各自分析光波长为25nm的带宽。例如,第一检测器通道和第一个双色向滤光器d(1)可以带通和分析400nm至425nm的光波长,并且中心波长为412.5nm。基本上滤除400nm至425nm之外的波长,而不将其透过到第一检测器通道中的第一检测器上。第二检测器通道和第二个双色向滤光器d(2)可以带通和分析425nm至450nm的光波长,并且中心波长为437.5nm,并且针对每个检测器通道递增等等。最后一个或第十六检测器通道和第十六个双色向滤光器d(16)可以带通和分析775nm至800nm的光波长,并且中心波长为787.5nm。
1f图像阵列106b的特性允许初始光信号传播到比图像阵列106a更多数量的检测器中。1f图像阵列106b通过降低每个镜面反射中的弯曲力来减小轴外像差。然而,在奇数通道和偶数通道中的双色向滤光器处的奇数锥角cao与偶锥角cae不同的情况下,需要确定从光纤孔径a(0)到双色向滤光器d(1)处的光点a(1)的输入级中的最佳放大倍率m。对于给定的光纤数值孔径(na)和孔径直径来说,从光纤孔径a(0)到双色向滤光器d(1)处的光点a(1)的放大倍率m是针对1f图像阵列106b中的奇数检测器通道和偶数检测器通道进行了优化的。
从频谱分辨率的角度来看,随着入射光点的锥角增大,双色向滤光器性能劣化。在1f图像阵列106b中,奇数通道中的光点锥角与偶数通道中的光点锥角不同。基本上,奇数通道中的锥角是由多模光纤的数值孔径(na)和从光纤孔径a(0)到双色向滤光器d(1)处的光点a(1)的放大倍率系数m确定的。与此相反,偶数通道的锥角是由奇数通道中光点的光点直径确定的。
在输入通道中,假设图像放大倍率是从光纤处的孔径a(0)至双色向滤光器d(1)处的光点a(1)的m。在偶数检测器通道(双色向滤光器d(2k))处,锥角与放大倍率m成比例。然而,在奇数检测器通道(双色向滤光器d(2k-1))中,锥角与放大倍率m成反比。从光纤孔径a(0)到光点a(1)的较大放大倍率导致奇数检测器通道(双色向滤光器d(2k-1))处的锥角较小,但偶数检测器通道(双色向滤光器d(2k))处的锥角较大。在具有多模光纤的一个示例实施方式中,其中na=0.12、孔径直径600um,并且微镜(滤光器)节距5.5mm;推荐放大倍率m被建模为大约2。显见的是,可以利用不同的输入确定其它放大倍率m,因此这里所公开的实施方式不限于2x放大倍率。在针对1f图像阵列106b呈现的示例中,数值孔径(na)和重新成像的数量都减少了2倍,从而与2f图像阵列106a相比,允许沿着相同长度的行有至少四倍(4x)多的检测器。
图3、图4a–图4b及图5例示了具有1f图像阵列106b的紧凑检测模块的模拟结果的图形以及具有na=0.12、孔径直径600um、微镜(滤光器)节距5.5m的光纤;以及推荐放大倍率2x的实施方式的示例输入值。图3、图4a–图4b及图5中所示的不同颜色的光线仅为清楚起见示出了不同位置处的光如何穿过检测器模块。
图3示出了光纤102的将荧光发射到检测系统中的一个端部。靠近光纤102的相对端(未示出),可以使用具有高na的集光物镜(collectionobjectivelens)以从孔径中聚集荧光并将其耦合到光纤的该相对端中。然后,光纤102采集来自物镜的光并将其引导至图3所示的端部。靠近图3所示的端部,该系统可以包括光纤数值孔径转换器,以将数值孔径降低到自由空间,以将荧光发射至检测器阵列。
下面,参照图3,紧凑检测模块300中的放大倍率m由输入级301实现。输入级301包括:准直透镜302、阻挡滤光器303以及聚焦透镜304。通过调节准直透镜302和聚焦透镜304的焦距比来实现放大倍率m。例如,为将放大倍率设定成等于2(m=2),聚焦透镜304的焦距是准直透镜302的焦距的两倍。输入通道301可以被认为还包括在到达第一个双色向滤光器d(1)之前图像阵列106b中的透明块的输入部分(例如,楔形、块厚度,参见图8)。
准直透镜302接收从光纤102发射的光并使光准直。准直光穿过阻挡滤光器303并输入到聚焦透镜304。阻挡滤光器303被用于清除在光纤102的相对端附近散射到集光光学系统中的激光。与荧色物相关联的荧光光谱的光穿过阻挡滤光器303并进入聚焦透镜304。聚焦透镜304将该荧光光谱的光聚焦到图像阵列106b中的第一个双色向滤光器d(1)上,以在光点a(1)处形成图像。光点a(1)处的图像的尺寸(例如,直径和面积)从光纤处的孔径a(0)处的尺寸放大了m倍。可以调节透镜302、304在光纤102的所述端部与图像阵列106b之间的位置。
紧凑检测模块300还包括与图像阵列106b连通的十六(16)通道1f图像阵列106b和十六(16)个检测器通道313a-313p(例如,参见图6)。在另选实施方式中,可以并行使用一对八(8)通道1f图像阵列(例如,参见图7a–图7c)以放宽每个紧凑图像阵列的成像要求。在流式细胞仪中,这些紧凑图像阵列中的超过一个(例如,三个)图像阵列可以用于将检测器通道的数量倍增成为大于十六(例如,对于四十个检测通道来说,三乘十六),如参照图13描述的检测器模块所说明的。
图像阵列106b由实心透明块材料形成。十六(16)通道1f图像阵列106b在透明块的一侧上包括十六(16)个双色向滤光器d(1)至d(16),并且在相反侧上包括十五个反射镜m(1)到m(15)。在最后一个检测器通道313p之后,该图像阵列不需要镜子。此外,最后的滤光器d(16)314可以不是双色向滤光器;相反,可以使用带通滤光器。在带通滤光器的情况下,入射光不需要进一步反射至另一镜或滤光器。
阵列或检测器中的每个检测器通道313a-313p(统称为检测器通道313)包括聚焦透镜316和检测器318(图3中示出了一个实例)。检测器318封装在薄外形(to)罐式封装320中,聚焦透镜316联接至或集成到该to罐式封装。聚焦透镜316将穿过滤光器的荧光聚焦到检测器318的小面积尺寸上。
下面,参照图4a,用于将从图像室捕获的荧光信号传输至检测器阵列的光纤102是多模光纤。光从光纤直径上的各个(如果不是全部)位置(举例来说,如位置x1至x5)离开多模光纤的端面。图3所示处于输入通道中的透镜303、304将光聚焦在孔径a(0)内,直到第一个双色向滤光器d(1)上的光点a(1)。因为从光点a(0)至光点a(1)有两倍(2x)放大倍率,所以孔径a(0)处的光点尺寸小于光点a(1)处的光点尺寸。从图4a中所示的孔径内的不同位置x1到x5发出的光线的不同颜色仅为了清楚起见,以示出不同位置处的光如何穿过检测器模块。如图4a所示,光轴402从光纤102的所述端部的圆形中心向外延伸。光以相对于光轴402的发射锥角(ca)404从光纤102的所述端部射出。
图3示出了图像阵列106b的模拟结果和如何通过镜和双色向滤光器的多次反射对来自光束中不同位置的光交替地进行成像和准直。虽然这些结果示出了所有的光反射,但在任何特定位置处的双色向滤光器d(n)是不同的,并且允许根据它们各自的通带传输光信号(仅在图3中的最后一个检测器通道313p中示出)。
下面,参照图3和图4b,在每个检测器通道313中,穿过双色向滤光器d(n)的希望波长范围的光信号可以通过透镜316会聚并被小孔径光敏检测器318检测到。在每个检测器通道中可以另选地或进一步使用另一带通滤光器314。双色向滤光片d(n)处的其它波长的光(若有的话)沿着微镜的链或行反射至下一微镜m(n)。该行或链的双色向滤光器d(n)将不同范围的光波长分解到检测器通道313a-313p的链中。
图5的放大图示出了光学束如何通过微镜和双色向滤光器的反射面交替成像和准直的模拟结果。在奇数编号的双色向滤光器(例如,图5所示的双色向滤光器d(7)、d(9)及d(11))上,光点是光纤孔径的图像。即,从光纤孔径发射的光被成像至奇数编号的双色向滤光器的每个滤光器表面。在偶数编号的双色向滤光器(例如,图5所示的双色向滤光器d(8)、d(10)及d(12))上,偶数编号的光点(图5所示的光点a(8)、a(10)及a(12))处于准直空间中,其中,从光纤孔径处的一点发射的光线变为准直光束。对于来自光纤孔径的不同点来说,每个偶数编号的双色向滤光器处的准直空间中的光束方向略有不同。
在流式细胞仪中,可以使用一个或更多个线性16通道紧凑波长检测模块来检测与微粒相关联的光的荧光信号。另选地或者联合地,可以在流式细胞仪中使用一个或更多个双重8通道紧凑波长检测模块来检测与微粒相关联的光的荧光信号。
图6和图7a-图7c例示了紧凑波长检测模块的实施方式,其具有图2b所示的1f图像阵列106b的功能。图6例示了线性16通道紧凑波长检测模块600。图7a-图7c例示了双重8通道紧凑波长检测模块700。
下面,参照图6,线性16通道紧凑波长检测模块600包括输入级(端头)601和安装至基部610的检测模块614。光通过光纤102耦合到输入级(端头)601中。输入级(端头)601包括安装至光具座的准直透镜602、长通滤光器603、清理光学阻挡器604以及聚焦透镜605。输入级(端头)601设定第一个双色向滤光器上的初始光点尺寸图像a(1)的放大倍率m。
从输入级601开始,光被耦合到检测模块614中。输入级(端头)601的一端联接至透明光楔(wedge)607以接收来自聚焦透镜605的光。输入级(端头)601和检测模块614联接至流式细胞仪的底盘或基部610,以保持它们的对准。
检测模块614包括1f图像阵列608和检测器/透镜阵列611。图像阵列608是图2b和图5的图像阵列106b的实施方式。图像阵列608包括透明块680(例如,参见图8和图10的块806、1006),所述透明块包括一侧的光楔607和十五个微镜612。在透明块680的相反侧,存在十六个双色向滤光器609。检测器/透镜阵列611(所述多个检测器313a-313p的实施方式)包括多个光电检测器d1到d16(例如,图3的检测器318),每个光电检测器都具有透镜(例如,图3的透镜316),以将所分解的光聚焦到光电检测器中。
由输入级601耦合到图像阵列608中的光经波长分解到检测器/透镜阵列611的检测器d1到d16中。16通道检测模块分析波长的范围(例如,400nm至800nm波长)。
为了提供更好地适合测试平台的不同占地面积并提供并行处理,线性16通道紧凑波长检测模块600可以代替地实现为双重8通道紧凑波长检测模块。
下面,参照图7a,示出了双检测模块700的俯视图,其具有一对8通道紧凑波长检测模块714、715。紧凑波长检测模块700包括与第一8通道检测模块714和第二8通道检测模块715连通的输入级(端头)701,所有这些都安装成与基部710对准。第一8通道检测模块714针对第一波长范围(例如,650nm至800nm-红光波长)进行分解并且并行地进行分析。第二8通道检测模块715针对第二波长范围(例如,400nm至650nm-蓝光波长)进行分解并且并行地分析。
从光纤102发射的光耦合到输入级(端头)701中。来自光纤102的光穿过准直透镜702进入长通双色向滤光器703。长通双色向滤光器703以45度角将处于激光激发波长(例如,小于400nm)的光反射至散射检测器(未示出)。侧向散射(ssc)光可以聚焦到具有类似于针对荧光所描述的球透镜的小孔径检测器上。处于荧光光谱(例如,400nm-800nm)的荧光穿过长通滤光器703并进入第二清理滤光器704。清理滤光器704确保没有激发激光到达分解检测模块714-715。
在清理滤光器704之后,通过长通滤光器705将荧光分离成长波长频带和短波长频带。长波长光(例如,红光-650nm至800nm)穿过长通滤光器705并被准直/聚焦透镜706聚焦到第一检测模块714中。光的穿过长通滤光器705的长波长部分被第一检测模块714分解。短波长光频带(例如,蓝光-400nm至650nm)被长通滤光器705以一角度反射回到准直/聚焦透镜713中。准直/聚焦透镜713将短波长频带的光聚焦到第二检测模块715中。由长通滤光器705反射的短波长部分被第二检测模块715分解。另选地,滤光器705可以是短通滤光器,并且短波长光穿过该滤光器并被第一检测模块714分解,而长波长光被该滤光器反射并被第二检测模块715分解。
参照第一检测模块714,在成像到第一个双色向或带通滤光器709上之前,来自聚焦透镜706的光垂直进入12度楔面707,并且穿过图像阵列708的透明块(例如,图8的块806)。光穿过带通滤光器709并聚焦到检测器/透镜阵列711中的第一小面积检测器d1上。被带通滤光器709拒绝的光被反射回到图像阵列中的多个微镜m(1)到m(7)中的第一微镜m(1)712上。第一微镜m(1)712使光准直并将光反射回到第二检测模块d2,依此类推,直到图像阵列708的透明块的微镜和检测模块的串行链末端。第二检测模块715与第一检测模块714类似地起作用。
反射通过图像阵列106b进行,如本文所述的第一检测模块714和第二检测模块715中的每一个中的708、708'交替地将光聚焦和准直,连续较短的带通光通过双色向滤光器,分别进入奇数和偶数检测器通道中的奇数和偶数检测器118。因此,通过第一检测模块714和第二检测模块715中的每一个中的多个检测器分解不同波长。
针对给定荧光事件,来自每个检测器(例如,图4b所示的检测器318,图6-图7中的镜头/检测器d1到d16)的信号被电子系统放大、数字化并同步,以提供输入的荧光信号的光谱表示。通过最小化检测器和放大电路的联接长度,将检测电子器件集成到光学模块组装件中允许紧凑的设计和较低的噪声。图4b中所示的检测器318将诸如输入的荧光信号的光学信号转换成电信号。
图7b和图7c分别例示了具有一对8通道紧凑波长检测模块714、715的双检测模块700的右侧立体图和左侧立体图。每个检测模块714、715包括安装基部720和盖722,以封闭检测器阵列或链中的透镜/检测器711所安装至的安装块1200(参见图12)。安装基部720和盖722使透明块806、1006中的图像阵列708、708'的部件一起与每个检测器模块714、715中的检测器阵列对准。每个检测模块714、715的安装基部720通过多个紧固件联接至基部710。
输入级701包括光具座751,光具座751具有:用于容纳滤光器703–705的多个滤光器槽;用于容纳透镜702、706、713的多个透镜槽;以及一个或更多个光通道,光沿所述光通道反射并传播通过滤光器和透镜。光具座751联接至检测模块700的基部710,以保持与检测模块714-715的对准。
下面,参照图13,示出了模块化流式细胞术系统中的光学板组装件1300的俯视图。光学板组装件1300包括具有三个半导体激光器1370a、1370b、1370c的激光系统1370,三个半导体激光器1370a、1370b、1370c将激发引导到流式细胞组装件1308中,其中样本流体与样本微粒一起流动。激光系统1370试图以共线方式将多个(例如,三个)激光束引导向流式细胞组装件1308。然而,所述多个激光束可以彼此略微偏移。激光系统1370包括波长通常约为405纳米(nm)、488nm及640nm的半导体激光器1370a、1370b、1370c。405nm半导体激光器的输出功率通常大于30毫瓦(mw);488nm半导体激光器的输出功率通常大于20mw;并且640nm半导体激光器的输出功率通常大于20mw。控制器电子器件控制半导体激光器在恒定温度和恒定输出功率下工作。
光学系统在空间上操纵分别由半导体激光器1370a、1370b、1370c生成的光学激光束1371a、1371b、1371c。该光学系统包括透镜、棱镜以及转向镜,以将光学激光束聚焦到携带生物细胞(biocell)的流体流上。聚焦的光学激光束尺寸通常横跨流动流聚焦达50微米(μm)-80μm,并且通常沿着在流式细胞组装件1308中流动的流聚焦达5μm-20μm。在图13中,该光学系统包括光束整形器1330a-1330c,它们分别从半导体激光器1370a-1370c接收激光1371a、1371b、1371c。从光束整形器1330a-1330c输出的激光分别耦合到反射镜1332a-1332c中,以将激光1399a、1399b、1399c引导向流式细胞组装件1308并进入流式细胞组装件1308,以瞄准被荧色物染料染色的微粒(例如,生物细胞)。激光1399a、1399b、1399c彼此略微分开,但是通过反射镜1332a-1332c直接大致平行进入流式细胞组装件1308。
激光束1399a、1399b、1399c到达流式细胞组装件1308中的流动流中的生物细胞(微粒)。然后激光束1399a、1399b、1399c被流动流中的细胞散射,从而使荧色物发荧光并产生荧光。前向散射二极管1314聚集轴上(on-axis)散射光。集光透镜1313会聚离轴散射光和荧光并将它们一起引导至二色镜1310。二色镜1310将离轴散射光聚焦到侧向散射二极管1315上。二色镜1310将荧光聚焦到至少一个光纤端头1316上。至少一个光纤组装件102将荧光向至少一个检测器模块600、700路由。
为了利用不同荧光染料和激光波长对生物样本进行更详细分析,可以使用多个光纤端头1316、多个光纤组装件102以及多个检测器模块600、700。三个光纤端头1316a、1316b、1316c可以平行安置以接收荧光,并且三个光纤组装件102a、102b、102c可以被用于将荧光引导至三个检测器模块600a、600b、600c或700a、700b、700c。
三个光纤端头1316a、1316b、1316c(以及三个光纤组装件102a、102b、102c)被启用,因为三个激光光束599a、599b、599c稍微偏移(例如,不精确地共线)。因此,三个光纤端头1316a、1316b、1316c可以分别从具有三个不同波长的三个激光光束599a、599b、599c收集光束数据。然后,三个光纤组装件102a、102b、102c将光引导到三个不同的检测器模块(例如,三个不同的检测器模块600a、600b、600c或700a、700b、700c)。
另选地,模块化流式细胞术系统可以使用一个检测器模块600、700来收集光束数据。例如,三个光纤组装件102a、102b、102c可以将光引导到一个检测器模块600、700中,而不是三个不同的检测器模块。然后进行光束数据的分离作为数据处理操作,而不是利用三个不同的检测器模块来分离光束数据。从实体装置的角度来看,利用一个检测器模块可能不太复杂。然而,数据处理操作可能更复杂,因为光束数据的分离需要更多的数据操纵(例如,识别不同波长并相应地分离光束数据)。
可以通过对前向和侧向散射数据的分析来对细胞几何特征进行分类。流体流中的细胞由可见波长范围为400nm至900nm的染料标记。在被激光激发时,染料产生荧光,它们由光纤组装件102收集并朝着检测器模块600、700路由。模块化流式细胞仪系统经由检测器模块600、700中的紧凑半导体激光器、11.5x焦度的集光透镜1313,以及紧凑图像阵列为光学板组装件保持相对小的尺寸。
集光透镜1313有助于检测器模块600、700的设计。集光透镜1313具有11.5倍焦度的短焦距。集光透镜1313(物镜)具有面对荧光发射的约1.3的高数值孔径(na),以在宽入射角范围内捕获荧光发射中的更多光子。集光透镜1313具有面对采集光纤(collectionfibre)102的约0.12的低na,以在窄锥角上将荧光发射到光纤中。因此,集光透镜1313从一侧的高na转换为相反侧的低na,以支持检测器模块600、700的输入通道中的放大倍率m。
采集光纤组装件517的芯体直径在约400μm至800μm之间,并且对于大约600μm的芯体直径,光纤na约为0.12。光纤输出端部可以逐渐变细到介于大约100μm至300μm之间的芯体直径,以将成像尺寸控制到接收光电二极管上。
采集光纤102的输入端部还可以包括透镜化光纤端部以增加采集na,从而允许使用小于大约400μm的光纤芯体直径。因为光纤102具有在流式细胞仪系统中的任何地方递送光的灵活性,所以使用光纤进行荧光采集使能优化接收器组装件和电子器件的位置,从而实现紧凑流式细胞仪系统。
为了制造低成本的流式细胞仪,可以引入更低成本的组件。每个检测模块614、714、715中的图像阵列106b由实心透明材料形成,以提供可靠、低成本和紧凑的检测模块。而且,流式细胞仪使用低成本的现成薄外形(to)罐式检测器。
下面,参照图12,在透明块806、1006(参见图8–图11)附近示出了安装块1200,它们联接在一起以形成将通过安装基部720和盖722安装至图7a-图7c所示的紧凑检测器模块700的基部710的1f图像阵列708、708'。安装块1200包括多个成角度的弯曲开口1201,以容纳多个to罐式透镜/检测器711。安装块1200与成像阵列708的透明块806、1006的对准以及成角度的弯曲开口1201的角度使得从微镜712e反射的光可以被双色向滤光器709e带通滤光并耦合到透镜/检测器711e。
每个to罐式透镜/检测器711包括联接在一起的聚焦透镜1211和低成本的to罐式检测器1212。to罐式检测器1212包括窗口顶部和to罐式封装内部的半导体光电检测器1213。半导体光电检测器1213电联接至多个电引脚1214,所述电引脚1214延伸到to罐式封装之外,流式细胞仪的其它电子器件电联接至所述电引脚。与图4b所示的检测器318类似,半导体光电检测器1213将诸如输入的荧光信号的光学信号转换成至少一个电引脚1214上的电信号。
下面,参照图8,示出了用于1f图像阵列106b、608、708、708'的实施方式的由实心透明材料800形成的透明块806的立体图。用于透明块806的实心透明材料800例如可以是透明玻璃或透明塑料。处于一行和串行链中的多个微镜810被形成在透明材料800的透明块806的一侧中或一侧上。处于一行和串行链中的多个双色向或带通滤光器812形成在透明材料800的透明块806相反侧中或相反侧上。每个双色向或带通滤光器812被调谐至光的不同波长范围,以允许检测由荧色物发射的宽范围的荧光。在一个实施方式中,多个微镜810是凹球面镜。
由实心透明材料800形成的透明块806还包括12度楔面820,以接收来自聚焦透镜的光,如参照1f成像阵列708描述的。光垂直于楔面820的表面进入并被引导(转向)朝向第一个双色向或带通滤光器d(1)。光穿过透明块806到达第一个双色向或带通滤光器d(1)。
下面,参照图10,示出了用于1f图像阵列106b、608、708、708'的另一实施方式的、由实心透明材料800形成的透明块1006的立体图。用于透明块1006的实心透明材料800例如可以是透明玻璃或透明塑料。多个微镜1010是形成到透明材料的一侧中的凹矩形镜。多个双色向或带通滤光器1012形成到透明材料800相反侧中或相反侧上。每个双色向或带通滤光器812被调谐至光的不同波长范围,以允许检测由荧色物发射的宽范围的荧光。
实心透明材料800还包括12度楔面820,以接收来自聚焦透镜的光,如参照图像阵列708描述的。光垂直于楔面820的表面进入并被引导(转向)朝向第一个双色向或带通滤光器d(1)。光穿过该透明块到达第一个双色向或带通滤光器d(1)。
下面,参照图9a,横截面图例示了透明块806的一侧上的球形微镜810与相反侧之间的距离(例如,厚度l)。在球形微镜810的中心处垂直于透明块的轴814延伸到透明块806的相反侧。图9b例示了在双色向或带通滤光器812的中心处垂直于透明块的轴815。轴815延伸到透明材料800的透明块806的相反侧。轴814和815彼此平行。
在实心透明材料800的球形透明微透镜形状上形成(例如,设置)反射材料811,以在透明块806的一侧形成各个球形微镜810。双色向或带通滤光器812在透明块806的相反侧联接至材料800。
图11类似地示出了在形成透明块1006的透明材料800的一侧上的凹矩形微镜1010与相反侧之间的距离和轴1014。图11还例示了在双色向或带通滤光器1012的中心点处的垂直轴1015。光轴1015延伸到由透明材料800形成的透明块1006的相反侧。光轴1014和1015彼此平行。
图11还示出了反射材料1011形成(例如,设置)在由透明材料800形成的实心透明块1006的弯曲透明矩形形状上,以形成矩形微镜1010。双色向或带通滤光器1012联接至实心透明块1006的相反侧。
流式细胞术应用中使用的荧光染料涵盖整个可见光和近红外波长范围。对于长波长荧色物来说,发射波长带宽通常较大。每个双色向或带通滤光器812可以使其检测器滤光器通带和中心波长被优化以利用相同量的光谱采样来测量不同染料。而且,单独滤光器优化允许排除来自其它激光的激发波长。以这种方式,可以完全利用每个通道中的检测器来检测关注信号。结合由计算机的处理器执行的荧光光谱离析算法,单独和优化的通带检测提供了对大量的关注荧光染料的最终检测。
方法
下面,对在流式细胞仪中使用本文所公开的各种检测系统的方法进行描述。在将由激光激发的荧色物所产生的荧光发射出图中所示的光纤102的所述端部之前,不同波长的荧光由被激光激发的各种荧色物产生,这些荧色物标记流动通道中的样本中的不同微粒。所产生的荧光由靠近激光器相对端的集光透镜接收,如可以在图13看到的。使用转换器,从捕获侧的第一数值孔径转换至小于第一数值孔径的第二数值孔径,以更好匹配光纤的数值孔径。然后,光纤将荧光引导向光纤的所述端部,以灵活地将其引导向紧凑检测模块600、700。
光纤102将荧光耦合到光纤的所述端部,从而将其从光纤中射出。所发射的荧光具有由已被激光激发的不同荧色物产生的不同波长,所述不同的荧色物附着于样本流体中的不同微粒。
在输入通道中,从光纤的所述端部发射的光被透镜准直并聚焦到第一分解成像阵列中的第一多个双色向滤光器中的第一个双色向滤光器。
进一步沿该输入通道,从光纤发射的、用于激发不同荧色物的激光被阻挡装置阻挡以免干扰检测荧光的波长。
进一步沿该输入通道,将来自光纤的一端部的图像尺寸放大至针对第一分解成像阵列中的第一多个双色向滤光器中的处于一串行链或行中的第一个双色向滤光器的光点尺寸。
在第一分解成像阵列中,另选地,在所述第一多个双色向滤光器与一串行链或行的第一多个微镜之间反射第一波长范围的荧光,以使荧光准直在奇数编号的双色向滤光器上,并且使荧光重新成像在偶数编号的双色向滤光器上。所述第一多个微镜的焦距和所述第一多个双色向滤光器与所述第一多个微镜之间的间隔距离提供沿着所述微镜链的望远镜效应,以使荧光准直在奇数编号的双色向滤光器上并且使荧光重新成像在偶数编号的双色向滤光器上。
在该串行链或行的第一多个双色向滤光器中,在各个滤光器处对第一波长范围的荧光的不同波长范围进行带通操作,以分解第一波长范围的荧光的波长谱。
与该串链或行的所述第一多个双色向滤光器相邻的是一串行链或行的具有第一多个第一检测器的多个检测器通道,如图3、图6以及7a-图7c所示。每个检测器通道都具有透镜,以将不同波长范围的荧光聚焦到第一多个光检测器中。
该串行链或行的多个检测器检测与标记至微粒的各个荧色物相关联的第一波长范围中的每个不同波长范围中的荧光。所述多个光检测器将各自接收到的荧光转换成可以分析和计数的电信号。
随着荧光被检测器转换成电信号,然后可以使用具有处理器的计算机来对样本流体中的每种不同微粒的数量进行计数,如由davidvrane等人于2017年4月26日提交的标题为compactmulti-colorflowcytometer的申请no.15/498,397中所公开的,其通过引用并入于此。
第二和/或第三分解成像阵列可以与第一分解成像阵列并行使用。在这种情况下,该方法还包括将荧光分成用于第一分解成像阵列的第一波长范围的荧光、用于第二分解成像阵列的第二波长范围的荧光和/或用于第三分解成像阵列的第三波长范围的荧光。如图13所示,第一光纤102a可以用于将荧光引导向第一分解成像阵列。第二光纤102b可以用于将荧光引导向第二分解成像阵列。第三光纤102b可以用于将荧光引导向第三分解成像阵列。
这里描述的用于第一分解成像阵列的步骤可以由第二和/或第三分解成像阵列同时执行,因此可以分析不同的附加波长范围。为简短起见,重复的步骤不再重复,但通过引用并入于此。
因此描述了这些实施方式。虽然已经具体描述了实施方式,但是它们不应该被解释为受这种实施方式的限制,而是根据下面的权利要求书来解释。
虽然已经对特定示例性实施方式进行了描述并且在附图中进行了示出,但要明白的是,因为本领域普通技术人员可以想到各种其它修改例,所以这种实施方式仅仅是例示性的,而非针对本宽泛发明的限制,并且这些实施方式不限于所示和描述的具体构造和排布结构。
流式细胞仪的某些功能可以用软件实现并由计算机或处理器执行,如分析由检测器检测到的电信号以对样本流体中的不同微粒进行计数。使用该软件的程序或代码段来执行为执行这些功能所必需的任务。该程序或代码段可以存储在处理器可读介质中,或者通过传输介质或通信链路上的载波中所具体实施的计算机数据信号发送。处理器可读介质可以包括可以存储信息的任何存储介质。处理器可读介质的示例包括:电子电路、半导体存储器装置、只读存储器(rom)、闪速存储器、可擦除可编程只读存储器(eprom)、软盘、cd-rom、光盘及硬盘。代码段可以经由诸如因特网、内联网等的计算机网络下载至存储介质。
虽然本说明书包括许多具体细节,但这些不应被解释为对本公开的范围或可以要求保护的范围的限制,而相反应被解释为对本公开的特定实现所特有的特征的描述。本说明书中在分离实现的背景下描述的某些特征还可以在单一实现中组合实现。相反地,在单一实现的背景下描述的各种特征还可以按多个实现、分离地或者按子组合来实现。此外,尽管上面将特征描述为在某些组件中起作用,甚至最终同样要求保护,但来自要求保护的组合的一个或更多个特征在某些情况下可以从该组合除去,并且该要求保护的组合可以被指向一子组合或一子组合的变型例。因此,要求保护的本发明要仅通过下面的专利权利要求书来限制。
- 还没有人留言评论。精彩留言会获得点赞!