PD-1CAR-T细胞及其制备方法和应用与流程
本发明涉及肿瘤治疗的细胞药物领域,特别是涉及一种PD-1 CAR-T细胞及其制备方法和应用。
背景技术:
随着肿瘤免疫治疗研究的逐步进展,程序性死亡生长因子-1(PD -1/CD 279 ) 及 其配体 PD-L1/2 (B7-H1/CD274) 作为肿瘤微环境中的重要成员获得众多研究者的青睐。2014年9月4号 ,美国食品及药物管理局 (food and drug adm inistration ,FD A ) 批准了Keytruda (pembrolizum ab ) 用于治疗对其它药物治疗无效的晚期或无法切除的黑色素瘤患者,成为阻断 PD-1 细胞通路的首款获得FD A批准的药物. 1992 年PD -1 首次被发现 ,其主要表达于T细胞、调节性 T 细胞 、“ 耗尽 ”的 T 细胞 、B细胞 、活化单核细胞 、树突细胞 、 自然杀伤细胞 、 自然杀伤 T 细胞 … 。 PD-1 一般表达于活化的 T 细胞 ,其包括跨膜区、茎区 、1 个 Ig 超家族区和 1 个包含 ITIM 、ITSM 的细胞内区。 PD -1 属于协同抑制受体 ,有 2 个配体 ,分别为 PD-L1、PD-L2。 PD-L1在不同的恶性肿瘤中异常表达,如肺、食管、头颈部的鳞状细胞癌以及其他类型的恶性肿瘤 ,如卵巢癌 、膀胱癌 、恶性黑色素瘤和胶质瘤中表达从结构 上看 ,PD -L2 与 PD -L1 类似 ,同属 于 I 型跨 膜蛋白,其包括信号肽、IgV 样 区、IgC 样区、茎区、跨膜区和胞质区。PD-1 与配体 PD-L1/2 结合使 ITIM 和 ITSM 内的酪氨酸磷酸化,ITIM 、IT SM 与 SH P- 1 和SH P-2 结合 ,通过 BC L· X L 的下调表达和 T 细胞的分化传递 T 细胞抑制性信号,间接导致细胞死亡 。 PD -1 PD - L 1/2 途径也被认为是介导免疫抑制的路径,PD -1 作为一个负性调控点起作用。 PD -1 和PD-L1 途径的抑制作用在体外能加强 T 细胞应答;在体内 PD-1 与特异性配体 (PD-L1、PD -L2 ) 结合起作用,下调抗原刺激的淋巴细胞增殖及细胞因子的产生 ,最终导致淋巴细胞“ 耗尽 ”以及诱导免疫耐受。实体肿瘤中的肿瘤细胞可上调 PD- L1 的表达 ,继而提供下调激活 T 细胞的抑制信号,最终关闭免疫反应并诱导免疫耐受性。PD-Ll 高表达 的患者生存率显著下降,与大多数报道肿瘤细胞上 PD -L1 的高表达与不良预后相关 且具有一致性. 除在恶性黑色素瘤表达外,PD -L1 还可在其他不同的肿瘤中表达,包括胶质母细胞瘤、胰腺癌 、卵巢癌 、乳腺癌、肾细胞癌 、头颈部及食管鳞状细胞癌和非小细胞肺癌,且肿瘤细胞上 PD -Ll 的高表达与不 良预后相关。
嵌合抗原受体T淋巴细胞技术(CAR-T) 的原理在于:经嵌合抗原受体修饰的T细胞,可以特异性地识别肿瘤相关抗原,使效应T细胞的靶向性、杀伤活性和持久性均较常规应用的免疫细胞高,并可克服肿瘤局部免疫抑制微环境并打破宿主免疫耐受状态。正常情况下,机体的T淋巴细胞是通过其表面的T 细胞受体来识别靶细胞的,这一识别具有特异性,即某一个T淋巴细胞只识别具有特定抗原的靶细胞,而且这种特定的抗原是在细胞内加工后,在特殊分子的作用下呈递给T淋巴细胞的。这种起抗原呈递作用的分子存在于抗原呈递细胞表面或靶细胞表面,即T细胞的活化不但需要特异性的识别抗原还需要有协同刺激信号。在肿瘤中:(1)肿瘤细胞要有抗原递呈,才会被 T 细胞受体识别(特异性信号)。(2)要有第二信号参与(CD28参与),CD28也必须被活化。第一、第二信号都活化后,T细胞才可以杀伤肿瘤。然而肿瘤主要是从两个方面实现了免疫逃逸:(1)肿瘤细胞抗原递呈的机制会被下调甚至丢失该能力(HLA 阴性),导致 T 细胞无法识别肿瘤细胞。(2)很多肿瘤细胞异常高表达PD-L1 分子,使 T 细胞表面 PD-1 分子被活化,会导致T细胞功能的耗竭、甚至T细胞的死亡。基于这种情况,科学家提出了构建嵌合T细胞受体(现在一般称为嵌合抗原受体)的概念。嵌合抗原受体(Chimeric Antigen Receptor, CAR)主要由两部分构成,一端位于细胞外能够特异性识别癌细胞表面某一抗原的抗体,另一端位于胞内含有信号激活元件(如T细胞受体的Zeta链),起传递信号激活T细胞的作用。这样表达CAR 的T淋巴细胞(CAR-T细胞)就能避免T细胞受体识别靶细胞的限制,从而起到靶向癌细胞的杀伤作用。
构建CAR-T就可以使T细胞识别和杀伤癌细胞不再受到限制,充分发挥T细胞的固有免疫杀伤功能。目前研究者针对多种肿瘤相关抗原设计CAR-T细胞,如CD138、CD19、ErbB2、EGFRvIII 、cell-surface glycoprotein (CS1)、GD2、CD20等,不过这些CAR-T细胞还大多处于研究阶段,临床效果还需要进一步证实。因此需要用创新性的想法,设计构建CAR-T细胞,实现实体肿瘤中治疗中的突破。
技术实现要素:
本发明主要解决的技术问题是提供一种PD-1 CAR-T细胞及其制备方法和应用,得到的PD-1 CAR-T细胞可特异性识别和结合PDL-1蛋白高表达的肿瘤细胞,可以在制备预防和治疗肿瘤疾病的药物中进行应用。
为解决上述技术问题,本发明采用的一个技术方案是:提供一种PD-1 CAR-T细胞,所述PD-1 CAR-T细胞是在T细胞内表达PD-1-CD8-4-1BB-CD3ζ融合蛋白。
在本发明一个较佳实施例中,所述PD-1 CAR-T细胞的制备方法包括步骤为:
(1)合成和扩增PD-1-CD8-4-1BB-CD3ζ融合蛋白基因,将所述PD-1-CD8-4-1BB-CD3ζ融合蛋白基因克隆到慢病毒表达载体上;
(2)利用慢病毒包装质粒和步骤(1)得到的慢病毒表达载体质粒感染293T细胞,包装和制备慢病毒;
(3)分离人外周血T细胞,培养扩增,利用步骤(2)得到的慢病毒感染T细胞,使所述T细胞表达PD-1-CD8-4-1BB-CD3ζ融合蛋白,得到PD-1 CAR-T细胞。
在本发明一个较佳实施例中,所述T细胞的表面表达所述PD-1分子,所述T细胞的胞内由所述4-1BB-CD3ζ分子传递T细胞活化信号。
在本发明一个较佳实施例中,所述PD-1-CD8-4-1BB-CD3ζ融合蛋白中所述PD-1的氨基酸序列如SEQ ID NO:5所示;所述PD-1-CD8-4-1BB-CD3ζ融合蛋白中所述CD8SEQ ID NO:1所示。
在本发明一个较佳实施例中,所述PD-1-CD8-4-1BB-CD3ζ融合蛋白中所述4-1BB的氨基酸序列如SEQ ID NO:2所示;所述PD-1-CD8-4-1BB-CD3ζ融合蛋白中的所述4-1BB能替换为CD28,所述CD28的分子序列如SEQ ID NO:3所示。
在本发明一个较佳实施例中,所述PD-1-CD8-4-1BB-CD3ζ融合蛋白中所述CD3ζ的氨基酸序列如SEQ ID NO:4所示;所述T细胞来源于人外周血T淋巴细胞中。
在本发明一个较佳实施例中,所述PD-1-CD8-4-1BB-CD3ζ融合蛋白的氨基酸序列如SEQ ID NO:6所示。
在本发明一个较佳实施例中,所述PD-1 CAR-T细胞在制备治疗肿瘤药物中的应用。
在本发明一个较佳实施例中,所述PD-1 CAR-T细胞在制备治疗高表达PDL-1分子的肿瘤药物中的应用。
本发明的有益效果是:本发明的PD-1 CAR-T细胞及其制备方法和应用,采用嵌合抗原受体修饰和改造T细胞,将PD-1-CD8-4-1BB-CD3ζ分子在T细胞内表达,使改造后的T细胞能够特异性识别和杀伤肿瘤,得到的细胞具备更高效的肿瘤杀伤活性。
附图说明
为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其它的附图,其中:
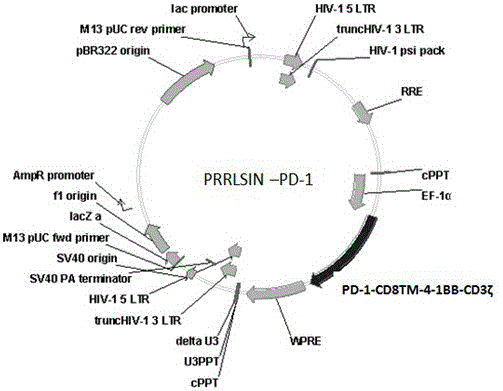
图1是慢病毒质粒载体PRRLSIN-PD-1图;
图2是高表达PD-L1的工程细胞株MCF7-PDL1 流式检测结果图;
图3是PBMC活化两天后流式检测T细胞比例图
图4是检测PD-1-CART不同体积的病毒14天侵染的效果图;
图5 是CAR-PD1体外杀伤实验结果:不同比例的effect图;
图6是PD-1-CAR-T 细胞增殖效果检测图;
图7是不同效靶比条件下PD-1-CAR-T细胞体外杀伤效果图。
具体实施方式
下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其它实施例,都属于本发明保护的范围。
实施例一:
慢病毒表达载体制备
基因合成PD-1- CD8TM-4-1BB-CD3ζ融合基因序列,通过酶切转化连接到PRRSLIN载体中,基因上游为EP-1α启动子。载体转化Stbl3大肠杆菌菌株,氨苄青霉素筛选,获得阳性克隆,提取质粒,酶切鉴定克隆,获得PRRSLIN-PD-1慢病毒转染载体,载体构建图见图1。
实施例二:
慢病毒制备
(1)转染前24小时,以每皿约8×106将293T细胞接种至15cm培养皿中。确保转染时细胞在80%左右的汇合度且均匀分布于培养皿中。
(2)准备溶液A和溶液B
溶液A:6.25 ml 2 ×HEPES buffer缓冲液(5个大皿一起包装的量,效果最好)。
溶液B:分以加入以下质粒的混合物:112.5 ug pRRLSIN-EF-PD1(target plasmid);39.5 ug pMD2.G (VSV-G envelop);73 ug pCMVR8.74 (gag, pol, tat, rev);625 μl 2M钙离子溶液。溶液A总体积:6.25ml。
充分混匀溶液B,轻轻涡旋溶液A的同时,逐滴加入溶液A,静置5-15分钟。轻轻涡旋上述A和B的混合溶液,逐滴加入含293T细胞的培养皿中,轻轻前后晃动培养皿使DNA与钙离子的混合物均匀分布。(不要旋转培养皿)放置于培养箱中培养16-18小时。更换新鲜培养基,继续培养,分别在48小时和72小时后收集含病毒的上清液。荧光显微镜观察。95%以上的细胞都应该显示绿色荧光。500g,25℃离心10分钟。PES膜(0.45μm)过滤。以70%乙醇消毒贝克曼库尔特Ultra-clear SW28 centrifuge tubes,并置于紫外灯下消毒30分钟。将已过滤的含慢病毒的上清液转移至离心管中。在离心管底部小心铺上一层20%蔗糖(每8ml上清液加1ml蔗糖)。以PBS平衡离心管,25000rpm (82, 700g),4℃离心2小时。小心取出离心管,倒掉上清液,倒置离心管去掉残余液体。加入100μl PBS,密封离心管,在4℃放置2小时,每20分钟轻轻涡旋一次,500g离心1分钟(25℃),收集病毒上清。冰上冷却后,置于-80℃保存。
实施例三:
PD-1 CAR-T细胞制备
取0.5ml血进行快速的病原微生物检测,排除HBV、HCV、HDV 和HEV、HIV-1/2、梅毒螺旋体及寄生虫等微生物感染;无菌条件下,用肝素瓶采血50ml(肝素抗凝),立即(4℃,24小时内)送至细胞制备实验室,保证此过程无病原微生物污染。得到患者血液后,在GMP制备室,用酒精棉球擦拭肝素瓶表面进行消毒后放入生物安全柜。预先打开2个50ml离心管,将血液转入两个50ml离心管中,旋紧。将上述装好血液的两个50ml离心管放入离心机离心。400 g (2000rpm),10min,室温离心后收集上层血浆,留下沉淀层。收集的自体血浆经56℃、30分钟灭活。4℃放置15分钟后,900g,30min,4℃离心,取上清备用。将上述富集的血细胞用生理盐水稀释至30ml/管,打开2个新的50ml离心管,每个离心管分别加入15ml人淋巴细胞分离液。用移液管把稀释后的血细胞液缓缓加入到盛有人淋巴分离液的离心管中,旋紧。注意血液要加到淋巴分离液的上层,勿打破人淋巴分离液的界面。将加好的血细胞液放入离心机,调至最小的升降速率,400 g(2000rpm),20min,常温离心。收集两管的中层白细胞层于一支15ml无菌离心管中,加入5ml生理盐水,洗两次(400g,10min离心),得外周血单核细胞(PBMC)。配置完全生长培养基,V-VIVO15添加自体AB(FBS)浓度为5%,IL-2浓度为40ng/ml,将分离得到的PBMC用培养基稀释成2×106/ml,取50ul流式检测PBMC中T细胞的纯度。0天,配置buffer1,PBS添加1%的FBS,将beads振荡30s或手动上下摇匀5min,根据beads与T细胞比例3比1的比例取出CD3/CD28 beads置于1.5ml EP管中,添加1mlBuffer1清洗beads,之后使用磁铁从EP管外吸beads 1min,弃洗液,重复两次,再使用培养基将beads重悬到原体积,将细胞和beads混合后按2×106 PBMC/ML加到合适的培养瓶中。第二天将细胞密度调整至3-5×106/ml,按virus vector:cell=1:5比例添加virus vector,同时添加polybrene 4ug/ml和40ng/ml IL-2。4h之后,补加新鲜的完全培养基将细胞密度调整至1×106/ml继续培养。将所有的细胞离心,加入新鲜的培养基,继续培养。每隔2-3天进行半量换液,维持细胞密度在0.5-1×106/ml。10-12天,细胞数量达到109级别,400g,5min离心得免疫细胞,再用预冷的PBS洗涤两遍(400g,5min)。用血球计数板计数,流式细胞仪检测细胞类群,CART细胞比例。每天观察培养基的颜色变化、细胞密度、细胞形态并作相应记录。逐步扩大培养过程中,加入总体积所需的白细胞介素2。
结果显示: PBMC活化两天后流式检测T细胞比例达到80%以上(见图3),病毒侵染T细胞后, 检测PD-1-CART不同体积的病毒14天侵染的效果,结果显示有35.8%的细胞被侵染成功(图4),制备成PD-1-CART细胞。
实施例四:
工程细胞株的构建及检测
(1)慢病毒PD-L1的制备(具体制备方法见实施例二中的方法);
(2)MCF细胞的侵染:侵染前一天,接种50万个MCF7细胞于6孔板中,待第二天细胞长到80%时,加入包装好的500ul的PD-L1病毒于6孔板中,同时设置对照细胞(不添加病毒),12-16小时后换液,侵染3天后,流式分选PD-L1的阳性细胞;
(3)工程细胞株的检测:取分选的PD-L1的阳性细胞2万个,400g,5min,再用预冷的PBS洗涤两遍,加入2.5ul的PD-L1的抗体(Biolegend)避光孵育20min,离心,再用预冷的PBS洗涤1遍,100ul PBS重悬细胞,上流式检测PD-L1的表达,见图2,实验结果证明工程细胞株构建成功,可作为靶细胞用于后续杀伤实验。
实施例五:
PD-1 CAR-T细胞体外活性检测
ELISA方法检测LDH释放实验,即检测PD-1 CAR-T细胞对MCF7-PD-L1靶细胞的杀伤效应。
(1)用含5%小牛血清的RPMI-1640培养液将靶细胞调整到5×104/ml。
(2)在96孔细胞培养板中加入靶细胞,每孔加100μl。3个效应细胞自然释放对照孔不加靶细胞,只加100μl培养液。
(3)向各孔加100μl效应细胞,效应细胞与靶细胞的比例50:1; 25:1; 10:1; 5:1; 1:1。自然释放孔不加效应细胞只加100μl培养液,效应细胞与靶细胞共孵育6小时,每个实验置三个复孔。
(4)最大释放孔中(阳性对照)加10μl Lysis Solution (10×),孵育45min-60min,每个实验置三个复孔。
(5)取上述3和4中待测样品和对照样品各50 ul,加入新鲜的96孔酶标板中,再加入assay buffer和substrate mix,避光30min。
(6)加入50 ul stop solution。
(7)490nm或492nm处测吸光度值,在1小时内测完。
(8)杀伤率=实验组LDH(OD)/Max LDH 释放组(OD)。
(9)计算公式:杀伤效率=(experimental - effector spontaneous - target spontaneous)/ (target maximum - target spontaneous)×100%
实验结果显示,制备的PD-1 CAR-T细胞能够显著杀伤高表达PDL1的靶细胞株, 不同比例的PD-1 CAR-T与target cells(MCF7-PDL1) 共孵育4小时后,ELISA实验结果显示,随着E:T比例的增加,细胞杀伤效率也逐渐增加(见图5),显微成像显示肿瘤细胞发生明显死亡(图7)。同时在靶细胞株的抗原刺激下,不同比例的CAR-T细胞与target cells(MCF7-PDL1) 共孵育16小时后,MTT计数T细胞数目,结果显示,随着E:T比例的增加,其中CAR-PD1细胞增殖显著。
序列表:
CD8SEQ ID NO:1为:
IYIWAPLAGTCGVLLLSLVITLYC。
4-1BB的序列SEQ ID NO:2为:
KRGRKKLLYIFKQPFMRPVQTTQEEDGCSCRFPEEEEGGCEL。
CD28的序列SEQ ID NO:3为:
RSKRSRLLHSDYMNMTPRRPGPTRKHYQPYAPPRDFAAYRS。
CD3ζ的分子序列SEQ ID NO:4为:
RVKFSRSADAPAYKQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR。
PD-1的序列SEQ ID NO:5为:
MQIPQAPWPVVWAVLQLGWRPGWFLDSPDRPWNPPTFSPALLVVTEGDNA
TFTCSFSNTSESFVLNWYRMSPSNQTDKLAAFPEDRSQPGQDCRFRVTQLPN
GRDFHMSVVRARRNDSGTYLCGAISLAPKAQIKESLRAELRVTERRAEVPTAHPSPSPRPAGQFQTLV。
PD-1-CD8-4-1BB-CD3ζ融合蛋白氨基酸的序列SEQ ID NO:6为:
MQIPQAPWPVVWAVLQLGWRPGWFLDSPDRPWNPPTFSPALLVVTEGDNA
TFTCSFSNTSESFVLNWYRMSPSNQTDKLAAFPEDRSQPGQDCRFRVTQLPN
GRDFHMSVVRARRNDSGTYLCGAISLAPKAQIKESLRAELRVTERRAEVPTAHPSPSPRPAGQFQTLVIYIWAPLAGTCGVLLLSLVITLYCKRGRKKLLYIFKQPFMRPVQTTQEEDGCSCRFPEEEEGGCELRVKFSRSADAPAYKQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR。
- 还没有人留言评论。精彩留言会获得点赞!