一种诱导成纤维细胞转分化为神经细胞的方法与流程
本发明涉及生物
技术领域:
,特别是涉及一种诱导成纤维细胞转分化为神经细胞的方法。
背景技术:
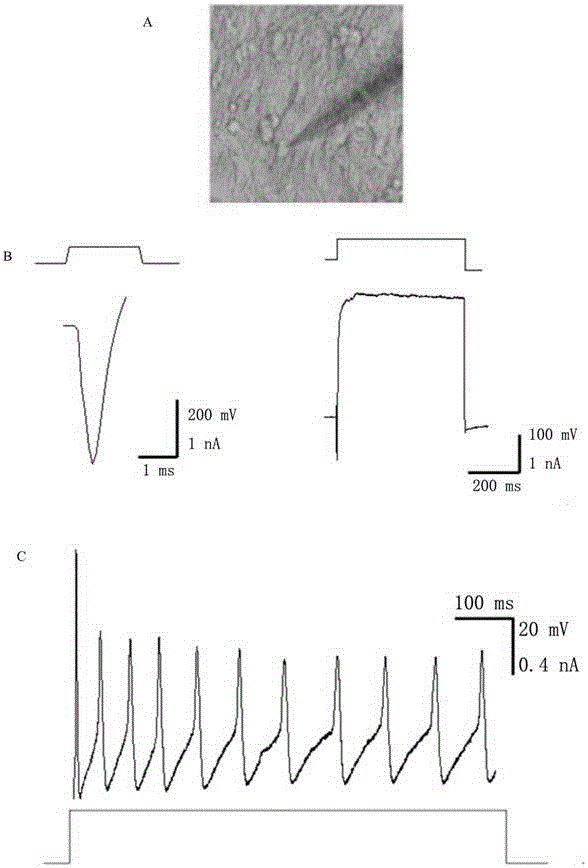
:多细胞生物体绝大部分是由全能性的受精卵发育而来的。精卵结合形成的受精卵经历逐级谱系分化最终发育为成熟个体。其中,细胞的命运决定是成千上万的外源信号与内源因子协同作用的结果,这一过程复杂而难以操控。近些年生命科学飞速发展,其中最引人注目的成就之一便是人们通过外源途径来改变细胞的命运。通过过量表达谱系特异性调控因子,人们不仅能使成体细胞去分化为胚胎干细胞,还能实现不同世系成体细胞之间的转分化过程。随着重编程技术的发展以及干细胞本身所具有的特性,使得人类有可能在体外培养某些干细胞,诱导其分化或定向转分化为具有重要功能的体细胞,以供临床所需;同时,再生医学则正是利用组织工程、干细胞移植和药物等临床手段,将功能无法自行恢复的病变组织、器官得到结构和功能的重建。干细胞在治疗神经和神经损伤举得一些疗效,但依然面临着细胞来源不足的问题,且异体移植又可能会导致免疫排斥的发生。目前,通过在体细胞中强制表达特定重编程因子,介导体细胞直接转分化为某些珍贵的或者不可再生的细胞,为解决上述细胞来源不足的问题提供了新的途径。然而,外源基因过量表达的方法技术壁垒较高,表达载体可能插入基因组,导入系统安全性存在隐患,效率也有待提高。除了特异性基因的诱导手段,一些小分子化合物也被证实能够促进细胞重编程过程,且重编程过程中的所有转录因子都可以被小分子所替代。小分子化合物不仅具有渗透入细胞膜、易操控和成本低等优势,并且小分子能实现没有任何外源基因介入的体细胞重编程过程,这无疑为人们获得多能性干细胞提供了新的方法和思路。技术实现要素:本发明提供了一种通过在培养基中添加小分子组合来诱导成纤维细胞转分化为神经细胞的方法。在系统分析了10多种小分子的不同组合对小鼠成纤维细胞基因表达和克隆形态影响的基础上,发现小鼠成纤维细胞可以同时转变为包括神经细胞、心肌细胞和脂肪细胞等各种体细胞类型。这种随机多向转分化的现象,称之为小分子组合诱导的多向转分化(inducedmulti-lineagetrans-differentiation,iMT)。具有这种功能的小分子组合称为诱导小分子组合。一种诱导成纤维细胞转分化为神经细胞的方法,步骤如下:(1)培养成纤维细胞20~30h;(2)将细胞转移到含诱导小分子组合6TCF的培养基中继续培养6~8天,期间每2~4天更换一次培养基;(3)将细胞再转移到含诱导小分子组合6TCF和8CFV的培养基中继续7~16天,期间每2~4天更换一次培养基,获得神经细胞;其中,6为E61541、T为苯环丙胺(Tranylcypromine)、C为CHIR99021、F为毛喉素(Forskolin,FSK)、8为A-83-01、V为丙戊酸(VPA,Valproicacid)。其中,E61542和A-83-01是TGF-β信号通路中ALK5位点的抑制剂;苯环丙胺是单胺氧化酶的抑制剂,一般作为抗抑郁药;CHIR99021是GSK3抑制剂;毛喉素是腺苷酸环化酶的激活剂;丙戊酸是组蛋白去乙酰化酶抑制剂。优选的,诱导小分子组合中各组分的浓度为:诱导小分子组合中各组分的浓度是在参考了各种文献报道的基础上,再经实验验证得到的,浓度过低或过高都会造成诱导转分化的效果变差。优选的,所述的成纤维细胞来源于小鼠。所述的成纤维细胞来源于10.5~14.5天的小鼠胚胎。或者,所述的成纤维细胞来源于小鼠尾尖。本发明还提供了利用所述的方法获得的神经细胞。本发明还提供了所述的神经细胞在药物筛选中的应用。如用于治疗神经方面疾病的药物筛选。本发明通过在培养基中添加诱导小分子组合,能够将成纤维细胞诱导转分化为神经细胞,所得神经细胞具有正常神经细胞的特异性分子标签,并且具有正常神经细胞的功能,为再生医学的细胞来源问题提供一种新的途径。附图说明图1为诱导小分子组合功能性筛选流程图;图2为不同小分子组合产生克隆个数与上调基因的散点图;图3为实施例2中不同iMT类型细胞的验证结果图,其中神经细胞(a-Actinin)、肝细胞(AFP)、脂肪细胞(Cebpa)、表皮细胞(E-cadherin)、神经细胞(Tuj1、GFAP)、平滑肌细胞(SMA)的免疫荧光染色,内脏层器官细胞的PAS染色和脂肪细胞的油红染色;图4为实施例2中6TCF小分子组合处理后iMT类型中神经细胞的验证结果图,其中,图A为电生理实验示意图;图B为利用电压钳检测神经细胞的Na+与K+电流结果图;图C为通过电流注入诱发的神经细胞动作电位的变化结果图;图5为实例3中6TCF小分子组合处理TTF的免疫荧光图;其中图A为6TCF组合处理后抗a-Actinin的免疫荧光图和对应的细胞核图片;图B为6TCF组合处理后抗Tuj1的免疫荧光图和对应的细胞核图片;图6为不同小分子组合处理MEFs的结果图,其中图A为克隆统计结果,图B为6TCF+8CFV处理后的GFAP-GAP阳性克隆图;图7为实施例5所得神经细胞中相关特异性基因上调结果图。具体实施方式基础培养基:DMEM、15%胎牛血清、2mM谷氨酰胺、40ng/mLbFGF、0.01mMβ-巯基乙醇、100μg/ml链霉素和100U/ml青霉素。实施例1(1)小鼠胚胎成纤维细胞(MEFs)的制备步骤如下:1)培养器皿的预处理:以0.2%明胶覆盖培养皿的底壁,室温下放置30min后,将0.2%明胶吸出,室温下备用。2)给孕13.5天的小鼠(野生型小鼠或者携带GFAP-GFP报告系统的转基因小鼠)注射约0.5mL阿佛丁麻醉后,实施断颈法处死小鼠,将其浸入75%酒精中消毒5分钟。3)用75%乙醇擦拭腹部,剪开皮肤并把皮肤向后拉,暴露出腹壁。剪开腹壁以暴露出子宫。将子宫移到100mm的皿里,用10mLPBS洗三遍。4)用剪刀剪开胚囊,并将胚胎移到培养皿中。5)小心去除胚胎的头和内脏,将胚胎躯干部分转移到青霉素小瓶中,用2mLPBS洗三遍。6)用眼科剪将组织剪碎,加入2mL的0.05%胰蛋白酶和0.02%EDTA,将悬液移入50mL离心管中,并在37℃孵育大约20min,每隔5min振荡几下。7)充分吹打后加入10mL培养基终止消化,静置5min后,将上层约8mL的细胞悬液移入培养皿中,置37℃,5%CO2培养6h后,换液。8)细胞约90%汇合时传代。(2)小鼠尾尖成纤维细胞(tail-tipfibroblasts,TTFs)的制备步骤如下:1)将6周龄的B6/C57小鼠实施断颈法处死小鼠后,浸入75%酒精中消毒5分钟。无菌剪取小鼠尾尖约4cm的组织;2)去除皮肤后,先用PBS洗3遍,除去血液和脂肪组织;再用眼科剪把鼠尾剪成适当大小分装至盛有2滴血清的1.5mL离心管中,再充分剪碎组织块,加入500μL的血清进行涂板;用组织块贴壁培养法倒置培养6-8h,期间注意添加血清,防止血清干涸;6-8小时后,添加5mL培养基,待到24h后,将培养基添加至8mL;3)在小鼠胚胎成纤维培养基中培养7天,期间每3天换一次液,并将培养基加至10mL;待细胞爬出至适当密度时,进行传代或冻存处理。实施例2为了探索小分子在改变细胞命运上的潜在作用,对已被证明对重编程有影响的10余种小分子化合物和其组合进行了系统的分析和筛选,他们包括HDAC抑制剂:NaB(N)、VPA(V)、TSA(A);DNMT抑制剂:RG108(R)、5-AZA(5);G9a抑制剂:BIX-01294(B);Ezh2抑制剂:DZNep(D)、GSK126(G);LSD1抑制剂:苯环丙胺(T);AC抑制剂:Forskolin(F);GSK3抑制剂:CHIR99021(C);MEK抑制剂:PD032590(P);ALK5抑制剂:A-83-01(8)、E616452(6)、SB431542(S)。各小分子化合物使用浓度如表1所示。表1小分子化合物浓度(μM)VPA(V)500NaB(N)20RG108(R)、Forskolin(F)、CHIR99021(C)10苯环丙胺(T)、E616452(6)、SB431542(S)55-AZA(5)4PD032590(P)1BIX-01294(B)、GSK126(G)、A-83-01(8)0.5TSA(A)0.1DZNep(D)0.05实验流程如图1所示,将实施例1制备的MEFs细胞(来自野生型小鼠)接种于96孔板上(每孔接种1000个细胞),从第二天开始培养基中添加不同的小分子组合,然后每四天换液,第16天检测,通过统计克隆的形成个数和qPCR分析,确定不同小分子组合的筛选效果。如表2所示,不同小分子组合获得的特定类型的克隆个数有所不同,其中,对照为未添加小分子,此时没有克隆形成。如图2所示,小分子组合6TCF和SGCF对MEFs相关基因上调数量较多,且转分化后的克隆数量最多,但所得的转分化后的克隆并不是单一的一种细胞类型,而是包括神经细胞、心肌细胞和脂肪细胞等各种体细胞类型(图3)。其中,对6TCF处理后的类神经细胞进行电生理试验和动物电位的检测,如图4所示,获取的部分类神经细胞具有同正常神经细胞相似的功能。所以,在6TCF小分子组合的基础上,进行进一步的优化与实验,以获得转分化后为单一神经体细胞类型的小分子组合。表2不同小分子组合下克隆形成数量(单位:个)。表皮样克隆圆形克隆神经样克隆心肌样克隆脂肪样克隆黑色克隆克隆总数对照0000000A0000000C0000000CF0000000F0000000SGC1010002G00005056VCF1040106610007088CF11800010T50008013SCF151800158000020020S000020020SGF000515020TCF102020023SGCF8718741456TC118030040V6TC1110030042SG000050050V6TCF46244160546TF500050055V6CF84156220556TCF18818816068实施例3将实施例1制备的TTFs细胞接种于细胞培养的6孔板上(每孔接种20000个细胞),从第二天开始在培养基中添加不同的小分子组合,然后每四天换液,第16天检测,通过统计克隆的形成个数和qPCR分析,确定不同小分子组合的筛选效果。如图5所示,小分子组合6TCF处理TTFs,也能获取a-Actinin阳性的类心肌细胞和Tuj1阳性的类神经细胞。实施例4GFAP蛋白为神经细胞形成初期的一个特异性标志物,通过检测GFAP蛋白的出现,可以判断成纤维细胞是否被诱导转分化为神经细胞。以不添加小分子组为阴性对照组,实验组为在培养基中添加6TCF、6CV、8CF或者添加6TCF+6CV、6TCF+8CFV、6TCF+8CFRV共6组,每组实验设置三个重复,具体实验过程如下:将实施例1制备的MEFs细胞(来自携带GFAP-GFP报告系统的转基因小鼠)接种在96孔板中(每孔接种2000个细胞),培养基为基础培养基。6TCF、6CV、8CF三组实验,第二天更换为添加有小分子组合的培养基,然后每隔4天更换一次添加有小分子组合的培养基,直到第16天进行GFAP-GFP阳性克隆计数。6TCF+6CV、6TCF+8CFV、6TCF+8CFRV三组实验,第二天更换为添加有小分子组合6TCF的培养基,然后每隔4天更换一次添加有小分子组合6TCF的培养基,第9天更换为在添加有小分子组合6TCF的基础上再添加6CV、8CFV或者8CFRV的培养基,直到第16天进行GFAP-GFP阳性克隆计数。而阴性对照组从头到尾只使用基础培养基进行培养。实验结果如图6所示,其中6TCF+8CFV的组合处理后GFAP-GFP阳性细胞的克隆数最多,说明将成纤维细胞诱导转分化成神经细胞的能力最强。实施例5将实施例1制备的MEFs细胞(来自携带GFAP-GFP报告系统的转基因小鼠)接种在35mm细胞培养皿上(每个培养皿接种20000个细胞),其培养基为基础培养基。第二天,更换培养基,并加入诱导小分子组合6TCF(5μME61541、5μM苯环丙胺、10μMCHIR99021、10μM毛喉素),每4天更换一次添加诱导小分子组合6TCF的培养基;第9天至第24天,更换为添加诱导小分子组合6TCF(5μME61541、5μM苯环丙胺、10μMCHIR99021、10μM毛喉素)和8CFV(0.5μMA-83-01、10mMCHIR99021、10μM毛喉素、500μMVPA)的培养基,第24天,收集细胞总RNA进行RT-qPCR检测相关基因的表达情况,并且在诱导过程中注意GFAP-GFP成纤维细胞绿色荧光蛋白的表达情况。定量结果如图7所示,Ascl1、PAX6、Sox2、Olig2和MYTL1等神经细胞特异性基因上调明显,且能观察到具有动作电位的神经细胞,并具有收缩潜能。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1