确定未裂解血液样本中基于血红蛋白的参数的方法和装置与流程
相关申请的交叉引用
本申请要求2013年9月19日提交的美国专利申请no.61/879,976以及2013年5月9日提交的美国专利申请no.61/821,448的优先权。
本发明总体涉及用于分析全血样本的方法和装置,尤其涉及用于确定未裂解、未稀释的全血样本中某些基于血红蛋白的参数(例如血红蛋白浓度)的方法和装置。
背景技术:
医师、兽医师和科学家对人类和动物的生物流体(特别是血液)进行检查,从而确定成分微粒的数量,以及识别不会在健康受试者身体中发现的异常微粒的存在。通常被测量、被量化和被识别的微粒包括红细胞(rbc)、白细胞(wbc)和血小板。rbc分析包括确定rbc的数量、血红蛋白浓度,以及血细胞比容(也称为血细胞压积)。
在诸多现有技术应用中,通过以下方式确定血液样本的血红蛋白浓度:首先裂解样本中的rbc,接下来确定包含已裂解rbc的样本的血红蛋白浓度。对rbc进行裂解的明显缺点是一旦rbc被裂解,则无法再对前述样本中的rbc进行细胞分析,例如,rbc的细胞体积(cv)、平均细胞体积(mcv),细胞血红蛋白浓度(chc)、平均细胞血红蛋白浓度(mchc),平均细胞血红蛋白含量(mch)等。
技术实现要素:
根据本发明的一个方面,提供了一种用于确定红细胞的血红蛋白浓度的方法,所述方法包括步骤:a)将未裂解、基本上未稀释的血液样本沉积到分析腔室中,所述分析腔室适于静态保持用于分析的所述样本,所述腔室由第一面板的内表面以及第二面板的内表面限定,其中,两个面板都是透明的,并且所述腔室具有在所述第一面板的内表面和所述第二面板的内表面之间延伸的高度;b)在所述分析腔室的区域中对所述样本成像,在所述区域中,所述腔室的高度不大于大约20微米(20μm)且不小于2微米(2μm),以生成代表成像区域的光学密度的图像信号;c)利用代表所述成像区域的所述光学密度的所述图像信号确定样本代表性光学密度值;以及d)利用所述样本代表性光学密度值确定所述样本的所述血红蛋白浓度。
根据本发明的另一个方面,提供了一种用于确定红细胞的血红蛋白浓度的方法,所述方法包括步骤:a)将未裂解、基本上未稀释的血液样本沉积到分析腔室中,所述分析腔室适于静态保持用于分析的所述样本;b)在所述分析腔室的区域中对所述样本成像,以生成代表成像区域的光学密度的图像信号;c)利用所述图像信号确定样本代表性光学密度值;以及d)利用所述样本代表性光学密度值确定所述样本的所述血红蛋白浓度。
根据本发明的另一个方面,提供了一种用于确定未裂解、基本上未稀释的全血样本中红细胞的血红蛋白浓度的装置。所述装置包括分析腔室、样本照明器、析像管以及分析器。分析腔室适于静态保持用于分析的所述样本。腔室由第一面板的内表面以及第二面板的内表面限定,其中两个面板都是透明的。腔室具有在所述第一面板的内表面和所述第二面板的内表面之间延伸的高度,所述高度不大于大约20微米(20μm)且不小于2微米(2μm)。样本照明器适于发出光线,所述光线穿过静态驻留于所述分析腔室内的样本。析像管适于捕获源自于所述样本照明器并穿过静态驻留于所述腔室内的所述样本的光线。析像管还适于生成代表穿过所述样本的所述光线的图像信号。分析器适于利用图像信号确定样本代表性光学密度值,并适于利用所述样本代表性光学密度值确定所述样本的区域中的所述血红蛋白浓度。
基于下面提供的包括附图在内的详细描述,可以更好地理解本方法和与其相关的优点。
附图说明
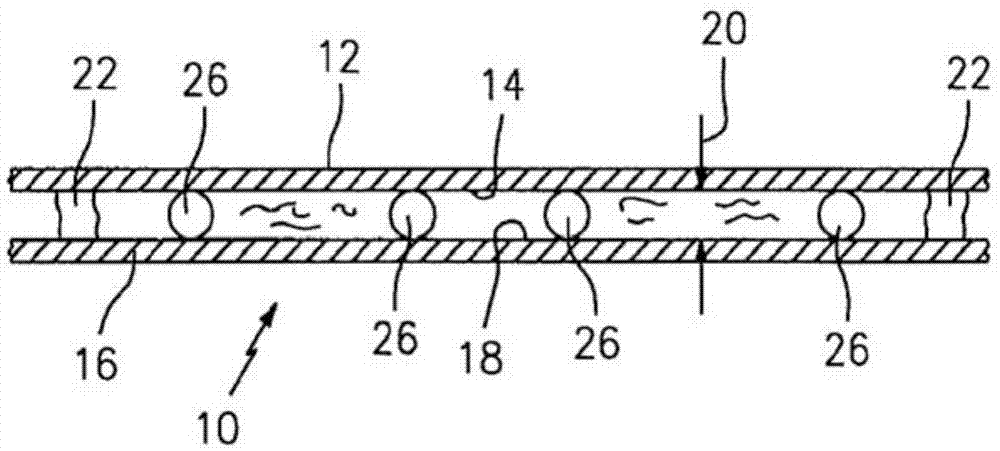
图1是表示可以在本方法中使用的分析腔室的横截面图。
图2是可以与本方法一起使用的分析设备的示意图。
图3是显示根据本发明的一个方面的方法步骤的框图,该方法步骤用于确定未裂解、基本上未稀释的全血样本的基于血红蛋白的参数。
具体实施方式
用于分析未裂解、基本上未稀释的全血样本的本方法和装置允许在不向样本中添加任何染料、试剂(除了在某些实施方式中使用抗凝剂)或稀释剂的情况下确定基于血红蛋白的参数,该参数包括但是不限于血红蛋白浓度、血细胞比容和红细胞(rbc)计数。
本方法利用分析腔室,该分析腔室为可操作的,以静态地保持未裂解且基本上未稀释的全血样本以用于分析。如下面所解释的那样,样本通常是(但不一定)抗凝的。腔室的大小通常为保持大约0.2μl至1.0μl的样本,但是腔室不限于任何特定的体积容量,该容量可以改变以适应分析应用。本文所使用的措辞“基本上未稀释”描述完全未稀释、或者未蓄意稀释但是对其添加了某些试剂以用于分析目的的血液样本。就试剂的添加会稀释样本而言,如果真的发生,这种稀释也不会对执行的分析产生临床上的重要影响。通常,将在执行本方法的过程中使用的唯一试剂是抗凝剂(例如edta、肝素)以及在某些情况下是等容成球剂(isovolumetricspheringagent)。这些试剂通常以干燥的形式被添加,其目的不是稀释样本。在某些情况下(例如,非常快速的分析),可能不必添加抗凝剂,但是在大多数情况下优选添加抗凝剂,以促进对样本的分析。术语“静态”用来描述样本被沉积在腔室内以用于分析,并且在分析期间样本不相对于腔室被蓄意地移动,亦即样本静态地驻留于腔室内。就血液样本内存在运动而言,这主要是由于血液样本的组成成分的布朗运动导致的,该运动不会使本发明的设备失去作用。
参照图1,在一些实施方式中,分析腔室10是由第一面板12的内表面14和第二面板16的内表面18限定的空间。面板12、面板16都足够透明,以允许光线沿着预定波长穿过那儿的传输,穿过的光线的量足以执行下面描述的光学密度分析。优选地,面板12、面板16的至少一部分彼此平行,在所述部分中,内表面14、内表面18由高度20彼此分开。本方法可以利用具有前述特征的多种不同类型的分析腔室,因此不限于任何特定类型的分析腔室。具有平行的面板12、面板16的分析腔室简化了分析,因此是优选的,但是对于本发明不是必须的,例如,可以使用一个面板设置成相对于另一个面板具有已知的非平行角度的分析腔室。对于人血分析,分析腔室10的高度20通常不大于20微米(20μm)并且不小于2微米(2μm),优选为大约4微米(4μm)。如下面所解释的那样,在这样狭窄高度的分析腔室10中形成的样本薄层提供了成像优势和分析优势。还可以使用包括单个面板的分析腔室,将样本沉积在该单个面板上。
在图1所示的分析腔室10的实施方式中,分析腔室10还由一个或多个侧边界22限定,该侧边界22包含内表面14、内表面18之间的样本的宽展,例如,侧边界22可以由涂覆到内表面14、内表面18中的一者或二者的疏水性涂层形成,或者由在内表面14、内表面18之间延伸的一滴粘性(或其它可成形的)材料形成,或者由阻止样本侧向毛细流动的物理结构形成。一滴粘性材料提供的优点是还将第一面板12附接到第二面板16。侧边界22在本发明中不是必须的。
在一些实施方式中,分析腔室10可以包括分析腔室10内设置在面板12、面板16之间的多个分离器26。分离器26可以是可设置在面板12、面板16之间、并可操作成将面板12、面板16彼此分开的任何结构。分离器26的在面板12、面板16之间延伸的尺寸在本文被称为分离器26的高度。分离器26的高度通常并非彼此精确相等(例如,制造公差),而是在针对类似分析装置中所使用的分隔构件处于商业可接受的公差范围内。球珠是可接受的分离器26的一个示例,并且例如可以从美国印第安纳州的bangslaboratoriesoffishers处商购到。
在一些实施方式中,分离器26可以由比第一面板12和第二面板16中的一者或二者具有更大柔性的材料制成,例如,当样本驻留于分析腔室10中时作用在面板12、面板16上的毛细力引起较大的分离器26压缩到大多数分离器26与面板12、面板16的内表面14、内表面18接触的一个点上,由此使腔室高度20恰好稍小于分离器26的平均直径。在一些实施方式中,分离器26可以由比第一面板12和第二面板16中的一者或二者具有更小柔性的材料制成。例如,第一面板12可以由比分离器26和第二面板16具有更大柔性的材料形成。响应于作用在面板12、面板16上的毛细力,第一面板12将会弯曲并以帐篷状的形式覆盖某些具有超过平均高度的分离器26。在该实施方式中,尽管腔室10的小片局部区域可能偏离预期的腔室高度20,但是腔室10的平均高度20将非常接近于分离器26的平均直径。分析表明,利用该实施方式,在低于4微米(4μm)的腔室高度下,平均的腔室高度20可以控制到1%或更佳。由于上述的柔性特征(以及其它因素,例如分离器的分布密度),分离器26和面板12、面板16可以由各种材料制成,前提是面板12、面板16足够透明。可接受的面板12、面板16的示例是由丙烯酸(acrylic)或聚苯乙烯组成的透明塑料膜,可接受的分离器26是由聚苯乙烯、聚碳酸酯、硅树脂等制成的球珠。可接受的分离器的具体示例是直径为4微米、由聚苯乙烯制成的球体,例如,所述聚苯乙烯可以从美国加利福尼亚州的thermoscientificoffremont商购到,产品目录为no.4204a。可接受的分析腔室10的该示例在美国专利申请no.12/971,860、no.13/341,618和no.13/594,439、以及美国专利no.7,903,241、no.7,929,122和no.7,951,599中被更详细地描述出,其每一者通过引用全部并入于此。
腔室10的高度20可以可替选地被确定为腔室10的制造过程的一部分并且与腔室一起被设置,或者可以利用各种技术来被确定,这些技术包括使用已知相当多数量的合理的着色剂或者使用分析腔室10内设置的几何特征,该几何特征可被用于确定已知区域面积中样本的体积,并因此确定腔室10的高度。这些技术以及其它技术在美国专利no.6,723,290和no.6,929,953中描述。但是,本发明不限于这些技术。
在一些实施方式中,等容成球剂(例如,两性离子清洁剂或相似功能的试剂)可以与样本的至少一部分混合,从而引起rbc中的至少一些rbc呈现基本上球形的几何形状,而其不是通常本质上呈现的两面凹入的盘形。可以将等容成球剂设置在腔室10的一部分或全部中(例如,通过沉积在内表面上),或设置在包括腔室10的盒子中的其它地方。
参照图2,使用分析设备44执行对静态设置在腔室10内的样本的分析,该分析设备44是可操作的,以对样本的至少一部分成像,并对图像执行分析。图像的生成方式允许以每图像单元为基础来确定样本的光学密度。术语“以每单元为基础”或“图像单元”的含意是定义的样本的图像可以被分割的增量单元。像素是图像单元的示例,像素通常被定义为可以在具体成像系统内被单独处理的最小图像元素,图像单元也可以以集合单元的形式包括少量的像素。也可以以线性方式来描述分析设备44的放大倍数(例如,焦平面上的每像素微米),其中线性尺寸是指沿着应用于图像的正交网格的特定轴。因此,焦平面上传感器的像素(或其它图像单元)所捕获的样本的实际面积是分析设备44所应用的放大倍数的函数。因此,分析设备44的放大倍数通常是已知的或是可确定的。因此,与像素关联的体积等于每像素图像的面积乘以已知/可确定的腔室高度20。例如,如果放大倍数是每像素0.5微米,则占据200像素的图像将具有50平方微米的面积以及50平方微米乘以腔室高度20的体积。
可以适于在本方法中使用的分析设备44的具体示例在图2中示出。为了说明目的,在后面描述了该具体的分析设备44,本发明不限于该具体设备。分析设备44包括至少一个样本照明器52、至少一个析像管54以及分析器58(例如,可编程分析器)。样本照明器52包括光源,该光源选择性地产生在波长范围内的特定波长的光线,所述波长范围足够宽广,以用于本文所描述的分析(例如,大约400nm至670nm的范围中的波长;在考虑高度的光线吸收的情况下确定人血样本内血红蛋白的光学密度的过程中,波长为413nm或大约为413nm以及波长为540nm或大约为540nm的光线尤其有效,在前述波长下,所述高度的光线吸收在血红蛋白内发生,这在前述波长下反映为高的摩尔消光系数(ε))。样本照明器52通常包括用于操纵光线的光学器件。在某些优选的实施方式中,光源包括多个发光二极管(light-emittingdiode,led)。根据其性质,led沿着相对窄的光谱辐射面产生光线,其中,峰值强度位于特定波长(即,led的“峰值波长”)。在本发明的那些利用包括多个led的光源的实施方式中,led以不同的峰值波长产生光线,例如,一个led的峰值波长为413nm或大约为413nm,另一个led的峰值波长为540nm或大约为540nm,诸如此类。为了进行下面提供的涉及确定样本的光学密度(od)的成像分析,利用单一波长的光线来确定“样本代表性od值”(下面进行定义),在使用led光源的那些实施方式中,单一波长是正在使用的led的峰值波长。
分析设备44利用透光率产生图像。例如,样本的透光特性可以通过引导来自样本照明器52的光线穿过静态设置在腔室的面板12、面板16之间的样本,然后利用析像管54捕获光线来测量。析像管54是可操作的,以在每图像单元的基础上产生信号,并将这些信号传递给用于进行处理的分析器58。可接受的析像管54的示例是电荷耦合器件(chargecoupledevice,ccd)式图像传感器,其将穿过样本的光线转换成电子数据格式。互补金属氧化物半导体(“cmos”)式图像传感器是可以使用的图像传感器的另一个示例,本发明不限于这些例子中的任何一个示例。
分析器58包括中央处理单元(centralprocessingunit,cpu)并与样本照明器52和析像管54通信。分析器58适于(例如,被编程为)选择性地执行完成本发明的各个方面所需的功能,包括:1)执行计算机程序的指令;2)执行基本的算术函数和/或逻辑函数;以及3)执行分析器的输入操作/输出操作等。例如,分析器58适于将信号发送给样本照明器52和析像管54,并从样本照明器52和析像管54接收信号,选择性地执行操作样本照明器52和析像管54所需的功能,并处理信号(例如,来自析像管54的信号)以完成本文所描述的分析。分析器58不限于与样本照明器52和析像管54进行交互,例如,在图2所示的实施方式中,分析器还适于控制托盘致动设备,该托盘致动设备是可操作的,以使分析腔室10相对于分析设备44的物镜50而移动。本领域技术人员能够调节(例如,编程)分析器58以执行本文所描述的功能,而无需过度的实验。美国专利no.6,866,823和美国专利申请no,13/077,476和no.13/204,415(其每一者通过引用全部并入于此)中描述的分析设备是适于与本方法一起使用的可接受类型的分析设备44的示例。但是,本发明的各个方面不限于使用这些分析设备。应当注意的是,分析器58的功能可以使用硬件、软件、固件或其组合而实现。
分析设备44适于针对样本的成像区域以每图像单元为基础确定与所检测的光信号关联的od值,例如,所述成像区域包括全血样本并且不限于样本内的rbc。所确定的样本的od是样本内血红蛋白浓度、在给定波长下用于血红蛋白的摩尔消光系数(也称为摩尔吸光系数)以及穿过血红蛋白的光路距离的函数,并且所确定的样本的od可以由以下关系式表示:
od=εcl
其中ε=血红蛋白的摩尔消光系数,c=血红蛋白浓度,以及l=穿过面板的内表面14、内表面18之间的样本内的血红蛋白的距离。摩尔消光系数是血红蛋白的固有特性,该固有特性可以通过实验被推导出,或者通过当前可用的经验数据被推导出。
在确定某些基于血红蛋白的参数的过程中,通过分析器58确定od,血红蛋白的摩尔消光系数(ε)是已知的。以每图像单元为基础确定正被分析的静态驻留在分析腔室10内的样本的一个区域(或整体)的od,例如,所述区域包括全血样本并且不限于样本区域内的rbc。如上所述,驻留在分析腔室10内的样本是未裂解且基本上未稀释的。随后由分析器58对已确定每图像单元的od值中的一部分进行统计分析,并确定代表各个图像单元od值的值(例如,平均值),该代表性值在下面称为“样本代表性od值”。确定样本代表性od值所使用的已确定的每图像单元od值的数量可以取决于应用而变化。为了提高精确度,确定样本代表性od值所使用的已确定的每图像单元od值的数量优选是样本分析区域内基本上所有的已确定的每图像单元od值。但是,在一些情况下,可能需要对已确定的每图像单元od值进行“过滤”,以排除异常值或可能对数据的精确度产生负面影响的值。可替选地,在一些应用中,可以利用比所有已确定的每图像单元od值少的值来获得有效数据,这些较少的值可以减少计算要求和计算时间。随后可以相对于经验数据来直接或间接地评估样本代表性od值,以确定基于血红蛋白的参数,例如,样本的血红蛋白浓度。可替选地,随后可以相对于理论模型或分析模型来直接或间接评估的样本代表性od值,所述理论模型或分析模型将光源(例如,led)的功率谱考虑为波长和析像管的响应度的函数,以确定基于血红蛋白的参数,例如,该参数为样本的血红蛋白浓度值。
可以利用样本代表性od值和经验数据确定样本的血红蛋白浓度。例如,分析器58可以适于包括经验数据,该经验数据将od值与血红蛋白浓度关联起来。在一个实施方式中,经验数据可以包括基于之前测试临床上的大量样本的od值和对应的血红蛋白浓度值,例如,样本的数量“n”,其中“n”是整数。例如,基于前述临床上的大量样本可以利用用于确定od值和血红蛋白浓度值的设备/技术而生成经验数据,所述设备/技术是本领域中确定和已知的,用于生成精确数据,例如,所述设备/技术能够生成标准参考值。可以以数种不同的形式来组织对应的“参考”od值和血红蛋白浓度值(例如,经验数据),其然后可以与由分析器58确定的样本代表性od值一起被使用,以确定正在被分析的样本的血红蛋白浓度。例如,经验数据可以以图解法被布置,其中图的y轴表示od值,图的x轴表示血红蛋白浓度值,然后将经验数据标绘为两个轴的函数。可以从标绘数据推导出线性解,其为标绘数据的代表性数据,例如,以“y=mx+b”的格式。在确定经验数据的线性解之后,利用该线性解确定对应于来自正在被分析的样本的样本代表性od值的血红蛋白浓度值。这里所描述的图解法是利用经验数据如何确定特定样本的血红蛋白浓度的示例。但是,本发明不限于该示例。例如,在可替选的方法中,根据经验生成的数据可以被用于创建查找表,该查找表可以被用于确定对应于已确定的样本代表性od值的血红蛋白浓度值。
参照图1至图3,为了说明本方法的各个方面或利用所描述方法的装置,提供了以下用于确定样本的血红蛋白浓度的示例。如上所述,未裂解、基本上未稀释的全血样本被放置在腔室10中,并且随后在成像期间静态驻留在分析腔室10内。在一些情况下,在将样本引入到腔室10之前或在将样本引入到腔室10时,可以将抗凝剂和等容成球剂中的一者或两者与样本混合。
利用分析设备44对静态驻留在腔室10内的未裂解、基本上未稀释的样本的至少一部分进行成像,例如,通过使来自样本照明器52的光线(例如,波长为413nm或大约为413nm的光线)穿过样本,并由析像管54检测这样穿过的光线。如上所述,不要求对驻留在分析腔室10内的整个样本进行成像,但是,例如,对于未裂解、基本上未稀释的全血样本,当腔室10内rbc的分布可能不均匀的情况下,对整个样本进行成像可以是优选的。针对一些或所有的静态驻留在分析腔室10内的样本,分析器58以每图像单元(例如,每像素)为基础确定od值。如上所述,针对样本的一部分以每图像单元为基础确定的od值反映了成像区域中的全血样本,并且不限于前述区域中的rbc,亦即od值不是以细胞为基础而确定的。随后分析器58对已确定的每图像单元od值进行统计分析并确定区域中代表各个图像单元od值的值(例如,平均值),该值在本文中称为“样本代表性od值”。随后相对于经验数据来直接或间接评估样本代表性od值(例如,利用上述线性解或查找表等),以确定样本的血红蛋白浓度值,其中以每分升克(g/dl)为单位来确定腔室10内样本的已知或可确定体积中的所述值。
上述样本的od成像将捕获样本内的所有成分,例如,以正常两面凹入形式的rbc、球化的rbc(如果成球剂被添加到样本中)、白细胞(wbc)、网织红细胞等。在一些实施方式中,分析器58可以适于将某些元素的图像部分从用于确定每图像单元od值的图像中掩盖掉,留下样本的剩余部分以进行分析。例如,对于某些分析,可能需要掩盖归属于wbc的图像部分,和/或那些归属于网织红细胞的图像部分,和/或归属于那些设置在样本内的分离器26的图像部分。如果使用了掩盖,则掩盖的图像之后可以被用于确定每图像单元od值,依次确定样本代表性od值和所需的基于血红蛋白的参数,例如,血红蛋白浓度。如上所述,本发明是可操作的,以按照上述方式确定样本的基于血红蛋白的参数,所述样本具有其本质上两面凹入形式的rbc或球化的rbc或二者皆有,例如,不管rbc与分析腔室10的内表面是否存在接触,本发明的上述方面都是可以操作的。
对于包括第一面板和第二面板的腔室的实施方式,针对人血分析,选择上述不大于20微米(20μm)且不小于2微米(2μm)、优选大约为4微米(4μm)的腔室高度20,以促进对本文所述描述的基于血红蛋白的参数的确定以及对其它参数的确定。前述的腔室高度20将样本层基本上限制为腔室10内成分的单层(特别是在高度为4微米(4μm)时)。在获得od图像时,薄样本层促进了精确成像以及随后的分析,最小化地适应或不需要适应光散射效应或来自任何特定光路内非rbc成分的潜在干扰。因此,简化了分析(例如,不需要操纵图像数据以处理光散射),同时伴随可能更高的精确度。
对本发明的各个方面的以上描述详细讨论了可操作以确定血红蛋白浓度的各个实施方式。本发明不限于该特定方面并且可以用于确定其它基于血红蛋白的参数。例如,本发明的各个方面可以用于确定样本的血细胞比容或用于确定样本的rbc计数。上面通过引用并入的美国专利no.7,903,241和no.7,929,241(“用于利用红细胞内含有的血红蛋白的内在色素沉着确定血液样本的红细胞指标的方法和装置”)描述了用于确定细胞的rbc指标的方法和装置,该rbc指标例如为平均细胞血红蛋白含量(mch)和平均细胞血红蛋白浓度(mchc)。本发明的各个方面可以利用这些根据所述的本发明的各个方面确定样本的基于细胞的值以及血红蛋白浓度(hbg),以确定样本的血细胞比容(hct)或rbc计数。例如,样本的血细胞比容可以确定为如下:
样本的rbc计数可以确定为如下:
这些基于血红蛋白的参数以及用于确定它们的方法说明了利用本发明的各个方面可以得到的信息,但是本发明不限于这些示例。但是,本发明的这些方面还说明了本发明的某些重要优点。例如,本发明具有确定静态驻留在薄腔室10(例如,不大于20微米(20μm)且不小于2微米(2μm))内的未裂解全血样本的基于血红蛋白的参数(例如血红蛋白浓度)的能力,该能力允许对样本进行多次分析,如果样本中的rbc是裂解的,则这将是不可能的,例如,样本内细胞水平的rbc信息仍然是可用的。
如上所述,除了血红蛋白浓度之外,本发明的各个方面还可以用于确定其它基于血红蛋白的参数。例如,对于某些分析,可能需要确定rbc的细胞体积值(例如,各个rbc的体积、rbc的平均细胞体积、红细胞分布宽度(有时称为“rdw”)等)。用于确定rbc的体积的方法在美国专利no.7,903,241(上面通过引用并入)和通过引用全部并入本文的美国专利公开no.2011/0164803中公开。
在专利no.7,903,241中,确定rbc的体积或多个rbc的平均体积的方法包括确定考虑中的rbc的每图像单元od值以及确定多个rbc(例如,统计学上足够多的与腔室10的两个面板12、面板16的内表面14、内表面18接触的rbc)的平均最大od值。通过将rbc内作为血红蛋白的od的函数的rbc的体积进行积分运算,确定rbc的细胞体积。由每个图像单元代表的腔室面积被确定,与该图像单元关联的体积因此等于图像单元的面积乘以已知的腔室高度。可替选地,可以通过将各个rbc划分成不同的体积部分来确定细胞体积:与两个表面都接触的部分(“区域i”)以及不与内表面的两者或甚至一者都接触的部分(“区域ii”)。与内表面接触的细胞部分的体积通过检测所述部分(即,区域i)的od被确定。以每图像单元为基础检测并定义od。如上所述,由每个图像单元代表的腔室面积被确定,并且与该图像单元关联的体积因此等于图像单元的面积乘以已知的腔室高度。与两个表面都接触的rbc部分(即,区域i)的体积因此等于与双面接触区域内每个图像单元关联的体积的总和。可以以相似方式确定不与两个表面都接触的rbc部分(即,区域ii)的体积,例如,确定为基于已确定的图像单元od值的体积百分比。由于血红蛋白的摩尔消光系数(ε)是线性函数,因而区域ii内每个像素的相对od值还代表与该图像单元关联的rbc高度。与区域ii中每个图像单元关联的体积以每图像单元为基础而被确定并求和以确定rbc区域ii中的体积。各个rbc的体积是区域i和区域ii的总和。对于那些不与两个内表面(或者如果腔室只有一个面板)都接触的rbc,可以利用之前获得的与两个内表面都接触的rbc的平均最大光学密度或者利用根据经验确定的数据来确定细胞体积。
专利公开no.2011/0164803描述了一种用于确定血液样本内rbc的细胞体积的方法,该方法基于每图像单元od值曲线进行几何建模。未裂解的全血样本被沉积到分析腔室中,该分析腔室具有第一面板和第二面板,第一面板和第二面板的内表面彼此隔开一定高度。对rbc成像以确定每图像单元od值,并生成代表性图像信号。利用每图像单元od值确定rbc的半径,以及利用已确定的半径确定已成像的红细胞的体积。
不管如何确定各个rbc的体积,都可以通过以下方式来确定样本内rbc的平均细胞体积(“mcv”):利用针对统计学上的大量rbc而确定的各个细胞体积值并对各个细胞体积值进行统计分析,以确定平均值以及平均值的精确度或置信度的度量,例如,可接受的平均值的标准偏差。利用可接受的精确度的测量来确定mcv所需的各个rbc细胞体积值的数量取决于所分析的rbc数量,该rbc数量的范围为从数百个rbc到数千个rbc。
rbc体积、mcv值以及相关的统计信息还可以被用于确定红细胞分布宽度(通常称为“rdw”或“rcdw”)。rdw是rbc的体积变化的统计测量。某些生物失常(例如,缺少维生素b12等)可以引起rdw值上升。在数学上,rdw值可以确定为如下:
rdw=(细胞体积的标准偏差÷mcv)×100
上面描述的用于确定各个rbc体积、mcv、平均mcv和mcv的标准偏差的方法是可接受方法的示例,本发明不限于这些特定技术。
例如,对于如上所述正在被分析的、静态驻留在分析腔室10(或具有单个面板的腔室)内的样本的一个区域(或全部区域),用于以每图像单元(例如,每像素)为基础确定od值的方法包括确定样本代表性od值。前述的每图像单元od值可以被用于确定各个rbc的体积。例如,样本的一个区域的每图像单元od值会在那些只与血浆(即,不是rbc或其它成分)关联的值与那些与被rbc(例如,球化rbc)完全占据的线性路径关联的每图像od值之间改变。通过代表血红蛋白存在的每图像od值以及基于给定rbc检测到的血红蛋白的数量而确定的细胞体积,可以识别各个rbc。mcv值和关联的统计值可以如上述方式来确定,并随后确定rdw。
尽管关于其详细的实施方式而对本发明进行了展示和描述,但是本领域技术人员将理解的是,在不背离本发明的精神和范围的前提下,可以在形式和细节上做出各种改变。
- 还没有人留言评论。精彩留言会获得点赞!