一种螺旋形微通道及其使用方法与串、并联安装结构与流程
本发明属于稀有细胞或颗粒富集筛选领域,涉及一种螺旋形微通道及其使用方法与串、并联安装结构。
背景技术:
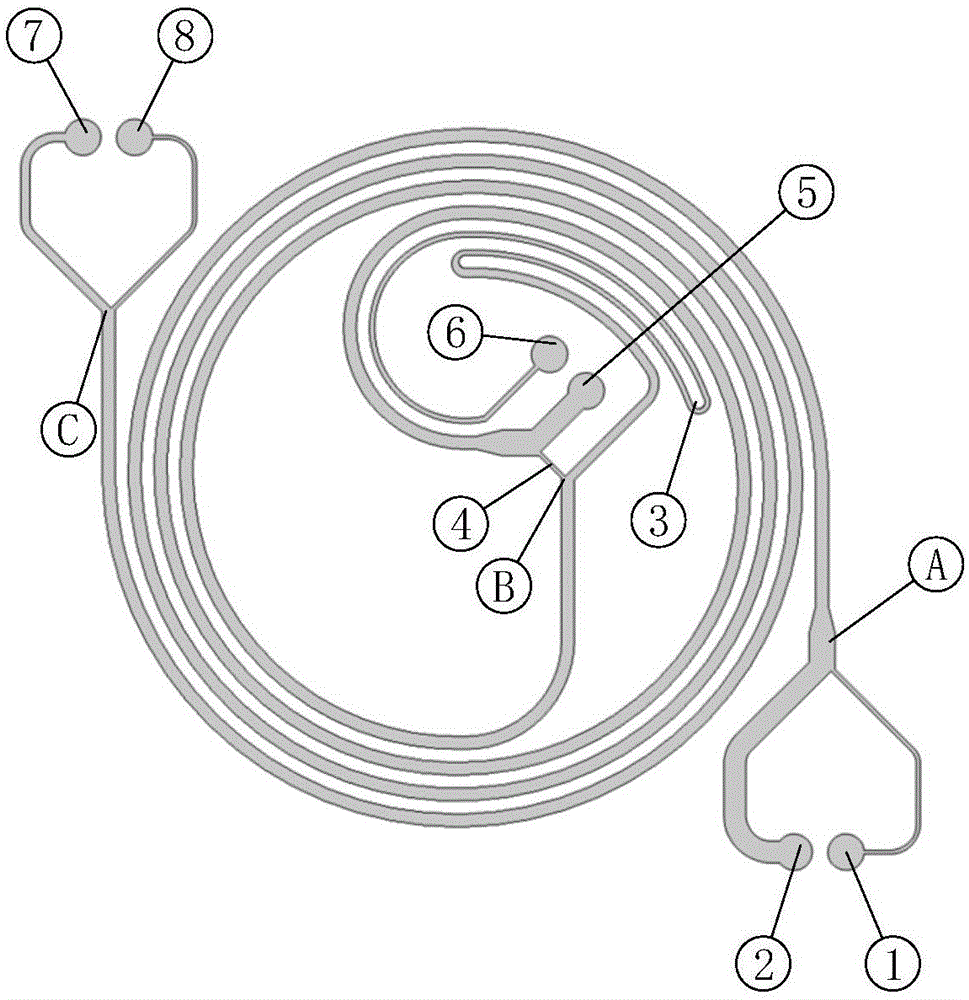
:侵袭和转移是肿瘤患者的主要临床致死原因,肿瘤转移疾病所引起的死亡占实体瘤所致死亡的90%左右,因此,肿瘤转移的早期精准检测显得优为重要。循环肿瘤细胞是指脱离原发和转移肿瘤病灶,侵袭并进入淋巴管、血液等循环系统的肿瘤细胞。循环系统中检测到循环肿瘤细胞提示可能有肿瘤微转移的存在,并有进一步发展成为远处转移的可能性。近年来,许多研究报告已经证实循环肿瘤细胞在肿瘤转移的早期诊断、个体化治疗、探索肿瘤转移机制等方面具有潜在的重要价值。相对于实体瘤的肿瘤组织细胞,外周血循环肿瘤细胞的检测具有可重复检测、取样简单、无创伤等优点,被称为液体活检,在近年来成为肿瘤精准诊断的热点。循环系统中的循环肿瘤细胞不仅有形态学和遗传学异质性,而且十分稀少,即使是晚期肿瘤患者,每毫升全血中的循环肿瘤细胞可仅有1-10个,因此,要实现循环肿瘤细胞的检测,对其进行分选富集是一个必不可少的步骤,并且,循环肿瘤细胞分选富集的优劣将直接影响其后续的检测效果(如:计数、基因扩增、基因测序、细胞培养)。基于惯性微流原理的微流控芯片近年来成为无标记分选富集循环肿瘤细胞的常用方法之一,其主要特点是无需施加任何外力,如电力、磁力,就可以在微通道内实现包括细胞在内的一定尺寸粒子的聚焦流动。按芯片结构特征来划分,基于惯性微流原理的微流控芯片可主要分为直线形微通道、弯弧形微通道、螺旋形微通道等3种,其中,螺旋形微通道是弯弧通道的一种特殊形式。当流体在直线形通道中呈层流状态时,流体的流速呈现一种抛物线状分布:通道中间的流体层速度最大,流体层越靠近通道壁,其流速越低,并且,随着流体层靠近通道壁的距离降低,其流速也按照一定比例降低,离通道壁最近的流体速度最小。伴随这种抛物线状的流速分布产生了一种剪切力梯度,这种剪切力梯度诱导产生的升力会将悬浮在流体中的粒子推向通道壁。当粒子迁移到距离通道壁足够近的位置时,通道壁诱导产生的升力又会将粒子推离通道壁。上述两种方向相反的升力的合力被称为惯性升力fl。惯性升力作用在粒子上,会使粒子在通道横截面中产生相对移动。当粒子移动到横截面的平衡位置,即粒子在横截面这一位置时,受到的惯性升力为零,粒子就会稳定在横截面这一位置,从而使粒子聚焦在横截面中稳定位置,形成聚焦流动,流向下游。粒子在直线形微通道横截面中受力平衡的位置与微通道横截面的形状有关:在圆形横截面的微通道中,粒子会聚焦形成一个环形;在正方形横截面的微通道中,粒子聚焦的位置会减少到四个,分别位于四个面的中间;在矩形横截面的微通道中,当微通道的纵横比较大时,即微通道特别宽或者特别高时,粒子聚焦的位置会减少到两个,分别位于两个较长面的中间。当流体在弯弧形微通道中流动时,情况比直线形微通道中的更复杂。呈抛物线流动的流体在通道中间速度最大。在经过微通道转弯处时,微通道中间的流体因其流速最大而受到的离心力最大,从而流向弯弧形微通道的外侧壁。靠近微通道壁的流体流速最小,所受离心力也最小,从而受到中间高流速流体的挤压。为了保持流体中各处质量守恒,在垂直于流体流动的方向上,形成一对反向旋转且对称的涡流,分别位于微通道横截面的上部和下部,由此产生一种被称作迪恩涡流的二次流。迪恩涡流会对流体中的颗粒产生曳力作用,被称为迪恩曳力fd。因此在弯弧形微通道中,流动的粒子会同时受到惯性升力和迪恩曳力的作用,这两种力的相对大小决定粒子在弯弧形通道中流动的聚焦流动情况。微通道螺旋形微通道是一种特殊的弯弧形微通道,它既具有弯弧形微通道的上述聚焦流动的特性,也具有自身的独有特征,因此,相对于上述的直线形和弯弧形微通道,螺旋形微通道在惯性微流芯片中具有独特的应用优势。在螺旋形微通道中层流流体的惯性迁移力和迪恩曳力共同作用下,粒子在管道内侧壁和外侧壁之间来回移动并形成迪恩涡流。上述横向迁移被称之为迪恩周期:当一个最初在外侧壁的粒子经过一定长度的微通道横向移动至内侧壁时,被称之为完成了0.5个迪恩周期;当此相同粒子再经过一定长度的下游微通道返回至初始的外侧壁时,被称之为完成了一个完整的迪恩周期,或者说,完成了1个迪恩周期。如上所述,除了迪恩曳力外,较大的粒子(特别是其直径达到a/h≥0.07)还会同时受到惯性升力的作用,从而使粒子的聚焦位置极度依赖于惯性升力与迪恩曳力的比值(fl/fd),上述比值与粒子的尺寸呈指数关系,粒子的聚焦主要依赖于最小的微通道尺度参数(如螺旋形微通道的高度h)。较大的粒子(即:a/h≥0.07),迪恩曳力和惯性升力处于一个平衡状态,会经过一定长度的微通道后聚焦于螺旋形通道的内侧壁,并在下游的微通道中始终保持在微通道的内侧壁;而较小粒子(即:a/h<0.07),其迪恩曳力占优势,粒子以迪恩涡流形式不断地在微通道内的外侧壁和内侧壁之间来回横移。在螺旋形微通道中,可通过在微通道的外侧壁部分设计粒子入口,在微通道的内侧壁部分设计鞘液入口。在此条件下,具有较高速度的鞘液流体会将粒子流挤压至微通道的外侧壁;当粒子在微通道中流动时,所有初始状态(即入口处)的粒子在迪恩曳力的作用下,由外侧壁经0.5个迪恩周期的微通道长度移动至内侧壁;当到达近内侧壁后,较大的粒子(即:a/h≥0.07)因受到强烈的惯性升力而强力聚焦于内侧壁,并进一步在迪恩曳力的作用下阻止其进一步向微通道的外侧壁移动,因此,在上述惯性升力和迪恩曳力达到某个平衡点的时候,较大的粒子始终聚焦在微通道的内侧壁,并在后续的下游微通道中始终保持在微通道内侧壁的聚焦流;但是,经0.5个迪恩周期移动到内侧壁的较小粒子(即:a/h<0.07)受到的惯性升力的小,主要承受的是迪恩曳力,因此,会在迪恩涡流的作用下在下游微通道中经1个迪恩周期长度的微通道横向迁移动至外侧壁,若下游的微通道足够长,则较小粒子以迪恩涡流形式在微通道壁的外侧壁和内侧壁来回横向迁移。可见,较大粒子始终在螺旋形微通道的内侧壁呈惯性聚焦流束,而较小粒子则以迪恩涡流形式在微通道的外侧壁和内侧壁来回横向迁移。当设计特定长度的螺旋形微通道,其出口处正好使较小的粒子位于或接近于外侧壁,就可通过适当的出口将较大粒子与较小粒子分离,实现特定尺寸粒子的富集。螺旋形微通道的上述特性被广泛应用于恶性肿瘤患者外周血循环肿瘤细胞的分选富集。其主要原理在于:相对于外周血中的红细胞(直径约为6-8μm)和白细胞(直径约为8-12μm),循环肿瘤细胞(直径约为20-30μm)的尺寸更大,通过限定纵横比的矩形横截面,在特定流体流速条件下,外周血循环肿瘤细胞将沿着螺旋形微通道的内侧壁聚焦层流至细胞出口,样本中的其余细胞则沿着所述通道的外侧壁层流至废液出口,从而实现循环肿瘤细胞的分离。同时,还可通过进一步设计多个出口,使具有不同尺寸的细胞自各个特定出口分流富集。相对于直线型和弯弧形惯性微流芯片,螺旋形惯性微流芯片在分选富集循环肿瘤细胞领域具有独特的优势,并主要表现在能够快速地处理全血样本,达到3ml/min的速度。但是,现有的螺旋形惯性微流芯片主要是单通道形式的单螺旋形微通道惯性微流芯片其主要弊端是所获得的循环肿瘤细胞纯度低,从而导致循环肿瘤细胞的后续鉴别和临床实际应用存在较大的困难,其实际临床应用价值较低。尽管现有的螺旋形微通道在分选富集循环肿瘤细胞方面仍然存在较大的不足和相关的技术瓶颈,但是,已有的研究结果提示,如果能够巧妙地“级联”应用多个单个螺旋形微通道,就能在确保良好捕获效率和处理通量的前提条件下,极大地提高的分选富集到的细胞混合液中循环肿瘤细胞纯度,使其满足临床的实际需求。技术实现要素:有鉴于此,本发明的目的在于提供一种螺旋形微通道及其使用方法与串、并联安装结构。为达到上述目的,本发明提供如下技术方案:一种螺旋形微通道,用于分选富集稀有细胞或颗粒,包括n个单螺旋形微通道,单个的单螺旋形微通道包括入口、与入口密封连接的微通道以及与通道远离入口的一端密封连接的出口,所述的入口由细胞入口及鞘液入口汇聚而成,所述的出口由废液出口及细胞出口汇聚而成;第(m-1)个单螺旋形微通道的细胞出口与第m个单螺旋形微通道的细胞入口密封连接成第(m-1)个分级循环点,由第(m-1)个单螺旋形微通道的废液出口、第m个单螺旋形微通道的鞘液入口以及第(m-1)个分级循环点构成第(m-1)个分级循环处;在第(m-1)个分级循环处内的第(m-1)个单螺旋形微通道的废液出口设有压力平衡模块,第m个单螺旋形微通道的细胞入口的液体流速为v1,第(m-1)个单螺旋形微通道的细胞入口的液体流速为v2;第m个单螺旋形微通道的细胞出口的液体流速为v3,第(m-1)个单螺旋形微通道的细胞出口的液体流速为v4;第m个单螺旋形微通道的废液出口的液体流速为v5,第(m-1)个单螺旋形微通道的废液出口的液体流速为v6;该压力平衡模块用于使第m个单螺旋形微通道的细胞入口的液体流动方向和第(m-1)个单螺旋形微通道的细胞入口的液体流动方向一致,且0.7*v2≤v1≤1.3*v2;使第m个单螺旋形微通道的细胞出口的液体流动方向和第(m-1)个单螺旋形微通道的细胞出口的液体流动方向一致,且0.7*v4≤v3≤1.3*v4,且v1=v4;使第m个单螺旋形微通道的废液出口的液体流动方向和第(m-1)个单螺旋形微通道的废液出口的液体流动方向一致,且0.7*v6≤v5≤1.3*v6;所述的n个单螺旋形微通道形成互不交叉的螺旋形微通道;其中,第一个单螺旋形微通道的细胞入口用于进入含稀有细胞或颗粒的样本液体;第n个单螺旋形微通道的细胞出口用于收集分选富集后的稀有细胞或颗粒;所述鞘液入口用于添加带有渗透压,保证稀有细胞或颗粒完整的稀释液;1<m≤n,m、n为正整数。可选地,所述压力平衡模块为设置在第(m-1)个分级循环处内的第(m-1)个单螺旋形微通道的废液出口处且与该废液出口密封连接的压力平衡微通道;所述压力平衡微通道设有(n-1)个。可选地,所述压力平衡微通道与n个单螺旋形微通道设置在同一平面内。可选地,所述压力平衡模块为设置在第(m-1)个分级循环处内的第(m-1)个单螺旋形微通道的废液出口处的压力泵。可选地,第一个单螺旋形微通道的入口及第n个单螺旋形微通道的出口位于螺旋形微通道几何形状的外侧。可选地,所述的螺旋形微通道由n个单螺旋形微通道形成相互平行的环状。可选地,所述的螺旋形微通道之间的单螺旋形微通道和与之相邻且平行的单螺旋形微通道之间的水平距离为0.1~1000μm。可选地,单个的单螺旋形微通道的截面为矩形或梯形。可选地,所述的单螺旋形微通道的截面为矩形,该矩形的宽度w与高度h的比值w/h=1.2~10。可选地,所述的单螺旋形微通道的截面为梯形,所述该梯形靠近螺旋形微通道的几何中心的一侧高度低于该梯形远离螺旋形微通道的几何中心的一侧高度。可选地,微通道的宽度w为0.1-1000μm,高度为0.1-800μm。可选地,n=2,所述的螺旋形微通道由第一个单螺旋形微通道及第二个单螺旋形微通道组成。可选地,单个的单螺旋形微通道的入口及该单螺旋形微通道的出口之间的距离为非靶细胞或非靶颗粒流体力学特征的1.7-2.0个迪恩周期,或者,2.7-3.0个迪恩周期,或者,3.7-4.0个迪恩周期,或者,4.7-5.0个迪恩周期,或者,5.7-6.0个迪恩周期,或者,6.7-7.0个迪恩周期,或者,7.7-8.0个迪恩周期,或者,8.7-9.0个迪恩周期,或者,9.7-10.0个迪恩周期。可选地,所述单螺旋形微通道的通道截面宽度最大处宽度为l1,该单螺旋形微通道的细胞入口和/或细胞出口的宽度为l2,0.1*l1≤l2≤0.4*l1;该单螺旋形微通道的鞘液入口和/或废液出口的宽度为l3,0.1*l1≤l3≤0.9*l1。可选地,n=4,所述的螺旋形微通道由第一个单螺旋形微通道、第二个单螺旋形微通道、第三个单螺旋形微通道、以及第四个单螺旋形微通道组成。可选地,所述稀有细胞或颗粒的直径为a,所述微通道的高度为h,0.07≤a/h≤0.5。可选地,所述稀有细胞或颗粒为循环肿瘤细胞、循环祖细胞、循环胎儿细胞、细胞囊泡、外泌体或病原体。可选地,还包括用于对该螺旋形通道所分选富集到的稀有细胞或颗粒进行鉴定和/或计数的检测单元;所述检测单元设置在第n个单螺旋形微通道的细胞出口处。可选地,所述检测单元通过特定技术手段进行稀有细胞或颗粒的性状鉴定;所述的特定技术手段选自由生物光学、生物电学、生物声学、生物磁学及其任意组合组成的组。可选地,所述检测单元通过对特定特征的检测进行稀有细胞或颗粒性状的识别,所述的特定特征选自由稀有细胞或颗粒的太赫兹波谱、拉曼光谱、阻抗、差分阻抗及其任意组合组成的组。可选地,(n-1)个所述的压力平衡微通道与n个单螺旋形微通道形成互不交叉的螺旋形微通道,一个或多个压力平衡微通道的出口设置在螺旋形微通道的几何图形外部,通过调整第(m-1)个压力平衡微通道的长度与内径来调整第(m-1)个细胞出口内通过内容物的流速。可选地,(n-1)个所述的压力平衡微通道的出口均设置在螺旋形微通道的几何图形外部。可选地,n个所述细胞出口中的一个或多个设置在螺旋形微通道的几何图形外部。可选地,所有细胞出口均设置在螺旋形微通道的几何图形外部。可选地,n个入口中的一个或多个设置在螺旋形微通道的几何图形外部。可选地,所有细胞入口均设置在螺旋形微通道的几何图形外部。可选地,所有鞘液入口均设置在螺旋形微通道的几何图形外部。一种螺旋形微通道的使用方法,包括以下步骤:s1:将样本液体从第一个单螺旋形微通道的细胞入口导入,将稀释液从第一个单螺旋形微通道的鞘液入口至第n个单螺旋形微通道的鞘液入口导入;s2:在第n个单螺旋形微通道的细胞出口收集富含稀有细胞或颗粒的流体;在第一个单螺旋形微通道的废液出口至第n个单螺旋形微通道的废液出口排出废液。可选地,步骤s1中采用的样本液体为具有一定红细胞比积的的血液样本,或通过溶血方式去除大量红细胞的血液样本;所述血液样本中的红细胞比积为0%~70%。可选地,步骤s1中采用的稀释液具有一定渗透压,用于保护血细胞完整性,为磷酸盐缓冲液、培养血清或生理盐水。可选地,还包括步骤s1.1;s1.1:调整压力平衡模块,使所述第m个单螺旋形微通道的细胞入口的液体流动方向和第(m-1)个单螺旋形微通道的细胞入口的液体流动方向一致,且0.7*v2≤v1≤1.3*v2;使第m个单螺旋形微通道的细胞出口的液体流动方向和第(m-1)个单螺旋形微通道的细胞出口的液体流动方向一致,且0.7*v4≤v3≤1.3*v4,且v1=v4;使第m个单螺旋形微通道的废液出口的液体流动方向和第(m-1)个单螺旋形微通道的废液出口的液体流动方向一致,且0.7*v6≤v5≤1.3*v6。一种螺旋形微通道的串联安装结构,其特征在于,采用p个螺旋形微通道串联设置的方式,第(q-1)个螺旋形微通道的第n个单螺旋形微通道的细胞出口与第q个螺旋形微通道的第一个单螺旋形微通道入口相连接,形成螺旋形微通道串联安装处,1<q≤p。可选地,在螺旋形微通道串联安装处的第(q-1)个螺旋形微通道的第n个单螺旋形微通道的废液出口处也设有压力平衡模块。可选地,所述压力平衡模块为与螺旋形微通道串联安装处的第(q-1)个螺旋形微通道的第n个单螺旋形微通道的废液出口密封连接的压力平衡微通道。可选地,所述的压力平衡微通道和与其相匹配的螺旋形微通道形成互不交叉的螺旋形微通道,一个或多个压力平衡微通道的出口设置在螺旋形微通道的几何图形外部,通过调整压力平衡微通道的长度与内径来调整与其相匹配的细胞出口内通过内容物的流速。可选地,所有压力平衡微通道的出口均设置在螺旋形微通道的几何图形外部。可选地,所述细胞出口中的一个或多个设置在螺旋形微通道的几何图形外部。可选地,所有细胞出口均设置在螺旋形微通道的几何图形外部。可选地,所述入口中的一个或多个设置在螺旋形微通道的几何图形外部。可选地,所有细胞入口均设置在螺旋形微通道的几何图形外部。可选地,所有鞘液入口均设置在螺旋形微通道的几何图形外部。可选地,所述压力平衡模块为设置在螺旋形微通道串联安装处的第(q-1)个螺旋形微通道的第n个单螺旋形微通道的废液出口处的压力泵。可选地,n=2,所述螺旋形微通道为双螺旋形微通道。可选地,p=2,采用2个螺旋形微通道串联设置的方式,第一个螺旋形微通道的第n个单螺旋形微通道的细胞出口与第二个螺旋形微通道的第一个单螺旋形微通道入口相连接。一种螺旋形微通道的并联安装结构,采用x个螺旋形微通道并联设置的方式,样本溶液从x个螺旋形微通道的第一个单螺旋形微通道的细胞入口进入,稀有细胞或颗粒从x个螺旋形微通道的第n个单螺旋形微通道的细胞出口流出;x>1。可选地,将x个螺旋形微通道的第一个单螺旋形微通道的细胞入口相互连通。可选地,将x个螺旋形微通道的第n个单螺旋形微通道的细胞出口相互连通。可选地,所述的x个螺旋形微通道设置在同一平面内。可选地,所述的x个螺旋形微通道同心设置在同一平面内。可选地,所述的x个螺旋形微通道同心且沿垂直于单个螺旋形微通道所在平面的方向设置。可选地,x=2,采用两个螺旋形微通道并联设置的方式,样本溶液从两个螺旋形微通道的第一个单螺旋形微通道的细胞入口进入,稀有细胞或颗粒从两个螺旋形微通道的第n个单螺旋形微通道的细胞出口流出。可选地,n=2,采用x个双螺旋形微通道并联设置的方式,样本溶液从x个双螺旋形微通道的第一个单螺旋形微通道的细胞入口进入,稀有细胞或颗粒从x个双螺旋形微通道的第二个单螺旋形微通道的细胞出口流出。可选地,在螺旋形微通道中的第x个螺旋形微通道的第n个单螺旋形微通道的废液出口处设有压力平衡模块。可选地,所述压力平衡模块为压力泵。可选地,所述压力平衡模块为压力平衡微通道。可选地,所述的压力平衡微通道和与其相匹配的螺旋形微通道形成互不交叉的螺旋形微通道,一个或多个压力平衡微通道的出口设置在螺旋形微通道的几何图形外部,通过调整压力平衡微通道的长度与内径来调整与其相匹配的细胞出口内通过内容物的流速。可选地,所有压力平衡微通道的出口均设置在螺旋形微通道的几何图形外部。可选地,所述细胞出口中的一个或多个设置在螺旋形微通道的几何图形外部。可选地,所有细胞出口均设置在螺旋形微通道的几何图形外部。可选地,所述入口中的一个或多个设置在螺旋形微通道的几何图形外部。可选地,所有细胞入口均设置在螺旋形微通道的几何图形外部。可选地,所有鞘液入口均设置在螺旋形微通道的几何图形外部。一种螺旋形微通道道的组合连接安装结构,包括k个微通道单体,所述微通道单体为权利要求1~27任一项中所述的螺旋形微通道;所述微通道单体采用串联、并联、多次串联、多次并联、或串并联组合的连接形式相互组合,其中k为正整数且k≥2;串联的连接形式为将第(k-1)个微通道单体的第n个细胞出口与第k个微通道单体的第一个细胞入口密封连接,组成串联式螺旋形微通道;并联的连接形式为将第(k-1)个微通道单体的第一个细胞入口与第k个微通道单体的第一个细胞入口密封连接汇聚组合成统一的细胞入口;将第(k-1)个微通道单体的第一个鞘液入口与第k个微通道单体的第一个鞘液入口密封连接汇聚组合成统一的鞘液入口,组成并联式螺旋形微通道。可选地,多次串联的连接形式为将多个串联式螺旋形微通道以串联的连接形式相互组合;或将串联式螺旋形微通道与微通道单体以串联的连接形式相互组合。可选地,并联的连接形式还包括将第(k-1)个微通道单体的第n个细胞出口与第k个微通道单体的第n个细胞出口密封连接汇聚组合成统一的细胞出口;将第(k-1)个微通道单体的第n个废液出口与第k个微通道单体的第n个废液出口密封连接汇聚组合成统一的废液出口。可选地,多次并联的连接形式为将多个并联式螺旋形微通道以并联的连接形式相互组合;或将并联式螺旋形微通道与微通道单体以并联的形式相互组合。可选地,串并联组合的连接形式为将一个或多个并联式螺旋形微通道和/或一个或多个串联式螺旋形微通道和/或一个或多个微通道单体以串联的连接形式或并联的连接形式相互组合,形成混联式螺旋形流道。一种单螺旋形微通道,包括入口、与入口密封连接的微通道以及与通道远离入口的一端密封连接的出口,所述的入口由细胞入口及鞘液入口汇聚而成,所述的出口由废液出口及细胞出口汇聚而成,其中,细胞入口用于进入含稀有细胞或颗粒的样本液体;细胞出口用于收集分选富集后的稀有细胞或颗粒;鞘液入口用于添加带有渗透压,保证稀有细胞或颗粒完整的稀释液。可选地,所述细胞入口和/或鞘液入口和/或废液出口和/或细胞出口设置在微通道的几何外形外侧。一种单螺旋形微通道的串联安装结构,采用p个单螺旋形微通道串联设置的方式,第(q-1)个单螺旋形微通道的细胞出口与第q个单螺旋形微通道的细胞入口相连接,1<q≤p。可选地,第(q-1)个单螺旋形微通道的废液出口处设有压力平衡模块。可选地,所述压力平衡模块为压力泵或压力平衡微通道。可选地,所述压力平衡模块为与第(q-1)单个螺旋形微通道的废液出口密封连接的压力平衡微通道。可选地,所述的压力平衡微通道和与其相匹配的所有单螺旋形微通道形成互不交叉的螺旋形微通道,一个或多个压力平衡微通道的出口设置在螺旋形微通道的几何图形外部,通过调整压力平衡微通道的长度与内径来调整与其相匹配的细胞出口内通过内容物的流速。可选地,所有压力平衡微通道的出口均设置在螺旋形微通道的几何图形外部。可选地,所述细胞入口和/或鞘液入口和/或废液出口和/或细胞出口设置在螺旋形微通道的几何外形外侧。一种单螺旋形微通道的并联安装结构,采用x个单螺旋形微通道并联设置的方式,样本溶液从x个单螺旋形微通道的细胞入口进入,稀有细胞或颗粒从x个单螺旋形微通道的细胞出口流出;x>1。可选地,将x个单螺旋形微通道的细胞入口和/或细胞出口相互连通。可选地,在第x个单螺旋形微通道的废液出口处设有压力平衡模块;所述压力平衡模块为压力泵或压力平衡微通道。可选地,所述的压力平衡微通道和与其相匹配的单螺旋形微通道形成互不交叉的螺旋形微通道,一个或多个压力平衡微通道的出口设置在螺旋形微通道的几何图形外部,通过调整压力平衡微通道的长度与内径来调整与其相匹配的细胞出口内通过内容物的流速。可选地,所有细胞入口和/或鞘液入口和/或废液出口和/或细胞出口设置在微通道的几何外形外侧。可选地,所有细胞入口和/或鞘液入口均设置在螺旋形微通道的几何图形外部。本发明的有益效果在于:本发明针对螺旋形微通道在恶性肿瘤患者外周血循环肿瘤细胞的分选富集领域的技术难题,开发更简单有效的技术,巧妙地设计出了合理级联应用多个螺旋形微通道的串联及并联式螺旋形微通道惯性分离结构,实现了在单张螺旋形惯性微流芯片上的级联叠加式分级富集和/或纯化循环肿瘤细胞。相对于现有的同类技术,本发明对分选富集和/或外周血循环肿瘤细胞,不仅具有良好的循环肿瘤细胞的捕获效率和处理通量,同时,也可以最大化循环肿瘤细胞的纯度,最小化循环肿瘤细胞的损失,并维持循环肿瘤细胞的原始表型,极大地降低检测成本,缩短了处理时间和流程,所获得的含有高纯度循环肿瘤细胞的细胞悬液特别适宜于后续的生物医学检测、遗传学分析、细胞培养、异种移植瘤制备等,具有广泛而深远的临床实际应用价值。本发明的其他优点、目标和特征在某种程度上将在随后的说明书中进行阐述,并且在某种程度上,基于对下文的考察研究对本领域技术人员而言将是显而易见的,或者可以从本发明的实践中得到教导。本发明的目标和其他优点可以通过下面的说明书来实现和获得。附图说明为了使本发明的目的、技术方案和优点更加清楚,下面将结合附图对本发明作优选的详细描述,其中:图1为本发明中实施例一的结构示意图;图2为本发明中实施例二的结构示意图;图3为本发明中实施例三的结构示意图;图4为本发明中实施例四的结构示意图;图5为本发明中实施例五的结构示意图;图6为本发明中实施例六的结构示意图;图7为本发明中实施例七的结构示意图;图8为本发明的实施例一中不同尺寸的颗粒在不同流速下的运动轨迹图;图8a为流速为150μl/min的不同尺寸的颗粒在实施例一中的运动轨迹;图8b为流速为300μl/min的不同尺寸的颗粒在实施例一中的运动轨迹;图8c为流速为450μl/min的不同尺寸的颗粒在实施例一中的运动轨迹;图8d为流速为600μl/min的不同尺寸的颗粒在实施例一中的运动轨迹;图8e为流速为750μl/min的不同尺寸的颗粒在实施例一中的运动轨迹;图8f为流速为900μl/min的不同尺寸的颗粒在实施例一中的运动轨迹;图9为本发明的实施例一中不同螺旋形微通道出口处的显微镜图片;图9a为传统的单螺旋形微通道细胞出口处的显微图片;图9b为本发明所述双螺旋形微通道细胞出口处的显微图片;图9c为本发明所述双螺旋形微通道废液出口7处的显微图片;图10为本发明的实施例一中螺旋形微通道中流体流动速度标注;图11为传统的单螺旋形微通道;图12为本发明中实施例八的结构示意图;图13为本发明中实施例九的结构示意图;图14为本发明中实施例十的结构示意图;图15为本发明中实施例十一的结构示意图;图16为本发明中实施例十二的结构示意图;图17为本发明中实施例十三的结构示意图;图18为本发明中实施例十四的结构示意图;图19为本发明中实施例十五的结构示意图;图20为本发明中实施例十六的结构示意图;图21为本发明中实施例十七的结构示意图;图22为本发明中实施例十八的结构示意图;图23为本发明中实施例八的仿真结果,表示不同流速下聚苯乙烯微球的运动轨迹;图23a中流速为200ul/min;图23b中流速为350ul/min;图23c中流速为500ul/min;图23d中流速为650ul/min;图23e中流速为800ul/min;图23f中流速为950ul/min;图24为本发明中实施例八与实施例十四的仿真结果对比图;图24a表示实施例八中第二个单螺旋形微通道的细胞出口处的富集情况;图24b表示图11所示传统的单螺旋形微通道的细胞出口处的富集情况;图24c表示实施例八中第一个单螺旋形微通道的细胞出口处的富集情况;图24d表示图11所示传统的单螺旋形微通道的废液出口处的富集情况;图24e表示实施例八中第二个单螺旋形微通道的废液出口处的富集情况;图25表示实施例八中第二个单螺旋形微通道的废液出口及细胞出口处收集到的细胞的免疫荧光染色结果;图25a为第二个单螺旋形微通道的废液出口处收集到的细胞在光镜40倍下的细胞形态;图25b为双螺旋芯片分选富集到的白细胞dapi荧光染色结果;图25c为双螺旋芯片分选富集到的白细胞cd45抗体荧光染色结果;图25d为双螺旋芯片分选富集到的白细胞荧光染色merge结果;图25e为第二个单螺旋形微通道的细胞出口处收集到的细胞在光镜40倍下的细胞形态;图25f为双螺旋芯片分选富集到的sw480dapi荧光染色结果图25g为双螺旋芯片分选富集到的sw480epcam荧光染色结果图25h为双螺旋芯片分选富集到的sw480荧光染色merge结果;图26为双螺旋芯片对肿瘤细胞的捕获效率的分析结果;图26a为双螺旋芯片对全血样本中不同浓度肿瘤细胞回收情况;图26b为双螺旋芯片对不同肿瘤细胞捕获效率直方图。具体实施方式以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。需要说明的是,以下实施例中所提供的图示仅以示意方式说明本发明的基本构想,在不冲突的情况下,以下实施例及实施例中的特征可以相互组合。请参阅图1-图26附图中的元件标号分别表示:第一个单螺旋形微通道的细胞入口1、第一个单螺旋形微通道的鞘液入口2、第一个单螺旋形微通道的入口a、压力平衡微通道3、第一个单螺旋形微通道的细胞出口4、第二个单螺旋形微通道的鞘液入口5、第一个单螺旋形微通道的废液出口6、第一个单螺旋形微通道的出口b、第二个单螺旋形微通道的废液出口7、第二个单螺旋形微通道的细胞出口8、第二个单螺旋形微通道的出口c、第二个螺旋形微通道中的第一个单螺旋形微通道的鞘液入口9、第二个螺旋形微通道的第一个单螺旋形微通道的废液出口10、第二个螺旋形微通道的第二个单螺旋形微通道的鞘液入口11、第二个螺旋形微通道的第二个单螺旋形微通道的细胞出口12、第二个螺旋形微通道的第二个单螺旋形微通道的废液出口13、第二个螺旋形微通道的第一个单螺旋形微通道的细胞入口14、第三个单螺旋形微通道的鞘液入口15、第三个单螺旋形微通道的废液出口16、第四个单螺旋形微通道的鞘液入口17、第四个单螺旋形微通道的细胞出口18、第四个单螺旋形微通道的废液出口19。实施例一本发明涉及一种螺旋形微通道,用于分选富集稀有细胞或颗粒,在本实施例中包括两个单螺旋形微通道,该两个单螺旋形微通道设置在同一平面内且互不交叉地缠绕成环状,如图1所示。单个的单螺旋形微通道包括入口a、与入口密封连接的微通道以及与通道远离入口的一端密封连接的出口b,所述的入口由细胞入口1及鞘液入口2汇聚而成,所述的出口b由废液出口6及细胞出口4汇聚而成;第一个单螺旋形微通道的细胞出口4与第二个单螺旋形微通道的细胞入口密封连接成第一个分级循环点,由第一个单螺旋形微通道的废液出口6、第二个单螺旋形微通道的鞘液入口5以及第一个分级循环点构成第一个分级循环处;在第一个分级循环处内的第一个单螺旋形微通道的废液出口6设有压力平衡微通道3,第二个单螺旋形微通道的细胞入口的液体流速为v1,第一个单螺旋形微通道的细胞入口1的液体流速为v2;第二个单螺旋形微通道的细胞出口8的液体流速为v3,第一个单螺旋形微通道的细胞出口4的液体流速为v4;第二个单螺旋形微通道的废液出口7的液体流速为v5,第一个单螺旋形微通道的废液出口6的液体流速为v6;该压力平衡微通道用于使第二个单螺旋形微通道的细胞入口的液体流动方向和第一个单螺旋形微通道的细胞入口1的液体流动方向一致,且0.7*v2≤v1≤1.3*v2;使第二个单螺旋形微通道的细胞出口8的液体流动方向和第一个单螺旋形微通道的细胞出口4的液体流动方向一致,且0.7*v4≤v3≤1.3*v4,且v1=v4;使第二个单螺旋形微通道的废液出口7的液体流动方向和第一个单螺旋形微通道的废液出口6的液体流动方向一致,且0.7*v6≤v5≤1.3*v6;其中,第一个单螺旋形微通道的细胞入口1用于进入含稀有细胞或颗粒的样本液体;第二个单螺旋形微通道的细胞出口8用于收集分选富集后的稀有细胞或颗粒;所述第一个单螺旋形微通道的鞘液入口2以及第二个单螺旋形微通道的鞘液入口5用于添加带有渗透压,保证稀有细胞或颗粒完整性和生物学活性的稀释液。采用两个单螺旋形微通道的形式,第二个单螺旋形微通道能够直接对第一个单螺旋形微通道分选富集到的稀有细胞或颗粒进行进一步的分选富集,从而比单个的单螺旋形微通道捕获稀有细胞或颗粒的效率更高,相当于对稀有细胞或颗粒进行了两次分选富集和纯化,其对靶细胞的捕获效率、吞吐量、细胞纯度、细胞活性等四项参数均优于单螺旋形微通道。本发明所述双螺旋形微通道由第一个单螺旋形微通道和第二个单螺旋形微通道经首尾直接连接方式构成一个外观为平行且具有相同圆心点的双螺旋形微通道的整体几何结构,其特征是双螺旋形微通道的第一个单螺旋形微通道的入口a与第二个单螺旋形微通道的出口均位于微通道主体几何结构的外侧。本发明所述双螺旋形微通道的每个单螺旋形微通道均有细胞入口1、鞘液入口2、细胞出口4和废液出口6,其中,细胞入口4和鞘液入口2汇聚成每个单螺旋形微通道的入口a,细胞出口4和废液出口6汇聚成每个单螺旋形微通道的出口b。细胞入口1通常位于既定单螺旋形微通道入口的外侧壁部分,鞘液入口2通常位于既定单螺旋形微通道入口的内侧壁部分;细胞出口4通常位于既定单螺旋形微通道出口的内侧壁部分,废液出口6通常位于既定单螺旋形微通道出口的外侧壁部分。本发明所述双螺旋形微通道的两个单螺旋形微通道具有相同或相近的限定纵横比的矩形横载面,也可为内侧壁高度低于外侧壁高度的梯形截面,用于因靶细胞与非靶细胞存在的尺寸差异而仅使靶细胞在微通道内侧壁形成聚焦流,非靶细胞则以迪恩涡流方式在微通道内侧壁和外侧壁之间来回横向迁移。更进一步,微通道的宽度是0.1-1000μm,深度是0.1-800μm,或更进一步,微通道的宽度是100-800μm,深度是50-500μm,或更进一步,微通道的宽度是600μm,深度是140-180μm。本发明所述双螺旋形微通道的两个单螺旋形微通道具有相同或相近的长度,其特征是第1个和第2个单螺旋形微通道的螺旋形微通道起始点至终点的长度是非靶细胞流体力学特征的1.7-2.0个迪恩周期,或者,2.7-3.0个迪恩周期,或者,3.7-4.0个迪恩周期,或者,4.7-5.0个迪恩周期,或者,5.7-6.0个迪恩周期,或者,6.7-7.0个迪恩周期,或者,7.7-8.0个迪恩周期,或者,8.7-9.0个迪恩周期,或者,9.7-10.0个迪恩周期。在此条件下,在第一个和第二个单螺旋形微通道的终点处,非靶细胞沿迪恩涡流迁移至螺旋形微通道的外侧壁部分。本发明所述双螺旋形微通道的第一个单螺旋形微通道的废液出口有压力平衡微通道3,本发明所上述的压力平衡微通道3的尺寸与外形无特殊要求,对其纵横比、曲率半径、宽度、高度和长度均无特殊要求,其作用是平衡第一个单螺旋形微通道的细胞出口1的压力,使第二个单螺旋形微通道的细胞入口或者第一个单螺旋形微通道的细胞出口4的流速与方向与第一个单螺旋形微通道的细胞入口1和第二个单螺旋形微通道的细胞出口4的流速与方向保持相同或极相近,同时,使第一个单螺旋形微通道的废液出口6的流速与方向与第二个单螺旋形微通道的废液出口7的流速与方向保持相同或极相近。本发明所述双螺旋形微通道的第一个和第二个螺旋形微通道的水平平行间距是0.1-1000μm。本发明所述双螺旋形微通道的第一个和/或第二个螺旋形微通道的细胞入口1微通道的宽度是微通道整体宽度的10-40%,第一个和/或第二个螺旋形微通道的废液出口6的微通道的宽度是微通道整体宽度的40-90%。本发明所述的血液样本是指具有一定红细胞比积的血液样本,或者,通过溶血方式去除大量红细胞的血液样本,或者,通过其他本领域公知方法或装置获取的无红细胞或仅有少量或极少量红细胞的血液样本。本发明所述鞘液是指具有一定渗透压,且不破坏血细胞完整性的任何一种本领域公知的各种溶液,如磷酸盐缓冲液、培养血清、生理盐水等。粒子在弯弧形微通道中能否形成惯性聚焦流动与微通道的尺寸和曲率半径、粒子的尺寸和流速等因素都有关系。已有的研究表明,在通道的宽度大于高度的矩形截面通道中,一定尺寸的粒子形成惯性聚焦流动通常需要满足条件a/h≥0.07,a是粒子的直径,h是微通道的最小尺寸,惯性微流芯片中微通道的高度通常是最小尺寸。如果粒子尺寸过小,可能导致粒子无法在有限长度的微通道内惯性聚焦。也有研究表明,a/h<0.5也是限制条件,粒子尺寸过大可能会导致通道容易堵塞。因此,在设计制备时,要根据分离粒子的尺寸来确定微通道的尺寸。本发明提供一种从外周血级联或串联式叠加分选富集外周血循环肿瘤细胞的方法,具体包括:待富集的样本溶液从第一个单螺旋形微通道的细胞入口1进样,鞘液从第一个单螺旋形微通道的鞘液入口2和第二个单螺旋形微通道的鞘液入口5进样,在一定的流体流速条件下,在第二个单螺旋形微通道的细胞出口8收集富含靶细胞的流体,而非靶细胞则从第二个单螺旋形微通道的废液出口7收集。本发明所述的双螺旋形微通道的工作原理如下:在第一个单螺旋形微通道的入口a处,血液样本自细胞入口1进入微通道,鞘液自鞘液入口2进入微通道,由于鞘液入口2的流体流速高于细胞入口1的流体流速,细胞入口1的所有细胞被挤压至第一个单螺旋形微通道的外侧壁,并由此进入后续的微通道,因此,可以说,在0个迪恩周期时,所有细胞的起始位置是第一个单螺旋形微通道的外侧壁。在惯性升力和迪恩曳力的共同作用下,靶细胞由于其尺寸较大,在0.5个迪恩周期时,在第一个单螺旋形微通道的内侧壁形成聚焦流束,并由于其惯性升力和迪恩曳力的作用,靶细胞在第一个单螺旋形微通道后续的微通道中始终保持在其内侧壁的聚焦流;非靶细胞因其尺寸较小,主要受到迪恩曳力的作用,以迪恩涡流的形式在第一个单螺旋形微通道的外侧壁和内侧壁来回横向迁移,并且,通常是0.5个迪恩周期时位于第一个单螺旋形微通道的内侧壁,而在1个完整的迪恩周期时返回至其初始位置,即第一个单螺旋形微通道的外侧壁。由于第一个单螺旋形微通道的长度与上述迪恩周期存在一定比例,在其出口处,靶细胞从位于第一个单螺旋形微通道内侧壁的细胞出口4流出并直接进入第二个单螺旋形微通道的细胞入口,而非靶细胞流体则从位于第一个单螺旋形微通道外侧壁的废液出口5流出并经压力平衡微通道3收集;由于第一个单螺旋形微通道的细胞出口4是第二个单螺旋形微通道的细胞入口,因此,在第二个单螺旋形微通道中,按照与第一个单螺旋形微通道的相同工作原理,第一个单螺旋形微通道分选富集到的靶细胞在第二个单螺旋形微通道被第2次分选富集,或级联式分选富集,或串联式分选富集,或叠加式分选富集。因此,可以说,通过本发明所述的双螺旋形微通道,血液样本中的靶细胞被级联或串联式地进行了2次叠加式分选富集,同时,由于大部分非靶细胞已经被第一个螺旋形微通道去除,进入第二个单螺旋形微通道的细胞悬液的细胞总数整体上远远低于第二个单螺旋形微通道的细胞悬液的细胞总数,从而由于细胞因其密度的干扰少,其分选富集效果会比单独使用单个螺旋形微通道更好,最终能够得到高纯度的靶细胞。请注意,本实施例的以下部分实际上是在比较本发明所述双螺旋形通道与传统的单螺旋形微通道(如图11所示)的分选富集效果。在具体的实验中,螺旋形微通道的宽度l为600μm,曲率半径1.15cm,微通道高度h为130μm。传统的单螺旋形微通道(如图11所示)是在螺旋形平面结构内部设计入口,平面结构外部构建出口,其中,细胞入口和细胞出口的宽度是0.15mm,分别位于螺旋形微通道的外侧壁和内侧壁,鞘液入口和废液出口的宽度是0.45mm,分别位于螺旋形微通道的内侧壁和外侧壁,且细胞入口和废液入口均位于螺旋形微通道平面几何结构的内侧,细胞出口和鞘液出口均位于螺旋形微通道平面几何结构的外侧。本发明所述的双螺旋形微通道的细胞入口1和细胞出口4的宽度是0.15mm,鞘液入口2和废液出口6的宽度是0.45mm;每个单螺旋形微通道均有细胞入口1、鞘液入口5、细胞出口4和废液出口6,其中,细胞入口1和鞘液入口2汇聚成每个单螺旋形微通道的入口,细胞出口4和废液出口6汇聚成每个单螺旋形微通道的出口b;细胞入口1位于既定单螺旋形微通道入口的外侧壁部分,鞘液入口2位于既定单螺旋形微通道入口的内侧壁部分;细胞出口4位于既定单螺旋形微通道出口的内侧壁部分,废液出口6位于既定单螺旋形微通道出口的外侧壁部分;第一个单螺旋形微通道的细胞出口4与第二个单螺旋形微通道的细胞入口密封连接成第一个分级循环点;由第一个单螺旋形微通道的废液出口6、第二个单螺旋形微通道的鞘液入口5以及第一个分级循环点构成第一个分级循环处;在第一个分级循环处内的第一个单螺旋形微通道的废液出口6设有压力平衡微通道3。考虑到不同流速的变化以及通道长度两个因素对不同尺寸细胞最终所产生的横向位移聚焦位置的不同,最终优化确定最佳参数。两种规格的螺旋形微通道芯片的制作主要通过基本的微细加工技术,采用su8光刻胶在硅片上进行标准的软光刻技术制作模具,pdms脱模后对其相应出入口处进行打孔处理,并键合在相应玻片上,为了增加键合的牢固性,放置70℃烤箱中,烘烤30min。键合后的螺旋形微通道芯片出入口采用磁力夹具装置以及精密导针的连接方式与进出微管进行紧密连接,并通过注射泵以及流速控制系统从而达到进样稳定并可实时监测流速变化的目的。对螺旋形微通道芯片其分离效果测试前,首先采用鞘流液在1个大气压的高压力下对其密封性进行检测,结果无漏液情况,说明芯片键合处及芯片出入口连接较牢固,通过显微镜下观察芯片完整性及气泡排除情况,待气泡完全排除后。利用标准聚苯乙烯彩色微珠对螺旋形微通道分选富集循环肿瘤细胞的最佳参数进行优化。采用3~6μm微球、7~10μm微球、15~18μm微球进行混合分别模拟红细胞、白细胞、循环肿瘤细胞,采用磷酸盐缓冲液对3~6μm、7~10μm、15~18μm的微球分别稀释到1.0*107微粒/毫升、1.0*106微粒/毫升、1.0*102个微粒/毫升,并按照等体积比进行混合。将装载混合微球的注射泵与装载磷酸盐缓冲液鞘流液的注射泵通过精密导针分别连接在排除气泡后的螺旋形芯片外侧和内侧壁入口,通过流速监测系统以及压力泵控制调整流速,分别记录并收集本发明所述的双螺旋形微通道(如图1所示)、传统的单螺旋形微通道(如图11所示)在不同流速下(即:150μl/min、300μl/min、450μl/min、600μl/min、750μl/min、900μl/min)在各出口的微球分选富集情况。细胞出口处微球分离的结果示例情况见图8,因普通照相机无法清楚捕获到单个稀有细胞或颗粒的运动状态,故为了清楚直观的表述稀有细胞或颗粒的运动轨迹,以较小直径的圆点代表3~6μm和7~10μm的稀有细胞或颗粒,以较大直径的圆点代表15~18μm的稀有细胞或颗粒的运动轨迹。细胞出口8和废液出口7处微球分离的显微镜计数观察结果示例情况见图9。图9-a为传统的单螺旋形微通道细胞出口处的显微图片,三种微球均较多,提示较大粒子的分选富集效果较差,纯度低;图9-b为本发明所述双螺旋形微通道细胞出口处的显微图片,几乎均为较大直径的微球,提示较大粒子的分选富集效果非常良好,纯度极高;图9-c为本发明所述双螺旋形微通道废液出口7处的显微图片,可见几乎均为较小直径的微球,几乎不见较大直径的微球,提示较大微粒均被富集到细胞出口,具有良好的回收率。进一步的分析结果显示,当流速在600~750μl/min时,两种螺旋形微通道均具有最佳的分选富集效果;当流体的流速小于600μl/min时,部分尺寸较大颗粒无法聚焦在靠近内侧壁的细胞出口;当流体的流速大于750μl/min时,较大微粒的细胞纯度下降;相关示例结果如图8所示。如表1所示,进一步的对比研究结果表明,无论在何种流速条件下,双螺旋形微通道分选富集的大尺寸颗粒(即:15~18μm)的纯度及重复性均远远优于传统的单螺旋形微通道,二者具有统计学显著性差异。其主要原因在于,传统的单螺旋形微通道中受其自身单个螺旋形微通道的限制,往往使得尺寸较小的颗粒发生横向位移,从而使分选富集到的大尺寸颗粒(即:15~18μm)纯度及实验结果的重复性均受到影响。但是,本发明所述双螺旋形微通道因能够二级分选富集,从而大大提高了包括纯度和重复性在内的检测效能(表1),二者具有统计学显著差异。进一步的实际应用结果表明,在相似的实验条件下,当处理8毫升血液样本时,传统的单螺旋形微通道耗时40分钟,而本发明所述双螺旋形微通道仅耗时10分钟,且本发明所述双螺旋形微通道所获得的循环肿瘤细胞的纯度和实验结果的重复性更高(与表1所述结果相近),二者具有统计学显著差异。上述研究结果提示,相对于传统的单螺旋形微通道,本发明所述双螺旋形微通道更能满足和符合循环肿瘤细胞的临床实际检测需求及后续检测分析的苛刻条件(如循环肿瘤细胞单细胞水平基因检测)。表一不同流速下记录收集到的颗粒纯度流速双螺旋单螺旋150μl/min54.56±1.1234.58±5.28300μl/min76.24±2.3542.56±5.81450μl/min86.10±2.8462.57±6.12600μl/min94.12±2.0867.60±7.27750μl/min99.08±0.4370.36±8.76900μl/min97.02±2.4754.56±5.21采用人工培养的hcc827、mcf-7、sw480肿瘤细胞株分别倍比稀释至102个细胞/ml,按照1:5的体积比混入利用红细胞裂解液处理后的正常血细胞,采用本发明所述双螺旋形微通道进行分选富集,检测结果利用免疫荧光技术染色涂片的计数结果见表二。结果显示本发明所述双螺旋形微通道对多种肿瘤细胞的回收率均至少达98%以上,且纯度与上述双螺旋形微通道相似,均约为99%。表二不同种类肿瘤细胞采用双螺旋形微通道进行富集后的回收率与传统的单螺旋形微通道相比,本发明所述双螺旋形微通道检测的时间缩短至传统的单螺旋形微通道的1/4,且分选富集到的稀有细胞或颗粒的纯度、实验结果的重复性和回收率等方法学参数均远远优于传统的单螺旋形微通道,说明相对于传统单螺旋形微通道,本发明所述双螺旋形微通道能够更好地满足临床应用的实际需求。实施例二本实施例与实施例一不同的是,本实施例中采用外加压力泵实现与实施例一中压力平衡微通道近似的效果,即使第二个单螺旋形微通道的细胞入口的液体流动方向和第一个单螺旋形微通道的细胞入口1的液体流动方向一致,且0.7*v2≤v1≤1.3*v2;使第二个单螺旋形微通道的细胞出口8的液体流动方向和第一个单螺旋形微通道的细胞出口4的液体流动方向一致,且0.7*v4≤v3≤1.3*v4,且v1=v4;使第二个单螺旋形微通道的废液出口7的液体流动方向和第一个单螺旋形微通道的废液出口8的液体流动方向一致,且0.7*v6≤v5≤1.3*v6。所述压力泵设置在第一个单螺旋形微通道的废液出口6处。实施例三本实施例与上述实施例不同的是,本实施例中,整体的螺旋形微通道由4个单螺旋形微通道组成。事实上,本发明所述双通道螺旋形流道可进一步演变成三螺旋形微通道、四螺旋形微通道,或更多级螺旋形微通道。所述多级螺旋形微通道中所包括的单螺旋形微通道的数量至少是2个以上,并且,所述多个单螺旋形微通道的圆心位于同一点,第(m-1)个单螺旋形微通道的细胞出口是第m个单螺旋形微通道的细胞入口,且第(m-1)个单螺旋形微通道的废液出口直接连接了压力平衡通道。所述压力平衡通道的作用是使第(m-1)个单螺旋形微通道的细胞出口或第m个单螺旋形微通道的细胞入口的流速及方向与第(m-1)个螺旋形微通道的细胞入口及第m个单螺旋形微通道的细胞出口的流速及方向保持相同或极相近,同时,使第m个单螺旋形微通道的废液出口流速及方向与第(m-1)个螺旋形微通道的废液出口的流速及方向保持相同或极相近,从而使所述多级螺旋形微通道中的每个螺旋形微通道给予靶细胞的流体力学特征保持相同或相似。本实施例以四螺旋形微通道为例,如图3所示,第一个单螺旋形微通道的细胞出口4是第二个单螺旋形微通道的细胞入口,第二个单螺旋形微通道的细胞出口是第三个单螺旋形微通道的细胞入口,第三个单螺旋形微通道的细胞出口是第四个单螺旋形微通道的细胞入口,并且,第一个、第二个和第三个单螺旋形微通道的废液出口均分别具有对应的压力平衡通道3。所述鞘液从第一个单螺旋形微通道的鞘液入口2、第二个单螺旋形微通道的鞘液入口5、第三个单螺旋形微通道的鞘液入口15、以及第四个单螺旋形微通道的鞘液入口17导入;废液从第一个单螺旋形微通道的废液出口6、第二个单螺旋形微通道的废液出口7、第三个单螺旋形微通道的废液出口16以及第四个单螺旋形微通道的废液出口19导出;最终在第四个单螺旋形微通道的细胞出口18处收集分选富集后的稀有细胞或颗粒。实施例四本实施例与实施例三不同的是,本实施例中采用外加压力泵实现与实施例中压力平衡微通道近似的效果。实施例五本实施例中,采用串联的方式连接两个螺旋形微通道,第一个螺旋形微通道的第二个单螺旋形微通道的细胞出口8与第二个螺旋形微通道的第一个单螺旋形微通道的细胞入口14相连接,形成两个螺旋形微通道的串联安装处,并在每个螺旋形微通道串联安装处的位置上设置压力平衡通道。所述鞘液从第一个螺旋形微通道的第一个单螺旋形微通道的鞘液入口2、第一个螺旋形微通道的第二个单螺旋形微通道的鞘液入口5、第二个螺旋形微通道的第一个单螺旋形微通道的鞘液入口9、以及第二个螺旋形微通道的第二个单螺旋形微通道的鞘液入口11导入;废液从第一个螺旋形微通道的第一个单螺旋形微通道的废液出口6、第一个螺旋形微通道的第二个单螺旋形微通道的废液出口7、第二个螺旋形微通道的第一个单螺旋形微通道的废液出口10、以及第二个螺旋形微通道的第二个单螺旋形微通道的废液出口13导出。从第二个螺旋形微通道的第二个单螺旋形微通道的细胞出口12收集分选富集后的稀有细胞或颗粒。采用本实施例的结构形式也可以对更多个n级螺旋形微通道进行串联设置,与现有的细胞入口和细胞出口分别位于单个螺旋形流道平面几何结构的内侧和外侧相比较(例如:最后一个附图),本发明可在不使用任何外接微管的条件下直接级联或串联式使用多个n级螺旋形流道,既简化了制作工艺,也使n级螺旋形流道的复杂性降低,提高工作效率与检测结果的准确性。实施例六本实施例与实施例五不同的是,本实施例中采用外加压力泵实现与实施例五中压力平衡微通道近似的效果。实施例七本实施例中,采用并联的方式连接两个双螺旋形微通道。样本溶液从两个双螺旋形微通道的第一个单螺旋形微通道的细胞入口1进入,稀有细胞或颗粒从两个双螺旋形微通道的第二个单螺旋形微通道的细胞出口12流出。参与并联的双螺旋形微通道的圆心投影重合。可在同一张微流控芯片上同时处理2个、3个或更多个待检测样本,从而提高检测效率的同时有效地降低检测成本和样本的处理时间。实施例八本实施例与实施例一不同的是,本方案中的所有出入口(包括:细胞入口和出口、鞘液入口和废液出口)均设置在整体螺旋形微通道的几何形状外侧,废液出口通过压力平衡微流道沿其他微流道的延伸方向流通至整体螺旋形微通道的几何形状外侧,通过对压力平衡微流道的宽度、深度和长度的调整实现对细胞出口内容物流速及流向的调整。在具体的实施过程中,将部分出入口(如:图1所示的第二级鞘液入口5和第一级废液废液6)设置在螺旋形微通道内侧的结构设计为芯片的成型和制造带来了很大不便,在芯片的中心穿孔并导出或导入流体和/或细胞的操作也较为复杂,导致相关的芯片夹具的制作难度高,难于观察第一级出口和第二级入口交汇处的流体和/或细胞的流动状态。因此在本实施例中将所有出入口(包括:细胞入口和出口、鞘液入口和废液出口)均设置在整体螺旋形微通道的外侧。基于惯性迁移力分选富集循环肿瘤细胞,采用comsolmultiphisics多物理量仿真软件,在构建了标准化单螺旋芯片的基础上,进一步改进芯片结构并成功构建标准化的双螺旋形微流道芯片。设计构建的标准化双螺旋芯片其关键目的是通过惯性聚焦使得尺寸较大的靶细胞(ctc)沿着通道的内壁分布聚焦,尺寸较小的血细胞从螺旋通道的外侧避随鞘流液分离。双螺旋芯片较单螺旋芯片相比,能够通过级联的方式更加快速、高效地捕获到血液样品中的ctc,满足临床实际要求,达到对肿瘤患者动态实时监测、选择最佳治疗方案的目的,同时还可以进一步的对肿瘤转移等相关机制进行深入探讨研究。不同细胞其惯性聚焦的位置受螺旋形微流道的三维尺寸的影响。通过comsolmultiphisics软件的仿真模拟计算,确定了能够使ctc(≥15um)与血细胞(3~15um)分离效果最佳的螺旋形微流道芯片三维尺寸,从而迫使样品能够从第一个单螺旋形微通道的细胞入口完全顺利进入螺旋形微通道内并开始其在流道内的横向位移。考虑到不同流速的变化以及长度两个因素对不同尺寸细胞(ctc、rbc、wbc)最终所产生的横向位移聚焦位置的不同,最终优化确定第二个单螺旋形微通道的细胞出口的最佳参数。双通道螺旋芯片在单通道螺旋芯片基础上增加了芯片内流道长度,避免了大流速高通量下因流道过短导致的尺寸较小颗粒横向位移过大造成细胞纯度低的问题。采用comsolmultiphysicsv5.2a软件,仿真分析在不同宽度的压力平衡通道3的条件下,双螺旋微流道的第一级出入口(包括:细胞入口1、鞘液入口2、废液出口6、细胞出口4)与第二级出入口(包括:细胞入口4、鞘液入口5、废液出口7、细胞出口8)的体积流量特征及相关比值。模拟条件是细胞入口的初始条件是150ul/min,鞘液入口的初始条件是750ul/min。模拟结果表明,只有当压力平衡通道3的宽度在350um时,第一级细胞出口4的流速才与第一级细胞入口1的流速相当,在此条件下,其流速是144.18ul/min(表三)。该结果表明,压力平衡通道3的宽度对第一级细胞出口4的流速具有重要的调节作用,并且,只有在其适当的宽度条件下,才能确保第一级细胞出口4的流速与第一级细胞入口1的流速相当。同时,进一步加大压力平衡通道3的宽度,会导致第一级细胞出口4呈反方向流动,说明压力平衡通道3提供的平衡压力过小,导致流体的反流。其它结果表明,当压力平衡通道3的宽度维持在250~400um时,第二级废液出口7和细胞出口8的体积流量比值维持在比较恒定的范围,具体结果见表四。进一步模拟分析结果表明,压力平衡通道3的深度和长度同样可以影响第一级细胞出口4的流速。表三在不同宽度的压力平衡通道3的条件下,各级入口的体积流量特征表四在不同宽度的压力平衡通道3的条件下,各级出口的体积流量特征螺旋形微流道芯片的制作主要通过基本的微细加工技术,采用su8光刻胶在硅片上进行标准的软光刻技术制作模具,pdms脱模后对其相应出入口处进行打孔处理,并键合在相应玻片(45mmx45mm)上,为了增加键合的牢固性,放置70℃烤箱中,烘烤30min。键合后的螺旋形微流道芯片出入口采用magneticprobe(corsolution)装置以及fluidicconnect(micronit)夹具连接方式与进样管进行紧密连接,并通过longerpump注射泵以及mcfs压力流速控制系统从而达到进样稳定并可实时监测流速变化的目的。对螺旋形微流道芯片其分离效果测试前,首先采用鞘流液在1bar高压力下对其密封性进行检测,结果无漏液情况,说明芯片键合处及芯片出入口连接较牢固,通过显微镜下观察芯片完整性及气泡排除情况,待气泡完全排除后。利用标准聚苯乙烯彩色微珠对螺旋形微流道分选富集ctc的最佳参数进行优化。采用3~6um微球、7~10um微球、15~18um微球进行混合分别模拟红细胞、白细胞、ctc,其中利用pbs缓冲液对3~6μm、7~10μm、15~18μm的微球分别稀释到1.0×109particles/ml、1.0×107particles/ml、1.0×103particles/ml并按照等体积比进行混合。将装载混合微球的注射泵与装载pbs鞘流液的注射泵通过芯片夹具分别连接在排除气泡后的螺旋形芯片的细胞入口1以及鞘液入口2,通过流速监测系统以及压力泵控制调整流速及压力,分别记录并收集单、双螺旋型芯片(实施例一中的单螺旋型芯片与本实施例)在不同流速下(200μl/min、350μl/min、500μl/min、650μl/min、800μl/min、950μl/min),芯片出口处有色微球分离情况见图23,并通过显微镜计数观察结果见图24。结果显示当流速在650~800μl/min时分离效果最佳。流速小于650μl/min部分尺寸较大颗粒无法聚焦在靠近细胞出口,当流速大于800μl/min时,ctc分选富集纯度将受到影响如图23所示,圆点多少及大小并不反映颗粒实际的数量多寡与尺寸大小。利用上述研究方法,对双通道螺旋型芯片进行测试,其结果统计如表五,反映了双通道螺旋型芯片其分选富集纯度大大高于单通道螺旋型芯片。同时由于单螺旋芯片流道长度的限制,当流速大于800μl/min时,往往使得尺寸较小的颗粒在较大惯性迁移力作用下发生横向位移导致分选富集到的ctc细胞纯度受到影响,然而双螺旋芯片增加了流道长度,进行第二级分离从而大大提高检测通量。结果表明,在相同时间内,单通道螺旋型芯片处理能够在20min内处理8ml血液样本,而双通道螺旋型芯片仅需10min,且其高纯度、高通量的富集结果更加满足符合ctc应用于临床及后续检测分析的苛刻条件。表五不同流速下记录收集到颗粒的纯度采用人工培养的hcc827、mcf-7、sw480细胞株分别倍比稀释至102cells/ml,按照1:5的体积比混入利用红细胞裂解液处理后的正常血细胞,采用本实施例中的芯片进行检测,检测结果利用免疫荧光技术染色涂片计数见表六。结果显示双螺旋微流道芯片对多种肿瘤细胞的回收率达90%以上,图25所示为分选富集到的sw480免疫荧光染色.通过混入肿瘤细胞与捕获到的细胞结果可见其有很好的线性相关,同时该双螺旋芯片捕获对多种肿瘤细胞捕获效率达90%,见图26。表六双螺旋芯片多种肿瘤细胞捕获回收率此外,分别对20例结直肠癌患者样本进行检测,其中利用标准化单螺旋和双螺旋芯片都检测出其中18例患者ctc细胞,但较单螺旋芯片相比,双螺旋型芯片检测时间缩短一半,贴近满足临床高通量的需求。同时,我们设计的双螺旋通道,通过标准化进出样口设计,使其能够配合大部分商品化的芯片夹具精确完成整个血液样品进样出样的全部流程,使其离临床大量标本、低成本、快速检测ctc更进一步,可在10min处理8ml血液样本.其对标准化微球的分选富集纯度达98%以上,从理论上来讲,其分选富集ctc纯度同样达98%以上,但因为肿瘤患者之间差异性较大(如化疗后wbc显著增高),故其纯度往往是一个变量.但相比单螺旋型芯片,双螺旋型芯片分选富集ctc细胞纯度均远高于单螺旋芯片,其细胞纯度对ctc细胞后续遗传学等生物操控分析至关重要。实施例九本实施例与实施例五在本质上较为相似,但本方案中的所有出入口(包括:细胞入口和出口、鞘液入口和废液出口)均设置在整体螺旋形微通道的几何形状外侧,更易于观测和分析结果,同时,也更易于标准化夹具,从而有利于实现批量化处理和操作。实施例十本实施例与实施例三在本质上较为相似,但该设计将第一个单螺旋形微通道的细胞入口、第一个单螺旋形微通道的鞘液入口、第二个单螺旋形微通道的鞘液入口、第一个单螺旋形微通道的废液出口设置在较为接近的位置,并将两个单螺旋形微通道设置以同心的形式交替设置,同时,所有出入口(包括:细胞入口和出口、鞘液入口和废液出口)均设置在整体螺旋形微通道的几何形状外侧,整体结构更为精巧,便于使用。实施例十一本实施例由两个实施例八中的双螺旋形微通道采用并联的方式进行连接的结构示意图,采用上述并联的形式可使同一个样本在单位时间内同时在两个双螺旋形微通道进行处理,或者说,可以在一次筛选的时间内实现更多流体的同时处理,可以有效增加筛选效率。相对于实施例八,临床样本的检测时间至少可缩短1倍。本实施例中仅展示两个双螺旋形微通道的并联形式,在实际使用中可以根据需要进行三条、四条及更多条双螺旋形微通道的并联。实施例十二本实施例与实施例七在本质上较为相似,但该设计将第一个双螺旋形微通道的第一个单螺旋形微通道的细胞入口、第一个单螺旋形微通道的鞘液入口、第二个单螺旋形微通道的鞘液入口、第一个单螺旋形微通道的废液出口设置在较为接近的位置;将第二个双螺旋形微通道中的第一个单螺旋形微通道的细胞入口、第一个单螺旋形微通道的鞘液入口、第二个单螺旋形微通道的鞘液入口、第一个单螺旋形微通道的废液出口设置在较为接近的位置,并将两个单螺旋形微通道设置以同心的形式交替设置,整体结构更为精巧,便于使用。同时,本方案中的所有出入口(包括:细胞入口和出口、鞘液入口和废液出口)均设置在整体螺旋形微通道的几何形状外侧,更易于观测和分析结果,同时,也更易于标准化夹具,从而有利于实现批量化处理和操作。实施例十三本实施例由两个实施例十中的螺旋形微通道(即串联的双螺旋微通道)采用并联的方式进行连接的结构示意图,采用上述并联的形式可使同一个样本在单位时间内同时在两个实施例十所示螺旋形微通道进行处理,或者说,可以在一次筛选的时间内实现更多流体的同时处理,可以有效增加筛选效率。相对于实施例十,临床样本的检测时间至少可缩短1倍。本实施例既具有通过串联的形式保证采用多级流道多次筛选,提高细胞纯度的优势,也具有通过并联的形式提高筛选效率的优势。本实施例中仅展示两个实施例十所示螺旋形微通道的并联形式,在实际使用中可以根据需要进行三条、四条及更多条实施例十所示螺旋形微通道的并联。实施例十四本实施例中展示基础设计-单螺旋形微通道的另一种实现形式,该种形式中将细胞出口及废液出口均设置在整体螺旋形微通道的外侧。在具体的实施过程中,将细胞出口及废液出口均设置在螺旋形微通道内侧的结构设计(如图11所示)为芯片的成型和制造带来了很大不便,在芯片的中心穿孔并导出或导入流体和/或细胞的操作也较为复杂,导致相关的芯片夹具的制作难度高,难于观察鞘液和细胞入口交汇处的流体和/或细胞的流动状态。因此在本实施例中将细胞出口及废液出口均设置在整体螺旋形微通道的外侧,更易于观测和分析,以及标准化夹具和简便化操作。实施例十五本实施例中展示两个实施例十四中的单螺旋形微通道采用串联的方式进行连接的结构示意图,采用串联的形式可以实现在一次流动过程中多次筛选,可进一步提高筛选细胞的纯度。本实施例中仅展示两个单螺旋形微通道的串联形式,在实际使用中可以根据需要进行三条、四条及更多条单螺旋形微通道的串联。实施例十六本实施例中展示实施例十五的另一种表现形式,两个单螺旋形微通道采用同心并列环绕设置,盘曲折叠螺旋绕制成环,采用串联的形式可以实现在一次流动过程中多次筛选,可进一步提高筛选细胞的纯度。本实施例中仅展示两个单螺旋形微通道的串联形式,在实际使用中可以根据需要进行三条、四条及更多条单螺旋形微通道的串联。实施例十七本实施例中展示两个实施例十四中的单螺旋形微通道采用并联的方式进行连接的结构示意图,采用上述并联的形式可使同一个样本在单位时间内同时在两个实施例十四所示单螺旋形微通道进行处理,或者说,可以在一次筛选的时间内实现更多流体的同时处理,可以有效增加筛选效率。相对于实施例十四,临床样本的检测时间至少可缩短1倍。本实施例中仅展示两个单螺旋形微通道的并联形式,在实际使用中可以根据需要进行三条、四条及更多条单螺旋形微通道的并联。实施例十八本实施例中展示实施例十七的另一种表现形式,两个单螺旋形微通道采用同心并列环绕设置,盘曲折叠螺旋绕制成环,采用并联的形式可以在一次筛选时间内实现更多流体的同时处理,可以有效增加筛选效率,本实施例中仅展示两个单螺旋形微通道的并联形式,在实际使用中可以根据需要进行三条、四条及更多条单螺旋形微通道的并联。在本发明的基础设计为单螺旋形微通道,其延伸设计为单螺旋形微通道的串联、并联、混联,以及多螺旋形微通道(本发明说明书中以双螺旋形微通道为例)的串联、并联、混联等多种实现形式,上述表现形式均为本方案的延伸设计,其基本原理均在本说明书中得到阐述,因此上述各种表现形式也均应落入本发明的保护范围之中。最后说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本技术方案的宗旨和范围,其均应涵盖在本发明的权利要求范围当中。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1