间充质干细胞制剂血管刺激性的评价方法和应用与流程
本发明涉及生物技术领域,尤其是涉及一种间充质干细胞制剂血管刺激性的评价方法和应用。
背景技术:
间充质干细胞来源于发育早期的中胚层和外胚层,属于多能干细胞,因其具有多向分化潜能、造血支持和促进干细胞植入、免疫调控和自我复制等特点而日益受到人们的关注。间充质干细胞在体内或体外特定的诱导条件下,可分化为脂肪、骨、软骨、神经、内皮等多种组织细胞,连续传代培养和冷冻保存后仍具有多向分化潜能,可作为理想的种子细胞用于衰老和病变引起的组织器官损伤修复。
美国临床试验数据库clinicaltrials数据显示,目前与间充质干细胞相关的临床试验已涉及300多种疾病,单是在美国开展的与间充质干细胞相关的临床试验就达到了650多件,主要的疾病包括骨损伤、神经退行性疾病、糖尿病、心肌缺血、重症肌无力和肝损伤等。
干细胞制剂制备所用的培养基成分除了要遵循《干细胞制剂质量控制及临床前研究指导原则》所制定的“应有足够的纯度并符合无菌、无致病微生物及内毒素的质量标准,残留的培养基对受者应无不良影响”的标准外,还要保证其“干性”、增殖及分化能力。但是干细胞作为特殊的药物,在临床前的安全性评价,特别是血管刺激性方面的评价缺乏评价指标和相应的技术手段。
有鉴于此,特提出本发明。
技术实现要素:
本发明的第一个目的在于提供一种间充质干细胞制剂血管刺激性的评价方法,以至少缓解现有技术中存在的技术问题之一。
本发明的第二个目的在于提供间充质干细胞制剂血管刺激性的评价方法在制备包含间充质干细胞的药物中的应用。
为解决上述技术问题,本发明特采用如下技术方案:
本发明提供了一种间充质干细胞制剂血管刺激性的评价方法,包括使用所述间充质干细胞制剂免疫动物,然后按照免疫后的动物的症状将所述间充质干细胞制剂的血管刺激性划分为预设的等级;
所述经间充质干细胞制剂免疫的动物包括低剂量组和高剂量组;
其中,所述低剂量组的给药剂量为所述动物的等效临床给药剂量的0.9~1.3倍,给药浓度为所述动物的等效临床给药浓度的0.8~1.2倍;
所述高剂量组的给药剂量为所述动物的等效临床给药剂量的3~3.5倍,给药浓度为所述动物的等效临床给药浓度的2.5~3.5倍。
进一步地,所述预设的等级包括无刺激、轻微刺激、轻度刺激、中度刺激、重度刺激和严重刺激;
所述无刺激为动物无明显反应;
所述轻微刺激为动物血管轻度充血;
所述轻度刺激为动物血管中度充血;
所述中度刺激为动物血管重度充血且红肿;
所述重度刺激为动物血管变性坏死;
所述严重刺激为动物血管出现广泛性坏死。
进一步地,所述评价方法还包括设置空白对照组。
进一步地,所述动物包括小鼠、大鼠、豚鼠、家兔、犬、小型猪、猴、雪貂、土拨鼠和裸鼹鼠中的一种或者多种。
进一步地,所述人间充质干细胞制剂免疫的动物为家兔。
进一步地,所述低剂量组的给药剂量为2×106~4×106cells/kg;给药浓度为5.0×105~7.0×105cells/ml;
优选地,所述低剂量组的给药剂量为3×106cells/kg;给药浓度为6.0×105cells/ml。
进一步地,所述高剂量组的给药剂量为8×106~10×106cells/kg;给药浓度为1.5×106~2.0×106cells/ml;
优选地,所述高剂量组的给药剂量为9×106cells/kg;给药浓度为1.8×106cells/ml。
进一步地,所述空白对照组为经生理盐水免疫的家兔。
进一步地,所述免疫的方式为耳缘静脉缓慢推注给药;
优选地,所述缓慢推注给药的时间不少于5min。
另外,本发明还提供了上述的间充质干细胞制剂血管刺激性的评价方法在制备包含间充质干细胞的药物中的应用;
优选地,所述药物包括人脐带间充质干细胞。
发明提供了一种间充质干细胞制剂血管刺激性的评价方法,一方面该方法使用两种免疫剂量的间充质干细胞制剂分别免疫动物,以降低单一剂量免疫动物造成的由于剂量不合适而结果不准确的风险,同时还可以得出间充质干细胞制剂的血管刺激性与剂量的关系;另一方面,本发明提供了低剂量和高剂量下的合理的药物用量,避免了由于给药量不合理导致的评价结果不准确的问题。该评价方法能够为提供间充质干细胞制剂的安全性资料,为临床安全用药提供参考。基于上述发明构思,本发明还提供了间充质干细胞制剂血管刺激性的评价方法在制备包含间充质干细胞的药物中的应用,以协助间充质干细胞作为活性成分或者辅助成分的药物的开发。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
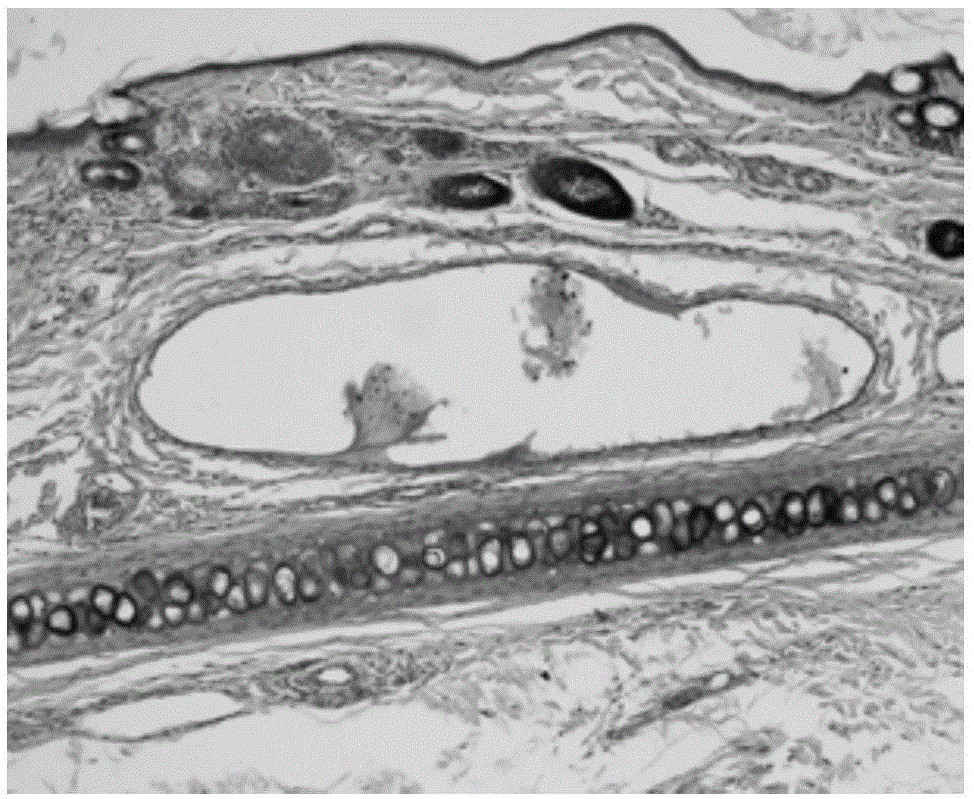
图1为本发明实施例1提供的家兔经耳缘静脉缓慢推注给予生理盐水的组织学检查结果图;
图2为本发明实施例1提供的家兔经耳缘静脉缓慢推注给予高剂量脐带间充质干细胞的组织学检查结果图;
图3为本发明实施例1提供的家兔经耳缘静脉缓慢推注给予低剂量脐带间充质干细胞的组织学检查结果图。
具体实施方式
下面将结合实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
需要说明的是:
本发明中,如果没有特别的说明,本文所提到的所有实施方式以及优选实施方法可以相互组合形成新的技术方案。
本发明中,如果没有特别的说明,本文所提到的所有技术特征以及优选特征可以相互组合形成新的技术方案。
本发明中,如果没有特别的说明,百分数(%)或者份指的是相对于组合物的重量百分数或重量份。
本发明中,如果没有特别的说明,所涉及的各组分或其优选组分可以相互组合形成新的技术方案。
本发明中,除非有其他说明,数值范围“a~b”表示a到b之间的任意实数组合的缩略表示,其中a和b都是实数。例如数值范围“0.8~1.2”表示本文中已经全部列出了“0.8~1.2”之间的全部实数,“0.8~1.2”只是这些数值组合的缩略表示。
本发明所公开的“范围”以下限和上限的形式,可以分别为一个或多个下限,和一个或多个上限。
本发明中,除非另有说明,各个反应或操作步骤可以顺序进行,也可以按照顺序进行。优选地,本文中的反应方法是顺序进行的。
除非另有说明,本文中所用的专业与科学术语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法或材料也可应用于本发明中。
根据本发明的一个方面,提供了一种间充质干细胞制剂血管刺激性的评价方法,该方法包括使用所述间充质干细胞制剂免疫动物,然后按照免疫后的动物的症状将所述间充质干细胞制剂的血管刺激性划分为预设的等级;
所述经间充质干细胞制剂免疫的动物包括低剂量组和高剂量组;
其中,所述低剂量组的给药剂量为所述动物的等效临床给药剂量的0.9~1.3倍,例如可以为,但不限于0.9倍、1.0倍、1.1倍、1.2倍和1.3倍,优选为1.1倍;给药浓度为所述动物的等效临床给药浓度的0.8~1.2倍,例如可以为,但不限于0.8倍、0.9倍、1.0倍、1.1倍或1.2倍,优选为1.0倍;
所述高剂量组的给药剂量为所述动物的等效临床给药剂量的3~3.5倍,例如可以为,但不限于3倍、3.1倍、3.2倍、3.3倍、3.4倍或3.5倍,优选为3.3倍;给药浓度为所述动物的等效临床给药浓度的2.5~3.5倍,例如可以为,但不限于2.5倍、2.6倍、2.7倍、2.8倍、2.9倍、3.0倍、3.1倍、3.2倍、3.3倍、3.4倍或3.5倍,优选为3.0倍。
间充质干细胞是一种多能干细胞,具有自我更新和多向分化能力,促进骨、软骨、韧带、肌肉和脂肪组织等间质组织再生。因间充质干细胞来源丰富、制备简单、多能性和低致瘤性具有很大的临床利用价值。本发明提供了一种间充质干细胞制剂血管刺激性的评价方法,一方面该方法使用两种免疫剂量的间充质干细胞制剂分别免疫动物,以降低单一剂量免疫动物造成的由于剂量不合适而结果不准确的风险,同时还可以得出间充质干细胞制剂的血管刺激性与剂量的关系;另一方面,本发明提供了低剂量和高剂量下的合理的药物用量,避免了由于给药量不合理导致的评价结果不准确的问题。该评价方法能够为提供间充质干细胞制剂的安全性资料,为临床安全用药提供参考。
其中,所述动物的等效临床给药剂量是指待评价的间充质干细胞制剂在人的临床治疗时的给药剂量折算成所述动物的给药剂量后的剂量;同理,所述动物的等效临床给药浓度指的是待评价的间充质干细胞制剂在人的临床治疗时的给药浓度折算成所述动物的给药浓度。以家兔为例,预设间充质干细胞制剂用于人时的临床给药剂量为1×106cells/kg,以人60kg(1.6246m2)、家兔2.5kg(0.1860m2)计,家兔等效剂量为2.75×106cells/kg,则低剂量组的给药剂量为2.75×106cells/kg的0.9~1.3倍;高剂量组的给药剂量为2.75×106cells/kg的3~3.5倍;所述动物的等效临床给药浓同理。
需要说明的是,本发明所述的间充质干细胞制剂指的是包含人间充质干细胞的试剂、药物或者间充质干细胞本身;发明所述的给药剂量,是以间充质干细胞制剂中起到活性成分的间充质干细胞的数量计算的。所述间充质干细胞分离自例如可以为但不限于为骨髓、骨膜、血管、脂肪、肌肉、外周循环、脐带血、皮肤或牙体组织等;所述间充质干细胞例如可以为但不限于为实验室分离得到的细胞或者市售细胞系;所述间充质干细胞的来源例如可以为但不限于为人或者其他可分离到间充质干细胞的动物;所述间充质干细胞也不限制为通过本领域可接受的手段得到的经诱变、突变或者经基因工程的改造得到的间充质干细胞。可以理解的是,本发明的目的是评价间充质干细胞制剂的血管刺激性,因此对间充质干细胞的来源不做限制。
在一些优选的实施方式中,所述预设的等级包括无刺激、轻微刺激、轻度刺激、中度刺激、重度刺激和严重刺激;
所述无刺激为动物无明显反应;
所述轻微刺激为动物血管轻度充血;
所述轻度刺激为动物血管中度充血;
所述中度刺激为动物血管重度充血且红肿;
所述重度刺激为动物血管变性坏死;
所述严重刺激为动物血管出现广泛性坏死。
该实施方式中根据经间充质干细胞制剂免疫的动物出现的症状将免疫程度划分为不同的等级,以评价间充质干细胞制剂的血管刺激性,该方法只需按照不同的血管刺激等级中分别对应的症状划分间充质干细胞制剂的血管刺激性即可。
在一些优选的实施方式中,所述评价方法还包括设置空白对照组进行方法学验证,从而进一步减小评价误差。
在一些优选的实施方式中,所述动物包括小鼠、大鼠、豚鼠、家兔、犬、小型猪、猴、雪貂、土拨鼠和裸鼹鼠中的一种或者多种。
优选地,所述人间充质干细胞制剂免疫的动物为家兔。
在一些优选的实施方式中,家兔按照如下剂量给药间充质干细胞制剂血管刺激性的评价效果更优:
低剂量组的给药剂量为2×106~4×106cells/kg,例如可以为,但不限于2×106cells/kg、2.5×106cells/kg、3×106cells/kg、3.5×106cells/kg或4×106cells/kg;给药浓度为5.0×105~7.0×105cells/ml,例如可以为,但不限于5.0×105cells/kg、5.5×105cells/kg、6.0×105cells/kg、6.5×105cells/kg或7.0×105cells/kg;
优选地,所述低剂量组的给药剂量为3×106cells/kg;给药浓度为6.0×105cells/ml。
通过优化和调整给药剂量,可以进一步优化间充质干细胞制剂血管刺激性的评价效果。
高剂量组的给药剂量为8×106~10×106cells/kg,例如可以为,但不限于8×106cells/kg、8.5×106cells/kg、9×106cells/kg、9.5×106cells/kg或10×106cells/kg;给药浓度为1.5×106~2.0×106cells/ml,例如可以为,但不限于1.5×106cells/kg、1.6×106cells/kg、1.7×106cells/kg、1.8×106cells/kg、1.9×106cells/kg或2×106cells/kg;
优选地,所述高剂量组的给药剂量为9×106cells/kg;给药浓度为1.8×106cells/ml。
通过优化和调整给药剂量,可以进一步优化间充质干细胞制剂血管刺激性的评价效果。
在一些优选的实施方式中,所述空白对照组为经生理盐水免疫的家兔,优选使用0.9%的氯化钠注射液进行免疫。
在一些优选的实施方式中,所述免疫的方式为耳缘静脉缓慢推注给药;
缓慢推注给药能够有效避免推注过快对血管造成的刺激,从而避免除间充质干细胞制剂对血管造成刺激外的其他刺激对实验造成干扰,减小评价误差。
优选地,所述缓慢推注给药的时间不少于5min。
在一个具体的实施方式中,所述缓慢推注给药每分钟至多推注2ml。
本发明还提供了上述间充质干细胞制剂血管刺激性的评价方法在制备包含间充质干细胞的药物中的应用,以协助以间充质干细胞作为活性成分或者辅助成分的药物的开发。在一些优选的实施方式中,所述药物包括人脐带间充质干细胞,人脐带间充质干细胞(humanumbilicalcordmesenchymalstemcells,huc-mscs)可分化为脂肪细胞、成骨细胞、软骨细胞、神经元和内皮细胞。人脐带间充质干细胞来源广泛、取材方便、成本低廉,具有高的可塑性和分化潜能,因此人脐带间充质干细胞在制备药物的应用中越加广泛,使用上述间充质干细胞血管刺激性的评价方法可为人脐带间充质干细胞在制备药物的研究中提供安全性资料,为临床安全用药提供参考。
下面结合优选实施例进一步说明本发明的有益效果:
实施例1
1、试验设计
1.1、组别设置:
本实施例使用的间充质干细胞制剂包括从脐带血分离的人脐带间充质干细胞和无人源蛋白的人脐带间充质干细胞;本试验设置3组,脐带间充质干细胞分别设低剂量和高剂量组(简称为低剂量组和高剂量组),同时用0.9%氯化钠注射液设空白对照组。每组4只家兔,雌雄各半,其中低剂量组和空白对照组使用1组动物,分别于家兔左右耳给药。
1.2、剂量设置及其依据
脐带间充质干细胞(mscs)具有多向分化功能,可分化为多种细胞,此研究拟将mscs用于多种疾病的临床治疗。临床输注剂量为1×106cells/kg,以人60kg(1.6246m2)、家兔2.5kg(0.1860m2)计,家兔等效剂量为2.75×106cells/kg。临床给药浓度为6×105cells/ml。
本试验剂量设置如下:
低剂量组:给药剂量3×106cells/kg,给药体积5ml/kg,药物浓度6.0×105cells/ml。
高剂量组:给药剂量9×106cells/kg,给药体积5ml/kg,药物浓度1.8×106cells/ml。
空白对照组:给予等体积0.9%氯化钠注射液。
本试验给药剂量达临床剂量的1.1倍、3.3倍;给药浓度达临床浓度的1.0倍、3.0倍;给药体积5ml/kg,因为低剂量组和空白对照组合并使用1组动物,其给药体积可达家兔血容量的12.5%~20%;给药时长不少于5min/只家兔。综合以上情况,本试验设计应能充分检测供试品对家兔血管及血管周围组织的局部刺激作用(表1)。
表1家兔刺激性试验给药情况汇总表
1.3、给药途径和方式
脐带间充质干细胞临床拟静脉输注给药,本试验采用与临床相近的给药方式进行给药,即耳缘静脉缓慢推注给药。每只动物给药时间应不短于5min。
1.4、给药和恢复周期
本试验家兔经单次给药后,恢复观察14天。
2、试验方法
2.1、动物接收和检验
实验动物由实验人员、动物保障部门人员和兽医共同接收。接收时查看动物供应单位提供的动物合格证明,并确认合格证内容与申请购买的动物种属、级别、数量和性别一致。运输工具和外包装无异常。经动物接收室将动物传入检疫室内,在检疫室打开动物外包装,核对动物各性别数量与动物合格证所载事项一致。逐一对动物进行检查(包括性别、体重、头部、躯干部、尾部、四肢、皮毛、精神、活动等),并填写《实验动物接收单》和《动物接收检验单》。检验后动物放入动物饲养笼中,每笼1只,并在笼具上悬挂标签,放在饲养架上进行适应期饲养。
2.2、动物适应期观察
家兔共适应性饲养9天,于适应期第1天和最后1天分别观察称重1次,其它时间每天观察1次,适应期间动物未见异常。
2.3、动物分组和处理
适应期结束后,选择状态良好的动物8只随机分为2组,分别记为ⅰ组、ⅱ组,每组4只,雌雄各半。分组后动物以苦味酸染色标记,每笼1只,在饲养笼具上悬挂标签进行标记。给药和恢复期间,动物继续饲养在饲养观察室,并在饲养观察室悬挂标签进行标记。
2.4、供试品准备
空白对照组直接取用0.9%氯化钠注射液。
低、高剂量组所需脐带间充质干细胞即送即给药。
2.5、给药部位分布
本试验每只家兔分别于耳缘静脉缓慢推注给药,具体给药部位和组别分布如下表2所示:
表2家兔给药部位分布情况表
2.6、给药
供试品脐带间充质干细胞在运输、接收、给药过程中使用冰袋进行低温保存。给药前药液需充分混匀,并在给药过程中不断摇动注射针管内药液,使细胞分布均匀,以免造成细胞聚集和血管堵塞。
由于本供试品为细胞悬液,因此给药时需适当控制速度,以避免给药过快导致动物死亡而影响实验结果的判定。本试验经耳缘静脉缓慢推注给药,每只家兔给药时间应不低于5min(6~8min),记录每只动物的给药开始和结束时间。
2.7、供试品废弃处理
本供试品为具有生物活性的生物制品,给药后剩余药液高压灭活后作为医疗废弃物统一处理。
2.8、血管刺激性观察
肉眼观察给药后24、48、72小时动物的全身反应和注射部位血管及血管周围组织的刺激反应,并按表3换算成反应分值。给药后72小时,每组随机选择1/2动物处死,解剖取出距注射部位1cm近心端耳缘组织(3×3cm2)做病理组织学检查。剩余动物继续恢复观察至药后14天剖杀,并进行组织病理学检查,观察和取材方法同上。计算各组动物血管反应的平均值,根据表4判断刺激反应等级,若各组动物最高和最低反应级数之差大于2,则需另取动物进行重复试验。
表3血管刺激反应评分标准
表4血管刺激强度评价标准
3、实验结果
3.1、全身毒性反应
未见明显全身毒性反应。
3.2、肉眼观察
家兔经耳缘静脉缓慢推注给药后恢复观察14天,各组动物给药和恢复期间给药局部血管和血管周围组织未见明显刺激反应症状,反应分值均为0分。具体评分结果见表5。
表5家兔血管刺激性试验肉眼观察评分结果
备注:n,为动物数。
3.3、解剖检查
药后3天和14天每组分别处死1/2家兔进行大体解剖检查,各组动物给药局部均未见肉眼可见的病理学异常改变,反应分值均为0分。具体评分结果见表6。
表6家兔血管刺激性试验解剖检查评分结果
备注:n,为动物数。
3.4、组织学检查
如图1、图2和图3所示,家兔经耳缘静脉缓慢推注给予脐带间充质干细胞后,血管内皮光滑、完整,内皮细胞未见水肿、变性、脱落及增生,血管腔内未见血栓形成,血管壁未见炎细胞浸润及增生等病理改变。本试验脐带间充质干细胞对家兔耳缘静脉无明显刺激作用。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
- 还没有人留言评论。精彩留言会获得点赞!