一种评价β-胡萝卜素乳液体系对β-胡萝卜素保护效果的方法与流程
本发明属于食品检测领域,具体涉及一种评价β-胡萝卜素乳液体系对β-胡萝卜素保护效果的方法。
背景技术:
脂溶性营养物质是指一类能够溶解在脂肪中,进而被人体摄入、消化、吸收的物质。常见的脂溶性营养物质包括维生素类、类胡萝卜素类、黄酮类、多酚类、多不饱和脂肪酸类等。营养物质的生物利用率表示摄取的营养素中能够通过正常生理功能被吸收利用或储存在人体中的比例。为了提高脂溶性营养物质在人体内的生物利用率,常见的方法是利用水包油乳液体系对其进行包埋并递送到体内。
β-胡萝卜素是自然界中分布最广、也是目前学者研究最多的类胡萝卜素,在食品工业和食品科学研究中非常重要。β-胡萝卜素是类胡萝卜素家族的典型代表,是哺乳动物合成维生素a的前体,又称为维生素a原。许多植物中都含有丰富的β-胡萝卜素,一些蔬菜和水果因富含β-胡萝卜素而呈饱满的黄色或橘色。β-胡萝卜素在食品、饮料、饲料、化妆品等方面有重要用途,近年来受到医学界的广泛关注,使其在保健品、药品中也起到重要作用。此外,其潜在的猝灭单线态氧和灭活自由基的能力在预防特定的癌症、心血管疾病、黄斑退化症、白内障和提高免疫反应中也发挥了较大作用。但因β-胡萝卜素遇光、热、氧时稳定性差,易被氧化分解,且有轻微异味,故在实际应用中常常受到一定限制。为了探究乳液中β-胡萝卜素在储藏期间温度及壁材对其稳定性的影响,通常采用等温储藏实验来考察不同温度下乳液壁材对β-胡萝卜素的保护程度。因此等温储藏实验是评价乳液体系保护效果的不可或缺的手段。
β-胡萝卜素的生物利用过程包括4个步骤:(1)β-胡萝卜素从食品基质中释放至消化液,(2)在小肠内形成脂质胶束后被小肠黏膜细胞吸收,(3)被转运至门静脉及淋巴循环,(4)在肝脏中转化为维生素a或被储存。在体外模拟实验中,常用β-胡萝卜素从食品基质中释放到胃肠道后,被包裹在脂质微粒中的程度来评价β-胡萝卜素的生物利用率。生物利用率是实现β-胡萝卜素生理功效发挥的决定因素。食物经胃消化后,可被小肠吸收的那部分营养素含量越高,代表其生物利用率越高。食物中的β-胡萝卜素在人体内的利用率较低,原因可能与β-胡萝卜素在食物基质中被包裹、水溶性差以及化学不稳定性等有关。因此,制备高生物利用率的β-胡萝卜素功能性食品和膳食补充剂具有广阔的市场前景。β-胡萝卜素为脂溶性物质,将其制成乳状液不仅可以解决其溶解性的问题,还可以提高其生物利用率,因此在食品、饮料、药品等行业中有广泛的应用前景。
虽然人体与动物实验是评价营养素生物利用率最直接有效的方式,但这两种实验方式耗费人力物力,且实验周期较长,不利于样品的快速批量检测。
技术实现要素:
本发明针对β-胡萝卜素乳液体系,公开了一种能直观快速地评价β-胡萝卜素乳液体系对β-胡萝卜素保护效果的方法;其中β-胡萝卜素乳液体系的具体定义为在油相中包含β-胡萝卜素的水包油乳液体系,水相中的乳化剂包括但不限于蛋白,也涵盖酶解物与商品化表面活性剂。以β-胡萝卜素保留率和生物利用率为评价指标,保留率和生物利用率越高,对β-胡萝卜素的保护效果越好,乳液体系递送效果也越好。
一种评价β-胡萝卜素乳液体系对β-胡萝卜素保护效果的方法,包括步骤:
s1、将待测β-胡萝卜乳液体系分为体系均匀的两部分,部分一乳液进行37℃和50℃等温储藏,部分二乳液进行体外模拟消化;以常用乳化剂——吐温20制得的吐温乳液作为对照分别进行37℃和50℃等温储藏、体外模拟消化;
其中,所述吐温乳液的具体制备方法为:取100~500μl吐温20,均匀分散于50~60ml10mmph8的磷酸盐缓冲液中得到水相,将β-胡萝卜素加入玉米油中,在10~30khz、50~55℃条件下超声加热10~20min,配制成β-胡萝卜素质量浓度为0.05%~0.1%的油相,将油相与水相按重量比(2~5):100的比例混合,10000~15000r/min高速分散2~3min,然后经10000~12000psi高压均质3~7次,得吐温乳液;
s2、等温储藏:取5~10ml部分一乳液分别在37℃和50℃避光储藏,取储藏时间为0天、1天、4天、7天和14天的样品测定β-胡萝卜素含量,计算其保留率,计算公式为:ct×100%/c0,其中ct为待测样品β-胡萝卜素含量,c0为储藏第0天样品的β-胡萝卜素含量;
s3、体外模拟消化,包括步骤:
s31、原液制备:取部分二乳液,用10mmph8的磷酸盐缓冲液对其进行稀释,通过计算将已知油相比例的乳液稀释到油相比例为2%,记为原液;测定所述原液β-胡萝卜素含量,记为c原液;
s32、模拟口相消化:取20ml部分二乳液,与20ml模拟唾液混合,调整ph6.8,温度37℃,避光震荡2~10min,得口相消化液;震荡结束后取样测定β-胡萝卜素含量1,计算β-胡萝卜素保留率,公式为:ct1×100%/c原液,其中ct1为β-胡萝卜素含量1;
s33、模拟胃相消化:将2g氯化钠与7毫升盐酸用去离子水定容至1l作为模拟胃液;取20ml模拟胃液加入终浓度2000u/ml的胃蛋白酶,放置30min,加入20ml步骤s32所得口相消化液,调整ph2.5,避光震荡,震荡结束后得胃相消化液,取样测定β-胡萝卜素含量2,计算β-胡萝卜素保留率,公式为:ct2×100%/c原液,其中ct2为β-胡萝卜素含量2;
s34、模拟小肠相消化:取30g步骤s33所得胃相消化液在37℃恒温环境中调整ph7,与1.5ml模拟小肠液混合后加入3.5ml53.6mg/ml胆汁盐溶液,再次调整ph为7后加入终浓度为100u/ml的脂肪酶,加入酶后混合液的ph开始降低,此时开始计时并用浓度为0.1~1m的氢氧化钠溶液滴定,保持混合液的ph恒定为7,2h后结束反应,得到小肠相消化液;
其中,所述模拟小肠液具体为:用去离子水配制的氯化钙终浓度为0.25mol/l、氯化钠终浓度为3.75mol/l的混合水溶液;
s35、取步骤s34所得小肠相消化液1~5ml测定β-胡萝卜素含量3,记为c小肠相,取步骤s34剩余小肠相消化液进行离心,测定离心后上清液的β-胡萝卜素含量记为c离心后,计算β-胡萝卜素保留率和生物利用率,β-胡萝卜素保留率计算公式为:c离心后×100%/c原液;生物利用率计算公式为:c离心后×100%/c小肠相。
步骤s2、s31、s32、s33、s35所述测定β-胡萝卜素含量具体为:取200μl待测样品与2.5ml乙醇/正己烷混合液(2:3v乙醇/v正己烷)震荡混匀,时间为10~20s,随后将混合液静置,待分层后取上层正己烷层转移至10ml棕色容量瓶中,向剩余的下层乙醇层中加入1.5ml正己烷,震荡混匀,时间为10~20s,将混合液静置,待分层后取上层正己烷层转移至10ml棕色容量瓶中;再次向剩余的下层乙醇层中加入1.5ml正己烷,震荡混匀,时间为10~20s,将混合液静置,待分层后取上层正己烷层转移至10ml棕色容量瓶中;第三次向剩余的下层乙醇层中加入1.5ml正己烷,震荡混匀,时间为10~20s,将混合液静置,待分层后取上层正己烷层转移至10ml棕色容量瓶中,最后将上述收集的正己烷层溶液用正己烷定容至10ml,测定其在450nm下的吸光度,根据标准曲线计算β-胡萝卜素含量;其中,所述β-胡萝卜素标准曲线的制作方法具体为:配置浓度范围从0.1μg/ml到100μg/ml的系列β-胡萝卜素标准溶液,测定各浓度溶液在450nm下的吸光度,根据β-胡萝卜素标准溶液的浓度及吸光度绘制标准曲线。
优选方式下,步骤s32所述震荡条件具体为:温度37℃,时间2~10min。
优选方式下,步骤s33所述震荡条件具体为:温度37℃,时间2h。
优选方式下,步骤s35所述离心条件为:10000~12000g,30~45min。
其中,步骤s1所述待测β-胡萝卜乳液体系可以选用申请号为201810741555x,名称为:《大黄鱼卵分离蛋白-β-胡萝卜素乳液的制备方法》的发明专利申请制备的乳液。
本发明的有益效果是:
本发明可用于多种水包油乳液对β-胡萝卜素的保护效果的评价,且可适用于大量样品,适合做各种消化条件或其他因素对营养素生物利用率影响的研究手段。
附图说明
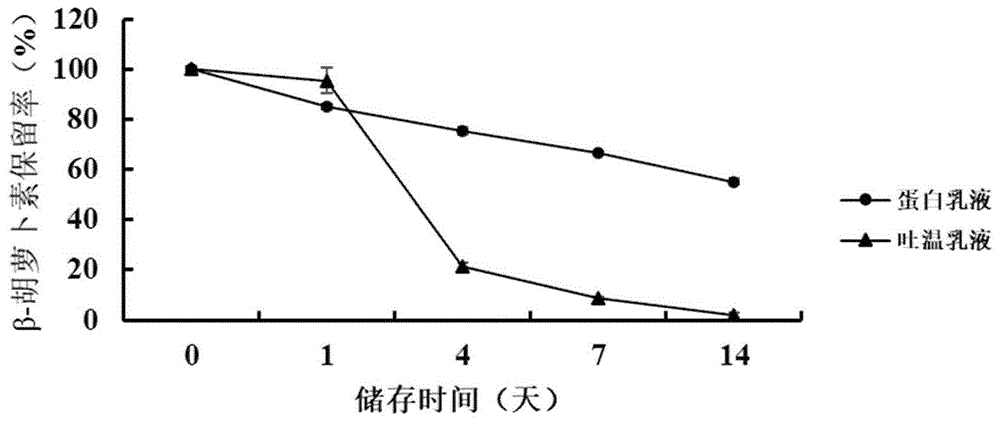
图1是蛋白乳液与吐温乳液在37℃存放0天、1天、4天、7天及14天的β-胡萝卜素保留率;
图2是蛋白乳液与吐温乳液在50℃存放0天、1天、4天、7天及14天的β-胡萝卜素保留率;
图3是蛋白乳液与吐温乳液在体外模拟消化时,原液、口相、胃相及小肠相的β-胡萝卜素保留率。
具体实施方式
下述实施例中使用的模拟唾液购自于:上海源叶生物,货号:r22154-500ml。
实施例1:
一种评价β-胡萝卜素乳液体系对β-胡萝卜素保护效果的方法,包括步骤:
s1、将待测β-胡萝卜乳液体系分为体系均匀的两部分,部分一乳液进行37℃和50℃等温储藏,部分二乳液进行体外模拟消化;以常用乳化剂——吐温20制得的吐温乳液作为对照分别进行等温储藏和体外模拟消化;
其中,所述吐温乳液的具体制备方法为:取100μl吐温20,均匀分散于50ml10mmph8的磷酸盐缓冲液中得到水相,将β-胡萝卜素加入玉米油中,在10khz、50℃条件下超声加热20min,配制成β-胡萝卜素质量浓度为0.1%的油相,将油相与水相按重量比2:100的比例混合,10000r/min高速分散2min,然后经12000psi高压均质3次,得吐温乳液;
s2、等温储藏:取6ml部分一乳液分别在37℃和50℃避光储藏,取储藏时间为0天、1天、4天、7天和14天的样品测定β-胡萝卜素含量,计算其保留率,计算公式为:ct×100%/c0,其中ct为待测样品β-胡萝卜素含量,c0为储藏第0天样品的β-胡萝卜素含量;
s3、体外模拟消化,包括步骤:
s31、原液制备:取部分二乳液,用10mmph8的磷酸盐缓冲液对其进行稀释,通过计算将已知油相比例的乳液稀释到油相比例为2%,记为原液;测定所述原液β-胡萝卜素含量,记为c原液;
s32、模拟口相消化:取20ml部分二乳液,与20ml模拟唾液混合,调整ph6.8,温度37℃,避光震荡10min,得口相消化液;震荡结束后取样测定β-胡萝卜素含量1,计算β-胡萝卜素保留率,公式为:ct1×100%/c原液,其中ct1为β-胡萝卜素含量1;
s33、模拟胃相消化:将2g氯化钠与7毫升盐酸用去离子水定容至1l作为模拟胃液;取20ml模拟胃液加入终浓度2000u/ml的胃蛋白酶,放置30min,加入20ml步骤s32所得口相消化液,调整ph2.5,37℃,避光震荡2h,震荡结束后得胃相消化液,取样测定β-胡萝卜素含量2,计算β-胡萝卜素保留率,公式为:ct2×100%/c原液,其中ct2为β-胡萝卜素含量2;
s34、模拟小肠相消化:取30g步骤s33所得胃相消化液在37℃恒温环境中调整ph7,与1.5ml模拟小肠液混合后加入3.5ml53.6mg/ml胆汁盐溶液,再次调整ph为7后加入终浓度为100u/ml的脂肪酶,加入酶后混合液的ph开始降低,此时开始计时并用浓度为0.1m的氢氧化钠溶液滴定,保持混合液的ph恒定为7,2h后结束反应,得到小肠相消化液;
其中,所述模拟小肠液具体为:用去离子水配制的氯化钙终浓度为0.25mol/l、氯化钠终浓度为3.75mol/l的混合水溶液;
s35、取步骤s34所得小肠相消化液1ml测定β-胡萝卜素含量3,记为c小肠相,取步骤s34剩余小肠相消化液进行离心,测定离心后上清液的β-胡萝卜素含量记为c离心后,计算β-胡萝卜素保留率和生物利用率,β-胡萝卜素保留率计算公式为:c离心后×100%/c原液;生物利用率计算公式为:c离心后×100%/c小肠相。
实施例2:
s1、将待测β-胡萝卜乳液体系分为体系均匀的两部分,部分一乳液进行37℃和50℃等温储藏,部分二乳液进行体外模拟消化;以常用乳化剂——吐温20制得的吐温乳液作为对照分别进行等温储藏和体外模拟消化;
其中,所述吐温乳液的具体制备方法为:取500μl吐温20,均匀分散于60ml10mmph8的磷酸盐缓冲液中得到水相,将β-胡萝卜素加入玉米油中,在30khz、55℃条件下超声加热10min,配制成β-胡萝卜素质量浓度为0.05%的油相,将油相与水相按重量比5:100的比例混合,15000r/min高速分散3min,然后经10000psi高压均质7次,得吐温乳液;
s2、等温储藏:取10ml部分一乳液分别在37℃和50℃避光储藏,取储藏时间为0天、1天、4天、7天和14天的样品测定β-胡萝卜素含量,计算其保留率,计算公式为:ct×100%/c0,其中ct为待测样品β-胡萝卜素含量,c0为储藏第0天样品的β-胡萝卜素含量;
s3、体外模拟消化,包括步骤:
s31、原液制备:取部分二乳液,用10mmph8的磷酸盐缓冲液对其进行稀释,通过计算将已知油相比例的乳液稀释到油相比例为2%,记为原液;测定所述原液β-胡萝卜素含量,记为c原液;
s32、模拟口相消化:取20ml部分二乳液,与20ml模拟唾液混合,调整ph6.8,温度37℃,避光震荡2min,得口相消化液;震荡结束后取样测定β-胡萝卜素含量1,计算β-胡萝卜素保留率,公式为:ct1×100%/c原液,其中ct为β-胡萝卜素含量1;
s33、模拟胃相消化:将2g氯化钠与7毫升盐酸用去离子水定容至1l作为模拟胃液;取20ml模拟胃液加入终浓度2000u/ml的胃蛋白酶,放置30min,加入20ml步骤s32所得口相消化液,调整ph2.5,37℃,避光震荡2h,震荡结束后得胃相消化液,取样测定β-胡萝卜素含量2,计算β-胡萝卜素保留率,公式为:ct2×100%/c原液,其中ct2为β-胡萝卜素含量2;
s34、模拟小肠相消化:取30g步骤s33所得胃相消化液在37℃恒温环境中调整ph7,与1.5ml模拟小肠液混合后加入3.5ml53.6mg/ml胆汁盐溶液,再次调整ph为7后加入终浓度为100u/ml的脂肪酶,加入酶后混合液的ph开始降低,此时开始计时并用浓度为0.1m的氢氧化钠溶液滴定,保持混合液的ph恒定为7,2h后结束反应,得到小肠相消化液;
其中,所述模拟小肠液具体为:用去离子水配制的氯化钙终浓度为0.25mol/l、氯化钠终浓度为3.75mol/l的混合水溶液;
s35、取步骤s34所得小肠相消化液5ml测定β-胡萝卜素含量3,记为c小肠相,取步骤s34剩余小肠相消化液进行离心,测定离心后上清液的β-胡萝卜素含量记为c离心后,计算β-胡萝卜素保留率和生物利用率,β-胡萝卜素保留率计算公式为:c离心后×100%/c原液;生物利用率计算公式为:c离心后×100%/c小肠相。
实施例3:
s1、将待测β-胡萝卜乳液体系分为体系均匀的两部分,部分一乳液进行37℃和50℃等温储藏,部分二乳液进行体外模拟消化;以常用乳化剂——吐温20制得的吐温乳液作为对照分别进行等温储藏和体外模拟消化;其中,所述吐温乳液的具体制备方法为:取300μl吐温20,均匀分散于55ml10mmph8的磷酸盐缓冲液中得到水相,将β-胡萝卜素加入玉米油中,在20khz、52℃条件下超声加热15min,配制成β-胡萝卜素质量浓度为0.08%的油相,将油相与水相按重量比3:100的比例混合,13000r/min高速分散3min,然后经11000psi高压均质5次,得吐温乳液。
s2、等温储藏:取10ml部分一乳液分别在37℃和50℃避光储藏,取储藏时间为0天、1天、4天、7天和14天的样品测定β-胡萝卜素含量,计算其保留率,计算公式为:ct×100%/c0,其中ct为待测样品的β-胡萝卜素含量,c0为储藏第0天样品的β-胡萝卜素含量;
s3、体外模拟消化,包括步骤:
s31、原液制备:取部分二乳液,用10mmph8的磷酸盐缓冲液对其进行稀释,通过计算将已知油相比例的乳液稀释到油相比例为2%,记为原液;测定所述原液β-胡萝卜素含量,记为c原液;
s32、模拟口相消化:取20ml部分二乳液,与20ml模拟唾液混合,调整ph6.8,温度37℃,避光震荡5min,得口相消化液;震荡结束后取样测定β-胡萝卜素含量1,计算β-胡萝卜素保留率,公式为:ct1×100%/c原液,其中ct1为β-胡萝卜素含量1;
s33、模拟胃相消化:将2g氯化钠与7毫升盐酸用去离子水定容至1l作为模拟胃液;取20ml模拟胃液加入终浓度2000u/ml的胃蛋白酶,放置30min,加入20ml步骤s32所得口相消化液,调整ph2.5,37℃,避光震荡2h,震荡结束后得胃相消化液,取样测定β-胡萝卜素含量2,计算β-胡萝卜素保留率,公式为:ct2×100%/c原液,其中ct2为β-胡萝卜素含量2;
s34、模拟小肠相消化:取30g步骤s33所得胃相消化液在37℃恒温环境中调整ph7,与1.5ml模拟小肠液混合后加入3.5ml53.6mg/ml胆汁盐溶液,再次调整ph为7后加入终浓度为100u/ml的脂肪酶,加入酶后混合液的ph开始降低,此时开始计时并用浓度为0.1m的氢氧化钠溶液滴定,保持混合液的ph恒定为7,2h后结束反应,得到小肠相消化液;
其中,所述模拟小肠液具体为:用去离子水配制的氯化钙终浓度为0.25mol/l、氯化钠终浓度为3.75mol/l的混合水溶液;
s35、取步骤s34所得小肠相消化液3ml测定β-胡萝卜素含量3,记为c小肠相,取步骤s34剩余小肠相消化液进行离心,测定离心后上清液的β-胡萝卜素含量记为c离心后,计算β-胡萝卜素保留率和生物利用率,β-胡萝卜素保留率计算公式为:c离心后×100%/c原液;生物利用率计算公式为:c离心后×100%/c小肠相。
检测结果如图1~图3所示,通过检测数据对比可知,本发明能够评价多种乳液体系对β-胡萝卜素的保护效果。经过14天相同条件下的等温储藏后,β-胡萝卜素保留率如下:37℃条件,蛋白乳液样品55.10%±1.23%,吐温乳液1.90%±0.92%,蛋白乳液样品的β-胡萝卜素保留率是吐温乳液的29倍;50℃条件,蛋白乳液样品56.03%±0.72%,吐温乳液-0.24%±0.37%;模拟消化小肠相β-胡萝卜素保留率如下:吐温乳液13.00%±1.53%,蛋白乳液样品81.63%±2.71%,蛋白乳液样品是吐温乳液的6.3倍;测得模拟消化生物利用率:吐温乳液69.81%±8.65%,蛋白乳液样品93.13%±3.59%,蛋白乳液样品是吐温乳液的1.3倍。
表1蛋白乳液与吐温乳液经过体外模拟消化后在小肠相的生物利用率
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明披露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!