UDP-Glc在肺癌转移评估中的应用的制作方法
本发明涉及一种肿瘤转移评估方法,特别是涉及一种udp-glc在肺癌转移评估中应用。
背景技术:
肺癌已经发展为十大恶性肿瘤之首。无论其发病率,还是死亡率都高居众多癌症前列,严重威胁着人们的生命健康,值得我们时刻警惕。肺癌容易发生转移,给患者身心造成双重伤害,也导致肺癌死亡率居高不下的重要原因之一。
udp-葡萄糖(udp-glc),即二磷酸尿苷葡萄糖,在生物体内,当各种苷、寡糖、多糖的生物合成时用作葡萄糖的供体。此外,在单糖的互变或糠醛酸生成时作为重要的中间产物,而在碳水化合物代谢中起着中心的作用。
现有技术中尚未报道udp-glc与肺癌转移之间的关系。
技术实现要素:
鉴于以上所述现有技术的缺点,本发明的目的在于提供一种udp-glc在肺癌转移评估中应用,用于解决现有技术中肺癌转移缺乏有效的检测方法的问题。
基于研究发现,在肺癌转移患者血液样本中udp-glc水平显著低于未转移患者体内的udp-glc水平。在此基础上申请人为肺癌转移的诊断和治疗提供了一种新思路。
为实现上述目的及其他相关目的,本发明提供一种udp-glc在制备或者筛选肺癌转移检测试剂中的应用。
进一步地,所述肺癌可以是各种类型的肺癌,例如非小细胞肺癌(nsclc)或小细胞肺癌(sclc)。
进一步地,所述肺癌转移检测试剂用于肺癌转移的判断、诊断或者肺癌患者的预后评估。
进一步地,所述udp-glc可以作为生物标志物用于判断肺癌是否发生了转移。
进一步地,研究发现,肺癌患者血清内udp-glc水平低于未转移患者大于等于31%即可判断发生了肺癌转移。
所述肺癌转移检测试剂包括特异性识别udp-glc的试剂。
本发明的另一方面提供了特异性识别udp-glc的试剂在制备肺癌转移检测试剂盒中的用途。
所述肺癌是非小细胞肺癌或者小细胞肺癌。
本发明的另一方面提供了一种肺癌转移检测试剂盒,所述试剂盒中含有特异性识别udp-glc的试剂。
进一步地,所述检测试剂盒具有检测样品中udp-glc含量的功能。
进一步地,所述样品为对肿瘤组织或者血液经过提取后获得的udp-glc。
进一步地,所述试剂盒中还包括以下试剂中的至少一种:四丁基酒石酸氢铵、磷酸二氢钾或甲醇。
进一步地,所述特异性识别udp-glc的试剂偶联可检测标记物。
进一步地,所述可检测标记物选自下物质中的至少一种:生色团、化学发光基团、荧光团、同位素或酶。
如上所述,本发明的udp-glc在肺癌转移评估中的应用,具有以下有益效果:
通过研究发现,肺癌转移患者血清内udp-glc的含量低于未转移患者体内的udp-glc水平。因此,可以通过检测患者血清内的udp-glc的水平判断肺癌是否发生转移,为进一步的治疗手段提供依据。
附图说明
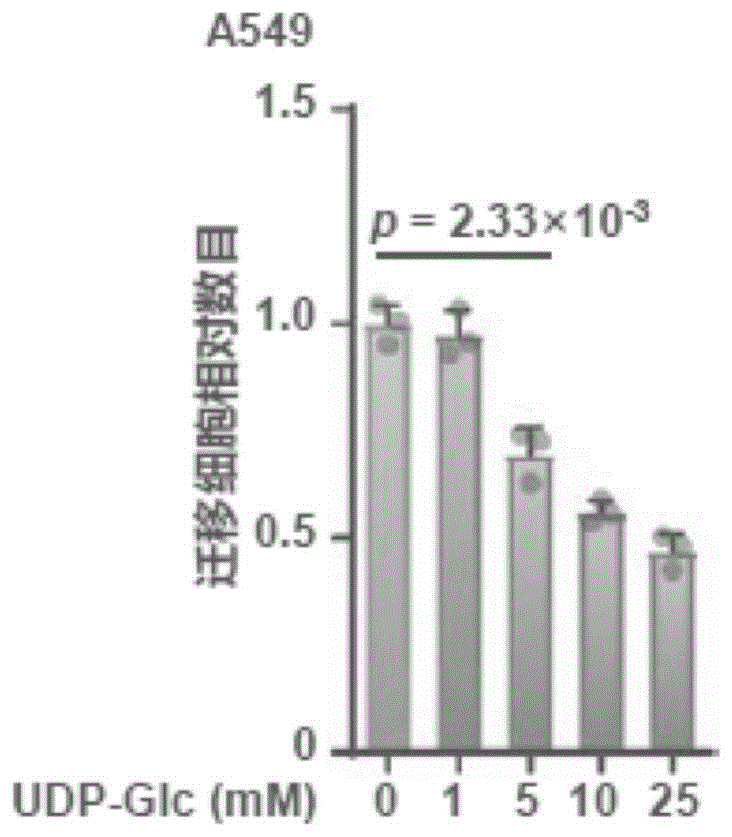
图1显示为本发明实施例1中16h后迁移细胞相对数目。
图2a显示为本发明实施例2中28天、30天拍摄小鼠荧光图(左)以及荧光强度的平均值±标准差(右)。
图2b显示为本发明实施例2中35天解剖获得小鼠肺部切片h&e染色图(上)以及推定小鼠的转移性结节的平均值±标准差(下)。
图2c显示为本发明实施例2中实验组以及对照组小鼠存活天数。
图3a显示为本发明实施例3中病人原发灶以及转移灶细胞内udp-glc水平。
图3b显示为实施例3中的roc曲线。
图4a显示为本发明实施例3中病人的血液样本中udp-glc水平。
图4b显示为实施例3中的roc曲线。
具体实施方式
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围;在本发明说明书和权利要求书中,除非文中另外明确指出,单数形式“一个”、“一”和“这个”包括复数形式。
当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
除非另外说明,本发明中所公开的实验方法、检测方法、制备方法均采用本技术领域常规的分子生物学、生物化学、染色质结构和分析、分析化学、细胞培养、重组dna技术及相关领域的常规技术。这些技术在现有文献中已有完善说明,具体可参见sambrook等
molecularcloning:alaboratorymanual,secondedition,coldspringharborlaboratorypress,1989andthirdedition,2001;ausubel等,currentprotocolsinmolecularbiology,johnwiley&sons,newyork,1987andperiodicupdates;theseriesmethodsinenzymology,academicpress,sandiego;wolffe,chromatinstructureandfunction,thirdedition,academicpress,sandiego,1998;methodsinenzymology,vol.304,chromatin(p.m.wassarmananda.p.wolffe,eds.),academicpress,sandiego,1999;和methodsinmolecularbiology,vol.119,chromatinprotocols(p.b.becker,ed.)humanapress,totowa,1999等。
本发明一方面提供一种udp-glc在制备或者筛选肺癌转移检测试剂中的应用。
于一实施例中,所述肺癌可以是各种类型的肺癌,例如非小细胞肺癌(nsclc)或者小细胞肺癌(sclc)。
肺癌转移可以骨转移、脑转移等其他组织的转移。
于一实施例中,所述肺癌转移检测试剂用于肺癌转移的判断、诊断或者肺癌患者的预后评估。
所述udp-glc可以作为生物标志物用于判断肺癌是否发生了转移。
研究发现,肺癌患者体内udp-glc低于未转移患者大于等于31%即可判断发生了肺癌转移可以判断发生了肺癌转移。
于一实施例中,所述肺癌转移检测试剂包括特异性识别udp-glc的试剂。
在另一优选例中,所述检测是针对离体样本的检测。
本发明的另一方面提供了特异性识别udp-glc的试剂在制备肺癌转移检测试剂盒中的用途。
于一实施例中所述肺癌是非小细胞肺癌或者小细胞肺癌。
本发明的另一方面提供了一种肺癌转移检测试剂盒,所述试剂盒中含有特异性识别udp-glc的试剂。
于一实施例中,所述检测试剂盒中还包括说明书和/或其他常用试剂。其他常用试剂为本领域的技术人员所熟知。
于一实施例中,所述常用试剂包括但是不限于:四丁基酒石酸氢铵、磷酸二氢钾或甲醇等试剂。
于一实施例中,可以采用液质联用的方法检测样品中udp-glc的含量。
于一实施例中,所述检测试剂盒具有检测样品中udp-glc含量的功能。
于一实施例中,所述样品为对肿瘤组织或者血液经过提取后获得的udp-glc。
于一实施例中,所述特异性识别udp-glc的试剂可以偶联可检测标记物。
于一实施例中,所述可检测标记物选自下物质中的至少一种:生色团、化学发光基团、荧光团、同位素或酶。
实施例1
通过用不同剂量的udp-glc(1mm,5mm,10mm,25mm)处理a549肺癌细胞。将收取的a549细胞(2×104)铺板到具有8μm孔径(falcon)和无血清培养基的transwell培养皿的上室中。16或24小时后,用含有4%多聚甲醛的pbs固定细胞。用棉签除去filter上侧未迁移的细胞,用含有0.4%结晶紫的10%乙醇染色filter下侧的细胞。同时,将细胞分别铺板到没有transwellfilter的平板上以确定附着细胞的总数。将迁移细胞数除以细胞总数计算相对细胞迁移数,然后进一步归一化至对照组。对于每个实验,计算filter下侧的五个随机区域(放大倍数,100×)中的细胞数,并分析三个独立的filter。
结果如图1,表明udp-glc以剂量依赖性方式抑制肿瘤细胞迁移。
实施例2
将稳定表达荧光素酶的a549细胞通过尾静脉注射(每组6只小鼠)接种随机分组的无胸腺裸鼠中。接种后14天,通过尾静脉注射给小鼠注射或不注射udp-glc(200mg/kg,每2天)。所有小鼠均饲养在上海生物化学与细胞生物学研究所的无病原体设施中。将动物随机分配到实验组。动物实验以盲法进行。所有动物实验均经中国科学院上海生物化学与细胞生物学研究所机构动物护理与使用委员会(iacuc)批准,并符合所有相关的道德规范。所有实验中的肿瘤大小均在sibcbiacuc允许的范围内。iacuc允许的最大肿瘤直径为1.5cm。
接种后28或30天,对这些接种的小鼠进行生物发光成像,拍摄肺转移的代表性图像如图2a,左图。统计分析肺中转移性肿瘤的荧光强度。将相对荧光强度用上述值除以28天未植入udp-glc处理的a549细胞接种的小鼠的强度。数据代表6只小鼠(双尾t检验)中荧光强度的平均值±标准差如图2a,右图。
接种后35天解剖肺并用4%多聚甲醛(pfa)固定。将石蜡包埋的肺组织系统地切成整个肺部,每0.5mm肺部厚度取一个5μm的切片。用这些肺切片中进行h&e染色。根据肺切片的h&e染色证实并定量转移性结节。代表性图像图2b,上图。基于这些h&e染色的肺切片定量转移性结节。数据代表6只小鼠中每只小鼠的转移性结节的平均值±标准差(双尾t检验)如图2b,下图。
另一批用或不用udp-glc处理的小鼠(每组9只小鼠)用kaplan-meier进行生存分析,双尾log-rank检验如图2c。
实验结果表明,注射udp-glc肺转移小鼠肺内转移性肿瘤的荧光强度相对于对照组小鼠的荧光强度强度低。
实施例3
每个样品需收集3×106个细胞,立即1000g离心5分钟。用磷酸缓冲盐溶液(pbs)洗涤细胞。然后将200μl冰预冷的高氯酸(0.5m)加入细胞中并剧烈混合。在冰上孵育2分钟后,将样品在10,000g,4℃下离心5分钟,然后除去细胞碎片。将上清液用50μl2.5mkoh校正ph值的1.5mk2hpo4中和,并在冰上孵育2分钟。将中和的样品再次离心以除去高氯酸钾沉淀,然后用0.2μm过滤器(millipore,billerica,ma)过滤。通过高效液相色谱(thermofisherscientific,waltham,ma)对细胞小分子提取物进行分离,色谱柱型号为nova-packc18色谱柱(thermofisherscientific,waltham,ma;3.9×150mm,
检测12个肺癌肿瘤原发灶和配对的肿瘤转移灶组织中udp-glc,结果如图3a和3b,数据代表两组样本的平均值±标准差(双尾配对t-检验),结果表明转移肿瘤灶的udp-glc水平比原发肿瘤灶低得多。
检测16个肺癌转移病人和16个肺癌非转移病人的血液样本中udp-glc水平,结果如图4a和4b,数据代表两组样本的平均值±标准差(双尾t-检验),表明远处转移的患者血液udp-glc水平低于没有远处转移的患者。
以上的实施例是为了说明本发明公开的实施方案,并不能理解为对本发明的限制。此外,本文所列出的各种修改以及发明中方法、组合物的变化,在不脱离本发明的范围和精神的前提下对本领域内的技术人员来说是显而易见的。虽然已结合本发明的多种具体优选实施例对本发明进行了具体的描述,但应当理解,本发明不应仅限于这些具体实施例。事实上,各种如上所述的对本领域内的技术人员来说显而易见的修改来获取发明都应包括在本发明的范围内。
- 还没有人留言评论。精彩留言会获得点赞!