一种快速联合诊断新冠/甲流/乙流的免疫层析检测试纸及其制备方法与流程
本发明涉及免疫诊断技术领域,尤其涉及一种快速联合诊断新冠/甲流/乙流的免疫层析检测试纸及其制备方法。
背景技术:
国际病毒分类委员会冠状病毒研究小组(csg)建议,在对相关冠状病毒进行系统分析的基础上,将2019新型冠状病毒(novelcoronaviruspneumonia,ncp)covid-19命名为“严重急性呼吸综合征冠状病毒2(sars-cov-2)”。新冠病毒感染的肺炎疫情暴发以来,市面上出现大量的pcr核酸、igm/igg检测试剂,针对抗原的检测几乎没有。例如一篇公开号cn111454839a的专利公开了一种新冠病毒核酸制备和pcr检测一体化装置,包括:壳体;样品处理模块,用于从所述样品台吸取样品;核酸提取模块,用于提取核酸;核酸转移模块,包括第三传输带和核酸提取枪,所述核酸提取枪从所述核酸提取板提取核酸;pcr检测模块,包括pcr管、温控底板、激光发射器、荧光信号检测装置、数据处理与控制元件和数据输出面板;在所述核酸提取枪将提取的核酸加入所述pcr管内后,所述激光发射器发射激光照射于所述pcr管,所述荧光信号检测装置检测所述pcr管内的荧光信号,所述数据处理与控制元件接收所述荧光信号检测装置的检测信号并将分析结果显示于所述数据输出面板。但是,单个样品采用核酸荧光pcr法需要3个小时才能给出检测结果,采用核酸测序法需要6个小时才能给出检测结果,更重要的是由于基因扩增对实验室环境要求极高导致检测通量成为最大制约因素,其极大制约了新型冠状病毒快速检测服务的供给能力,不足以全面满足疫情的防控需要。
igm/igg在人体内出现的时间较抗原相对滞后。并且目前大部分的研究主要是单一性的针对新冠病毒引起的肺炎检测的研究。而其他常见呼吸道病毒例如甲型流感病毒、乙型流感病毒等引起的患者症状与新冠病毒肺炎患者症状相似,因此在早期联合多种呼吸道病毒检测试剂对疑似病例进行筛查,快速进行患者疾病分型,对于做到快速隔离、有针对性的治疗具有非常重要的意义。
技术实现要素:
本发明为了克服新型冠状病毒的检测耗时长、检测项目单一的问题,提供一种快速联合诊断新冠/甲流/乙流的免疫层析检测试纸及其制备方法,可同时检测新型冠状病毒n/s蛋白、甲型流感病毒和乙型流感病毒,检测试纸采用抗体检测抗原的方式,抗原没有潜伏期,较检测抗体的产品更准确,检测抗原的准确性较检测抗体高,检测效率高,制备工艺简单。
为了实现上述目的,本发明采用以下技术方案:一种快速联合诊断新冠/甲流/乙流的免疫层析检测试纸,包括新冠检测试纸和甲流/乙流检测试纸,新冠检测试纸和甲流/乙流检测试纸均包括pvc底板,pvc底板中间设有改性硝酸纤维素膜,改性硝酸纤维素膜两端分别设有微球探针处理垫和吸水垫,微球探针处理垫、吸水垫的底面两侧均分别与改性硝酸纤维素膜、pvc底板连接,微球探针处理垫在与pvc底板连接端的上表面设有样品垫,样品垫的底面两侧分别与微球探针处理垫、pvc底板连接;新冠检测试纸的微球探针处理垫为乳胶标记处理垫,其改性硝酸纤维素膜的非连接段从乳胶标记处理垫一侧开始依次设有包被抗新型冠状病毒n蛋白单克隆抗体和抗新型冠状病毒s蛋白单克隆抗体的检测线t和包被链霉亲和素偶联物的质控线c一,甲流/乙流检测试纸的微球探针处理垫为金标探针处理垫,其改性硝酸纤维素膜的非连接段从金标探针处理垫一侧开始依次设有包被抗甲型流感病毒单克隆抗体的检测线a、抗乙型流感病毒单克隆抗体的检测线b和包被羊抗鼠igg抗体的质控线c二。
利用所述新冠检测试纸条,可以检测含有新冠病毒抗原的样本。将样本用试纸条进行检测,当检测线t和质控线c均出现红色条带,说明样本中含有新冠病毒;若仅有质控线c出现红色条带,说明样本不含新冠病毒;若质控线c没有出现红色条带,则说明该试纸条失效。利用所述甲流/乙流检测试纸可以检测含有甲型流感病毒抗原和/或乙型流感病毒的样本。将样本用试纸条进行检测,当检测线a和质控线c二均出现红色条带,说明样本中含有甲型流感病毒,当检测线b和质控线c二均出现红色条带,说明样本中含有乙型流感病毒,当检测线a、检测线b和质控线c二均出现红色条带,说明样本中含有甲型流感病毒和乙型流感病毒;若仅有质控线c二出现红色条带,说明样本不含甲型流感病毒和乙型流感病毒;若质控线c二没有出现红色条带,则说明该试纸条失效。
作为优选,乳胶标记处理垫为标记抗新型冠状病毒n蛋白单克隆抗体-乳胶颗粒、抗新型冠状病毒s蛋白单克隆抗体-乳胶颗粒和生物素-牛血清白蛋白-乳胶颗粒偶联物的标记垫;金标探针处理垫为标记抗甲型流感病毒单克隆抗体-胶体金、抗乙型流感病毒单克隆抗体-胶体金和鼠igg-胶体金偶联物的标记垫。
新冠检测试纸所运用的原理为乳胶免疫层析、双抗夹心法,当样本中含有新冠病毒抗原,加样后该抗原会先与标记垫中的抗新冠病毒单克隆抗体-乳胶颗粒结合,形成抗原-抗体复合物,随着层析过程的进行,该复合物会被包被在硝酸纤维素膜上的抗新冠病毒单克隆抗体捕获,形成抗新冠病毒单克隆抗体-新冠病毒抗原-抗新冠病毒单克隆抗体-乳胶颗粒,颜色呈红色,清晰可辨,且不需要任何辅助设备,操作方便。甲流/乙流检测试纸所运用的原理为胶体金免疫层析、双抗夹心法,当样本中含有甲型流感病毒和/或乙型流感病毒抗原,加样后该抗原会先与标记垫中的抗甲型流感病毒单克隆抗体-金标探针和/或乙型流感病毒单克隆抗体结合,形成抗原-抗体复合物,随着层析过程的进行,该复合物会被包被在硝酸纤维素膜上的抗甲型流感病毒单克隆抗体和/或甲型流感病毒单克隆抗体捕获,形成抗甲型流感病毒单克隆抗体-甲型流感病毒抗原-抗甲型流感病毒单克隆抗体-金标探针和/或抗乙型流感病毒单克隆抗体-乙型流感病毒抗原-抗乙型流感病毒单克隆抗体-金标探针,颜色呈紫红色,清晰可辨,且不需要任何辅助设备,操作方便。
作为进一步优选,所述乳胶颗粒直径为200-500nm,此处标记后抗新型冠状病毒n蛋白单克隆抗体-胶体金偶联物的使用浓度应为0.2-0.5%,标记后抗新型冠状病毒s蛋白单克隆抗体-胶体金偶联物的使用浓度应为0.1-0.4%;所述胶体金颗粒直径为40-100nm,此处标记后抗甲型流感病毒单克隆抗体-胶体金偶联物的使用浓度应为od1-od4,标记后抗乙型流感病毒单克隆抗体-胶体金偶联物的使用浓度应为od1-od4。胶体金颗粒大小的不同会影响产品的性能、标记偶联物的稳定性以及标记偶联物的颜色,颗粒大小<40nm颜色偏红,灵敏度较弱;而颗粒大小>100nm颜色偏黑,形状不均匀,及其容易沉淀,因此胶体金颗粒粒径为40-100nm最为合适。将抗甲型/乙型流感病毒单克隆抗体用70nm金颗粒标记成抗甲型流感病毒单克隆抗体-胶体金偶联物/抗乙型流感病毒单克隆抗体-胶体金偶联物,并同时按吸光度为od0.5、od1.0、od2.0、od3.0、od4.0、及od5.0处理到玻璃纤维上,置于真空冷冻干燥设备过夜(12-24小时)。用甲型流感病毒阳性参考品100ha/ml,300ha/ml,乙型流感病毒阳性参考品30ha/ml,90ha/ml和阴性参考品进行测试,15-20分钟读数结果显示抗甲型流感病毒单克隆抗体-胶体金偶联物的使用浓度od1-od4时,抗乙型流感病毒单克隆抗体-胶体金偶联物的使用浓度od1-od4时,效果最佳。
作为优选,所述检测线t包被的包被用抗新型冠状病毒n蛋白单克隆抗体和包被用抗新型冠状病毒s蛋白单克隆抗体浓度分别为0.5-2.0mg/ml和0.5-2.0mg/ml;所述检测线a包被的包被用抗甲型流感病毒单克隆抗体浓度为0.5-2.0mg/ml,所述检测线b包被的包被用抗乙型流感病毒单克隆抗体浓度为0.5-2.0mg/ml。当包被用抗新型冠状病毒n蛋白单克隆抗体和抗新型冠状病毒s蛋白单克隆抗体浓度低于0.5mg/ml时,反应过程中,样本中新型冠状病毒抗原被抗新型冠状病毒单克隆抗体捕获不充分,临床上出现漏检情况。同时,若包被用抗新型冠状病毒单克隆抗体仅有抗新型冠状病毒n蛋白单克隆抗体或抗新型冠状病毒s蛋白单克隆抗体,临床上也会出现漏检情况。当包被用抗新冠病毒单克隆抗体浓度高于2.0mg/ml,样本中的杂蛋白在层析过程中会被非特异性捕获,临床上会出现假阳性风险,因此检测线t包被用抗新型冠状病毒n蛋白单克隆抗体和抗新型冠状病毒s蛋白单克隆抗体的最佳浓度范围为0.5mg/ml-2.0mg/ml。当包被用抗甲型流感病毒单克隆抗体浓度低于0.5mg/ml,反应过程中,样本中甲型流感病毒抗原被抗甲型流感病毒单克隆抗体捕获不充分,临床上出现漏检情况。当包被用抗甲型流感病毒单克隆抗体浓度高于2.0mg/ml,样本中的杂蛋白在层析过程中会被非特异性捕获,临床上会出现假阳性风险,因此检测线a包被用抗甲型流感病毒单克隆抗体的最佳浓度范围为0.5mg/ml-2.0mg/ml。当包被用抗乙型流感病毒单克隆抗体浓度低于0.5mg/ml,反应过程中,样本中乙型流感病毒抗原被抗乙型流感病毒单克隆抗体捕获不充分,临床上出现漏检情况。当包被用抗乙型流感病毒单克隆抗体浓度高于2.0mg/ml,样本中的杂蛋白在层析过程中会被非特异性捕获,临床上会出现假阳性风险,因此检测线b包被用抗乙型流感病毒单克隆抗体的最佳浓度范围为0.5mg/ml-2.0mg/ml。
作为优选,所述质控线c一包被的链霉亲和素偶联物浓度为0.5-2.0mg/ml;所述质控线c二包被的羊抗鼠igg抗体浓度为1.0-3.0mg/ml。当质控线c一包被用链霉亲和素偶联物浓度低于0.5mg/ml,反应过程中,微球探针处理垫中的生物素-牛血清白蛋白-乳胶抗体偶联物和链霉亲和素偶联物结合不充分,临床上出现质控线偏弱的问题。当质控线包被用链霉亲和素偶联物浓度高于2.0mg/ml,处理到硝酸纤维素膜上的包被用链霉亲和素偶联物因溢量会出现扩散现象,影响整体美观。因此质控线c一包被用包被用链霉亲和素偶联物的最佳浓度范围为0.5mg/ml-2.0mg/ml。当质控线包被抗体浓度低于1.0mg/ml,反应过程中,标记垫中的鼠igg单克隆抗体-胶体金偶联物和羊抗鼠多克隆抗体结合不充分,临床上出现质控线偏弱的问题。当质控线包被抗体浓度高于3.0mg/ml,处理到硝酸纤维素膜上的羊抗鼠多克隆抗体因溢量会出现扩散现象,影响整体美观。因此质控线c包被用羊抗鼠igg多克隆抗体的最佳浓度范围为1.0mg/ml-3.0mg/ml。
本发明还提供一种上述快速联合诊断新冠/甲流/乙流的免疫层析检测试纸的制备方法,包括以下步骤,
步骤一-新冠检测试纸的制备,
1)制备检测线t和质控线c一:分别将抗新型冠状病毒n蛋白单克隆抗体混合抗新型冠状病毒s蛋白单克隆抗体和链霉亲和素偶联物溶液稀释后分别以1.0-1.2μl/cm的速度喷点于硝酸纤维素膜上分别作为检测线t和质控线c一,置于36-38℃烘干,得到检测线t和质控线c一;
2)乳胶标记处理垫的制备:将纯化的乳胶抗体稀释到浓度分别为0.2-0.5%时和0.1-0.4%,以2.0-3.0μl/cm的速度喷点在聚酯纤维素膜上,置于电热鼓风干燥机中,制得乳胶标记处理垫;
3)制备检测试纸:将吸水垫、样品垫、乳胶标记处理垫、包被好抗体的改性硝酸纤维素膜及pvc底板按顺序进行连接组装,即得成品;
步骤二-甲流/乙流检测试纸的制备,
1)制备检测线a、检测线b和质控线c二:分别将抗甲型流感病毒单克隆抗体、抗乙型流感病毒单克隆抗体和羊抗鼠igg溶液稀释后分别以1.0-1.2μl/cm的速度喷点于硝酸纤维素膜上分别作为检测线a、检测线b和质控线c二,置于36-38℃烘干,得到检测线a、检测线b和质控线c二;
2)金标探针处理垫的制备:将纯化的金标抗体稀释后浓度为od1-od4时包被于玻纤垫上置于冷冻干燥机处理,冻干过程中温度不超过35℃,制得金标探针处理垫;
3)制备检测试纸:将吸水垫、样品垫、金标探针处理垫、包被好抗体的改性硝酸纤维素膜及pvc底板按顺序进行连接组装,即得成品。
甲流/乙流检测试纸的制备过程中关键工艺技术为步骤2)中的冷冻干燥处理,冷冻干燥处理在真空条件下进行,相较于常规的鼓风干燥,胶体金偶联物在载体上的分布比较均匀,抗原或者抗体的效价受影响较小。但在冻干过程中,由于设备的不断升温,舱体内温度有可能超过预期温度,产品性能因此受影响,为保证舱体温度维持在预期范围内,我们在冻干机上安装温度控制设备,严格控制冻干过程中舱体温度不超过35℃,以保障产品的性能不受影响。
作为优选,所述纯化的乳胶抗体的制备过程为:
a、清洗:选取羧基化的红色乳胶颗粒,并采用1.8-2.2mg/ml磷酸氢二钠和8.6-8.8mg/ml氯化钠的混合液进行清洗;
b、标记反应:将标记用抗新冠病毒单克隆抗体加入到已清洗过的红色乳胶颗粒中,标记比例为1:40-1:20,同时加入edc活化物,恒温反应12-24h后,加入适量的终止液,离心后加入保存液并超声2-3min,得到抗新冠病毒单克隆抗体-乳胶颗粒偶联物;将生物素加入到已清洗过的红色乳胶颗粒中,标记比例为1:40-1:20同时加入edc活化物,恒温反应12-24h后,加入适量的终止液,离心后加入保存液并超声2-3min,得到生物素-乳胶颗粒偶联物;
c、将抗新冠病毒单克隆抗体-乳胶颗粒偶联物和生物素-乳胶颗粒偶联物混合即得纯化的乳胶抗体。
红色乳胶颗粒大小一般200-500nm,采用羧基化微球,先对微球进行清洗,然后加入edc活化物(edc和sulfo-nhs)进行活化,加入待标记的抗新型冠状病毒n蛋白单克隆抗体或抗新型冠状病毒s蛋白单克隆抗体进行反应,封闭未反应的微球活性表面,最后超声,并用紫外风光光度计检测偶联物的浓度,用百分比表示。在整个反应阶段,乳胶颗粒偶联物起显色作用,且由于偶联过程中,羧基和氨基酸的结合主要是通过化学键反应,因此和胶体金比,标记更加稳定,不容出现死金、漂金或金标沉淀现象。
作为进一步优选,步骤b中edc活化物的浓度范围为0.5-1.5mg/ml。偶联过程中,edc活化物的含量非常重要,其含量过多、过少都会影响最终标记物的效价,在抗新型冠状病毒n蛋白单克隆抗体或抗新型冠状病毒s蛋白单克隆抗体和乳胶抗体的偶联物过程中,分别加入0.1%,0.5%,1%,1.5%,2%,3%edc,偶联物最终浓度均大于0.9%,用乳胶稀释液将偶联物稀释到0.25%,以2.0μl/cm的速度处理到聚酯纤维素膜上,于电热鼓风干燥机中烘制过夜(12-24小时),用新冠病毒n蛋白阳性参考品100pg/ml,10ng/ml,100ng/ml,新冠病毒s蛋白阳性参考品100pg/ml,10ng/ml,100ng/ml和阴性参考品进行测试,15-20分钟读数结果显示edc的浓度范围在0.5-1.5mg/ml结果最佳。作为进一步优选,步骤b中的恒温反应温度为25-28℃。反应过程中的温度控制需要非常严格,因为反应温度范围会影响检测试纸最终测试的结果准确性,活化能edc的活化效果需要在规范的温度范围内,研究发现25-28℃条件下,edc的活化效果最佳,乳胶颗粒和抗体的偶联也最充分。作为进一步优选,步骤c中所述终止液为质量分数1-1.2mol/l的乙醇胺,所述保存液为5.8-6.2mg/mltris及5-5.2mg/mlcasein的混合液。
作为优选,所述纯化的金标抗体的制备过程:
d、获得胶体金:在98-102ml沸腾的0.008-0.012%氯金酸水溶液中加入1.8-2.2ml的0.8-1.2%柠檬酸三钠水溶液,得胶体金;
e、标记胶体金:用0.18-0.22mol/l的k2co3溶液调节上述胶体金的ph至8.4-8.6,将标记用抗甲型流感病毒单克隆抗体或抗乙型流感病毒单克隆抗体加入到调整ph后的胶体金中,标记20-25min;
f、纯化金标抗体:向步骤e的标记胶体金溶液中加入质量分数8-12%的bsa水溶液,至bsa的终浓度为0.8-1.2%,后停止加入,继续搅拌25-30min,继续加入8-12%peg20000至peg20000终浓度为0.18-0.22%,继续搅拌10-15min,离心,弃上清液,即得纯化的金标抗体。
抗甲型/乙型流感病毒单克隆抗体-胶体金偶联物制备过程中,胶体金和抗体的偶联过程尤为重要,由于该产品选择的颗粒粒径偏大,因此在偶联过程中容易出现漂金、死金现象。在反应过程中,加入复溶液可大大降低漂金、死金现象。控制氯金酸通过还原剂柠檬酸三钠反应的条件,可获得直径为65-75nm的胶体金。
作为进一步优选,步骤e中标记用抗甲型流感病毒单克隆抗体与调整ph后的胶体金的体积比为1:1-1.2,标记用抗乙型流感病毒单克隆抗体与调整ph后的胶体金的体积比为1:1-1.2。将抗甲型/乙型流感病毒单克隆抗体分别和氯金酸按1:0.5,1:1,1:1.2,1:1.4,1:1.6,1:2.0比例进行偶联,偶联物最终浓缩值均大于od100,用金标稀释液将偶联物稀释到od2,并处理到玻璃纤维上,真空冷冻烘制过夜(12-24小时),用甲型流感病毒阳性参考品100ha/ml,300ha/ml,乙型流感病毒阳性参考品30ha/ml,90ha/ml和阴性参考品进行测试,15-20分钟读数结果显示体积比为1:1-1:1.2结果最佳。作为进一步优选,步骤f中的离心条件为:离心温度4-6℃,离心转速9900-10000rpm,离心时间30-40min。蛋白质在2-8℃条件下比较稳定,胶体金偶联物离心速度一般定于12000rpm,离心时间约为0.5小时,由于该产品选用的胶体金颗粒粒径大小约为70nm,因此将离心速度控制在9900-10000rpm,离心时间为30-40分钟,效果最佳。
因此,本发明具有如下有益效果:(1)提供一种可同时快速检测新型冠状病毒n/s蛋白、甲型流感病毒/乙型流感病毒的胶体金免疫层析检测试纸,制备出利用抗体检测试纸检测抗原的产品,检测时间短,仅需15-20min,能够满足现场检测的需要;
(2)直接检测抗原的准确性较检测抗体高,制备得到能准确检测出是否感染新型冠状病毒、甲型/乙型流感病毒,抗原没有潜伏期,检测抗原能够更好的避免因窗口期抗体滴度低而出现的临床漏检情况,较检测抗体的产品更准确;
(3)操作简便,不需要借助其他设备仪器;检测结果显示直观,肉眼就可判断,适合个人使用;检测效率高,检测结果更直接,避免了抗体潜伏期所带来的检测误差;
(4)制备工艺简单,检测试纸条可在常温下保存,无需特殊的设备仪器,只需保持试纸条干燥即可,保存期可达2年。
附图说明
图1是新冠检测试纸的结构示意图。
图2是甲流/乙流检测试纸的结构示意图。
图3是本发明的试纸检测窗口结构示意图。
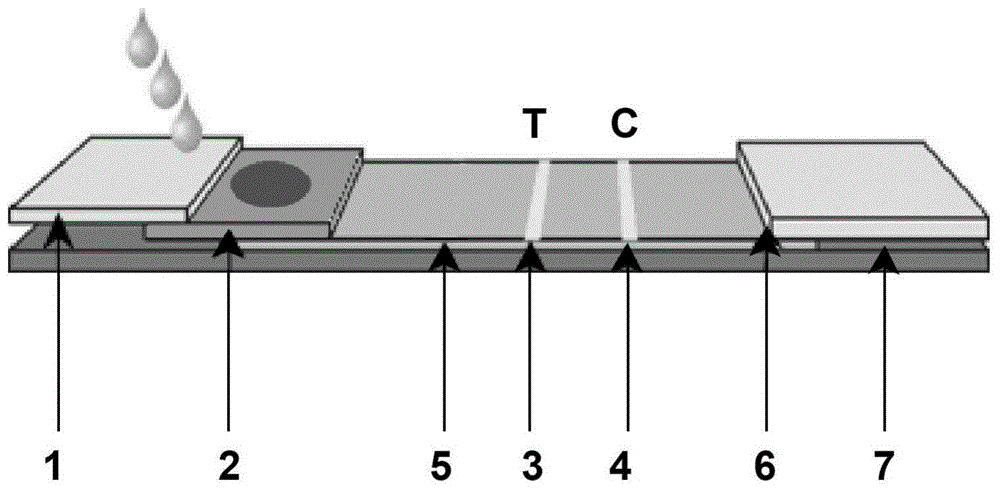
图中:1、样品垫,2、乳胶标记处理垫,3、检测线t,4、质控线c一,5、改性硝酸纤维素膜,6、吸水垫,7、pvc底板,8、质控线c二,9、金标探针处理垫,10、检测线a,11、检测线b。
具体实施方式
下面通过具体实施例,对本发明的技术方案做进一步说明。
本发明中,若非特指,所采用的原料和设备等均可从市场购得或是本领域常用的,实施例中的方法,如无特别说明,均为本领域的常规方法。
一种快速联合诊断新冠/甲流/乙流的免疫层析检测试纸,包括新冠检测试纸和甲流/乙流检测试纸。新冠检测试纸全称为快速诊断新型冠状病毒抗原的免疫层析检测试纸,如图1所示,包括pvc底板7,所述pvc底板7上表面从左到右依次设有样品垫1、微球探针处理垫、改性硝酸纤维素膜5和吸水垫6,改性硝酸纤维素膜5位于pvc底板7中间,微球探针处理垫和吸水垫6位于所述改性硝酸纤维素膜5两端,所述微球探针处理垫和所述吸水垫6一端底侧分别连接于所述改性硝酸纤维素膜5的两端、另一端底侧分别与pvc底板7连接(图1中因为角度原因看起来吸水垫6和pvc底板7之间的接触不明显,其实两者的侧边是相互连接的,下文所述的样品垫1和pvc底板7之间也是侧边相连的,图2中同理);微球探针处理垫与pvc底板7连接的一端上侧设有样品垫1,所述样品垫1一端底侧与微球探针处理垫上侧连接、另一端底侧与pvc底板7连接,新冠检测试纸的微球探针处理垫为乳胶标记处理垫2,乳胶标记处理垫2为标记抗新型冠状病毒n蛋白单克隆抗体-乳胶颗粒、抗新型冠状病毒s蛋白单克隆抗体-乳胶颗粒和生物素-牛血清白蛋白-乳胶颗粒偶联物的标记垫。所述改性硝酸纤维素膜5的非连接段从微球探针处理垫一侧开始依次设有包被抗新型冠状病毒n蛋白单克隆抗体和抗新型冠状病毒s蛋白单克隆抗体的检测线t3和包被链霉亲和素偶联物的质控线c一4。新冠检测试纸所运用的原理为乳胶免疫层析、双抗夹心法,当样本中含有新冠病毒抗原,加样后该抗原会先与标记垫中的抗新冠病毒单克隆抗体-乳胶颗粒结合,形成抗原-抗体复合物,随着层析过程的进行,该复合物会被包被在硝酸纤维素膜上的抗新冠病毒单克隆抗体捕获,形成抗新冠病毒单克隆抗体-新冠病毒抗原-抗新冠病毒单克隆抗体-乳胶颗粒,颜色呈红色,清晰可辨,且不需要任何辅助设备,操作方便。利用所述新冠检测试纸条,可以检测含有新冠病毒抗原的样本。将样本用试纸条进行检测,当检测线t3和质控线c一4均出现红色条带,说明样本中含有新冠病毒;若仅有质控线c一4出现红色条带,说明样本不含新冠病毒;若质控线c一4没有出现红色条带,则说明该试纸条失效。
甲流/乙流检测试纸全称为快速诊断甲流/乙流抗原的免疫层析检测试纸,如图2所示,包括pvc底板7,所述pvc底板7上表面从左到右依次设有样品垫1、微球探针处理垫、改性硝酸纤维素膜5和吸水垫6,改性硝酸纤维素膜5位于pvc底板7中间,所述改性硝酸纤维素膜5两端分别设有微球探针处理垫和吸水垫6,所述微球探针处理垫和所述吸水垫6一端底侧分别连接于所述改性硝酸纤维素膜5的两端,另一端底侧分别与pvc底板7连接;微球探针处理垫与pvc底板7连接的一端上侧设有样品垫1,所述样品垫1一端底侧与微球探针处理垫上侧连接,另一端底侧与pvc底板7连接,甲流/乙流检测试纸的微球探针处理垫为金标探针处理垫9,金标探针处理垫9为标记抗甲型流感病毒单克隆抗体-胶体金、抗乙型流感病毒单克隆抗体-胶体金和鼠igg-胶体金偶联物的标记垫。所述改性硝酸纤维素膜5的非连接段从微球探针处理垫一侧开始依次设有包被抗甲型流感病毒单克隆抗体的检测线a10、抗乙型流感病毒单克隆抗体的检测线b11和包被羊抗鼠igg抗体的质控线c二8。甲流/乙流检测试纸所运用的原理为胶体金免疫层析、双抗夹心法,当样本中含有甲型流感病毒和/或乙型流感病毒抗原,加样后该抗原会先与标记垫中的抗甲型流感病毒单克隆抗体-金标探针和/或乙型流感病毒单克隆抗体结合,形成抗原-抗体复合物,随着层析过程的进行,该复合物会被包被在硝酸纤维素膜上的抗甲型流感病毒单克隆抗体和/或甲型流感病毒单克隆抗体捕获,形成抗甲型流感病毒单克隆抗体-甲型流感病毒抗原-抗甲型流感病毒单克隆抗体-金标探针和/或抗乙型流感病毒单克隆抗体-乙型流感病毒抗原-抗乙型流感病毒单克隆抗体-金标探针,颜色呈紫红色,清晰可辨,且不需要任何辅助设备,操作方便。利用所述甲流/乙流检测试纸可以检测含有甲型流感病毒抗原和/或乙型流感病毒的样本。将样本用试纸条进行检测,当检测线a10和质控线c二8均出现红色条带,说明样本中含有甲型流感病毒,当检测线b11和质控线c二8均出现红色条带,说明样本中含有乙型流感病毒,当检测线a10、检测线b11和质控线c二8均出现红色条带,说明样本中含有甲型流感病毒和乙型流感病毒;若仅有质控线c二8出现红色条带,说明样本不含甲型流感病毒和乙型流感病毒;若质控线c二8没有出现红色条带,则说明该试纸条失效。
其中抗新型冠状病毒n蛋白单克隆抗体/抗新型冠状病毒s蛋白单克隆抗体/甲型流感病毒单克隆抗体/乙型流感病毒单克隆抗体的制备方法为:a.用抗原免疫八周龄的balb/c小鼠,进行皮下注射,每隔三周注射一次,共免疫五次,采血用elisa测抗体效价,效价可以,再融合前三天加强注射;b.细胞融合与培养:超强免疫3d的小鼠,脱颈致死小鼠,无菌手术取出脾脏制备脾细胞,与sp2/0细胞在peg作用下进行细胞融合,将融合后的细胞悬液加到细胞培养板上,置37℃,5%co2培养箱中以hat、ht培养基选择培养;c.细胞筛选:用间接竞争elisa筛选阳性孔,对强阳性、细胞生长旺盛的孔进行三次有限稀释克隆化;d.腹水单克隆抗体的生产:取小鼠六只,腹腔注射石蜡,2.5ml/只,10d后再注射克隆化杂交瘤细胞株,12d后抽取腹水,以辛酸一硫酸铵盐析法提纯抗体,紫外吸收法测定其浓度。
实施例1
一种快速联合诊断新冠/甲流/乙流的免疫层析检测试纸的制备方法,包括以下步骤,步骤一-新冠检测试纸的制备,
1)制备检测线t3和质控线c一4:分别将抗新型冠状病毒n蛋白单克隆抗体混合抗新型冠状病毒s蛋白单克隆抗体和链霉亲和素偶联物溶液稀释后分别以1.0μl/cm的速度喷点于硝酸纤维素膜上分别作为检测线t3和质控线c一4,置于36℃烘干,得到检测线t3和质控线c一4;所述检测线t3包被的包被用抗新型冠状病毒n蛋白单克隆抗体和抗新型冠状病毒s蛋白单克隆抗体浓度分别为0.5mg/ml和0.5mg/ml;所述质控线c一4包被的链霉亲和素偶联物浓度为0.5mg/ml;
2)乳胶标记处理垫2的制备:将纯化的乳胶抗体(抗新型冠状病毒n蛋白单克隆抗体-乳胶颗粒偶联物稀释后浓度为0.2%+抗新型冠状病毒s蛋白单克隆抗体-乳胶颗粒偶联物稀释后浓度为0.1%)以2.0μl/cm的速度喷点在聚酯纤维素膜上,置于电热鼓风干燥机中,制得乳胶标记处理垫2;所述纯化的乳胶抗体的制备过程为:a、清洗:选取羧基化的红色乳胶颗粒(购于thermofisher),并采用1.8mg/ml磷酸氢二钠和8.6mg/ml氯化钠的混合液进行清洗;b、标记反应:将标记用抗新型冠状病毒n蛋白单克隆抗体或抗新型冠状病毒s蛋白单克隆抗体加入到已清洗过的红色乳胶颗粒中,标记比例为1:40,同时加入edc活化物,25℃恒温箱内恒温反应12h后,加入1mol/l乙醇胺作为终止液,离心后加入5.8mg/mltris及5mg/mlcasein的混合保存液中并超声2min,得到抗新冠病毒单克隆抗体-乳胶颗粒偶联物;将生物素加入到已清洗过的红色乳胶颗粒中,标记比例为1:40同时加入edc活化物,25℃恒温箱内恒温反应12h后,加入1mol/l乙醇胺作为终止液,离心后加入5.8mg/mltris及5mg/mlcasein的混合保存液中并超声2min,得到生物素-乳胶颗粒偶联物;c、将抗新冠病毒单克隆抗体-乳胶颗粒偶联物和生物素-乳胶颗粒偶联物混合即得纯化的乳胶抗体;
3)制备检测试纸:将吸水垫6、样品垫1、乳胶标记处理垫2、包被好抗体的改性硝酸纤维素膜5及pvc底板7按顺序进行连接组装,即得成品。
步骤二-甲流/乙流检测试纸的制备,
1)制备检测线a10、检测线b11和质控线c二8:分别将抗甲型流感病毒单克隆抗体、抗乙型流感病毒单克隆抗体和羊抗鼠igg溶液稀释后分别以1.0μl/cm的速度喷点于硝酸纤维素膜上分别作为检测线a10、检测线b11和质控线c二8,置于36℃烘干,得到检测线a10、检测线b11和质控线c二8;所述检测线a10包被的包被用抗甲型流感病毒单克隆抗体浓度为0.5mg/ml;所述检测线b11包被的包被用抗乙型流感病毒单克隆抗体浓度为0.5mg/ml;所述质控线c二包被的羊抗鼠igg抗体浓度为1.0mg/ml;
2)金标探针处理垫9的制备:将纯化的金标抗体稀释至浓度为od1时包被于玻纤垫上置于冷冻干燥机处理,冻干过程中温度不超过35℃,制得金标探针处理垫9;所述纯化的金标抗体的制备过程:a、获得胶体金:在98ml沸腾的0.008%氯金酸水溶液中加入1.8ml的0.8%柠檬酸三钠水溶液,可获得直径为65nm的胶体金;b、标记胶体金:用0.18mol/l的k2co3溶液调节上述胶体金的ph至8.4,将浓度为1mg/ml的标记用抗甲型流感病毒单克隆抗体或抗乙型流感病毒单克隆抗体加入到调整ph后的胶体金中,标记用抗甲型流感病毒单克隆抗体或抗乙型流感病毒单克隆抗体与调整ph后的胶体金的体积比为1:1,标记20min,得到直径为40nm的抗甲型流感病毒单克隆抗体-胶体金偶联物或得到直径为40nm的抗乙型流感病毒单克隆抗体-胶体金偶联物;c、纯化金标抗体:向步骤b的标记胶体金溶液中加入质量分数8%的bsa(牛血清白蛋白)水溶液,至bsa的终浓度为0.8%,后停止加入,继续搅拌25min,继续加入8%peg20000至peg20000终浓度为0.18%,继续搅拌10min,4℃、9900rpm离心30min,弃上清液,即得纯化金标抗体;
3)制备检测试纸:将吸水垫6、样品垫1、金标探针处理垫9、包被好抗体的改性硝酸纤维素膜5及pvc底板7按顺序进行连接组装,即得成品。
步骤三、将新冠检测试纸和甲流/乙流检测试纸整合到一张底板上,得到一种快速联合诊断新冠/甲流/乙流的免疫层析检测试纸。
实施例2
与实施例1的区别在于步骤二-甲流/乙流检测试纸的制备,
1)制备检测线a10、检测线b11和质控线c二8:分别将抗甲型流感病毒单克隆抗体、抗乙型流感病毒单克隆抗体和羊抗鼠igg抗体溶液稀释后分别以1.05μl/cm的速度喷点于硝酸纤维素膜上分别作为检测线a10、检测线b11和质控线c二8,置于36.5℃烘干,得到检测线和质控线;所述检测线a10包被的包被用抗甲型流感病毒单克隆抗体浓度为1.0mg/ml;所述检测线b11包被的包被用抗乙型流感病毒单克隆抗体浓度为1.0mg/ml;所述质控线c二8包被的羊抗鼠igg抗体浓度为1.5mg/ml;
2)金标探针处理垫9的制备:将纯化的金标抗体稀释至浓度为od2时包被于玻纤垫上置于冷冻干燥机处理,制得金标探针处理垫9;所述纯化的金标抗体的制备过程:a、获得胶体金:在99ml沸腾的0.009%氯金酸水溶液中加入1.9ml的0.9%柠檬酸三钠水溶液,可获得直径为68nm的胶体金;b、标记胶体金:用0.19mol/l的k2co3溶液调节上述胶体金的ph至8.5,将浓度为2mg/ml的标记用抗甲型流感病毒单克隆抗体或抗乙型流感病毒单克隆抗体加入到调整ph后的胶体金中,标记用抗甲型流感病毒单克隆抗体或抗乙型流感病毒单克隆抗体与调整ph后的胶体金的体积比为1:1.1,标记21min,得到直径为50nm的抗甲型流感病毒单克隆抗体-胶体金偶联物或得到直径为40nm的抗乙型流感病毒单克隆抗体-胶体金偶联物;c、纯化金标抗体:向步骤b的标记胶体金溶液中加入质量分数9%的bsa(牛血清白蛋白)水溶液,至bsa的终浓度为0.9%,后停止加入,继续搅拌26min,继续加入9%peg20000至peg20000终浓度为0.19%,继续搅拌11min,5℃、9920rpm离心32min,弃上清液,即得纯化金标抗体。
实施例3
与实施例1的区别在于步骤二-甲流/乙流检测试纸的制备,
1)制备检测线a10、检测线b11和质控线c二8:分别将抗甲型流感病毒单克隆抗体、抗乙型流感病毒单克隆抗体和羊抗鼠igg抗体溶液稀释后分别以1.1μl/cm的速度喷点于硝酸纤维素膜上分别作为检测线a10、检测线b11和质控线c二8,置于37℃烘干,得到检测线和质控线;所述检测线a10包被的包被用抗甲型流感病毒单克隆抗体浓度为1.5mg/ml;所述检测线b11包被的包被用抗乙型流感病毒单克隆抗体浓度为1.5mg/ml;所述质控线c二8包被的羊抗鼠igg抗体浓度为2.0mg/ml;
2)金标探针处理垫9的制备:将纯化的金标抗体稀释至浓度为od3时包被于玻纤垫上置于冷冻干燥机处理,制得金标探针处理垫9;所述纯化的金标抗体的制备过程:a、获得胶体金:在100ml沸腾的0.01%氯金酸水溶液中加入2.0ml的1.0%柠檬酸三钠水溶液,可获得直径为70nm的胶体金;b、标记胶体金:用0.2mol/l的k2co3溶液调节上述胶体金的ph至8.5,将浓度为3mg/ml的标记用抗甲型流感病毒单克隆抗体或抗乙型流感病毒单克隆抗体加入到调整ph后的胶体金中,标记用抗甲型流感病毒单克隆抗体或抗乙型流感病毒单克隆抗体与调整ph后的胶体金的体积比为1:1.1,标记23min,得到直径为60nm的抗甲型流感病毒单克隆抗体-胶体金偶联物或得到直径为40nm的抗乙型流感病毒单克隆抗体-胶体金偶联物;c、纯化金标抗体:向步骤b的标记胶体金溶液中加入质量分数10%的bsa(牛血清白蛋白)水溶液,至bsa的终浓度为1.0%,后停止加入,继续搅拌28min,继续加入10%peg20000至peg20000终浓度为0.2%,继续搅拌12min,5℃、9950rpm离心35min,弃上清液,即得纯化金标抗体。
对比例1
与实施例3的区别在于,抗甲型流感病毒单克隆抗体-胶体金偶联物和抗乙型流感病毒单克隆抗体-胶体金偶联物的直径过小为20nm。
对比例2
与实施例3的区别在于,省去了步骤2)中纯化金标抗体的步骤。
对比例3
与实施例3的区别在于,步骤a中胶体金粒径过大为90mm。
对比例4
与实施例3的区别在于,将最终离心速度降至6000r/min,离心0.5小时。
对比例5
与实施例3的区别在于,步骤2)处理好的金标抗体,置于40℃鼓风干燥设备中烘制过夜(12-24小时)。
实施例4
与实施例1的区别在于步骤二-甲流/乙流检测试纸的制备,
1)制备检测线a10、检测线b11和质控线c二8:分别将抗甲型流感病毒单克隆抗体、抗乙型流感病毒单克隆抗体和羊抗鼠igg抗体溶液稀释后分别以1.1μl/cm的速度喷点于硝酸纤维素膜上分别作为检测线a10、检测线b11和质控线c二8,置于37.5℃烘干,得到检测线和质控线;所述检测线a10包被的包被用抗甲型流感病毒单克隆抗体浓度为2.0mg/ml;所述检测线b11包被的包被用抗乙型流感病毒单克隆抗体浓度为2.0mg/ml;所述质控线c二8包被的羊抗鼠igg抗体浓度为2.5mg/ml;
2)金标探针处理垫9的制备:将纯化的金标抗体稀释至浓度为od4时包被于玻纤垫上置于冷冻干燥机处理,制得金标探针处理垫9;所述纯化的金标抗体的制备过程:a、获得胶体金:在101ml沸腾的0.011%氯金酸水溶液中加入2.1ml的1.1%柠檬酸三钠水溶液,可获得直径为72nm的胶体金;b、标记胶体金:用0.21mol/l的k2co3溶液调节上述胶体金的ph至8.5,将浓度为4mg/ml的标记用抗甲型流感病毒单克隆抗体或抗乙型流感病毒单克隆抗体加入到调整ph后的胶体金中,标记用抗甲型流感病毒单克隆抗体或抗乙型流感病毒单克隆抗体与调整ph后的胶体金的体积比为1:1.1,标记24min,得到直径为80nm的抗甲型流感病毒单克隆抗体-胶体金偶联物或得到直径为40nm的抗乙型流感病毒单克隆抗体-胶体金偶联物;c、纯化金标抗体:向步骤b的标记胶体金溶液中加入质量分数11%的bsa(牛血清白蛋白)水溶液,至bsa的终浓度为1.1%,后停止加入,继续搅拌29min,继续加入11%peg20000至peg20000终浓度为0.21%,继续搅拌14min,5.5℃、9980rpm离心38min,弃上清液,即得纯化金标抗体。
实施例5
与实施例1的区别在于步骤二-甲流/乙流检测试纸的制备,
1)制备检测线a10、检测线b11和质控线c二8:分别将抗甲型流感病毒单克隆抗体、抗乙型流感病毒单克隆抗体和羊抗鼠igg抗体溶液稀释后分别以1.2μl/cm的速度喷点于硝酸纤维素膜上分别作为检测线a10、检测线b11和质控线c二8,置于38℃烘干,得到检测线和质控线;所述检测线a10包被的包被用抗甲型流感病毒单克隆抗体浓度为2.0mg/ml;所述检测线b11包被的包被用抗乙型流感病毒单克隆抗体浓度为2.0mg/ml;所述质控线c二8包被的羊抗鼠igg抗体浓度为3.0mg/ml;
2)金标探针处理垫9的制备:将纯化的金标抗体稀释至浓度为od4时包被于玻纤垫上置于冷冻干燥机处理,制得金标探针处理垫9;所述纯化的金标抗体的制备过程:a、获得胶体金:在102ml沸腾的0.012%氯金酸水溶液中加入2.2ml的1.2%柠檬酸三钠水溶液,可获得直径为75nm的胶体金;b、标记胶体金:用0.22mol/l的k2co3溶液调节上述胶体金的ph至8.6,将浓度为5mg/ml的标记用抗甲型流感病毒单克隆抗体或抗乙型流感病毒单克隆抗体加入到调整ph后的胶体金中,标记用抗甲型流感病毒单克隆抗体或抗乙型流感病毒单克隆抗体与调整ph后的胶体金的体积比为1:1.2,标记25min,得到直径为100nm的抗甲型流感病毒单克隆抗体-胶体金偶联物或得到直径为40nm的抗乙型流感病毒单克隆抗体-胶体金偶联物;c、纯化金标抗体:向步骤b的标记胶体金溶液中加入质量分数12%的bsa(牛血清白蛋白)水溶液,至bsa的终浓度为1.2%,后停止加入,继续搅拌30min,继续加入12%peg20000至peg20000终浓度为0.22%,继续搅拌15min,6℃、10000rpm离心40min,弃上清液,即得纯化金标抗体。
实施例6
与实施例1的区别在于步骤一-新冠检测试纸的制备,
1)制备检测线t3和质控线c一4:分别将抗新型冠状病毒n蛋白单克隆抗体混合抗新型冠状病毒s蛋白单克隆抗体和链霉亲和素偶联物溶液稀释后分别以1.05μl/cm的速度喷点于硝酸纤维素膜上分别作为检测线t3和质控线c一4,置于36.5℃烘干,得到检测线和质控线;所述检测线t3包被的包被用抗新型冠状病毒n蛋白单克隆抗体和抗新型冠状病毒s蛋白单克隆抗体浓度分别为1.0mg/ml和1.0mg/ml;所述质控线c一4包被的链霉亲和素偶联物浓度为1.0mg/ml;
2)乳胶标记处理垫2的制备:将纯化的乳胶抗体(抗新型冠状病毒n蛋白单克隆抗体-乳胶颗粒偶联物稀释后浓度为0.3%+抗新型冠状病毒s蛋白单克隆抗体-乳胶颗粒偶联物稀释后浓度为0.2%)以2.2μl/cm的速度处理到聚酯纤维素膜上,置于电热鼓风干燥机中过夜,制得乳胶标记处理垫2;所述纯化的乳胶抗体的制备过程为:a、清洗:选取羧基化的红色乳胶颗粒(购于thermofisher),并采用1.9mg/ml磷酸氢二钠和8.65mg/ml氯化钠的混合液进行清洗;b、标记反应:将标记用抗新型冠状病毒n蛋白单克隆抗体或抗新型冠状病毒s蛋白单克隆抗体加入到已清洗过的红色乳胶颗粒中,标记比例为1:35,同时加入edc活化物,26℃恒温箱内恒温反应16h后,加入1.2mol/l乙醇胺作为终止液,离心后加入5.9mg/mltris及5.05mg/mlcasein的混合保存液中并超声2.5min,得到抗新冠病毒单克隆抗体-乳胶颗粒偶联物;将生物素加入到已清洗过的红色乳胶颗粒中,标记比例为1:35同时加入edc活化物,26℃恒温箱内恒温反应16h后,加入1.2mol/l乙醇胺作为终止液,离心后加入5.9mg/mltris及5.05mg/mlcasein的混合保存液中并超声2.5min,得到生物素-乳胶颗粒偶联物;c、将抗新冠病毒单克隆抗体-乳胶颗粒偶联物和生物素-乳胶颗粒偶联物混合即得纯化的乳胶抗体。
实施例7
与实施例1的区别在于步骤一-新冠检测试纸的制备,
1)制备检测线t3和质控线c一4:分别将抗新型冠状病毒n蛋白单克隆抗体混合抗新型冠状病毒s蛋白单克隆抗体和链霉亲和素偶联物溶液稀释后分别以1.1μl/cm的速度喷点于硝酸纤维素膜上分别作为检测线t3和质控线c一4,置于37℃烘干,得到检测线和质控线;所述检测线t3包被的包被用抗新型冠状病毒n蛋白单克隆抗体和抗新型冠状病毒s蛋白单克隆抗体浓度分别为1.5mg/ml和1.5mg/ml;所述质控线c一4包被的链霉亲和素偶联物浓度为1.5mg/ml;
2)乳胶标记处理垫2的制备:将纯化的乳胶抗体(抗新型冠状病毒n蛋白单克隆抗体-乳胶颗粒偶联物稀释后浓度为0.4%+抗新型冠状病毒s蛋白单克隆抗体-乳胶颗粒偶联物稀释后浓度为0.3%)以2.5μl/cm的速度处理到聚酯纤维素膜上,置于电热鼓风干燥机中过夜,制得乳胶标记处理垫2;所述纯化的乳胶抗体的制备过程为:a、清洗:选取羧基化的红色乳胶颗粒(购于thermofisher),并采用2mg/ml磷酸氢二钠和8.7mg/ml氯化钠的混合液进行清洗;b、标记反应:将标记用抗新型冠状病毒n蛋白单克隆抗体或抗新型冠状病毒s蛋白单克隆抗体加入到已清洗过的红色乳胶颗粒中,标记比例为1:30,同时加入edc活化物,26℃恒温箱内恒温反应18h后,加入1.1mol/l乙醇胺作为终止液,离心后加入6mg/mltris及5.1mg/mlcasein的混合保存液中并超声2.5min,得到抗新冠病毒单克隆抗体-乳胶颗粒偶联物;将生物素加入到已清洗过的红色乳胶颗粒中,标记比例为1:30同时加入edc活化物,26℃恒温箱内恒温反应18h后,加入1.1mol/l乙醇胺作为终止液,离心后加入6mg/mltris及5.1mg/mlcasein的混合保存液中并超声2.5min,得到生物素-乳胶颗粒偶联物;c、将抗新冠病毒单克隆抗体-乳胶颗粒偶联物和生物素-乳胶颗粒偶联物混合即得纯化的乳胶抗体。
对比例6
与实施例7的区别在于,活化物edc的使用浓度为0.1%。
对比例7
与实施例7的区别在于,将反应过程置于20℃恒温箱过夜。
对比例8
与实施例7的区别在于,终止反应后,超声30秒。
实施例8
与实施例1的区别在于步骤一-新冠检测试纸的制备,
制备检测线t3和质控线c一4:分别将抗新型冠状病毒n蛋白单克隆抗体混合抗新型冠状病毒s蛋白单克隆抗体和链霉亲和素偶联物溶液稀释后分别以1.15μl/cm的速度喷点于硝酸纤维素膜上分别作为检测线t3和质控线c一4,置于37.5℃烘干,得到检测线和质控线;所述检测线t3包被的包被用抗新型冠状病毒n蛋白单克隆抗体和抗新型冠状病毒s蛋白单克隆抗体浓度分别为2.0mg/ml和2.0mg/ml;所述质控线c一4包被的链霉亲和素偶联物浓度为2.0mg/ml;
2)乳胶标记处理垫2的制备:将纯化的乳胶抗体(抗新型冠状病毒n蛋白单克隆抗体-乳胶颗粒偶联物稀释后浓度为0.5%+抗新型冠状病毒s蛋白单克隆抗体-乳胶颗粒偶联物稀释后浓度为0.4%)以2.8μl/cm的速度处理到聚酯纤维素膜上,置于电热鼓风干燥机中过夜,制得乳胶标记处理垫2;所述纯化的乳胶抗体的制备过程为:a、清洗:选取羧基化的红色乳胶颗粒(购于thermofisher),并采用2.1mg/ml磷酸氢二钠和8.75mg/ml氯化钠的混合液进行清洗;b、标记反应:将标记用抗新型冠状病毒n蛋白单克隆抗体或抗新型冠状病毒s蛋白单克隆抗体加入到已清洗过的红色乳胶颗粒中,标记比例为1:25,同时加入edc活化物,27.5℃恒温箱内恒温反应22h后,加入1.15mol/l乙醇胺作为终止液,离心后加入6.1mg/mltris及5.15mg/mlcasein的混合保存液中并超声2.8min,得到抗新冠病毒单克隆抗体-乳胶颗粒偶联物;将生物素加入到已清洗过的红色乳胶颗粒中,标记比例为1:25同时加入edc活化物,27.5℃恒温箱内恒温反应22h后,加入1.15mol/l乙醇胺作为终止液,离心后加入6.1mg/mltris及5.15mg/mlcasein的混合保存液中并超声2.8min,得到生物素-乳胶颗粒偶联物;c、将抗新冠病毒单克隆抗体-乳胶颗粒偶联物和生物素-乳胶颗粒偶联物混合即得纯化的乳胶抗体。
实施例9
与实施例1的区别在于步骤一-新冠检测试纸的制备,
1)制备检测线t3和质控线c一4:分别将抗新型冠状病毒n蛋白单克隆抗体混合抗新型冠状病毒s蛋白单克隆抗体和链霉亲和素偶联物溶液稀释后分别以1.2μl/cm的速度喷点于硝酸纤维素膜上分别作为检测线t3和质控线c一4,置于36-38℃烘干,得到检测线和质控线;所述检测线t3包被的包被用抗新型冠状病毒n蛋白单克隆抗体和抗新型冠状病毒s蛋白单克隆抗体浓度分别为2.0mg/ml和2.0mg/ml;所述质控线c一4包被的链霉亲和素偶联物浓度为2.0mg/ml;
2)乳胶标记处理垫2的制备:将纯化的乳胶抗体(抗新型冠状病毒n蛋白单克隆抗体-乳胶颗粒偶联物稀释后浓度为0.5%+抗新型冠状病毒s蛋白单克隆抗体-乳胶颗粒偶联物稀释后浓度为0.4%)以3μl/cm的速度处理到聚酯纤维素膜上,置于电热鼓风干燥机中过夜,制得乳胶标记处理垫2;所述纯化的乳胶抗体的制备过程为:a、清洗:选取羧基化的红色乳胶颗粒(购于thermofisher),并采用2.2mg/ml磷酸氢二钠和8.8mg/ml氯化钠的混合液进行清洗;b、标记反应:将标记用抗新型冠状病毒n蛋白单克隆抗体或抗新型冠状病毒s蛋白单克隆抗体加入到已清洗过的红色乳胶颗粒中,标记比例为1:20,同时加入edc活化物,28℃恒温箱内恒温反应24h后,加入1.2mol/l乙醇胺作为终止液,离心后加入6.2mg/mltris及5.2mg/mlcasein的混合保存液中并超声3min,得到抗新冠病毒单克隆抗体-乳胶颗粒偶联物;将生物素加入到已清洗过的红色乳胶颗粒中,标记比例为1:20同时加入edc活化物,28℃恒温箱内恒温反应24h后,加入1.2mol/l乙醇胺作为终止液,离心后加入6.2mg/mltris及5.2mg/mlcasein的混合保存液中并超声3min,得到生物素-乳胶颗粒偶联物;c、将抗新冠病毒单克隆抗体-乳胶颗粒偶联物和生物素-乳胶颗粒偶联物混合即得纯化的乳胶抗体。
性能测试
(1)对实施例1-5和对比例1-5的甲流/乙流检测试纸进行性能试验,结果如表1所示。分别用甲型流感病毒阳性参考品100ha/ml,300ha/ml,乙型流感病毒阳性参考品30ha/ml,90ha/ml和阴性参考品滴加到本发明的试纸条加样孔,进行检测,每个浓度设定重复三次,检测结果完全一致,证明本发明试纸条检测结果稳定可靠。稳定性试验采用加速稳定性试验,将同一批次的试纸条分别置于45℃和55℃烘箱,并以下表的时间短分别对甲型/乙型流感病毒标准品进行检测。
表1
结论分析:实施例1-5均能制备出检测灵敏度高、检测结果准确、使用周期长的胶体金免疫层析检测试纸。对比例1-5与实施例3相比较,对比例1中抗甲型流感病毒单克隆抗体-胶体金偶联物和抗乙型流感病毒单克隆抗体-胶体金偶联物的直径过小为20nm。抗体和胶体金的偶联方式为物理吸附,粒径过小的胶体金虽然稳定,但是其表面吸附的抗甲型流感病毒单克隆抗体或抗乙型流感病毒单克隆抗体的数量有限,影响产品的灵敏度。对比例2中省去了步骤2)中纯化金标抗体的步骤,在标记过程中,因杂蛋白的干扰,可能会出现临床假阳性风险。对比例3中步骤a中胶体金粒径过大为90mm。该产品所用胶体金粒径胶粒径过大,在标记过程容易出现漂金、死金,且标记好的胶体金偶联物颜色偏黑,临床容易出现假阳性。对比例4中将最终离心速度降至6000r/min,离心0.5小时。离心速度偏慢,时间偏短,离心不充分,胶体金偶联物的浓缩值偏低,部分有效成分未被收集,灵敏度偏弱。对比例5中步骤1)处理好的抗体金标,置于40℃鼓风干燥设备中烘制过夜(12-24小时)。鼓风干燥设备温度偏高,且鼓风效果容易导致分子向边缘扩散,烘干后的标记垫不均匀,临床上会出现个体差异。
(2)对实施例1、实施例6-9和对比例6-8的新冠检测试纸进行性能试验,结果如表2所示。灵敏度试验,分别用新冠病毒n蛋白阳性参考品100pg/ml,10ng/ml,100ng/ml,新冠病毒s蛋白阳性参考品100pg/ml,10ng/ml,100ng/ml和阴性参考品滴加到本发明的试纸条加样孔进行检测,每个浓度设定重复三次,检测结果完全一致,证明本发明试纸条检测结果稳定可靠。稳定性试验采用加速稳定性试验,将同一批次的试纸条分别置于45℃和55℃烘箱,并以下表的时间段分别对新冠病毒标准品进行检测。
表2
结论分析:实施例1和6-9均能制备出检测灵敏度高、检测结果准确、使用周期长的快速诊断新冠检测试纸。对比例6与实施例7相比较,对比例6中活化物edc的使用浓度为0.1%。过低的活化物能影响抗体和彩色乳胶的结合效果,临床上容易出现漏检风险。对比例7中将反应过程置于20℃恒温箱过夜。活化物质edc对温度比较敏感,低于25℃活化物效果不明显,影响抗体和彩色颗粒的结合效果,临床上容易出现漏检风险。对比例8中步骤c中终止反应后,超声30秒。超声的目的是消除乳胶的凝集现象,超声时间过短,乳胶凝集消除不充分,临床上容易出现假阳性风险。
如图3所示,本发明的检测试纸滴加阳性标准品后,试纸检测线显色,滴加阴性样品后,试纸检测线不显色。新冠检测试剂盒将检测样本滴加在“s”样本孔内,样本中的新冠抗原与标记垫中的新冠抗体结合,形成新冠抗原-抗体复合物,该复合物在毛细管作用下流动至硝酸纤维素膜上的检测线位置t,与检测线t3中的新冠抗体结合反应。甲型/乙型流感病毒检测试剂盒将检测样本滴加在“s”样本孔内,样本中的甲型流感病毒或/和乙型流感病毒抗原与标记垫中的甲型流感病毒或/和乙型流感病毒抗原抗体结合,形成甲型流感病毒抗原-抗体和/或乙型流感病毒抗原-抗体复合物,该复合物在毛细管作用下流动至硝酸纤维素膜上的检测线位置a和b,与检测线a10中的甲型流感病毒抗体和/或检测线b11中的乙型流感病毒抗体结合反应。
由实施例1-9以及对比例1-8的数据可知,只有在本发明权利要求范围内的方案,才能够在各方面均能满足上述要求,得出最优化的方案,得到最优的性能的胶体金免疫层析检测试纸。而对于配比的改动、原料的替换/加减,或者加料顺序的改变,均会带来相应的负面影响。
(3)临床样本验证
发明人收集50例感染新冠病毒,45例感染甲型流感,30例感染乙型流感的样本,利用本发明制备的胶体金试纸条进行检测,检测结果显示,50例感染新冠病毒,45例感染甲型流感,30例感染乙型流感的样本均显示阳性,与pcr实验检测结果完全一致。证明本发明的试纸条结果可靠,特异性强,操作简便、快速,而且可以不用借助任何设备就能进行临床样本的检测,检测结果显示直观、准确。
以上所述,仅是本发明的较佳实施例而已,并非对本发明作任何形式上的限制,虽然本发明已以较佳实施例揭露如上,然而并非用以限定本发明,任何熟悉本专业的技术人员,在不脱离本发明技术方案范围内,当可利用上述揭示的技术内容作出些许更动或修饰为等同变化的等效实施例,但凡是未脱离本发明技术方案内容,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与修饰,均仍属于本发明技术方案的范围内。
- 还没有人留言评论。精彩留言会获得点赞!