铁蛋白检测试剂盒及其制备方法与流程
本发明实施例涉及生化检测领域,特别涉及铁蛋白检测试剂盒及其制备方法。
背景技术:
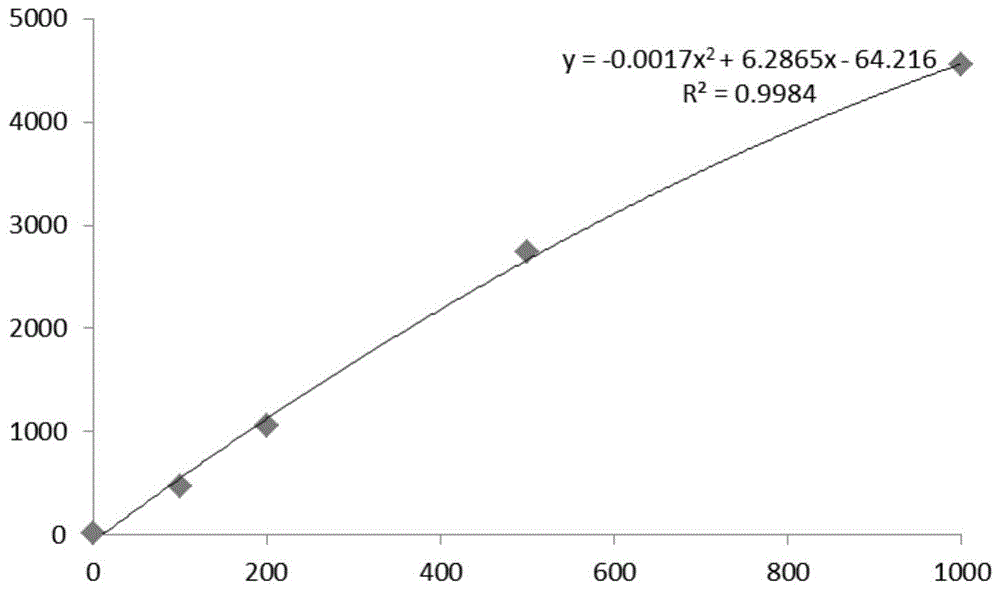
:铁蛋白(ferritin,fer)是一种可溶性组织蛋白,其分子量较大,能与生物体内的铁离子进行强结合,可防止游离铁损害人体正常细胞,是体内铁元素的主要储存形式。通常情况下,生物体内的铁离子与铁蛋白以结合态形式存在,因此生物体内的铁储存状况可通过铁蛋白含量来表征。正常人血清中铁蛋白含量较少,但当某些疾病存在时,比如炎症、肝脏疾病,尤其是有恶性肿瘤存在时,血清铁蛋白含量显著上升,因此,铁蛋白的检测在对疾病的筛查诊断和治疗中都起到非常重要的作用。免疫比浊法,其基本原理是:当抗原与抗体在特殊稀释系统中反应而且比例合适(一般规定抗体过量)时,形成的可溶性免疫复合物在稀释系统中增浊剂的作用下,自液相析出,形成微粒,使反应液出现浊度。当抗体浓度固定时,形成的免疫复合物的量随着检样中抗原量的增加而增加,反应液的浊度也随之增加。通过测定反应液的浊度与一系列标准品对照,即可计算出检样中抗原的含量。发明人发现现有技术中至少存在如下问题:现有的铁蛋白测定试剂盒易受干扰物质(如类风湿,乳糜等)影响,抗干扰能力差,因此存在重复性差、稳定性差等缺点,进而影响铁蛋白测定准确性和可靠性。技术实现要素:本发明实施方式的目的在于提供一种铁蛋白检测试剂盒及其制备方法,使得试剂盒抗干扰能力提升,以获得更好的重复性、稳定性。为解决上述技术问题,本发明的实施方式提供了一种铁蛋白检测试剂盒,包括彼此独立的试剂r1和试剂r2,所述试剂r1包括:ph范围为6~8的第一缓冲液、防腐剂、表面活性剂、促聚剂、稳定剂、电解质以及兔抗人抗体;所述试剂r2包括:ph范围为8~10的第二缓冲液、防腐剂以及铁蛋白抗体乳胶颗粒。本发明实施方式相对于现有技术而言,现有技术中,干扰物质与试剂r2中铁蛋白抗体乳胶颗粒结合,产生的浊度造成检测不准确,忽高忽低;本发明实施方式优化了试剂r1和试剂r2的组成,致使干扰物质先与试剂r1中成分结合,从而阻断干扰物质与试剂r2结合,避免了干扰物质与试剂r2中铁蛋白抗体乳胶颗粒结合产生的浊度,提高了试剂盒抗干扰能力,优化后的试剂r1和试剂r2的组成可使得试剂盒重复性更好,稳定性更佳。所述干扰物质先与试剂r1中成分结合,可认为是干扰物质与试剂r1中表面活性剂、促聚剂、稳定剂以及兔抗人抗体中至少一种结合,进一步地,可认为是干扰物质与试剂r1中表面活性剂与兔抗人抗体中至少一种结合。一实施例中,所述试剂r1与试剂r2之比为9:1至1:9。一实施例中,所述试剂r1与试剂r2之比为3:1~1:3。一实施例中,所述试剂r1中,所述防腐剂的质量百分含量范围为3~6‰;一实施例中,所述表面活性剂的质量百分含量范围为1~3‰;一实施例中,所述促聚剂的质量百分含量范围为0.1~2%;一实施例中,所述稳定剂的质量百分含量范围为1~3‰;一实施例中,所述电解质的摩尔浓度范围为0.1~2mol/l;一实施例中,所述兔抗人抗体质量百分含量范围为1~3‰;一实施例中,所述试剂r2中,所述防腐剂的质量百分含量范围为0.1~3‰;一实施例中,所述铁蛋白抗体乳胶颗粒的质量浓度范围为0.005~0.1mg/ml。一实施例中,所述试剂r1中,所述防腐剂的质量百分含量范围为4~5‰;所述表面活性剂的质量百分含量范围为1.5~2.5‰;所述促聚剂的质量百分含量范围为0.4~1%;所述稳定剂的质量百分含量范围为1.5~2.5‰;所述电解质的摩尔浓度范围为0.4~1mol/l;所述兔抗人抗体质量百分含量范围为1.5~2.5‰;所述试剂r2中,所述防腐剂的质量百分含量范围为0.5~1.5‰;所述铁蛋白抗体乳胶颗粒的质量浓度范围为0.01~0.5mg/ml。一实施例中,所述试剂r1中,所述防腐剂的质量百分含量为5‰;所述表面活性剂的质量百分含量为2‰;所述促聚剂的质量百分含量为0.5%;所述稳定剂的质量百分含量为2‰;所述电解质的摩尔浓度为0.5mol/l;所述兔抗人抗体质量百分含量为2‰;所述试剂r2中,所述防腐剂的质量百分含量为1‰;所述铁蛋白抗体乳胶颗粒的质量浓度为;0.03mg/ml。一实施例中,所述兔抗人抗体,可以是任意种兔抗人抗体,可以是单克隆抗体,也可以是多克隆抗体。一实施例中,所述兔抗人抗体选自:兔抗人视黄醇抗体、兔抗人igg抗体、兔抗人igm抗体中至少一种。一实施例中,所述第一缓冲液选自磷酸盐缓冲液、hepes、pipes、mops、巴比妥钠盐酸缓冲溶液中至少一种。一实施例中,所述防腐剂选自:叠氮钠、苯酚、对羟基苯甲酸、对羟基苯甲酸乙酯、硫柳汞、proclin-300、proclin-950中至少一种。一实施例中,所述表面活性剂选自:tween-20、tween80、tritonx100、tritonx405、b66至少一种。一实施例中,所述促聚剂选自:peg6000、peg8000、peg20000、pvp中至少一种。一实施例中,所述电解质选自:钠盐、钾盐中至少一种。一实施例中,所述稳定剂选自:酪蛋白、甘露醇、壳聚糖、乙二胺四乙酸二钠、牛血清白蛋白中至少一种。一实施例中,所述第二缓冲液选自:tris缓冲液、巴比妥钠盐酸缓冲溶液、甘氨酸-氢氧化钠缓冲溶液、碳酸氢钠-碳酸钠缓冲溶液中至少一种。一实施例中,所述铁蛋白抗体乳胶颗粒的平均粒径为0.005~0.1μm。一实施例中,所述铁蛋白抗体乳胶颗粒的平均粒径为0.01~0.05μm。一实施例中,所述铁蛋白抗体乳胶颗粒的平均粒径为0.03μm。一实施例中,所述铁蛋白试剂盒还包括校准品,所述校准品为人血清基质中添加定值铁蛋白。本发明的实施方式还提供了上述铁蛋白检测试剂盒的制备方法,所述方法包括步骤:a.试剂r1制备:将所述防腐剂、表面所述活性剂、所述促聚剂、所述稳定剂、所述电解质以及所述兔抗人抗体溶于所述ph范围为6~8的第一缓冲液,制得试剂r1;b.试剂r2制备:将活化剂活化的微球与铁蛋白抗体溶于ph范围为8~10的第二缓冲液,制得所述试剂r2。一实施例中,所述活化剂选自:edc、dcc中至少一种。一实施例中,所述活化剂活化时间为:5~30分钟。一实施例中,所述活化剂活化时间为:5~15分钟。一实施例中,所述活化剂活化的微球与铁蛋白抗体的体积比范围为9:1至1:9。一实施例中,所述活化剂活化的微球与铁蛋白抗体的体积比范围为3:1至1:3。一实施例中,所述活化剂活化的微球与铁蛋白抗体的体积比范围为2:1。一实施例中,所述试剂r2制备步骤中还包括加入分散剂分散微球。一实施例中,所述分散剂为mes溶液。附图说明一个或多个实施例通过与之对应的附图中的图片进行示例性说明,这些示例性说明并不构成对实施例的限定。图1是实施例1制备的铁蛋白检测试剂盒绘制的浓度-吸光度标准曲线图。图2是实施例1制备的铁蛋白检测试剂盒及对比例1试剂盒的相关曲线图。具体实施方式为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合实验例对本发明的各实施方式进行详细的阐述。然而,本领域的普通技术人员可以理解,在本发明各实施方式中,为了使读者更好地理解本申请而提出了许多技术细节。但是,即使没有这些技术细节和基于以下各实施方式的种种变化和修改,也可以实现本申请所要求保护的技术方案。实施例1:铁蛋白检测试剂盒的制备1.1试剂r1制备在纯化水中,加入磷酸氢二钠4.65g,磷酸二氢钠0.56g,氯化钠9g,2mltween-20,兔抗人视黄醇结合蛋白20ml,proclin-3005ml,牛白血清2g,peg适量10~20g,并用纯化水定容至1000ml。1.2试剂r2制备步骤一:铁蛋白多克隆抗体乳胶颗粒的制备取1ml粒径在300nm左右空白微球,加入300μledc溶液(浓度为1g/l)溶液活化10分钟,离心。用mes溶液分散粒子,再加入500μl铁蛋白多克隆抗体反应过夜,即得铁蛋白多克隆抗体乳胶颗粒。步骤二:试剂r2制备将0.1ml步骤一所得铁蛋白多克隆抗体乳胶颗粒置于1mltris缓冲液,即得试剂r2(浓度约为2mg/ml)。1.3校准品取靶值分别为0ng/ml(生理盐水)、100ng/ml、200ng/ml、500ng/ml、1000ng/ml的铁蛋白人血清标准溶液作为校准品。实施例2:铁蛋白检测试剂盒的应用2.1标准曲线绘制取8μl标准品,加入160μl试剂r1中,混匀,37℃孵育5分钟,1分钟后读取第一个测光点;加入80μl试剂r2,反应5分钟,读取第二个测光点,第二个测光点减去第一个测光点的吸光度差△a即为对应的反应度。根据校准品不同浓度对应不同反应度,绘制标准曲线如图1所示,标准曲线的线性范围是25ng/ml—1000ng/ml。2.2样本铁蛋白含量检测取8μl血清(血浆)样本,加入160μl试剂r1中,混匀,37℃孵育5分钟,1分钟后读取第一个测光点;加入80μl试剂r2,反应5分钟,读取第二个测光点;第二个测光点减去第一个测光点的吸光度差△a即为对应的反应度。根据血清(血浆)样本反应度,在标准曲线上算出样本的浓度值。对比例1:取市场上认可度高的试剂盒(北京利德曼生化,货号fe7002),由试剂r1、试剂r2和校准品(选配)组成,其中试剂r1为缓冲液(ph=8.4),r2为乳胶颗粒包被铁蛋白的单克隆抗体。测试例1:抗干扰验证试验取铁蛋白含量为105ng/ml的血清样本若干,分别加入类风湿因子、乳糜和胆红素等干扰物质,具体干扰因子的加入量见下表1。表1使用实施例1和对比例1的铁蛋白检测试剂盒对上述还有定量铁蛋白的血清样本进行检测,每个样本分别测定三次取平均值,结果见表2。表2编号实施例1试剂盒对比例1试剂盒编号实施例1试剂盒对比例1试剂盒11041071710912421051061811013331051071910612741041102011112451071112110313761071092210211371081242310911581061182411111791071262510711410105114261071181110911827105112121061142811311213107116291071231410511330108119151071203110711316104121测试例2:重复性验证取铁蛋白含量为100ng/ml及500ng/ml的临床血清样本1平均分成10份,取铁蛋白含量为500ng/ml的样本2,平均分成10份,分别用实施例1制备的试剂盒及对比例1的试剂盒进行铁蛋白含量的检测,每个样本分别测定10次,计算其平均值、标准偏差及相对标准偏差,结果见表3。表3根据测试结果,可显而易见地得出以下结论:由于实施例1制备的铁蛋白检测试剂盒和对比例1的试剂盒测定样本1与样本2检测结果的相对标准偏差均小于5%,且实施例1实施例1制备的铁蛋白检测试剂盒测定样本1与样本2检测结果的相对标准偏差小于对比例1的试剂盒测定测定样本1与样本2检测结果的相对标准偏差,故可得实施例1制备的铁蛋白检测试剂盒相比对比例1的试剂盒,具有更好的重复性。测试例3:稳定性验证效期稳定性试验取实施例1制备的铁蛋白检测试剂盒(未开瓶)和对比例1的试剂盒(未开瓶)置于2℃~8℃、无腐蚀性气体的避光环境中贮存,对其进行稳定性监测。具体地,测定期间,间隔设定的时间段分别取出实施例1制备的铁蛋白检测试剂盒(未开瓶)和对比例1的试剂盒(未开瓶)对铁蛋白含量为150ng/ml的临床血清标准样进行检测,取三次测量平均值,以偏差10%为限,测定结果见表5。表5热稳定性试验取实施例1制备的铁蛋白检测试剂盒(未开瓶)和对比例1的试剂盒(未开瓶)置于37℃、腐蚀性气体的避光环境中贮存,对其进行稳定性监测,具体地,测定期间,间隔设定的时间段分别取出实施例1制备的铁蛋白检测试剂盒(未开瓶)和对比例1的试剂盒(未开瓶)对铁蛋白含量为150ng/ml的临床血清标准样进行检测,取三次测量平均值,以偏差10%为限,测定结果见表6。表6间隔时间段实施例1试剂盒对比例1试剂盒0天1431511天1441573天1461637天15715610天15316314天14916717天15117021天15816524天15617728天16117830天168182开瓶稳定性取实施例1制备的铁蛋白检测试剂盒(开瓶)和对比例1的试剂盒(开瓶)置于全自动生化分析仪中,对其进行稳定性监测。具体地,测定期间,间隔设定的时间段分别取出实施例1制备的铁蛋白检测试剂盒(开瓶)和对比例1的试剂盒(开瓶)对铁蛋白含量为150ng/ml的临床血清标准样进行检测,取三次测量平均值,以偏差10%为限,测定结果见表7。表7间隔时间段实施例1试剂盒对比例1试剂盒0天1431511天1441553天1421517天14414310天14614714天14815517天14715821天15116124天15116228天14915730天155159测试例4:准确度验证取实施例1制备的铁蛋白检测试剂盒及对比例1的试剂盒,使用实施例2的方法依次检测bio-rad质控66401(靶值:30.9ng/ml,范围:26.0~35.8ng/ml),bio-rad质控66402(靶值:156ng/ml,范围:135~178ng/ml),bio-rad质控66403(靶值:263ng/ml,范围:228~297ng/ml),以及20个临床血清样本(含不等量铁蛋白),检测结果见表8。表8准确度分析根据表3实施例1制备的铁蛋白试剂盒和对比例1试剂盒分别测试bio-rad质控66401、66402、66403的测定值,两组试剂盒的测定值都在bio-rad质控靶值范围内,证明实施例1制备的铁蛋白试剂盒和对比例1的试剂盒准确度均较好;进一步地,实施例1制备的铁蛋白试剂盒测定bio-rad质控66401、66402、66403的测定值相比对比例1试剂盒更接近靶值,证明实施例1制备的铁蛋白试剂盒测定结果更加准确。相关性分析根据表3数据,做出实施例1制备的铁蛋白试剂盒和对比例1的试剂盒测试20个临床血清样本的数据相关性曲线,如图2所示。实施例1制备的铁蛋白试剂盒和对比例1的试剂盒测试20个临床血清样本的数据相关系数为0.9973,证明实施例1制备的铁蛋白试剂盒和对比例1的试剂盒相关性较好。本领域的普通技术人员可以理解,上述各实施方式是实现本发明的具体实施例,而在实际应用中,可以在形式上和细节上对其作各种改变,而不偏离本发明的精神和范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1