一种p-n异质结CdS-Cu2O/TM纳米棒阵列的制备方法、传感器及应用与流程
本发明属于纳米新材料技术领域,具体涉及一种p-n异质结cds-cu2o/tm纳米棒阵列的制备方法、生物传感器及应用。
背景技术:
前列腺癌是男性中最常见和最致命的疾病之一。据世界卫生组织称,前列腺癌是导致癌症死亡的第二大原因。大多数患者在知道疾病时处于癌症的末期,死亡率极高。因此,早期和准确地检测癌症至关重要。前列腺特异性抗原(psa)是前列腺癌早期检测中最可靠的癌症标志物之一。前列腺癌和其他前列腺疾病的存在导致psa的水平升高。到目前为止,已经报道了多种用于检测psa的分析平台,例如elisa检测,电化学方法,比色分析和荧光分析,但大型仪器的使用,时间的消耗,样品制备的复杂和不令人满意的灵敏度阻碍了它们的广泛使用。因此,迫切需要开发一种快速测定psa的可靠方法,以早期和敏感地诊断前列腺癌。
光电化学(pec)作为一种前瞻性分析技术,凭借其高灵敏度,低成本,快速响应,低背景和简单的仪器,吸引了越来越多的研究兴趣。一般来说,pec传感器的性能取决于光活性对光照射敏感的材料。因此,用于构建传感器的材料对于实现优异的pec响应至关重要。硫化镉(cds)作为优异的可见光响应n型的光活性材料。虽然三维自支撑cds纳米棒阵列电极具有大的表面积和高活性位点密度,但是仍然具有较高的光生电子-空穴复合率。纯cds中的空穴仍然影响光电极的性能。因此需要改善cds的光电性能。
技术实现要素:
本发明的目的是提供一种p-n异质结cds-cu2o/tm纳米棒阵列的制备方法,所述纳米棒阵列具有表面积大,活性位点密度高,稳定性好,电解质扩散性好等优点,有利于产生pec信号;本发明同时还提供一种所述cds-cu2o纳米棒阵列得应用,用于快速检测psa的光电化学生物传感器,对博莱霉素的检测稳定性好,检测限低。
为了实现上述目的,本发明采用的技术方案为:
一种p-n异质结cds-cu2o/tm纳米棒阵列的制备方法,其特征在于,采用以下步骤:
(1)将cd(no3)2·4h2o、ch4n2s和谷胱甘肽溶解在水中并搅拌得混合液,并将钛网(tm)置于混合液中反应,将所得样品冷却、洗涤、干燥,得到cds/tm;
(2)将步骤(1)合成的cds/tm浸入含有na2s2o3和cuso4的水溶液中,洗涤,得到cds-cu2o/tm纳米棒阵列;
(3)将步骤(2)得到的cds-cu2o/tm纳米棒阵列浸入65-75℃的naoh水溶液中2-4秒,洗涤,得到p-n异质结cds-cu2o/tm纳米棒阵列。
进一步地,步骤(1)所述的cd(no3)2·4h2o、ch4n2s和谷胱甘肽的质量比为0.35-4:0.08-0.10:0.20-0.25;所述cd(no3)2·4h2o和水的质量体积比为(0.35-0.4)g:(35-45)ml;所述搅拌时间为8-12分钟。
进一步地,步骤(1)所述的水为去离子水;步骤(1)所述的洗涤为用去离子水和乙醇洗涤;步骤(2)和步骤(3)所述的洗涤为用去离子水洗涤。
进一步地,步骤(2)所述的含有na2s2o3和cuso4的水溶液中na2s2o3和cuso4的浓度为0.8-1.2m,所述naoh水溶液的浓度为0.45-0.55m。
进一步地,步骤(2)中将cds/tm浸入含有na2s2o3和cuso4的24-26℃水溶液中2-4秒;步骤(3)将cds-cu2o/tm纳米棒阵列浸入65-75℃的naoh水溶液中2-4秒。
一种光电化学生物传感器,包括和电化学工作站连接的工作电极、参比电极、对电极,在工作电极上修饰有权利要求1-5任一项所制得的cds-cu2o/tm纳米棒阵列。
进一步地,所述光电化学生物传感器应用于对psa的灵敏检测。
上述光电化学生物传感器的应用,采用以下步骤进行检测:
(1)将光电极cds-cu2o/tm在含有n-(3-二甲基氨基丙基)-n'-乙基-碳二亚胺盐酸盐和n-羟基琥珀酰亚胺的溶液中活化,用tris-hcl缓冲溶液冲洗,随后将18-22μl适体固定在cds-cu2o/tm电极上,使电极在4℃下静置15-17小时,用tris-hcl缓冲溶液冲洗,用n2吹干;
(2)将制备的适体传感器与18-22μlbsa(1%)在室温下孵育0.8-1.2小时,用tris-hcl缓冲溶液彻底冲洗bsa/适体/cds-cu2o/tm电极在4℃下储存以备后用;
(3)将制备的传感器与18-22μl的psa在36-38℃下孵育18-22分钟,然后pec测量在tris-hcl缓冲液中进行,在300w氙灯下照射,根据光电化学生物传感器光电信号变化对psa进行检测。
进一步地,所述tris-hcl缓冲液的浓度为0.01m。
本发明所述的适体是指一种dna单链,这个单链具有特殊序列,能够特异性捕获目标物,本实验中的适体为psa的适体,即能特异性识别捕获psa的dna单链。
氧化亚铜(cu2o)作为典型的p型半导体材料,具有相对小的带隙(约2.0ev)和在可见区域中相对高的吸收能力,可以与其他半导体结合以提高pec性能。因此,我们预期通过构建这种复合材料可以大大提高cds的光催化性能。
有益效果
(1)本发明制备的cds-cu2o/tm纳米棒阵列具有表面积大,活性位点密度高,稳定性好,电解质扩散性好等优点,有利于产生pec信号;
(2)本发明所制备的新型的用于快速检测psa的光电化学生物传感器,对psa的检测稳定性好,检测限低,检测限为0.026ng·ml-1。
总之,基于使用cds-cu2o/tm纳米棒阵列设计了用于监测psa活性的简单pec生物分析平台;实验证实构建的光电化学生物传感器平台简单且经济,并且对于psa检测具有高灵敏度,选择性和可靠性,这项工作是一种新的通用pec适体传感器,可以扩展用于探测其他感兴趣的生物相互作用。
附图说明
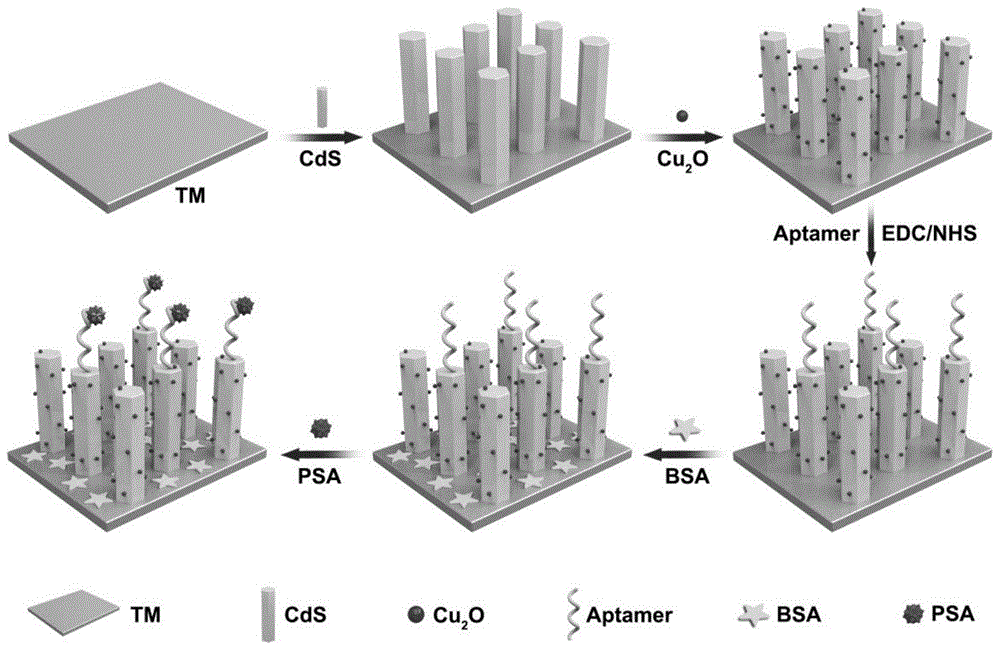
图1、本发明实施例1中所制备的cds-cu2o/tm纳米棒阵列用于检测psa的光电化学生物传感器的示意图;
图2、cds-cu2o/tm纳米棒阵电荷-载流子转移过程的示意图;
图3、(a)实施例1中制备的cds/tm和cds-cu2o/tm的x射线衍射谱(xrd);实施例1制备的cds-cu2o/tm的x射线光电子能谱分析图(xps);(b)cds-cu2o/tm总谱图;(c)cd3d;(d)s2p;(e)cu2p;(f)o1s区域的高分辨率xps光谱;
图4、(a)实施例1制备的cds/tm和(b)cds-cu2o/tm的扫描电镜图(sem);(c)实施例1制备的cds和(d)cds-cu2o纳米复合材料的透射电镜图(tem);插图分别是cds(插图c)和cds-cu2o(插图d)的高分辨率透射电镜图(hrtem);
图5、光电化学生物传感器中,(a)在0.01mtris-hcl缓冲液中的光电流响应,(a)cds/tm,(b)cds-cu2o/tm,(c)适体/cds-cu2o/tm,(d)bsa/适体/cds-cu2o/tm和(e)psa/bsa/适体/cds-cu2o/tm;(b)在5.0mm[fe(cn)6]3-/4-中的电化学阻抗光谱(eis),以下为各工作电极:(a)cds/tm,(b)cds-cu2o/tm,(c)适体/cds-cu2o/tm和(d)bsa/适体/cds-cu2o/tm;
图6、实施例1制备的光电化学生物传感器用于检测不同浓度的psa的电流响应(a),和与之相对应的校正曲线(b);
图7、(a)实施例1制备的光电化学生物传感器用于检测psa选择性的对照图;(b)用光开和关测量适体/cds-cu2o/tm电极的稳定性和重现性。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,一下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
实施例1
(1)将0.35gcd(no3)2·4h2o,0.08gch4n2s和0.20g谷胱甘肽溶解在40ml去离子水中并搅拌12分钟。将上述混合物转移到50ml高压釜中,并将清洁的钛网(tm)置于其中。反应在200℃下进行8小时。最后,将所得样品冷却,用去离子水和乙醇洗涤,并自然干燥,得到cds/tm。
(2)将合成的cds/tm浸入含有na2s2o3(1.0m)和cuso4(1.0m)的25℃水溶液中2秒,然后用去离子水冲洗。其次,将纳米棒阵列在65℃下浸入naoh水溶液(0.45m)中4秒,用去离子水冲洗。
实施例2
(1)将0.4gcd(no3)2·4h2o,0.10gch4n2s和0.25g谷胱甘肽溶解在45ml去离子水中并搅拌8分钟。将上述混合物转移到50ml高压釜中,并将清洁的钛网(tm)置于其中。反应在220℃下进行8小时。最后,将所得样品冷却,用去离子水和乙醇洗涤,并自然干燥,得到cds/tm。
(2)将合成的cds/tm浸入含有na2s2o3(1.0m)和cuso4(1.0m)的25℃水溶液中2秒,然后用去离子水冲洗。其次,将纳米棒阵列在75℃下浸入naoh水溶液(0.55m)中2秒,用去离子水冲洗。
实施例3
(1)将0.38gcd(no3)2·4h2o,0.09gch4n2s和0.22g谷胱甘肽溶解在40ml去离子水中并搅拌10分钟。将上述混合物转移到50ml高压釜中,并将清洁的钛网(tm)置于其中。反应在200℃下进行9小时。最后,将所得样品冷却,用去离子水和乙醇洗涤,并自然干燥,得到cds/tm。
(2)将合成的cds/tm浸入含有na2s2o3(1.0m)和cuso4(1.0m)的25℃水溶液中2秒,然后用去离子水冲洗。其次,将纳米棒阵列在70℃下浸入naoh水溶液(0.5m)中3秒,用去离子水冲洗。
光电化学生物传感器
本发明所述的光电化学生物传感器,包括和电化学工作站连接的工作极、参比电极(ag|agcl|cl-)、对电极(铂电极),采用氙灯照射为模拟光源,工作电极为钛网(tm),在工作电极为钛网(tm)上修饰有实施例1制备的cds-cu2o/tm纳米棒阵列,tm在修饰之前,在超纯水中超声清洗15min,tm电极的面积为0.5*0.5cm2。
实施例1所述的光电化学生物传感器在tm工作电极上直接水热生成cds纳米棒阵列,然后通过连续离子层吸附反应将cu2o附着在cds纳米棒阵列上。
实施例1所述光电化学生物传感器对psa检测时,将光电极cds-cu2o/tm在含有n-(3-二甲基氨基丙基)-n'-乙基-碳二亚胺盐酸盐和n-羟基琥珀酰亚胺的溶液中活化1小时,并用tris-hcl冲洗。随后,将20μl适体固定在cds-cu2o/tm电极上,并使电极在4℃下静置16小时。用tris-hcl冲洗电极以洗去未固定的适体,并用n2吹干。之后,将制备的适体传感器与20μlbsa(1%)在室温下孵育1小时以阻断非特异性位点。然后用缓冲溶液彻底冲洗bsa/适体/cds-cu2o/tm电极以洗去过量的bsa并在4℃下储存以备后用。最后,将制备的传感器与20μl的psa在37℃下孵育20分钟。之后,pec测量在0.01mtris-hcl缓冲液中进行,在300w氙灯下照射,根据光电化学生物传感器光电信号变化对psa进行检测。
如图1所示,基于bsa/适体/cds-cu2o/tm光电极建立了一个新的平台用于psa的超灵敏检测;
如图2所示,示出了所提出的pec生物传感器的光生电子-空穴转移机制;
如图3所示,通过xrd和xps图像研究了cds和cds/cu2o的形态。图3a显示纯cds/tm和cds-cu2o/tm的xrd谱图。纯cds/tm的衍射峰可以指向六方相cds晶体。至于cds-cu2o/tm,24.8o,26.5o,28.2o,36.6o,43.7o,47.8o,51.8o和52.8o的衍射峰可以分别指向(100),(002),(101),(102),(110),(103),(112)和(201)晶面,为六方相cds晶体(jcpdsno.41-1049)。与纯cds相比,cds-cu2o/tm的xrd图谱中没有观察到其他cu2o衍射峰,表明cu2o纳米粒子的负载量小且分散性高。图3b显示了cds-cu2o/tm的xps光谱,进一步表明存在cd,s,cu和o元素。cd3d的高分辨率xps光谱如图3c所示。以405.2ev和412.0ev的结合能为中心的两个峰可以分别指向cd3d的cd3d5/2和cd3d3/2。此外,图3d显示了s2p区域,峰值在161.5ev和162.8ev分别对应于s2-状态的s2p3/2和s2p1/2。cu2p的光谱如图3e所示,两个峰位于932.0ev和951.9ev,对应于cu2p3/2和cu2p1/2。图3f中的o1s的高分辨率光谱具有531.4ev的特征峰,对应于cu2o的氧物种,532.2ev的弱峰可能来自表面羟基或h2o2。xps结果与xrd分析一致,进一步证实了cds-cu2o/tm的成功制备。
图4a显示纯cds的sem图像,其显示具有纳米棒阵列的裸tm的完全覆盖。如图4b所示,非均相cds-cu2o/tm的sem图像显示,在涂覆cu2o纳米颗粒后,cds的表面变得粗糙,表明复合材料的成功制备。所得纯cds的tem图像进一步证实了其纳米棒形态(图4c)。图4c插图中的hrtem图像表明cds的晶面间距为0.32nm,对应于cds的(101)面。图4d显示了非均相cds-cu2o纳米粒子的tem图像,表明cds纳米粒子的表面在吸附cu2o纳米粒子后变得粗糙,这与sem的分析一致。图4d插图显示从单个cds-cu2o纳米棒获得的hrtem图像显示具有0.25nm的晶面间距的晶格条纹,对应于cu2o晶相的(111)晶面。
如图5a,为了进一步研究逐步制造过程,还通过pec方法表征电极。使用通过用间歇可见的入射光照射改性的tm电极产生的光电流来表征制备的纳米材料的pec特性。对于纯cds/tm电极,观察到14μa的光电流强度(曲线a)。另外,cds-cu2o/tm电极的光电流强度显着增强到116μa(曲线b),为cds/tm电极的大约8.3倍。在引入适体(曲线c)后,光电流显着降低,这可归因于适体产生的空间位阻效应。当bsa在适体/cds-cu2o/tm电极上组装时,光电流强度进一步降低(曲线d)。在用psa孵育bsa/适体/cds-cu2o/tm后,光电流显着增强(曲线e),这意味着适体特异性地捕获psa分子作为被光生孔氧化的电子供体并消耗空穴然后阻碍电子-空穴对的重组。为了评估传感器组件的电极表面的电子转移,使用[fe(cn)6]3-/4-作为氧化还原探针,通过奈奎斯特图的半圆直径测量eis(图5b)。cds-cu2o/tm的奈奎斯特图(曲线b)显示出比cdsnas/tm(曲线a)小得多的半圆直径,cu2o的引入可以加速电极上的电子转移和导致阻抗降低。此外,由于它们的绝缘性质,适体可以导致电子转移电阻的进一步增加(曲线c)。在适体/cds-cu2onas/tm上涂覆bsa(曲线d)也阻碍电极表面上的电子交换,导致阻抗增加。这些结果证明了不同组分在tm电极上的连续固定。
如图6所示,配置不同浓度的psa水溶液,测试光电化学生物传感器对不同浓度psa的电流响应曲线,看以看出,psa浓度之间呈现较好的相关性,线性回归方程为a=64.24+0.73cpsa(r2=0.9907),在s/n=3时检测下限为0.026ng·ml-1。
对于新制备的传感体系,需要在分析实际样品时对目标分析物具有良好的选择性,为了验证本发明制备的光电化学生物传感器对psa信号放大的特异性,我们使用其他肿瘤标志物和一些潜在的干扰来评估选择性,包括癌胚抗原(cea),甲胎蛋白(afp),免疫球蛋白g(igg),牛血清白蛋白(bsa),人血清白蛋白(hsa)和碳水化合物抗原125(ca125)的比较进行光电流响应评估,在相同的条件下,测试该传感器对psa的选择性。由图7c可以看出,与其他几种干扰物相比,psa具有最好的选择性,这表明该生物检测的选择性良好,具有高度特异可用于实际样本的检测。另外,当重复打开可见光照射时,pec探针的光电流强度几乎保持恒定(图7d)。这些结果支持该适体传感器用于敏感pec测定的可行性,表明该方法对于检测psa具有良好的选择性和稳定性。
为了进一步证明实用性,进行人血清测定以评估本发明的pec免疫测定。结果表明,psa的回收率为95.2%~107.5%。所构建的pec适体传感器具有很大的生物样品定量测量潜力。
以上所述仅为本发明的较佳实施例而已,并不用于限制本发明,凡在本发明的精神和原则之内所做的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!