一种植物食品中消螨多残留量的测定方法与流程
本发明涉及食品安全领域,特别是一种植物食品中消螨多残留量的测定方法。
背景技术:
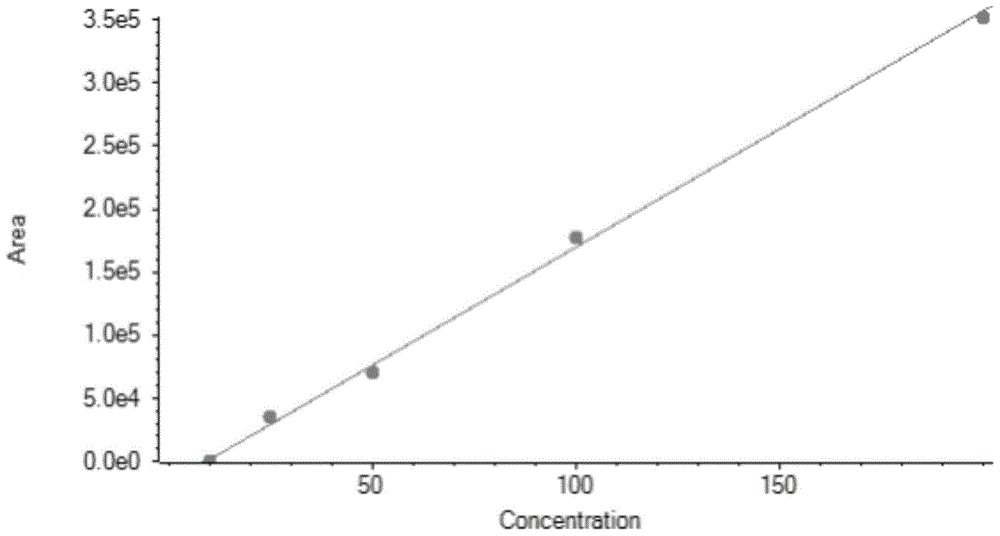
:消螨多(meptyldinocap,2,4-dnopc,casno:131-72-6)为非内吸性杀螨剂,同时具有一定的接触性杀菌作用。消螨多是从杀菌(螨)剂敌螨普(dinocap,casno:39300-45-3)的6种异构体中分离出来的、具有最高生物活性的异构体之一。主要用于防治苹果、柑橘、梨、葡萄、黄瓜、甜瓜、西瓜、南瓜、草莓、蔷薇和观赏植物的红蜘蛛和白粉病,对桑树白粉病和茄子红蜘蛛也有良好的防治效果,同时还具有杀螨卵的作用。目前欧盟已制定了多种农产品中消螨多的最大残留限量(mrl,maximumresiduelimit)如在柑橘、苹果、梨中的mrl为0.05mg/kg,在葡萄中的mrl为1mg/kg,在草莓中的mrl为3mg/kg。香港规定葡萄、草莓、瓜、黄瓜、西葫芦中的mrl分别为0.2mg/kg、0.3mg/kg、0.5mg/kg、0.7mg/kg、0.7mg/kg。目前关于消螨多的测定方法主要是液相色谱法和液相色谱-质谱/质谱法。例如,hplc检测方法,采用传统的有机溶剂萃取,固相萃取净化,经c18色谱柱分离,但方法的灵敏度低,检测限,即检测的有效数字也不能满足现行法规的要求;采用甲醇提取后,氯化羟胺进行水解,提取方法相对简单,但碱性羟胺溶液需要临用现配,该溶液需要冰浴保存,且有效期仅为3h,不适宜日常使用;液液萃取检测方法,采用丙酮:甲醇:4nhcl(100:10:5,v/v/v),提取液经旋转蒸发至近干后加入甲醇和氢氧化钠水解,再用盐酸调ph至中性,再用乙酸乙酯提取,复溶解后萃取净化,再经液相色谱-质谱法(lc-ms)/(质谱法)ms检测,该方法法操作繁琐,使用溶剂量大,不绿色环保,并且,用氢氧化钠或氢氧化钾进行水解时,回收率均低于60%,且由于后期加入盐酸调ph值,形成的无机盐会导致质谱的esi喷雾针堵塞;采用quechers技术进行提取,再取净化液,用氨水水解进行消螨多提取净化,然后再碱性水解,但需要衍生12h,时间过久,不适用日常工作。为做好我国出口食品的质量安全保障工作,亟需一种植物食品中消螨多残留量的测定方法。技术实现要素:针对现有技术存在的问题,本发明的目的在于提供一种植物食品中消螨多残留量的测定方法,该方法适用性强、溶剂回收率较高、测量准确。为实现上述目的,本发明的技术方案如下:一种植物食品中消螨多2,4-dnopc残留量的测定方法,包括:取样:取预定质量的试样,制成浆状,混匀后装入洁净的盛样容器内;保存:将所述试样在-18℃冷冻保存12小时以上;提取:称取经所述保存后的所述试样10.0g,加入10ml的乙酸乙酯、5.0g氯化钠、在离心转速为15000rpm均质2min,再经过离心转速为9500rpm离心5min,静置;水解:取经过所述提取后的上清液2ml,35℃氮吹至近干,加入1ml1%乙醇胺溶液,超声15min后,在离心转速为9500rpm离心5min;净化:取经过所述水解后的上清液0.5ml,用1%甲酸溶液将其ph值调至中性后,用甲醇水溶液定容至1ml,其中,甲醇与水的体积比为6:4,再经过离心转速为9500rpm离心5min后,经过孔径为0.22μm微孔滤膜过滤,得到过滤后的待测样液;检测:将所述待测样液加入到液相色谱串联质谱仪中,检测所述待测样液中2,4-二硝基-6-(1-甲基庚基)苯酚2,4-dnop的含量,根据该含量选定标准工作溶液,对所述标准工作溶液与所述待测样液等体积参插进样测定,得到所述待测样液的质量色谱图与所述标准工作溶液的质量色谱图;测定:若所述待测样液的质量色谱图与所述标准工作溶液的质量色谱图在相同保留时间有色谱峰出现,二者色谱峰偏差的绝对值小于2.5%,比较所述待测样液中所选择离子的样品丰度比与所述标准工作溶液中对应离子的标准丰度比,所述样品丰度比和所述标准丰度比的相对差值在允许范围,则判断所述待测样液中存在相应含量的2,4-二硝基-6-(1-甲基庚基)苯酚2,4-dnop;通过所述标准工作溶液对应的消螨多2,4-dnopc标准工作曲线上得到所述被测物的含量;计算消螨多2,4-dnopc残留量:式中:x——消螨多2,4-dnopc残留量,单位为微克每千克μg/kg;c——2,4-二硝基-6-(1-甲基庚基)苯酚2,4-dnop的含量,单位为微克每升μg/l;v——在所述净化过程中定容的1ml;m——在所述提取过程中提取的10g。进一步,在所述计算消螨多2,4-dnopc残留量之前,所述测定方法还包括空白试验,加入不含消螨多2,4-dnopc的空白试样,进行所述提取、所述水解、所述净化、所述检测、所述定性和所述定量的步骤。进一步,所述检测、所述定性和所述定量步骤中的所述标准工作溶液的制备方法包括:分别取0.1μg、0.2μg、0.5μg、1.0μg、2.0μg消螨多加至10.0g不含消螨多2,4-dnopc的空白试样中,进行所述提取、所述水解和所述净化步骤,得到5种不同浓度的所述标准工作溶液。进一步,所述标准工作溶液的制备方法还包括:根据5种所述标准工作溶液中含消螨多2,4-dnopc的浓度绘制标准工作曲线。进一步,所述定性步骤中的允许范围为:当相对离子丰度大于50%时,所述相对偏差为±20%;当相对离子丰度大于20%,小于或等于50%时,所述相对偏差为±25%;当相对离子丰度大于10%,小于或等于20%时,所述相对偏差为±30%;当相对离子丰度小于或等于10%时,所述相对偏差为±50%。进一步,所述预定质量为500g。本发明的植物食品中消螨多2,4-dnopc残留量的测定方法,乙酸乙酯的极性较低,可有效减少样品中的高极性物质及色素类物质的提取量,同时乙酸乙酯的沸点较低,旋转蒸发时间相对较短,在对消螨多2,4-dnopc的提取过程中存在巨大的优势。本方法前处理简单、试剂用量少、灵敏度高、定量结果准确,适用于蔬菜、水果、粮谷等植物源食品中消螨多2,4-dnopc残留量的测定。本方法的测定低限(即测定精度)为0.01mg/kg,检测精度高,能够满足国内外现有法规要求。附图说明图1为本发明示例的消螨多2,4-dnopc标准工作曲线。具体实施方式为清楚地说明本发明的设计思想,下面结合示例对本发明进行说明。为了使本领域的技术人员更好地理解本发明的方案,下面结合本发明示例中的附图对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的示例仅仅是本发明的一部分示例,而不是全部的示例。基于本发明的中示例,本领域的普通技术人员在没有做出创造性劳动的前提下,所获得的所有其他实施方式都应当属于本发明保护的范围。本示例提供了本发明植物食品中消螨多2,4-dnopc残留量的测定方法的一种实施方式,该方法所使用得设备包括:配有电喷雾离子源(electronsprayionization,esi)的液相色谱串联质谱仪;感量分别为0.0001g和0.01g的分析天平;均质器:将测定步骤中的溶液或溶剂混合均匀,达到实验所要求的标准;转速不低于9500r/min的高速离心机:用于对测定过程中的溶液进行离心操作;涡旋混合器:将测定步骤中所需混合的物质以高速漩涡形式快速混合,混合速度快、均匀、彻底;氮吹仪:对水解步骤中的样品进行浓缩。该方法包括:取样:取预定质量的试样,制成浆状,混匀后装入洁净的盛样容器内;本步骤的预定质量为500g,以便多次使用该方法进行测定,得到较为准确的测量平均值,本示例中的试样采用组织捣碎机加工成浆状,密封并根据试样标明标记。在本发明的其他示例中,预定质量也可以是其他质量,主要取决于测定的次数,当测定次数较少时,预定质量可以少于500g,当测定的次数较多时,预定质量可以大于500g,但是,无论哪种情况,预定质量均需要多于测定需要量。保存:将所述试样在-18℃下冷冻12小时以上。提取:称取经保存后的试样10.0g,加入10ml的乙酸乙酯、5.0g氯化钠、在离心转速为15000rpm均质2min,再经过离心转速为9500rpm离心5min,静置;本示例的乙酸乙酯为色谱纯。2,4-dnopc水解为2,4-dnop的反应式为:关于提取溶剂的选择及试样和乙酸乙酯试样用量的分析:由于提取液需要吹干后衍生处理,故选择极性相对低,且沸点低的常用试剂进行优化,按照以上要求选取了二氯甲烷、乙酸乙酯及丙酮分别作为提取溶剂,经试验表明:1、二氯甲烷:其沸点相对较高,且其密度为1.33,比水重,有机相处于提取液下层,不方便操作,导致回收率偏低,同时二氯甲烷属于2a类致癌物,故不推荐使用;2、乙酸乙酯,其极性较低,可有效减少样品中的高极性物质及色素类物质的提取量,同时乙酸乙酯的沸点较低,旋转蒸发时间相对较短,回收率较高;3、丙酮:丙酮和乙酸乙酯类似,但其回收率<70%,综合考量,采用乙酸乙酯作为提取溶剂。确定乙酸乙酯为提取溶剂后,分别对试样用量和溶剂用量进行了优化,考量到试样本身对乙酸乙酯溶剂用量的影响,本试验选择葡萄、芒果及石榴三种试样,取三种试样的用量分别为10g、25g,溶剂用量分别为10ml,25ml,20ml,50ml,下表中给出相应试样、溶剂以及乙酸乙酯溶剂的回收率:上表的试验结果表明:加大试样用量和提取溶剂用量没有显著提高回收率,从经济适用性及环保方面考虑,试样用量为10g,提取溶剂为:10ml。水解:取经过提取后的上清液2ml,35℃氮吹至近干,加入1ml1%乙醇胺溶液,超声15min后,在离心转速为9500rpm离心5min;其中,氮吹采用氮吹仪实现,1%乙醇胺溶液溶液的配制方法:量取1ml乙醇胺,用甲醇水溶液(6/4,v/v)定容至100ml。净化:取经过水解后的上清液0.5ml,用1%甲酸溶液将其ph值调至中性后,用甲醇水溶液(6/4,v/v)定容至1ml,再经过离心转速为9500rpm离心5min后,经过孔径为0.22μm微孔滤膜过滤,得到过滤后的待测样液;其中,1%甲酸溶液的配制方法:量取1ml甲酸,用甲醇水溶液(6/4,v/v)定容至100ml,微孔滤膜为适用有机溶液的有机系滤膜。检测:将待测样液加入到液相色谱串联质谱仪中,检测待测样液中2,4-二硝基-6-(1-甲基庚基)苯酚(2,4-dnop)的含量,根据该含量选定标准工作溶液,对标准工作溶液与所述待测样液等体积参插进样测定,得到所述待测样液的质量色谱图与所述标准工作溶液的质量色谱图。测定:若待测样液的质量色谱图与标准工作溶液的质量色谱图在相同保留时间有色谱峰出现,二者色谱峰偏差的绝对值小于2.5%,比较待测样液中所选择离子的样品丰度比与标准工作溶液中对应离子的标准丰度比,样品丰度比和标准丰度比的相对差值在允许范围,则判断待测样液中存在相应含量的2,4-二硝基-6-(1-甲基庚基)苯酚(2,4-dnop);通过标准工作溶液对应的消螨多2,4-dnopc标准工作曲线上得到被测物的含量;该步骤中的允许范围如下表所示:相对离子丰度>50%>20%至50%>10%至20%≤10%允许的相对偏差±20%±25%±30%±50%该步骤中,液相色谱条件为:色谱柱:c18,150mm×2.1mm(内径),3.5μm,或性能相当者;柱温:40℃;进样量:5μl;流动相:a:水(0.1%甲酸),b:甲醇(1+9,体积比);流速:0.3ml/min;质谱条件为:极性:负离子源温度:350℃气体流速:7l/min雾化器压力:35psi毛细管电压:4kv鞘气温度:350℃鞘气流速:10l/min扫描模式:mrm在上述步骤中标准工作溶液的制备方法包括:制备若干组消螨多2,4-dnopc的备用液,每组备用液的制备方法包括:称取10mg消螨多2,4-dnopc,用甲醇溶解,定容至10ml;分别取0.1μg、0.2μg、0.5μg、1.0μg、2.0μg消螨多加至10.0g不含消螨多2,4-dnopc的空白试样中,进行上述的提取、水解和净化步骤,得到5种不同浓度的标准工作溶液,根据这5种标准工作溶液中含消螨多2,4-dnopc的浓度绘制标准工作曲线,如图1所示,以峰面积(y)为纵坐标,相应质量浓度(x,μg/l)为横坐标,其中,y=1872.88391x-17426.02759,绘制消螨多2,4-dnopc标准工作曲线,经软件分析可知,在0~200μg/l范围内,消螨多2,4-dnopc在液相色谱串联质谱仪上标准工作曲线的线性良好,相关系数均大于0.999;将浓度为10μg/l、20μg/l、50μg/l、100μg/l、200μg/l的消螨多2,4-dnopc溶液分别进行上述提取、水解和净化步骤处理,将试样替换为浓度分别为10μg/l、20μg/l、50μg/l、100μg/l、200μg/l的消螨多2,4-dnopc溶液。计算消螨多2,4-dnopc残留量:式中:x——消螨多2,4-dnopc残留量,单位为微克每千克μg/kg;c——2,4-二硝基-6-(1-甲基庚基)苯酚2,4-dnop的含量,单位为微克每升μg/l;v——在所述净化过程中定容的1ml;m——在所述提取过程中提取的10g。在计算消螨多2,4-dnopc残留量之前,测定方法还包括空白试验,在加入不含消螨多2,4-dnopc的空白试样的条件下,进行上述的提取、水解、净化、检测、测定的步骤。以确定检测的环境和条件对检测准确性的影响。以下为本方法的验证过程:分别选用大米、生菜、黄瓜、橙、葡萄、西葫芦6种果蔬类作为试样基质,分别做三个不同水平的消螨多2,4-dnopc添加,添加量分别为10μg/kg、50μg/kg、100μg/kg,4℃放置过夜,消螨多2,4-dnopc即可完全进入相应的试样基质中,按上述方法处理后得到试样,测量试样中消螨多2,4-dnopc的残留量,每个浓度水平进行6次重复试验,测得的回收率和精确度如下表所示:根据上表可知,本示例的植物食品中消螨多2,4-dnopc残留量的测定方法,能够较为准确地消螨多2,4-dnopc在植物食品中的残留量,并且,此时消螨多具有较高的回收率,能够有效地进行资源的回收再利用。最后,可以理解的是,以上实施方式仅仅是为了说明本发明的原理而采用的示例性实施方式,然而本发明并不局限于此。对于本领域普通技术人员而言,在不脱离本发明的原理和实质的情况下,可以做出各种变型和改进,这些变型和改进也视为本发明的保护范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1