评价体腔液浓缩器蛋白质回收性能的测试液及其制造方法与流程
1.本发明属于医疗器械领域,涉及一种医疗器械的性能评价中使用的测试液及其制造方法,尤其涉及一种处理人体体腔液的装置或部件的性能评价中使用的测试液及其制造方法。
背景技术:
2.作为难治性腹水症的治疗方法,存在一种腹水过滤浓缩静脉回输疗法(cell-free and concentrated ascites reinfusion therapy):从患者处取出腹水,从该腹水中去除细菌、癌细胞等病因物质,将该腹水在留下白蛋白等有用成分的状态下进行除水,将进行该除水后的浓缩液回输到体内。
3.有腹水积存的患者大致区分的话分为由肝硬化等疾患导致积存的肝性腹水患者和由胃癌、卵巢癌、大肠癌等癌症导致积存的癌性腹水患者。以往主要是对肝性腹水患者施行上述治疗方法,但近年来对癌性腹水患者实施上述治疗方法的治疗效果逐渐得到认可,对癌性腹水患者的施行机会有所增加。
4.在上述的治疗方法中,一般使用了腹水处理装置。在该腹水处理装置中使用了如下结构:将腹水袋、过滤器、浓缩器以及浓缩腹水袋按此顺序串联连接,利用落差或泵使腹水流动来对腹水进行过滤、浓缩。
5.例如,对于肝硬化等容易积存腹水、胸液(以下总称为腹水)的患者,为了利用上述腹水中的蛋白质使患者的血中蛋白质浓度上升,而进行如下腹水过滤浓缩再静脉注射法:通过使用有中空纤维膜等的两种过滤器,对将针刺入积液部而排出体外的腹水进行过滤浓缩处理,得到浓的蛋白质溶液,而将其向患者注射点滴。两种过滤器中的第一种过滤器是用于除去腹水中所含有的癌细胞、血球成分等细胞成分的过滤器,可使用具有不使细胞成分通过而使水分、蛋白质等溶质成分通过的孔径的膜。另一方面,另一种过滤器是用于自稀的蛋白质浓度的腹水中除去水而浓缩蛋白质的浓缩过滤器,可使用蛋白质成分基本上不通过而使水分、电解质等通过的膜。通常从便利性的观点出发,可采取利用过滤器对细胞成分进行过滤分离,利用浓缩器对该经过滤分离的腹水进行浓缩的方法,可使用使它们连续进行的装置。
6.另外,作为这样的腹水处理装置,参考文献1公开了一种具备自动从过滤向再循环转移的系统的腹水处理装置。
7.参考文献:
8.参考文献1:日本特开2013-188427号公报
技术实现要素:
9.发明要解决的问题
10.针对体腔液的处理已经出现各种实用的设备和装置,对于这样的设备和装置在实际使用中具有极高的安全性和可靠性要求。如前所述,对于浓缩器的使用是对体腔液中对
人体有用的营养成分的浓缩,通常情况下,这些浓缩后的体腔液中已经认为去除了病毒成分,并去除了多余的水分,因此,总是期望尽可能快速地直接将其返回人体。
11.在实际使用这些浓缩器进行腹水的浓缩时,通常根据设备或装置提供的各种控制手段对浓缩器进行控制。但本发明的发明人等发现:
12.一方面,尽管借助设备或装置本身结构,或者主要零部件的数据能够对浓缩能力和效果给出一些参考,但实际操作过程中,调整浓缩器以达到满意的参数在一些境况下却出现了困难,并且,在稳定操作方面也可能出现问题;
13.另一方面,浓缩器在使用过程中,为了获得满意的效果,除了受到各种控制手段的调节以外,浓缩器本身的材料(通常为具有一定孔径的多孔膜材料)对于体腔液浓缩效果具有重要的影响。然而,本发明发明人等也发现,对于这些材料的选取,目前仅仅依靠膜材料生产厂家所提供的参数,而这些生产膜材料的厂家给出的参数通常仅仅是依据非医疗领域的测试手段(即理化测试)而进行测试和标注的。通常情况下,在进行了膜材料的选择以后,默认这些膜材料本身对于处理人体体腔液而言是合格的。因此,提高浓缩器使用的安全性以及可靠性方面主要如上文所述的那样使用调节浓缩器工作状态/参数,或者调整浓缩器结构来进行。
14.此外,实际使用过程中,浓缩器仍然要面临各种各样不同的复杂的局面,一些情况下,被认为合格的浓缩器,在进行浓缩时,仍然难以获得可靠的浓缩效果,可能造成浓缩时间的增长或者人体营养物质的过度流失;在另外一些情况下,在腹水的处理过程中,由于使用浓缩器所处理的体腔液通常为上游过滤器所过滤后的体腔液,而这些体腔液不仅由于形成原因不同而不同,例如肝硬化或癌症引起的体腔液中成分不同,而且由于上游过滤器及其过滤条件的不同而成分不同。因此,即便一种/一批浓缩器应对一类特定患者的处理时或与某种特定上游过滤器组合使用时可以获得满意的处理效果,其应对另一类特定的患者或与另一类特定上游过滤器组合使用时也可能会产生风险,这对浓缩器适用性提出了挑战。相应地,迫切需要评价浓缩器适用性的测试方法。
15.由于包含浓缩器的体腔液处理设备为封闭的、一对一的设备,一旦浓缩器对体腔液处理出现异常时(如浓缩器的因堵塞等原因导致浓缩能力异常下降),则通常无法简单的进行装置的修复和替换。由于通常缺少可行的解决办法,一般都可能需要整体换用新的设备,而这样的经济成本以及实际损失往往是难以承受的。同样是因为缺少可行的解决办法,往往将这样的问题归结为不可避免的系统性风险。
16.针对上述本发明所发现的问题,本发明的发明人等认为,以往依靠孤立的材料参数、控制手段、设备结构等经验对浓缩器性能上进行判断可能是产生上述系统性风险的原因。经过进一步的研究,本发明也发现,这样的系统性风险并非是不可避免的,为此,本发明的课题在于,提供一种测试工具(测试液)对浓缩器进行评价,以准确反映浓缩器的浓缩性能。
17.用于解决问题的方案
18.根据本发明发明人等长期研究,发现通过以下技术方案的实施,能够解决上述技术问题:
19.本发明提供了一种评价体腔液浓缩器蛋白质回收性能的测试液,其中,所述测试液中总蛋白浓度为0.5~2.4g/dl,白蛋白与球蛋白之比(a/g比)为0.8~1.5,并且血球数为
1
×
102个/μl以下。
20.在一些具体的实施方案中,其中,所述的测试液还含有抗凝剂。
21.在一些具体的实施方案中,其中,所述抗凝剂包含选自由肝素及其盐、乙二胺四乙酸盐、柠檬酸盐、草酸盐、水蛭素中的至少任一种物质。
22.在一些具体的实施方案中,其中,所述抗凝剂包含2单位/ml以上的肝素和/或其盐。
23.在一些具体的实施方案中,其中,所述测试液的总蛋白质浓度为0.5~0.9g/dl。
24.在一些具体的实施方案中,其中,所述测试液的总蛋白质浓度为2.0~2.4g/dl。
25.在一些具体的实施方案中,其中,将所述的测试液用于对体腔液浓缩器的蛋白质回收性能评价测试。
26.本发明还提供了一种评价体腔液浓缩器蛋白质回收性能的测试液的制造方法,其特征在于,包括如下工序:
27.过滤工序,使用过滤膜对原料液进行过滤,所述过滤膜具有0.2μm以下的平均孔径;
28.浓度调整工序,调整过滤后的滤液中总蛋白和/或白蛋白浓度。
29.在一些具体的实施方案中,其中,所述过滤膜具有0.08以上且0.12μm以下的孔的个数相对于全部孔个数的比例为60%以上的孔径分布。
30.在一些具体的实施方案中,其中,所述原料液包括非人的动物血浆。
31.在一些具体的实施方案中,其中,所述非人的动物血浆为牛血浆。
32.在一些具体的实施方案中,其中,所述浓度调整工序中,调整总蛋白浓度至0.5~2.4g/dl。
33.在一些具体的实施方案中,其中,所述浓度调整工序中,调整总蛋白浓度至0.5~0.9g/dl。
34.在一些具体的实施方案中,其中,所述浓度调整工序中,调整总蛋白浓度至2.0~2.4g/dl。
35.在一些具体的实施方案中,其中,所述浓度调整工序中,调整白蛋白与球蛋白之比(a/g比)为0.8~1.5。
36.在一些具体的实施方案中,所述制造方法还包括:
37.冷冻-溶解工序,以及
38.纤维蛋白除去工序。
39.在一些具体的实施方案中,其中,所述纤维蛋白除去工序包括在冷冻-溶解工序后,使用纱布过滤以除去所述纤维蛋白。
40.在一些具体的实施方案中,其中,所述冷冻-溶解工序和纤维蛋白除去工序在所述过滤工序之前进行,或者在所述过滤工序之后且在所述浓度调整工序之前进行。
41.本发明还提供了一种试剂盒,其用于评价体腔液浓缩器蛋白质回收性能,其特征在于,所述试剂盒包括容纳部以及置于所述容纳部中的测试液,所述测试液包括上述本发明的测试液或者根据上述本发明的制造方法得到的测试液。
42.在一些具体的实施方案中,将所述试剂盒用于体腔液浓缩器的蛋白质回收性能评价测试。
43.发明的效果
44.本发明提供了一种评价体腔液浓缩器蛋白质回收性能的测试液及其制造方法,以及包含该测试液或通过该制造方法制造的测试液的试剂盒,以及上述测试液和上述试剂盒的应用,并通过上述技术方案的实施,能够获得如下的技术效果:
45.(1)通过使用本发明提供的测试液等,能够对体腔液浓缩器蛋白质回收性能进行整体性、系统性的评价,测试液及其制造方法在本领域已经公开的文献中尚未被报道过,为本领域中使用的浓缩器提供了一种可靠的评价试剂。
46.(2)本发明所提供的测试液等,能够真实的反映浓缩器对人体体腔液进行浓缩时的处理效果以及处理能力,进而能够准确地评价该种或该批次的浓缩器是否能够可靠而安全地对患者提供医疗服务,能够尽可能地避免在浓缩器使用过程中出现的偏差或事故,减轻了患者的医疗负担和医疗风险。
47.(3)本发明所提供的测试液等具有广泛的适用性,即,不仅适用于针对肝硬化所产生的腹水的浓缩器的评价,也同样适用于针对由癌症所产生的腹水的浓缩器的评价。
48.(4)通过使用本发明所提供的测试液等,能够对浓缩器实施具有便捷的可操作性的评价方法,因而能够快速检测。
附图说明
49.图1:作为本发明的测试液的评价对象的一种体腔液浓缩器结构示意图
50.图2:使用本发明一个具体实施方案的测试液评价体腔液浓缩器蛋白质回收性的试验中所使用的装置示意图
51.图3:本发明实施例与参考例中各浓缩器在运行时的跨膜压力(tmp)数据图
52.附图标记说明
53.1:浓缩器主体 2:浓缩液出口(第1输出口)
54.3:浓缩器输入口 4:滤液出口(第2输出口)
55.5:测试液存储器 6:浓缩液存储器 7:滤液存储器
56.a/b/c:管路
具体实施方式
57.以下,针对本发明的内容进行详细说明。以下所记载的技术特征的说明基于本发明的代表性的实施方式、具体例子而进行,但本发明不限定于这些实施方式、具体例子。需要说明的是:
58.本说明书中,使用“数值a-数值b”表示的数值范围是指包含端点数值a、b的范围。
59.本说明书中,使用“%”在没有特殊声明的情况下,均指的是重量或质量百分数。
60.本说明书中,使用“可以”表示的含义包括了进行某种处理以及不进行某种处理两方面的含义。
61.本说明书中,使用“任选”或“任选的”表示某些物质、组分、执行步骤、施加条件等因素使用或者不使用。
62.本说明书中,所使用的单位名称均为国际标准单位名称。
63.本说明书中,如没有特别声明,则“多(个/种)”指的是具有两个/种或两个/种以上
的情况。
64.本说明书中,所提及的“一些具体/优选的实施方案”、“另一些具体/优选的实施方案”、“实施方案”等是指所描述的与该实施方案有关的特定要素(例如,特征、结构、性质和/或特性)包括在此处所述的至少一种实施方案中,并且可存在于其它实施方案中或者可不存在于其它实施方案中。另外,应理解,所述要素可以任何合适的方式组合在各种实施方案中。
65.本发明提供了一种评价体腔液浓缩器蛋白质回收性能的测试液,其中,所述测试液中总蛋白浓度为0.5~2.4g/dl,白蛋白与球蛋白之比(a/g比)为0.8~1.5,并且血球数为1
×
102个/μl以下。
66.<体腔液浓缩器>
67.适用于本发明的体腔液浓缩器(有时简称为浓缩器),可以是本领域中对体腔液进行浓缩的任意的浓缩器。
68.图1示出了本发明的浓缩器的典型的结构,其中1表示浓缩器主体,3表示浓缩器的输入口。在实际对患者进行治疗时,经由上游的过滤器(图1未示出)处理过的体腔液从浓缩器输入口3进入到浓缩器主体1中。于此相对地,在使用本发明的测试液对浓缩器性能进行评价时,该测试液从输入口3进入到浓缩器主体1中。图1中2表示浓缩器的浓缩液出口(第1输出口),在实际使用时,经由所述浓缩器处理过的浓缩液从浓缩液出口2被导出。图1中4表示滤液出口(第2输出口),用于将浓缩器在浓缩过程中产生的滤液导出。
69.此外,在另外一些具体的实施方案中,本发明的浓缩器还具有残液的排出口(图1中未示出),用于排出残留于浓缩器主体1中的体腔液。
70.其中,浓缩器主体1中设置有浓缩单元。在本发明一些具体的实施方案中,所述浓缩单元选自多孔膜。对于多孔膜没有特别的限定,可以使用本领域通常的超滤膜。一般而言,用于浓缩器的多孔膜的孔径小于其上游的过滤器中使用的膜。多孔膜主要是对低浓度的蛋白质溶液中的蛋白质进行浓缩,并在膜的另一侧分离出基本上去除了蛋白质的含水滤液。
71.在本发明一些优选的实施方案中,适用于本发明的多孔膜中具有0.08μm以上且0.12μm以下的孔的个数相对于全部孔个数的比例为60%以上,优选比例为70%以上的孔径分布。在另外一些优选的实施方案中,本发明浓缩器的超滤性能为85ml/分钟/200mmhg~150ml/分钟/200mmhg。当超滤性能在该范围以下时,在浓缩的过程中,滤液的排出量会下降,不能获得被充分浓缩的蛋白质溶液。另外,当超滤性能在85ml/分钟/200mmhg以上时,发生堵塞的可能性更低,因此优选,更优选为95ml/分钟/200mmhg以上。当超滤性能在150ml/分钟/200mmhg以上时,有时蛋白质漏出到滤液中,可能不能获得充分的浓度的蛋白质浓度。上述的优选的多孔膜因其性能优异而广泛使用,在使用本发明的测试液来评价具备这样的多孔膜的浓缩器的性能的情况下,能够进一步发挥本发明的效果。
72.对于多孔膜的类型,没有特别的限定,在一些优选的实施方案中,可以出于浓缩效率的观点,使用具有中空结构的纤维膜。这里所说的中空纤维膜对形状和尺寸没有特别限定,只要具有上述超滤性能即可。关于材质,出于在制膜时容易控制孔径且化学稳定性优异的理由,优选使用聚砜类原料。或者,可以为也包括聚醚砜的砜类、纤维素类。聚砜类高分子是芳香族化合物,因此抗辐射性特别优异,而且也非常耐热、耐化学性处理,安全性也优异。
因而,能够选用各种制膜条件,并且能够辐射灭菌,特别优选作为浓缩器所用的膜材质。另外,“~类”不仅指均聚物,也包含与其它单体构成的共聚物、进行了化学修饰的衍生物。
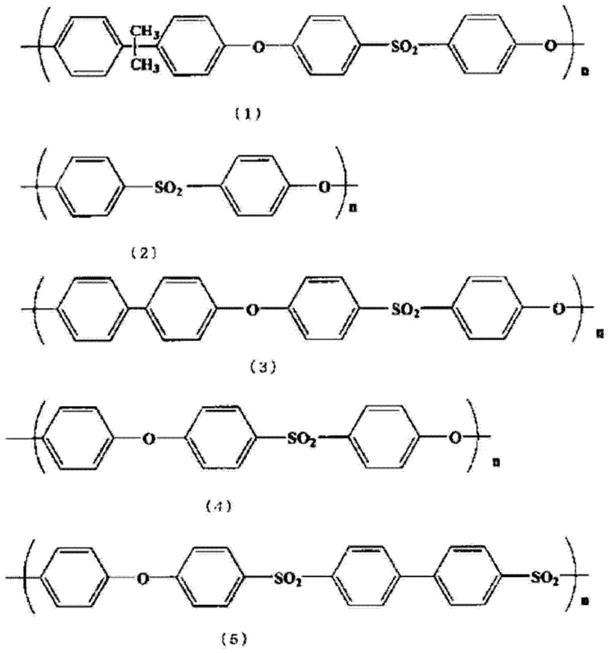
73.这里所说的聚砜类高分子(以下有时称作psf)是具有砜键的高分子化合物的总称,没有特别规定,例如,能够列举出重复单元由下述式(1)、式(2)、式(3)、式(4)及式(5)表示的聚砜类聚合物。也可以是向上述芳香环的一部分中导入取代基的改性聚合物。基于工业上容易获得的观点,优选重复单元由式(1)、式(2)及式(3)表示的芳香族聚砜类聚合物,其中,尤为优选具有由式(1)表示的化学构造的聚砜。该双酚型聚砜树脂例如由solvay advanced polymers l.l.c以“udel(注册商标)”的商品名贩卖,该双酚型聚砜树脂根据聚合度等存在多种,但并不进行特别的限定。
[0074][0075]
本发明中的聚砜类中空纤维膜优选利用亲水性高分子而具有亲水性。这是因为,仅具有聚砜类高分子,中空纤维膜表面为疏水性,蛋白质容易吸附在该种表面上,这成为使蛋白质的回收性能降低的原因。作为亲水性高分子,可以使用聚乙烯基吡咯烷酮(以下有时称作pvp)、聚乙二醇、聚乙烯醇、聚丙烯乙二醇等,其中,从亲水化的效果、安全性的方面考虑,优选pvp。关于pvp,根据分子量等的不同也有若干种类,例如,作为市面上销售的产品,有pvp的k-15、k-30、k-90(均为国际特种化学品(isp)公司生产)等。在本发明中使用的pvp的分子量(粘度平均分子量)为1万~200万,优选为5万~150万。膜中的亲水性高分子的含有率为聚合物的全部重量的3%~20%,优选为3%~10%。在含有率为3%以下的情况下,作为亲水化剂的效果减弱,另外,在含有率大于20%的情况下,制膜原液的粘度过高,因此在生产方面不理想。
[0076]
亲水化了的聚砜类中空纤维膜的制造方法可以利用公知的干湿式制膜技术。首先,将聚砜类高分子和聚乙烯基吡咯烷酮等亲水性高分子溶解在两者共用的溶剂中,调制
均匀的纺丝胶液。在亲水性高分子为聚乙烯基吡咯烷酮的情况下,作为该种共用溶剂,例如可以使用二甲基乙酰胺(以下称作dmac)、二甲亚砜、n-甲基-2-吡咯烷酮、二甲基甲酰胺、环丁砜、二氧六环(dioxane)等溶剂,或由上述溶剂的两种以上的混合液构成的溶剂。另外,为了控制孔径,也可以在纺丝胶液中添加水等添加物。
[0077]
在进行中空纤维膜的制膜时,使用孔内有管(tube in orifice)型的喷丝模,同时向空中喷出来自该喷丝模的孔的纺丝胶液和来自管的中空内液。中空内液用于使纺丝胶液凝固的物质,可以使用水或以水为主体的凝固液。可以依据中空纤维膜的目标超滤性能等性能,来决定中空内液的组成等,虽不能一概而论,但通常可以适当地使用纺丝胶液所用的溶剂与水的混合溶液。例如,作为中空内液,可以使用0重量%~65重量%的dmac水溶液等。自喷丝模与中空内液一并被喷出的纺丝胶液在空走部行进,向设置于喷丝模下部的以水为主体的凝固浴中导入、浸渍于其中而完成凝固。然后,经过对凝固了的中空纤维的清洗工序等,利用卷绕机卷绕湿润状态的中空纤维膜,获得中空纤维膜的膜束,然后进行干燥。或者,也可以经过清洗工序,然后在干燥机内进行干燥,获得中空纤维膜束,并不限定制造方法。
[0078]
由于浓缩器在进行工作时需要依靠一定的压力,因此,为了说明上的方便,将浓缩器中多孔膜压力较大的一侧称为多孔膜的一次侧,将多孔膜的压力较小的一侧称为多孔膜的二次侧。
[0079]
其中,在所述一次侧进行诸如蛋白质成分的浓缩,在所述二次侧进行滤液(含水成分)的分离。不言而喻的,图1中浓缩器的浓缩液出口2与多孔膜一次侧所在的空间相通,滤液出口4与多孔膜二次侧所在的空间相通。
[0080]
<测试液>
[0081]
本发明通过提供测试液以测试浓缩器的浓缩和分离能力。理论上为了能够完全反映待测试的浓缩器的实际浓缩和分离能力,使用患者的体腔液进行评价和测试是最为可靠的。然而,这样的理论却几乎是不现实的。
[0082]
一方面,几乎不可能事先得到患者的体腔液,更难以标准化的方式获得用过滤器过滤后的体腔液;另一方面,使用特定患者的体腔液对浓缩器进行评价,其评价结果只能是针对处于特定时期的该孤立的特定患者,不具有任何的普遍性。此外,由于浓缩器本身具有通常高昂的价格,而进行测试后的浓缩器几乎无法重复利用,如果照此进行,则一个患者至少要付出两倍的医疗费用。而且,患者的体腔液一旦用于测试便无法回收,从医疗伦理的角度出发也是不可行的。因此,显然使用患者体腔液对浓缩器浓缩性能进行评价是缺少实用价值的。
[0083]
因此,提供一种可靠的测试液以对浓缩器进行评价是重要的。本发明人等认为,由于浓缩器最重要的功能为对含有蛋白质的体液的浓缩和回收,因此,提供一种含有一定浓度的蛋白质的测试液以评价浓缩器的浓缩性能是可行的。进一步,由于人体体腔液形成的原因不同,导致了体腔液的组成情况也是不同的,进而实际处理过程中,浓缩器所面对的从上游的过滤器导出的体腔液组成也无法一概而论。因此,选择合适的浓度的测试液也是重要的。
[0084]
本发明的评价体腔液浓缩器蛋白质回收性能的测试液中,总蛋白浓度为0.5~2.4g/dl,白蛋白与球蛋白之比(a/g比)为0.8~1.5,并且血球数为1
×
102个/μl以下。
[0085]
本发明中,所述测试液中血球数超过1
×
102个/μl时,测试液中容易发生凝血级联
(容易生成血栓那样的块),无法对浓缩性能重现性良好地进行试验。从该观点出发,本发明中将所述测试液中控制血球数控制为1
×
102个/μl以下、优选为50个/μl以下、更优选为10个/μl以下、进一步优选为本质上不含血球。从考虑工艺成本的角度出发,血球数例如可以为5个/μl以上。
[0086]
本发明中,出于提高测试液的普遍适用性以及可靠性的角度,使用蛋白质含量为0.5~2.4g/dl的溶液,尤其是水溶液作为测试液。蛋白质浓度过低,则不能够评价浓缩的效果(蛋白质太稀时,则实际上浓缩器是对水进行了浓缩,评价测试的结果无法反映浓缩器实际处理人体体腔液的效果)。同时,将蛋白质含量控制在2.4g/dl以下,可以在评价测试时间内(30分钟~1小时,与通常用于患者的治疗时间相同)的期间tmp(浓缩器中多孔膜所经受的跨膜压差)不会上升,保证评价测试的重现性良好。
[0087]
本发明人等发现,通过将测试液中蛋白质含量设定为如上的范围,使得评价结果与浓缩器实际使用效果更为接近。同时,将蛋白质含量在上述范围内调整,不仅能够显著提高本发明测试液的普适性,即,既可以对针对肝硬化产生的人体体腔液的浓缩器进行实际使用性能的准确评价,也能够对针对各种癌症所产生的人体体腔液的浓缩器进行实际使用性能的评价。
[0088]
进一步,在本发明一些优选的实施方案中,将测试液中的蛋白含量控制在0.5~0.9g/dl的范围。对于这样测试液,尤其在针对肝硬化产生的人体体腔液的浓缩器进行实际使用性能进行评价时,具有更优良的可靠性。
[0089]
在本发明另外一些优选的实施方案中,将测试液中的蛋白含量控制在2.0g~2.4g/dl的范围。对于这样测试液,尤其在针对各种癌症所产生的人体体腔液的浓缩器进行实际使用性能进行评价时,具有更优良的可靠性。
[0090]
此外,对于蛋白质的类型,本发明中可以使用包括白蛋白以及白蛋白以外的蛋白,优选地,所述白蛋白以外的蛋白可以为球蛋白。另外,出于减少测试液中成分对浓缩器造成阻塞,优选地,所述蛋白质中,少量使用或者不使用纤维蛋白。
[0091]
在本发明一些具体的实施方案中,所述测试液中的白蛋白与球蛋白之比(a/g比)为0.8~1.5。本发明认为将白蛋白与球蛋白之比控制在上述范围而形成的测试液,其评价结果更能够反映浓缩器实际工作时的性能。
[0092]
进一步,在本发明一些优选的实施方案中,所述测试液的白蛋白与球蛋白之比(a/g比)为0.8~1.2。对于这样测试液,尤其在针对肝硬化产生的人体体腔液的浓缩器进行实际使用性能进行评价时,具有更优良的可靠性。
[0093]
进一步,在本发明一些优选的实施方案中,所述测试液的白蛋白与球蛋白之比(a/g比)为0.9~1.5。对于这样测试液,尤其在针对各种癌症所产生的人体体腔液的浓缩器进行实际使用性能进行评价时,具有更优良的可靠性。
[0094]
另外,实际使用测试液时不仅希望测试液能够在评价测试中具有优良的可靠性,同时也期望其具有成分的均一性和稳定性。这不仅有利于测试液的实际使用也有利于测试液的存储。因此,在本发明一些优选的实施方案中,出于在不影响本发明测试液使用时的可靠性的同时提高测试液的稳定性,在测试液中使用一定含量的抗凝剂。
[0095]
对于可以使用于本发明测试液中的抗凝剂,没有特别的要求,可以选自肝素及其盐、乙二胺四乙酸盐、柠檬酸盐、草酸盐、水蛭素中的至少任一种物质或它们中多种的混合
物。
[0096]
在一些优选的实施方案中,所述抗凝剂至少包括肝素或其盐,从有效提高测试液稳定性的角度考虑,所述抗凝剂中包括2单位/ml以上,优选3单位/ml以上,进一步优选5单位/ml以上的肝素和/或其盐。
[0097]
对于本发明的评价用测试液,除了含有上述的蛋白质、任选的抗凝剂以外,还可以根据实际需要而含有其它辅助成分,只要这些成分的存在不影响测试液的评价效果即可。对于这些辅助成分,可以包括无机盐、ph缓冲性成分。
[0098]
<测试液的制造方法>
[0099]
本发明的测试液的制造方法包括如下工序:
[0100]
过滤工序,使用过滤膜对原料液进行过滤,所述过滤膜具有0.2μm以下的平均孔径;
[0101]
浓度调整工序,调整过滤后的滤液中总蛋白和/或白蛋白浓度。
[0102]
在本发明一些优选的实施方案中,可以借助非人类的动物的血浆来制备上述测试液。由于动物血浆中也包含蛋白质,同时从生物性方面也与人体体腔液存在一定程度上的接近,使用动物血浆作为上述原料液时能够简化测试液的制备过程并提高测试液的使用效果。
[0103]
对于上述动物血浆,没有特别限定,可以使用(体型相对大一些)的哺乳类动物的血液,例如,牛、羊、猪、马、鹿的血液。从取材的方便性的角度考虑,优选使用牛或羊的血浆。此外,这些血浆可以是新鲜的血浆也可以是冷藏存储的血浆,从处理的方便性角度考虑,优选使用新鲜的动物血浆。另外,任选的,也可以向血浆中添加上文所述的抗凝剂,尤其是肝素。
[0104]
在所述过滤工序中,作为所述过滤膜,没有特别的限定,在本发明一些具体的实施方案中,可以使用本领域通常的多孔膜,典型地可以使用中空纤维膜。
[0105]
在本发明一些具体的实施方案中,所述过滤膜可以以在筒状容器的内部包括有中空纤维膜束的过滤器的形态来使用。在该筒状容器中使原料液自所述中空纤维膜束的中空纤维膜的外侧向中空纤维膜的内侧通过从而除去体腔液中的特定的物质,其中,所述中空纤维膜以所述中空纤维膜束的填充率在所述筒状容器的内部横截面中为20%以上且41%以下的方式分散配置,所述中空纤维膜束中的平均中空纤维膜间距离为150μm以上。
[0106]
在一些优选的实施方案中,所述中空纤维膜束中的最大中空纤维膜间距离为300μm以上;所述中空纤维膜束的有效膜面积为0.7m2以上且3.0m2以下;所述中空纤维膜的内径为50μm以上且500μm以下。
[0107]
在一些优选的实施方案中,从过滤性能的平衡的观点出发,所述过滤膜具有0.08μm以上且0.12μm以下的孔的个数相对于全部孔个数的比例为60%以上、优选为70%以上、更优选为80%以上的孔径分布。
[0108]
此外,在本发明另外一些具体的实施方案中,在所述过滤工序之前,可以用例如纱布、无纺布、滤纸等粗孔径的过滤膜来进行过滤(以下也称为粗过滤)。这些粗孔径的过滤膜,代表性地具有例如10μm、100μm、或1mm级的平均孔径,可以单层使用也可以层叠使用。
[0109]
从过滤的便利性以及成本角度考虑,本发明优选使用上述的纱布等粗孔径的过滤膜执行所述粗过滤工序。通过该粗过滤工序而能够去除不需要的组分,从而提高了上述过
滤工序的效率,这样的组分主要包含组织碎片、纤维蛋白、以及一部分血球。为了确保过滤的效果,可以进行多次的过滤。
[0110]
另外,在一些优选的实施方案中,为了防止由诸如纤维蛋白等成分导致的试验结果的一致性降低,可以在所述过滤工序前,对原料液进行冷冻-溶解的工序,进而通过例如上述粗过滤工序而将纤维蛋白进行去除。当然,这样的冷冻-溶解工艺以及去除纤维蛋白的工序也可以在所述过滤工序之后且所述浓度调整工序之前进行。
[0111]
过滤工序后得到的滤液,进一步进行浓度调整的工序,使得其最终满足所需的组成,优选为本发明上述测试液的组成。
[0112]
对于浓度调整工序,包括对其中的蛋白质浓度的调整,典型地,可以通过外加蛋白质的手段,将其中的蛋白质浓度调整到本发明测试液所限定的范围。
[0113]
进一步,将根据上述工序获得的测试液置于容器中,以备使用。对于测试液的保存条件,没有特别限定,典型地,可以进行冷藏存储。
[0114]
出于方便使用的角度,在本发明优选的实施方案中,可以将上述工序得到的测试液存储于试剂盒中。所述试剂盒包括容纳部以及置于所述容纳部中的测试液。所述试剂盒可以具有柔性或刚性的壳体,并且在一些具体的实施方案中,具有至少一个可以与外界连通的出口或接口。这样的出口或接口在使用前是密闭的。在另外的一些具体的实施方案中,所述试剂盒可以被抽真空,即试剂盒在被使用前内部是真空的。
[0115]
<评价方法>
[0116]
本发明中,使用上述测试液,对浓缩器进行评价。
[0117]
在一些具体实施方案中,通过至少使用浓缩步骤以及计算步骤来进行浓缩器的评价。
[0118]
浓缩步骤
[0119]
本发明中,通过浓缩步骤,将含蛋白质的测试液送至浓缩器,分离为浓缩液与滤液。
[0120]
参见附图2所示的装置,其显示了本发明一个具体实施方案中,进行评价测试所使用的装置,其中,3表示浓缩器输入口,5表示存储测试液的容器(测试液存储器),6表示存储经由浓缩器处理得到的浓缩液的容器(浓缩液存储器),7表示存储从浓缩器排出的滤液的容器(滤液存储器)。在该情况下,所谓浓缩步骤,即通过将测试液通过管路由浓缩器输入口3导入浓缩器中,并通过多孔膜将测试液分离成浓缩液与滤液。
[0121]
此外,在其它的一些具体实施方案中,用作评价测试的系统除了包含图2所显示的装置或结构以外,任选的还可以包含:再循环装置,其将浓缩液存储器6中的浓缩液再循环至测试液存储器;控制装置,当所述浓缩液存储器中储存的浓缩体腔液的液量达到第一规定量时,所述控制装置使过滤动作停止,利用所述再循环装置使所述浓缩液存储器6中储存的浓缩液再循环至所述测试液存储器5,进而再次进入浓缩器并进行浓缩。
[0122]
此外,本发明的各个装置间的物质的传送可以依靠动力装置进行,所述动力装置的种类没有特别限定,可以是输送泵。
[0123]
本发明的评价测试可以在0~50℃的条件下进行,优选地,可以在15~35℃的条件下进行,温度过低,造成测试液的流动性变差,同时也不利于浓缩器的浓缩处理;温度过高,则有导致蛋白成分变性的担忧。
[0124]
进行本发明的评价测试时,测试液从管路a被输送到浓缩器主体1中,通过浓缩器中多孔膜一次侧的加压,进行测试液的浓缩以及滤液(主要是含水成分)的分离,其中浓缩液进一步通过管路b而进入到浓缩液存储器6中,滤液通过管路c被输送至滤液存储器7中。
[0125]
此外,可以通过再循环装置,将浓缩液存储器6中浓缩液返回到测试液存储器5中,进而进行循环浓缩和分离。
[0126]
将进了浓缩处理后的浓缩液存储器6中的浓缩液和/或滤液存储器7中的滤液进行成分的检测,以评价浓缩器的性能。
[0127]
计算步骤
[0128]
本发明中,通过计算步骤,测定所述测试液、所述浓缩液和/或所述滤液中的组分,并计算出所述体腔液浓缩器的蛋白质回收性能。
[0129]
在一些具体的实施方案中,根据浓缩器的白蛋白回收率来评价浓缩器的蛋白回收性能。
[0130]
使用自动检测仪(日本电子株式会社制biomajesty
tm
jca-bm6050)对浓缩液中的白蛋白的量进行检测,同时根据测试液中原本的白蛋白的量,进而根据如下式(1)计算所述白蛋白回收率:
[0131]
式(1)
···
白蛋白回收率(%)=(浓缩液中的白蛋白量/测试液中的白蛋白量)
×
100。
[0132]
在其它一些具体的实施方案中,其中,所述白蛋白回收率还可以通过如式(2)计算而得到:
[0133]
式(2)
···
白蛋白回收率(%)={(浓缩液量
×
浓缩液中的白蛋白浓度)/(测试液量
×
测试液中的白蛋白浓度)}
×
100。
[0134]
此外,在其它一些具体的实施方案中,浓缩器的评价方法还考虑到残留于浓缩器中的残液,尤其是当浓缩器的体积较大,或者残液较为明显的情况。
[0135]
在这种情况下,本发明的评价测试中,还包括残液回收步骤,以在所述浓缩步骤后回收在所述体腔液浓缩器中残留的残留测试液。
[0136]
因此,在一些具体的实施方案中,所述蛋白质回收性能为白蛋白回收率,在计算步骤中,测定所述测试液、所述浓缩液、所述残留测试液中的白蛋白,算出所述体腔液浓缩器的蛋白质回收性能。
[0137]
该种情况下,所述白蛋白回收率根据如式(3)进行计算:
[0138]
式(3)
···
白蛋白回收率(%)={(浓缩液中的白蛋白量+残留测试液中的白蛋白量)/测试液中的白蛋白量}
×
100。
[0139]
进一步,所述白蛋白回收率也可以根据如式(4)进行计算:
[0140]
式(4)
···
白蛋白回收率(%)={(浓缩液量
×
浓缩液中的白蛋白浓度+残留测试液量
×
残留测试液中的白蛋白浓度)/(测试液量
×
测试液中的白蛋白浓度)}
×
100。
[0141]
在本发明另外一些具体的实施方案中,在所述浓缩步骤后还回收所述滤液。该滤液中还可能存在通过多孔膜的蛋白质,因此,这种情况下,所述蛋白质回收性能也可以通过白蛋白透过率来表示。即在所述计算步骤中,测定所述测试液和所述滤液中的白蛋白,算出所述白蛋白透过率。
[0142]
在一些具体的实施方案中,其中,所述白蛋白透过率可以如式(5)计算得出:
[0143]
式(5)
···
白蛋白透过率(%)=(滤液中的白蛋白量/测试液中的白蛋白量)
×
100。
[0144]
在一些具体的实施方案中,所述白蛋白透过率也可以如式(6)计算得出:
[0145]
式(6)
···
白蛋白透过率(%)={(滤液量
×
滤液中的白蛋白浓度)/(测试液量
×
测试液中的白蛋白浓度)}
×
100。
[0146]
此外,除了使用白蛋白的浓缩情况来评价浓缩器的实际使用性能以外,还可以用α1-mg(α1微球蛋白)的回收率来进行评价。
[0147]
所述计算步骤中,测定所述测试液、所述浓缩液中的α1-mg,来算出所述浓缩器的所述α1-mg回收率。
[0148]
在一些具体的实施方案中,其中,所述α1-mg回收率如式(7)计算得到:
[0149]
式(7)
···
α1-mg回收率(%)=(浓缩液中的α1-mg量/测试液中的α1-mg量)
×
100。
[0150]
在一些具体的实施方案中,所述α1-mg回收率也可以如式(8)计算得到:
[0151]
式(8)
···
α1-mg回收率(%)={(浓缩液量
×
浓缩液中的α1-mg量)/(测试液量
×
测试液中的α1-mg量)}
×
100。
[0152]
同样,在考虑或不可忽略残液的情况下,在计算步骤中,测定所述测试液、所述浓缩液、所述残留测试液中的α1-mg,算出所述浓缩器的所述α1-mg回收率。
[0153]
在一些具体的实施方案中,所述α1-mg回收率如式(9)计算得出:
[0154]
式(9)
···
α1-mg回收率(%)={(浓缩液中的α1-mg量+残留测试液中的α1-mg量)/测试液中的α1-mg量}
×
100。
[0155]
在一些具体的实施方案中,所述α1-mg回收率如式(10)计算得出:
[0156]
式(10)
···
α1-mg回收率(%)={(浓缩液量
×
浓缩液中的α1-mg浓度+残留测试液量
×
残留测试液中的α1-mg浓度)/(测试液量
×
测试液中的α1-mg浓度)}
×
100。
[0157]
另外,同样,也可以以α1-mg的透过率评价所述蛋白质回收性能,在此情况下,所述计算步骤中,测定所述测试液和所述滤液中的α1-mg,算出所述α1-mg透过率。
[0158]
在一些具体的实施方案中,所述α1-mg透过率如式(11)计算得出:
[0159]
式(11)
···
α1-mg透过率(%)=(滤液中的α1-mg量/测试液中的α1-mg量)
×
100。
[0160]
在一些具体的实施方案中,所述α1-mg透过率如式(12)计算得出:
[0161]
式(12)
···
α1-mg透过率(%)={(滤液量
×
滤液中的α1-mg浓度)/(测试液量
×
测试液中的α1-mg浓度)}
×
100。
[0162]
数据处理
[0163]
本发明中,通过如上所述的白蛋白的回收率、白蛋白的透过率、α1-mg的回收率或α1-mg的透过率来评价浓缩器的实际使用性能。
[0164]
一些具体的实施方案中,可以根据上述式(1)~(12)任一项计算数据作为评价标准。另外,任选的,也可以依据现有的数学方法对这些数据进行加权处理,以得到更为综合的评价指数。对于具体的数学处理方法,本发明没有特别限制。
[0165]
实施例
[0166]
以下,将通过具体的实施例对本发明进行说明。
[0167]
实施例
[0168]
在牛血浆添加肝素,冷冻解冻后,用纱布粗过滤,然后用具有0.2μm以下的平均孔径的中空纤维膜进行过滤,然后调整为总蛋白(以下称为“tp”。)浓度2g/dl、白蛋白/球蛋白比(“a/g比”)1.2,将由此得到液体作为测试液。该测试液中的肝素浓度为3.2单位/ml,血球数为0个/μl。
[0169]
将测试液置于测试液存储器(图2中5)并调温至27
±
1℃,将测试液以浓缩倍率为10倍的方式,通过管路向浓缩器输入口(图2中3)以流量50ml/分钟的速度供给,同时,浓缩器第1输出口(图2中的2)流量为5ml/分钟(收集于袋中),并且,浓缩器第2输出口(图2中的4)以45ml/分钟的流量产生滤液(收集于袋中),送液60分钟(测试液量为3l)。
[0170]
浓缩停止后,使用测试液和浓缩液,根据式(1)进行白蛋白的回收率的计算。此时,浓缩器内残留的液体为46ml。
[0171]
白蛋白回收率(%)=(浓缩液中的白蛋白量/测试液中的白蛋白量)
×
100。
[0172]
经检测结果为,浓缩液中的白蛋白的量为23.7g。此外,白蛋白回收率为69.3%。
[0173]
进而,从浓缩器输出口导入空气,回收残留于浓缩器中的残留测试液。使用测试液和浓缩液、残留测试液,根据式(3)进行白蛋白的回收率的计算。
[0174]
白蛋白回收率(%)={(浓缩液中的白蛋白量+残留测试液中的白蛋白量)/测试液中的白蛋白量}
×
100
[0175]
经检测结果为,浓缩液和残留测试液中的白蛋白的量为27.5g。此外,白蛋白回收率为80.6%。
[0176]
使用该测试液对同一批次的3个浓缩器进行了试验(n=3),其结果,使用测试液和浓缩液、残留测试液根据式(3)求出的白蛋白回收率的平均值为79.9%,相对标准偏差(rsd)为1.61%。
[0177]
参考例1
[0178]
将实施例中的测试液中蛋白质浓度调整为4g/dl,其它条件与实施例相同,进行浓缩作业。
[0179]
参考例2
[0180]
将实施例中的测试液中蛋白质浓度调整为7g/dl,其它条件与实施例相同,进行浓缩作业。
[0181]
<评价>
[0182]
检测实施例与两个参考例在浓缩进行时的tmp(跨膜压差),用tp2表示实施例浓缩时tmp的变化,用tp4表示参考例1浓缩时tmp的变化,用tp7表示参考例2浓缩时tmp的变化,结果参见图3。
[0183]
图3显示了在测试时间内(患者通常所需要的医疗时间内,即30min~60min)实施例中的tmp均低于150mmhg。而参考例1的情况下,在进行到30min时tmp已经升高至400mmhg附近,参考例2的情况下,在进行到10min时tmp已经升高至400mmhg附近。
[0184]
从以上现象可以认为,实施例中提供的测试液能够得到重现性高的试验结果,能准确地进行性能试验。其可以模拟出浓缩器在对人体体腔液进行浓缩处理时,正常使用下的浓缩情况,可以基本得出浓缩器实际正常工作时的浓缩性能。
[0185]
而参考例1和参考例2中,tmp(跨膜压差)很快(在30分钟之内)上升。这样一来,无
法继续完成预定的整个处理时间内的试验。另外,tmp过度上升时,存在膜破裂、容器损伤的可能性,无法继续试验。这样的情况无法有效预期浓缩器正常工作时的性能,也不具有可靠的重现性。
[0186]
需要说明的是,尽管以具体实例介绍了本发明的技术方案,但本领域技术人员能够理解,本公开应不限于此。
[0187]
以上已经描述了本公开的各实施例,上述说明是示例性的,并非穷尽性的,并且也不限于所披露的各实施例。在不偏离所说明的各实施例的范围和精神的情况下,对于本技术领域的普通技术人员来说许多修改和变更都是显而易见的。本文中所用术语的选择,旨在最好地解释各实施例的原理、实际应用或对市场中的技术的改进,或者使本技术领域的其它普通技术人员能理解本文披露的各实施例。
[0188]
产业上的可利用性
[0189]
本发明所提供的测试液及其制造方法,可以在工业生产中用于评价人体体腔液用浓缩器。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1