监测对治疗的响应的方法与流程
领域
本发明涉及药物基因组学的领域。特别地,本文提供了药效学标志物在监测受试者对癌症治疗的响应的方法中的用途。
背景
结肠直肠癌是在美国诊断出的第四大最常见的癌症类型,仅在2017年美国就有约95000例病例。在美国,结肠直肠癌是女性中癌症相关死亡的第三大主要原因和男性中癌症相关死亡的第二大主要原因。结肠直肠癌可以从结肠或直肠开始。通常,状况始于可以在结肠或直肠的内壁上形成的息肉。一些息肉随着时间的推移发展成癌症。
富含亮氨酸重复序列的g蛋白偶联受体5(lgr5)是在活跃循环的肠干细胞的表面上存在的七次跨膜蛋白,并且是wnt/β-连环蛋白信号传导途径的激动剂。这些lgr5阳性干细胞具有长期的寿命和持续不断的更新,导致它们有高机率获得致癌突变。这些突变被传给子细胞,这可以导致癌症。发现lgr5在iv期转移性结直肠癌患者中高度表达,并且是用于癌症疗法的靶。
药效学(pd)标志物可以被用于监测接受治疗药物的那些患者的响应。如果pd标志物指示患者对治疗没有适当地响应,那么可以增加、降低或停止治疗药物的剂量。因此,对开发与lgr5靶向疗法相关的pd标志物存在需求。这种方法将确保患者接受最合适的治疗。合适的pd标志物的鉴定还将有助于理解施用后的作用机制。
发明概述
本发明公开了监测受试者对用wnt/β-连环蛋白信号传导调节剂治疗的响应的方法。
在一个方面中,提供了监测受试者对用wnt/β-连环蛋白信号传导调节剂治疗的响应的方法,所述方法包括:
a)向受试者施用wnt/β-连环蛋白信号传导调节剂;以及
b)在向受试者施用wnt/β-连环蛋白信号传导调节剂之后,确定从受试者获得的样品中基质金属蛋白酶9(mmp-9)和金属蛋白酶组织抑制因子1(timp-1)表达水平的比率;
其中与在施用wnt/β-连环蛋白信号传导调节剂之前的mmp-9和timp-1表达水平的比率相比,mmp-9和timp-1表达水平的比率的变化指示受试者对wnt/β-连环蛋白信号传导调节剂有响应。
在另一个方面中,提供了用wnt/β-连环蛋白信号传导调节剂治疗患有过度增殖性疾病的受试者的方法,所述方法包括:
a)向受试者施用wnt/β-连环蛋白信号传导调节剂;
b)在向受试者施用wnt/β-连环蛋白信号传导调节剂之后,确定从受试者获得的样品中mmp-9和timp-1表达水平的比率;其中与在施用wnt/β-连环蛋白信号传导调节剂之前的mmp-9和timp-1表达水平的比率相比,mmp-9和timp-1表达水平的比率的变化指示受试者对wnt/β-连环蛋白信号传导调节剂有响应;以及
c)治疗被发现对wnt/β-连环蛋白信号传导调节剂有响应的受试者。
在一种实施方案中,wnt/β-连环蛋白信号传导调节剂是lgr5受体激动剂或拮抗剂。
附图简述
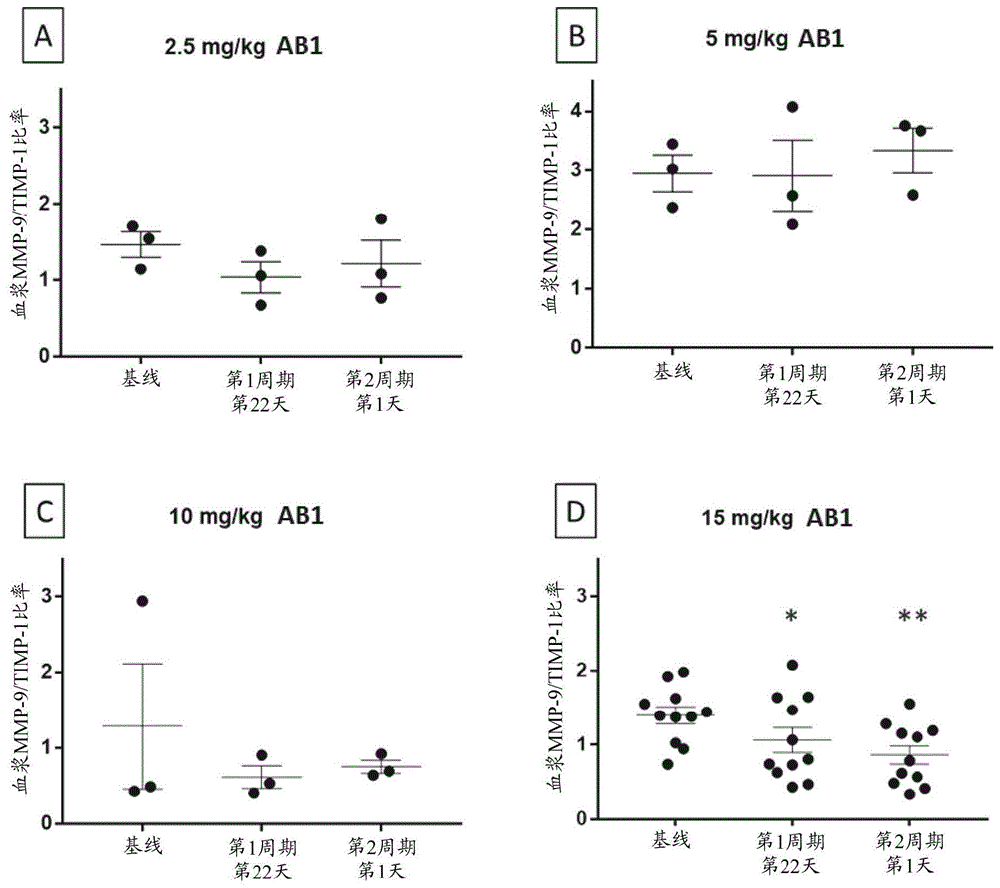
图1是示出按照ab1剂量分组的并且每个治疗时间点作为一个组分析的患者中mmp-9/timp-1比率的评估的图形表示。a)在2.5mg/kg剂量水平,每个时间点的患者血浆mmp-9/timp-1比率的平均值±sem。b)在5mg/kg剂量水平,每个时间点的患者血浆mmp-9/timp-1比率的平均值±sem。c)在10mg/kg剂量水平,每个时间点的患者血浆mmp-9/timp-1比率的平均值±sem。d)在15mg/kg剂量水平,每个时间点的患者血浆mmp-9/timp-1比率的平均值±sem。当将基线与第22天和基线与第2周期第1天进行比较时,在15mg/kgab1治疗的组中得到了显著性。使用单因素anova和tukey多重比较检验进行统计分析,由此p≤0.05*并且p≤0.01**。
图2是在接受15mg/kgab1的kras野生型患者与kras突变型患者中的mmp-9/timp-1比率的评估的图形表示。a)在一个治疗周期内分析的kras野生型组的血浆mmp-9/timp-1比率。b)在一个治疗周期内分析的kras突变型组的血浆mmp-9/timp-1比率。仅当将基线与第2周期第1天进行比较时,在15mg/kgab1治疗的kras突变型组中得到了显著性。使用单因素anova和tukey多重比较检验进行统计分析,由此p≤0.05*并且p≤0.01**。
发明详述
本发明公开了用于监测受试者对用wnt/β-连环蛋白信号传导抑制剂治疗的响应的方法。
本文提供了监测受试者对用wnt/β-连环蛋白信号传导调节剂治疗的响应的方法,所述方法包括:
a)向受试者施用wnt/β-连环蛋白信号传导调节剂;以及
b)在向受试者施用wnt/β-连环蛋白信号传导调节剂之后,确定从受试者获得的样品中基质金属蛋白酶9(mmp-9)和金属蛋白酶组织抑制因子1(timp-1)表达水平的比率,
其中与在施用wnt/β-连环蛋白信号传导调节剂之前的mmp-9和timp-1表达水平的比率相比,mmp-9和timp-1表达水平的比率的变化指示受试者对wnt/β-连环蛋白信号传导调节剂有响应。
在另外的方面中,提供了用wnt/β-连环蛋白信号传导调节剂治疗患有过度增殖性疾病的受试者的方法,所述方法包括:
a)向受试者施用wnt/β-连环蛋白信号传导调节剂;
b)在向受试者施用wnt/β-连环蛋白信号传导调节剂之后,确定从受试者获得的样品中mmp-9和timp-1表达水平的比率;其中与在施用wnt/β-连环蛋白信号传导调节剂之前的mmp-9和timp-1表达水平的比率相比,mmp-9和timp-1表达水平的比率的变化指示受试者对wnt/β-连环蛋白信号传导调节剂有响应;以及
c)治疗被发现对wnt/β-连环蛋白信号传导调节剂有响应的受试者。
在一种实施方案中,提供了监测受试者对用wnt/β-连环蛋白信号传导抑制剂治疗的响应的方法,所述方法包括:
a)向受试者施用wnt/β-连环蛋白信号传导抑制剂;
b)在向受试者施用wnt/β-连环蛋白信号传导抑制剂之后,确定从受试者获得的样品中基质金属蛋白酶9(mmp-9)和金属蛋白酶组织抑制因子1(timp-1)表达水平的比率;并且
其中与在施用wnt/β-连环蛋白信号传导抑制剂之前的mmp-9和timp-1表达水平的比率相比,mmp-9和timp-1表达水平的比率的变化指示受试者对wnt/β-连环蛋白信号传导抑制剂有响应。
在一种实施方案中,提供了用wnt/β-连环蛋白信号传导抑制剂治疗患有过度增殖性疾病的受试者的方法,所述方法包括:
a)向受试者施用wnt/β-连环蛋白信号传导抑制剂;
b)在向受试者施用wnt/β-连环蛋白信号传导抑制剂之后,确定从受试者获得的样品中mmp-9和timp-1表达水平的比率;
其中与在施用wnt/β-连环蛋白信号传导抑制剂之前的mmp-9和timp-1表达水平的比率相比,mmp-9和timp-1表达水平的比率的变化指示受试者对wnt/β-连环蛋白信号传导抑制剂有响应;以及
治疗被发现对wnt/β-连环蛋白信号传导抑制剂有响应的受试者。
在一种实施方案中,提供了监测受试者对用wnt/β-连环蛋白信号传导激动剂治疗的响应的方法,所述方法包括:
a)向受试者施用wnt/β-连环蛋白信号传导激动剂;
b)在向受试者施用wnt/β-连环蛋白信号传导激动剂之后,确定从受试者获得的样品中基质金属蛋白酶9(mmp-9)和金属蛋白酶组织抑制因子1(timp-1)表达水平的比率;并且
其中与在施用wnt/β-连环蛋白信号传导激动剂之前的mmp-9和timp-1表达水平的比率相比,mmp-9和timp-1表达水平的比率的变化指示受试者对wnt/β-连环蛋白信号传导激动剂有响应。
在一种实施方案中,提供了监测受试者对用lgr5受体激动剂治疗的响应的方法,所述方法包括:
a)向受试者施用lgr5受体激动剂;
b)在向受试者施用lgr5受体激动剂之后,确定从受试者获得的样品中mmp-9和timp-1表达水平的比率;并且
其中与在施用lgr5受体激动剂之前的mmp-9和timp-1表达水平的比率相比,mmp-9和timp-1表达水平的比率的变化指示受试者对lgr5受体激动剂有响应。
在一种实施方案中,提供了用lgr5受体激动剂治疗患有过度增殖性疾病的受试者的方法,所述方法包括:
a)向受试者施用lgr5受体激动剂;
b)在向受试者施用lgr5受体激动剂之后,确定从受试者获得的样品中mmp-9和timp-1表达水平的比率;
其中与在施用lgr5受体激动剂之前的mmp-9和timp-1表达水平的比率相比,mmp-9和timp-1表达水平的比率的变化指示受试者对lgr5受体激动剂有响应;以及
c)治疗被发现对lgr5受体激动剂有响应的受试者。
在一种实施方案中,提供了监测受试者对用ab1抗体治疗的响应的方法,所述方法包括:
c)向受试者施用ab1抗体;
d)在向受试者施用ab1抗体之后,确定从受试者获得的样品中mmp-9和timp-1表达水平的比率;并且
其中与在施用ab1抗体之前的mmp-9和timp-1表达水平的比率相比,mmp-9和timp-1表达水平的比率的降低指示受试者对ab1抗体有响应。
在一种实施方案中,提供了用ab1抗体治疗患有过度增殖性疾病的受试者的方法,所述方法包括:
a)向受试者施用ab1抗体;
b)在向受试者施用ab1抗体之后,确定从受试者获得的样品中mmp-9和timp-1表达水平的比率;
其中与在施用ab1抗体之前的mmp-9和timp-1表达水平的比率相比,mmp-9和timp-1表达水平的比率的降低指示受试者对ab1抗体有响应;以及
c)治疗被发现对ab1抗体有响应的受试者。
在一种实施方案中,提供了监测受试者对用wnt/β-连环蛋白信号传导调节剂治疗的响应的方法,所述方法包括:
c)向受试者施用wnt/β-连环蛋白信号传导调节剂;以及
d)在向受试者施用wnt/β-连环蛋白信号传导调节剂之后,确定从受试者获得的样品中基质金属蛋白酶9(mmp-9)和金属蛋白酶组织抑制因子1(timp-1)表达水平的比率,
其中mmp-9和timp-1表达水平的比率的变化指示受试者对wnt/β-连环蛋白信号传导调节剂有响应。
在一种实施方案中,提供了用wnt/β-连环蛋白信号传导调节剂治疗患有过度增殖性疾病的受试者的方法,所述方法包括:
a)向受试者施用wnt/β-连环蛋白信号传导调节剂;
b)在向受试者施用wnt/β-连环蛋白信号传导调节剂之后,确定从受试者获得的样品中mmp-9和timp-1表达水平的比率;其中mmp-9和timp-1表达水平的比率的变化指示受试者对wnt/β-连环蛋白信号传导调节剂有响应;以及
e)治疗被发现对wnt/β-连环蛋白信号传导调节剂有响应的受试者。
在一种实施方案中,受试者罹患过度增殖性疾病。过度增殖性疾病可以是癌症。
术语“癌症”和“癌性”指的是或描述哺乳动物中通常部分地以不受调节的细胞生长为特征的生理状况。如本文使用的,术语“癌症”指的是非转移性癌症和转移性癌症,包括早期癌症和晚期癌症。术语“癌前的”指的是通常在癌症之前或发展成癌症的状况或生长。“非转移性”意指为良性的或保持在原发部位并且尚未渗透到淋巴或血管系统或除原发部位以外的组织的癌症。通常,非转移性癌症是为0期、i期或ii期癌症,以及偶尔为iii期癌症的任何癌症。“早期癌症”意指非侵袭性的或非转移性的或被分类为0期、i期或ii期癌症的癌症。术语“晚期癌症”通常指的是iii期或iv期癌症,但也可以指ii期癌症或ii期癌症的亚期(sub-stage)。本领域技术人员将理解,ii期癌症被分类为早期癌症或晚期癌症取决于癌症的具体类型。
在一种实施方案中,癌症是包含lgr5+细胞的器官中的癌症。在一种实施方案中,癌症是包含lgr5+干细胞的器官中的癌症。在一种实施方案中,癌症是来自包含lgr5+干细胞的器官的转移性癌症。
在一种实施方案中,癌症是已知过表达lgr5的癌症,诸如肝细胞癌(肝癌)和胃癌(gastriccancer)(胃癌(stomachcancer)),并且因此具有通过lgr5靶向抗体治疗的潜力。
在一种实施方案中,癌症是包括结肠癌、结肠直肠癌、胰腺癌、乳腺癌、肝癌、胃癌或肺癌的癌症。
在一些实施方案中,癌症是包括结肠癌、转移性结肠直肠癌、转移性胰腺癌、三阴性乳腺癌或小细胞肺癌的癌症。
在一些实施方案中,癌症是包括结肠癌、结肠直肠癌、胰腺癌、乳腺癌或肺癌的癌症。在一些实施方案中,癌症是包括包含apc突变的结肠癌、包含kras突变的结肠癌、转移性结肠直肠癌、转移性胰腺癌、三阴性乳腺癌或小细胞肺癌的癌症。
在一种实施方案中,癌症是结肠直肠癌。术语“结肠直肠癌”可以指结肠癌或直肠癌。在另一种实施方案中,癌症是胰腺癌或胃癌。
术语“施用”指的是将本发明的组合物接触、应用或提供至受试者。
如本文使用的术语“治疗”可以指(1)预防或延迟紊乱的一种或更多种症状的出现;(2)抑制紊乱的发展或紊乱的一种或更多种症状;(3)缓解紊乱,即引起紊乱或紊乱的至少一种或更多种症状的消退;和/或(4)引起紊乱的一种或更多种症状的严重程度的降低。
如在整个说明书中使用的术语“受试者”应被理解为意指人类或可以是家养动物或伴侣动物。虽然特别设想本发明的方法用于治疗人类,但它们也适用于兽医治疗,包括治疗伴侣动物诸如犬和猫,以及家养动物诸如马、牛和羊,或动物园动物诸如灵长类动物、猫科动物、犬科动物、牛科动物和有蹄类动物。“受试者”可以包括人、患者或个体,并且可以是任何年龄或性别。
如本文使用的,“表达”指的是dna藉以被转录成mrna的过程和/或转录的mrna藉以随后被翻译成肽、多肽或蛋白的过程。如果多核苷酸源自基因组dna,则表达可以包括真核细胞中的mrna的剪接。
在一种实施方案中,wnt/β-连环蛋白信号传导调节剂是lgr5受体的别构调节剂。在一种实施方案中,wnt/β-连环蛋白信号传导调节剂是lgr5受体抑制剂(或拮抗剂)。在一种实施方案中,wnt/β-连环蛋白信号传导抑制剂是lgr5受体拮抗剂。lgr5受体抑制剂或拮抗剂可以导致wnt/β-连环蛋白信号传导下游信号传导的降低。
在一种实施方案中,wnt/β-连环蛋白信号传导调节剂是lgr5受体激动剂。lgr5受体激动剂可以与lgr5受体结合,并且通过lgr5受体导致wnt/β-连环蛋白信号传导下游信号传导的增加。在一种实施方案中,lgr5受体激动剂是r-spondin配体。在一种实施方案中,lgr5受体激动剂是抗lgr5抗体或其片段。在一种实施方案中,lgr5受体激动剂是ab1抗体或其片段。
在一种实施方案中,所述方法包括以15mg/kg的剂量向受试者施用ab1。
如本文使用的,术语“抗体”包括但不限于合成抗体、单克隆抗体、重组产生的抗体、细胞内抗体(intrabodies)、多特异性抗体(包括双特异性抗体)、人抗体、人源化抗体、嵌合抗体、合成抗体、单链fv(scfv)、fab片段、f(ab′)片段、二硫键连接的fv(sdfv)(包括双特异性sdfv)和抗独特型(抗-id)抗体,以及以上任一种的表位结合片段。本文提供的若干种实施方案的抗体可以是单特异性的、双特异性的、三特异性的或更大的多特异性的。多特异性抗体可以对多肽的不同表位具有特异性,或者可以对多肽以及异源表位(诸如异源多肽或固体支持材料)两者具有特异性。
在一种实施方案中,抗体是抗体片段(诸如scfv、ds-fv、ds-scfv、sdab和双抗体)。
如本文使用的,lgr5包括但不限于人lgr5,包括ncbi登录号np003658.1的多肽或其片段,其由nm003667.2内的编码核苷酸序列或其片段编码。登录号np003658.1的氨基酸序列和整个条目以及nm003667.2的核苷酸序列和整个条目全部通过引用以其整体并入。本文设想的lgr5片段的实例包括lgr5胞外域、跨膜结构域或细胞内结构域及其部分。
若干种实施方案涉及产生抗lgr5抗体的轻链和/或重链的杂交瘤,所述抗lgr5抗体包括如在us9546214b2中详细描述的被命名为18g7h6a3和18g7h6a1的抗lgr5抗体,us9546214b2通过引用以其整体并入本文。
多种实施方案涉及包含编码抗lgr5抗体的轻链和/或重链的一种或更多种核酸分子的载体,所述抗lgr5抗体包括如在us9546214b2中详细描述的被命名为18g7h6a3和18g7h6a1的抗lgr5抗体中的任一种,us9546214b2通过引用以其整体并入本文。
在多种实施方案中,抗体的糖基化可以被修饰。例如,可以制备无糖基化抗体(即,抗体缺乏糖基化)。糖基化可以被改变,以便例如增加抗体对靶抗原的亲和力。这样的碳水化合物修饰可以通过例如改变抗体序列中的一个或更多个糖基化位点来完成。例如,可以进行导致一个或更多个可变区框架糖基化位点的消除的一个或更多个氨基酸取代,以便从而消除在该位点处的糖基化。这样的无糖基化可以增加抗体对抗原的亲和力。
在一些实施方案中,本文提供的抗lgr5抗体包含含有gysftayw(seqidno:1)的重链cdr1、含有ilpgsdst(seqidno:2)的重链cdr2、和含有arsgyygssqy(seqidno:3)的重链cdr3。在一些实施方案中,本文提供的抗lgr5抗体包含含有esvdsygnsf(seqidno:4)的轻链cdr1、含有lts(seqidno:5)的轻链cdr2、和含有qqnaedprt(seqidno:6)的轻链cdr3。
在一种实施方案中,抗lgr5抗体(命名为ab1)包含含有gysftayw(seqidno:1)的重链cdr1、含有ilpgsdst(seqidno:2)的重链cdr2、含有arsgyygssqy(seqidno:3)的重链cdr3、含有esvdsygnsf(seqidno:4)的轻链cdr1、含有lts(seqidno:5)的轻链cdr2、和含有qqnaedprt(seqidno:6)的轻链cdr3。
在一种实施方案中,抗lgr5抗体包含具有以下序列的重链可变结构域:
在一种实施方案中,抗lgr5抗体包含具有以下序列的轻链可变结构域:
另一种实施方案包括在抗lgr5抗体诸如ab1的任何部分中引入保守氨基酸取代。本领域熟知“保守氨基酸取代”指的是取代功能上等同的氨基酸的氨基酸取代。保守氨基酸改变导致所得到的肽的氨基酸序列的沉默改变。例如,一个或更多个相似极性的氨基酸充当功能等同物,并且导致肽的氨基酸序列内的沉默改变。电荷中性的并且用较小的残基替代残基的取代也可以被认为是“保守取代”,即使残基在不同的组中(例如,用较小的异亮氨酸替代苯丙氨酸)。
如本文使用的,术语“核酸”和等效术语诸如多核苷酸指的是包含嘌呤和嘧啶碱基,或其他天然的、化学或生物化学修饰的、非天然的或衍生化的核苷酸碱基的任何长度的核苷酸的聚合形式,诸如核糖核苷酸、脱氧核糖核苷酸或肽核酸(pna)。核酸可以是双链的或单链的。对单链核酸的述及包括对有义链或反义链的述及。多核苷酸的骨架可以包含如可以通常在rna或dna中存在的糖和磷酸基团,或修饰的或被取代的糖或磷酸基团。多核苷酸可以包含修饰的核苷酸,诸如甲基化的核苷酸及核苷酸类似物。核苷酸的序列可以被非核苷酸组分隔开。术语核苷、核苷酸、脱氧核苷和脱氧核苷酸通常包括核苷、核苷酸、脱氧核苷和脱氧核苷酸或其类似物的互补物、片段和变体。
如本文描述的wnt/β-连环蛋白信号传导调节剂可以被肠胃外施用。wnt/β-连环蛋白信号传导调节剂可以被直接施用到血流、组织、肌肉或内部器官中。施用可以是全身性的,例如注射或输注。施用可以是局部的。合适的施用方法包括静脉内、动脉内、鞘内、心室内、尿道内、胸骨内、颅内、视网膜下、玻璃体内、前房内、肌内、滑膜内和皮下。合适的施用装置包括针(包括微针)注射器、无针注射器以及输注技术。
wnt/β-连环蛋白信号传导调节剂将通常,但不必须,作为与一种或更多种药学上可接受的赋形剂结合的制剂施用。术语“赋形剂”包括除了本公开内容的化合物、其他脂质组分和生物活性剂之外的任何成分。赋形剂可以赋予制剂功能性(例如药物释放速率控制)和/或非功能性(例如加工助剂或稀释剂)的特性。赋形剂的选择将很大程度上取决于诸如特定的施用模式、赋形剂对溶解性和稳定性的影响和剂型的性质的因素。
肠胃外制剂通常是水性或油性的溶液或悬浮液。在制剂是水性的情况下,赋形剂诸如糖(包括但不限于葡萄糖、甘露醇、山梨糖醇等)、盐、碳水化合物和缓冲剂(优选地至从3至9的ph),但对于一些应用,它们可以更合适地用无菌非水性溶液配制或被配制为干燥形式,以便与合适的媒介物诸如无菌的、无热原的水(wfi)结合使用。
术语“样品”可以是任何生物组织或流体。样品可以是源自患者的样品。这样的样品包括但不限于血液、血清、血浆、尿液、唾液、精液、乳房渗出物、脑脊髓液、泪液、痰、粘液、淋巴、胞质溶胶、腹水、胸腔积液、腹腔液、羊水、膀胱洗涤液和支气管肺泡灌洗液、血细胞(例如白细胞)、组织或活检样品(例如肿瘤活检)或来自其的细胞。生物样品还可以包括组织切片诸如出于组织学目的采集的冷冻切片。
在一种实施方案中,该方法包括测量从受试者获得的样品中的mmp-9和timp-1的表达水平。这可以包括使用本领域已知的方法从受试者收集生物材料的样品。测量mmp-9和timp-1的表达水平的步骤可以通过任何合适的方法进行,包括elisa、蛋白印迹法、ria(放射免疫测定)、基于核酸的适体技术(例如基于聚合酶链式反应的技术)或基于蛋白的适体技术、hplc(高精度液相色谱法)、spr(表面等离子体共振)、质谱法。然后,可以确定mmp-9和timp-1之间的表达水平的比率(mmp-9/timp-1)。
在一种实施方案中,该方法包括在施用wnt/β-连环蛋白信号传导调节剂之前从受试者获得样品,并且确定样品中mmp-9和timp-1表达水平的比率。
在另一种实施方案中,该方法包括在施用wnt/β-连环蛋白信号传导调节剂之后从受试者获得样品,并且确定样品中mmp-9和timp-1表达水平的比率。
在一种实施方案中,该方法包括将在向受试者施用wnt/β-连环蛋白信号传导调节剂之后获得的样品中和在向受试者施用wnt/β-连环蛋白信号传导调节剂之前获得的样品中的mmp-9和timp-1表达水平的比率进行比较。
可以测量除了mmp-9和timp-1之外的一种或更多种另外的生物标志物。
在一种实施方案中,mmp-9和timp-1表达水平的比率的变化是mmp-9和timp-1表达水平的比率的增加。
在一种实施方案中,mmp-9和timp-1表达水平的比率的增加指示受试者对wnt/β-连环蛋白信号传导调节剂有响应。mmp-9和timp-1的比率的增加可以是1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、11倍、12倍、13倍、14倍、15倍、16倍、17倍、18倍、19倍、20倍、21倍、22倍、23倍、24倍、25倍、26倍、27倍、28倍、29倍、30倍、31倍、32倍、33倍、34倍、35倍、36倍、37倍、38倍、39倍、40倍、41倍、42倍、43倍、44倍、45倍、46倍、47倍、48倍、49倍、50倍、51倍、52倍、53倍、54倍、55倍、56倍、57倍、58倍、59倍、60倍、61倍、62倍、63倍、64倍、65倍、66倍、67倍、68倍、69倍、70倍、71倍、72倍、73倍、74倍、75倍、76倍、77倍、78倍、79倍、80倍、81倍、82倍、83倍、84倍、85倍、86倍、87倍、88倍、89倍、90倍、91倍、92倍、93倍、94倍、95倍、96倍、97倍、98倍、99倍或100倍,或其间的增加。
在一种实施方案中,mmp-9和timp-1表达水平的比率的变化是mmp-9和timp-1表达水平的比率的降低。
在一种实施方案中,mmp-9和timp-1表达水平的比率的降低指示受试者对wnt/β-连环蛋白信号传导调节剂有响应。mmp-9和timp-1的比率的降低可以是1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、11倍、12倍、13倍、14倍、15倍、16倍、17倍、18倍、19倍、20倍、21倍、22倍、23倍、24倍、25倍、26倍、27倍、28倍、29倍、30倍、31倍、32倍、33倍、34倍、35倍、36倍、37倍、38倍、39倍、40倍、41倍、42倍、43倍、44倍、45倍、46倍、47倍、48倍、49倍、50倍、51倍、52倍、53倍、54倍、55倍、56倍、57倍、58倍、59倍、60倍、61倍、62倍、63倍、64倍、65倍、66倍、67倍、68倍、69倍、70倍、71倍、72倍、73倍、74倍、75倍、76倍、77倍、78倍、79倍、80倍、81倍、82倍、83倍、84倍、85倍、86倍、87倍、88倍、89倍、90倍、91倍、92倍、93倍、94倍、95倍、96倍、97倍、98倍、99倍或100倍,或其间的降低。
在一种实施方案中,基质金属蛋白酶9(mmp-9)和金属蛋白酶组织抑制因子1(timp-1)表达水平的比率是在向受试者施用wnt/β-连环蛋白信号传导调节剂之后在合适的时间段内确定的。时间段可以是1天、2天、3天、4天、5天、6天、7天、8天、9天、10天、11天、12天、13天、14天、15天、16天、17天、18天、19天、20天、21天、22天、23天、24天、25天、26天、27天、28天、29天、30天、31天、32天、33天、34天、35天、36天、37天、38天、39天、40天、41天、42天、43天、44天、45天、46天、47天、48天、49天、50天、51天、52天、53天、54天、55天、56天、57天、58天、59天、60天、61天、62天、63天、64天、65天、66天、67天、68天、69天、70天、71天、72天、73天、74天、75天、76天、77天、78天、79天、80天、81天、82天、83天、84天、85天、86天、87天、88天、89天或90天,或其间的时间段。
本文还提供了治疗受试者的方法。在一种实施方案中,该方法还包括用wnt/β-连环蛋白信号传导调节剂治疗受试者,其中受试者被发现对wnt/β-连环蛋白信号传导调节剂有响应。
在一种实施方案中,提供了用于鉴定对wnt/β-连环蛋白信号传导调节剂(例如ab1抗体)的治疗有响应的受试者的子集的方法。例如,示出基于在施用wnt/β-连环蛋白信号传导调节剂之后mmp-9和timp-1表达水平的比率的变化,具有kras突变的受试者中的特定受试者对用ab1抗体治疗特别有响应。
在一种实施方案中,提供了治疗患有过度增殖性疾病的受试者的方法,该方法包括向受试者施用wnt/β-连环蛋白信号传导调节剂(例如ab1抗体),其中受试者被鉴定为具有kras突变。
在一种实施方案中,提供了确定用wnt/β-连环蛋白信号传导调节剂(例如ab1抗体)治疗的治疗有效剂量的方法。这可以通过向受试者施用特定剂量的wnt/β-连环蛋白信号传导调节剂并且确定在施用wnt/β-连环蛋白信号传导调节剂之后mmp-9和timp-1表达水平的比率是否存在变化来确定。
本文提供了用于确定样品中基质金属蛋白酶9(mmp-9)和金属蛋白酶组织抑制因子1(timp-1)表达水平的比率的组合物。在一种实施方案中,提供了包含抗mmp-9抗体和timp-1抗体的组合物。抗体可以与一种或更多种标记(例如荧光标记)缀合,以允许检测mmp-9和timp-1。在一种实施方案中,提供了包含用于扩增和检测mmp-9和timp-1的核酸引物的组合物。核酸引物可以与一种或更多种标记(例如荧光标记)偶联或附接,以允许检测。
本文提供了用于确定样品中基质金属蛋白酶9(mmp-9)和金属蛋白酶组织抑制因子1(timp-1)表达水平的比率的试剂盒。在一种实施方案中,该试剂盒包括一种或更多种包含抗mmp-9抗体和抗timp-1抗体的隔室。抗体可以与一种或更多种标记(例如荧光标记)缀合,以允许检测mmp-9和timp-1。
在一种实施方案中,提供了抗mmp-9抗体和抗timp-1抗体在制备诊断测定中的用途。诊断测定可以用于监测在用wnt/β-连环蛋白信号传导调节剂治疗之后的治疗中的响应,其中mmp-9和timp-1的表达水平的比率的变化指示受试者对wnt/β-连环蛋白信号传导调节剂有响应。
在一种实施方案中,提供了wnt/β-连环蛋白信号传导调节剂(例如ab1抗体)在制备用于治疗受试者的过度增殖性疾病的药物中的用途。在一种实施方案中,过度增殖性疾病是癌症。在一种实施方案中,所述癌症是具有kras突变的癌症。
如在本申请中使用的,单数形式“一(a)”、“一(an)”和“该(the)”包括复数指示物,除非上下文另外清楚地指示。
在整个本说明书和所附权利要求中,除非上下文另有要求,否则词语“包括/包含(comprise)”及变形诸如“包括/包含(comprises)”和“包括/包含(comprising)”将被理解为暗示包括陈述的整数或步骤或者整数或步骤的组,但不排除任何其他整数或步骤或者整数或步骤的组。
在本说明书中对任何先前的出版物(或源自其的信息)或对任何已知的物质的引用不是并且不应当被视为确认或承认或以任何形式暗示该先前的出版物(或源自其的信息)或已知的物质形成本说明书涉及的领域中的公知常识的一部分。
实施例
材料与方法
患者血浆样品收集
来自每个地点的患者在ab1治疗的第一个周期的每周给药前经历血液收集,接下来在每个随后周期的第一天给药前经历血液收集。血液被收集在streck-bct管中,并且通常在血液收集之后24小时,通过在1900xg离心10分钟处理血液来获得血浆。血浆样品在-80℃以700μl等分试样储存。从一名健康志愿者收集对照全血于streck-bct管中,并且依照患者样品处理血浆。
mmp-9elisa
依照制造商的使用说明运行mmp-9elisa板。使用生成的标准曲线斜率定量血浆mmp-9蛋白浓度。为每个elisa板生成的标准曲线在附录中概述。每个板使用新鲜解冻的血浆。在每个elisa板上运行健康对照以及另外的筛选失败基线样品作为阳性对照。基于制造商的使用说明,当运行在推荐的稀释剂中稀释至适当浓度的患者血浆时,在每个elisa板上生成标准曲线。基于最初的优化板,血浆在稀释剂中的1:300稀释被用于mmp-9检测。
timp-1elisa
依照制造商的使用说明运行timp-1elisa板。使用生成的标准曲线斜率定量血浆timp-1蛋白浓度。为每个elisa板生成的标准曲线在附录中概述。每个板使用新鲜解冻的血浆。在每个elisa板上运行健康对照以及另外的来自患者s03-006-1的筛查失败基线样品作为阳性对照。基于制造商的使用说明,当运行在推荐的稀释剂中稀释至适当浓度的患者血浆时,在每个elisa板上生成标准曲线。基于最初的优化板,1:100血浆稀释被用于timp-1检测。
mmp-9/timp-1比率
处理患者血浆,以确定mmp-9和timp-1蛋白浓度。焦点最初是确定在1个治疗周期内mmp-9/timp-1比率的任何潜在失衡,分析基线、第15天、第22天和第2周期第1天(治疗前)的血浆样品。还感兴趣的是,确定接受超过第2周期的延长的治疗期的患者是否展示出mmp-9/timp-1比率的任何持续变化。因此,评估了从超过第2周期的研究的任何队列选择的患者,其包括患者1、2、5、9、10和13。在单独的elisa板上确定mmp-9和timp-1的血浆浓度后,计算每个患者每个时间点的mmp-9/timp-1的比率(原始数据可以在参考的excel表中找到)。每次运行患者时间进程,所有样品被新鲜解冻,并且针对内部板标准曲线进行分析。患者的所有队列(队列12.5mg/kg、队列25mg/kg、队列310mg/kg、队列4和扩展队列15mg/kg)都使用graphpadprism7.02进行统计分析,由此在anova和tukey多重比较检验之后,当p≤0.05时得到显著性。
实施例1
本文描述了通过elisa对ab1患者血浆样品中的可溶性蛋白mmp-9和timp-1的分析。在本文中研究了mmp-9/timp-1比率,以确定这两种蛋白是否存在失衡,该失衡潜在地指示肿瘤微环境的变化。观察到mmp-9和timp-1的血浆水平的比率的统计学上显著的降低,这为用15mg/kg的ab1治疗之后的药效学作用提供了支持,并且特别是在携带kras突变的患者中,这可能对临床研究中的患者选择是有用的。
ab1是结合wnt/β-连环蛋白信号传导激动剂lgr5的单克隆抗体,lgr5被发现在结肠直肠癌(crc)患者中高度表达。在iv期转移性crc患者中用mab靶向lgr5的结果是未知的,并且虽然进行了该i期研究以证明安全性和耐受性,但它还提供了开发可以呈现关于用ab1治疗的患者的有用信息或突出新的药效学(pd)标志物的方法的机会。虽然关于ab1研究的所有患者都是iv期转移性crc患者,但他们具有显著不同的治疗史、突变谱、性别、年龄和转移部位。这种广泛的变量列表对数据分析的能力提出了挑战。
感兴趣的是,对来自2名用ab1治疗的患者的患者肿瘤转移组织的初步基因表达分析展示出在第22天mmp-9和/或timp-1mrna表达的变化。询问ab1是否影响患者血浆中mmp-9/timp-1比率,这可能指示在治疗之后tme的变化。mmp-9和timp-1是在血浆中发现的高浓度的可溶性蛋白,通过elisa可容易检测出。研究了mmp-9/timp-1比率,以确定ab1研究患者中的潜在失衡以及ab1治疗对肿瘤微环境的任何影响。
实施例2
通过elisa分析血浆mmp-9和timp-1蛋白浓度
在一个治疗周期内ab1治疗的患者样品中的血浆mmp-9和timp-1蛋白浓度以比率表示。如图1中概述的,可以在第一个治疗周期内单独地追踪每个患者,并且在基线、第22天和第2周期第1天(给药前)绘制关键时间点。虽然给药2.5mg/kg或5mg/kg(图1a)和10mg/kg(图1b)的ab1的患者在第一个治疗周期内显示具有稳定的mmp-9/timp-1比率,但给药15mg/kg的ab1的患者在第2周期第1天时间点显示具有朝向mmp-9/timp-1比率降低的趋势(图1c)。
为了确定在更长的治疗的时间过程内是否存在任何可观察到的变化,分析了来自持续3个或更多个周期的研究的跨越2.5-15mg/kgab1给药的一系列队列的患者中的血浆mmp-9和timp-1蛋白浓度(图1d)。计算mmp-9/timp-1比率,以确定在ab1治疗之后患者的肿瘤微环境内mmp-9蛋白水解活性的调节的任何潜在变化。
由于15mg/kgab1队列在第2周期第1天展示出mmp-9/timp-1比率的降低,该组患者被进一步分为kras野生型和kras突变型(图2)。与基线相比,在第2周期第1天时间点的mmp-9/timp-1比率在kras突变型组中显著降低(p<0.01),但在kras野生型组中没有显著降低。
结论
基于本文描述的数据,用15mg/kgab1治疗的患者在作为一个组(平均值±sem)而不是每个患者进行分析时,显示出在ab1治疗之后在第22天和第2周期第1天两者的mmp-9/timp-1比率的降低。当进一步分析该组时,携带kras突变的患者显示是所观察到的血浆mmp-9/timp-1的降低的驱动因素。证明通过elisa评估血浆mmp-9和timp-1蛋白浓度并且分析mmp-9/timp-1比率作为ab1治疗的药效学标志物是有用的。
序列表
<110>生态学有限公司
<120>监测对治疗的响应的方法
<130>35524502
<160>8
<170>patentinversion3.5
<210>1
<211>8
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>重链cdr1
<400>1
glytyrserphethralatyrtrp
15
<210>2
<211>8
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>重链cdr2
<400>2
ileleuproglyseraspserthr
15
<210>3
<211>11
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>重链cdr3
<400>3
alaargserglytyrtyrglyserserglntyr
1510
<210>4
<211>10
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>esvdsygnsf
<400>4
gluservalaspsertyrglyasnserphe
1510
<210>5
<211>3
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>轻链cdr2
<400>5
leuthrser
1
<210>6
<211>9
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>轻链cdr3
<400>6
glnglnasnalagluaspproargthr
15
<210>7
<211>137
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>重链可变结构域
<400>7
metglutrpsertrpvalpheleuphepheleuservalthrthrgly
151015
valhissergluvalglnleuvalglnserglyalagluvallyslys
202530
proglygluserleuargilesercyslysglyserglytyrserphe
354045
thralatyrtrpileglutrpvalargglnalaproglylysglyleu
505560
glutrpileglygluileleuproglyseraspserthrasntyrasn
65707580
glulysphelysglyhisvalthrileseralaasplysserileser
859095
thralatyrleuglntrpserserleulysalaseraspthralaval
100105110
tyrtyrcysalaargserglytyrtyrglyserserglntyrtrpgly
115120125
glnglythrleuvalthrvalserser
130135
<210>8
<211>131
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>轻链可变结构域
<400>8
metservalprothrglnvalleuglyleuleuleuleutrpleuthr
151015
aspalaargcysaspilevalleuthrglnserproalaserleuala
202530
valserproglyglnargalathrilethrcysargalasergluser
354045
valaspsertyrglyasnserphemethistrptyrglnglnlyspro
505560
glyglnproprolysleuleuiletyrleuthrserasnleugluser
65707580
glyvalproaspargpheserglyserglyserglythraspphethr
859095
leuthrileasnprovalglualaasnaspalaalathrtyrtyrcys
100105110
glnglnasnalagluaspproargthrpheglyglyglythrlysleu
115120125
gluilelys
130
- 还没有人留言评论。精彩留言会获得点赞!