一种磁微粒化学发光法人皮质醇测定试剂盒及使用方法与流程
本发明涉及医疗器械生物类免疫体外诊断相关技术领域,特别涉及一种磁微粒化学发光法人皮质醇测定试剂盒及使用方法。
背景技术:
皮质醇主要是糖皮质激素并由肾上腺皮质生产和分泌。其可产生的影响包括:(a)影响蛋白质,脂肪和碳水化合物的代谢,(b)维持肌肉组织和心肌完整性,以及(c)抑制炎症和过敏性的活动。
可结合的皮质类固醇球蛋白和白蛋白与由肾上腺皮质分泌出的约90%的皮质醇可进行结合。经结合的皮质醇进行机体循环时暂时处于无活性状态。而少量未经结合的皮质醇的循环水平决定了其生理活性。
促肾上腺皮质激素(acth)对肾上腺皮质的合成和释放产生激活作用。垂体在由下丘脑分泌出的促肾上腺皮质激素释放激素(crh)刺激下可产生和释放acth。未结合的皮质醇在垂体和下丘脑水平下的下丘脑-垂体-肾上腺皮质轴(hpa)进行负反馈调节的机制。此外,昼夜变化和应激反应,如热原引起的发烧,严重精神病或创伤也会对肾上腺皮质的神经内分泌调节产生影响。
下丘脑,垂体或肾上腺功能失常可导致皮质醇水平的异常变化。若不接受诊断和治疗可能导致致命的严重代谢失衡。皮质醇血清或血浆的测定-晨间及晚间不同水平和/或诸如acth刺激或地塞米松抑制的压力测试-有助于对相关肾上腺疾病的诊断。同时在cushing综合征(肾上腺皮质机能亢进)中的皮质醇水平过高,而在addison症(肾上腺皮质功能不全)中皮质醇水平降低。
肝脏的代谢保证了皮质醇结合蛋白。血清中未结合(或游离)皮质醇经肝脏代谢产生多种形式的代谢物。其中许多代谢物(成对式,葡糖苷酸式及硫酸盐式)是水溶性的且在尿液中很快分解。少量(<100μg/24小时)的皮质醇和其它可提取的代谢物也会排入尿液。尿液中的皮质醇可在测试前通过可以去除提取水溶性代谢物的步骤测量到或者直接对尿液进行分析来测定。因而,尿液皮质醇的免疫测定以及一些免疫代谢物应针对每一种免疫检测方法建立代表期望值。尿液皮质醇的测定反映血清中未结合(或游离)皮质醇的数量,而且有助于肾上腺功能亢进的诊断。尿液中皮质醇水平升高有助于诊断cushing综合症(肾上腺皮层机能亢进)。
鉴于皮质醇检测指标的重要性,研发一种制备简单,操作便捷,结果准确可靠,并且成本低廉的皮质醇测定产品,对现有技术有着重要的意义。
技术实现要素:
针对现有技术存在的需要一种制备简单,操作便捷,结果准确可靠,并且成本低廉的皮质醇测定产品的技术问题,本发明提供一种磁微粒化学发光法人皮质醇(cortisol)测定试剂盒及使用方法。
为实现上述目的,本发明的技术方案为:
一种磁微粒化学发光法人皮质醇测定试剂盒,包括相互独立包装的磁分离试剂、生物素化cortisol单克隆抗体、碱性磷酸酶标记cortisol衍生物、校准品和质控品;
a、所述生物素化cortisol单克隆抗体通过包括以下步骤的操作制备而成:
sa1:准确称量0.3~0.5mg生物素-nhs并用dmso溶解至终浓度为4.5~5.5mg/ml,制得生物素-nhs的dmso溶液;
sa2:准确称量0.9~1.1mgcortisol单克隆抗体并加入所述生物素-nhs的dmso溶液中,充分混匀后室温反应1.5~2.5h;
sa3:用透析袋对sa2中反应产物进行透析处理;
sa4:用抗试剂缓冲液将sa3制得的混合物稀释至0.45~0.55μg/ml即得;
所述抗试剂缓冲液为ph值为5~6的pbs体系;所述抗试剂缓冲液包括纯化水1l、na2po3h·12h2o10~20g、napo3h2·12h2o1~2g、绵羊血清1~5g、新生牛血清3~10g和马血清1~5g;
b、所述碱性磷酸酶标记cortisol衍生物通过包括以下步骤的操作制备而成:
sb1:将检测cortisol衍生物进行透析处理后用2-it进行活化;
sb2:将碱磷酶用smcc进行活化;
sb3:将活化后的所述检测cortisol衍生物和所述碱磷酶混合后在2~8℃反应16~20h;
sb4:将sb3制备的反应物用层析柱进行纯化,收集i峰ii峰并混合,制得抗体-碱磷酶;
sb5:用抗试剂缓冲液将所述抗体-碱磷酶稀释至0.09~0.11μg/ml即得;
c、所述校准品和所述质控品的成分相同,且均通过包括用cortisol校准品缓冲液将cortisol纯品稀释的操作制备而成。
优选的,所述cortisol单克隆抗体为鼠cortisol单克隆抗体。
优选的,所述cortisol单克隆抗体与所述生物素-nhs的摩尔比为1:20;其中,cortisol单克隆抗体的分子量以30000计,生物素-nhs的分子量以587计;
优选的,sa3中所述透析袋的截留分子量为500。
优选的,sa3中透析处理所用的透析缓冲液为ph为7.5的0.15m的pbs缓冲液。
优选的,sb1中透析处理所用的透析缓冲液为0.1m的pbs缓冲液。
优选的,所述cortisol校准品缓冲液通过向0.05m的ph为7.4的tris缓冲液中加入牛血清白蛋白和防腐剂制备而成,所述cortisol校准品缓冲液中所述牛血清白蛋白的体积百分比为0.5%,所述防腐剂的体积百分比为0.2%。
优选的,所述cortisol纯品稀释的最终浓度为0ug/ml、2.5ug/ml、5ug/ml、10ug/ml、25ug/ml和60ug/ml。
优选的,所述磁分离试剂为链霉亲和素磁珠。
一种上述任一项所述的磁微粒化学发光法人皮质醇测定试剂盒的使用方法,包括以下步骤:
sd1:准确称取待检测样本30μl、所述生物素化cortisol单克隆抗体30μl和所述碱性磷酸酶标记cortisol衍生物30μl充分混合并在37℃条件下孵育30min;
sd2:向sd1制得的反应物中加入所述磁分离试剂30μl充分混合并孵育5min;
sd3:对sd2制得的反应物磁分离2min,去除上清保留底物;
sd4:对所述底物洗涤3次,每次用300μl洗液;
sd5:用200μl所述cortisol校准品缓冲液将所述底物稀释后用全自动发光分析仪测值。
本发明具有如下优点:
1.本发明的cortisol化学发光免疫检测试剂盒的制备方法简单方便;
2.整个反应体系反应时间短,避免了放射性污染,灵敏度高,测试结果准确,简化了实验操作流程;
3.亲和素与生物素间的结合具有极高的亲和力,其反应呈高度专一性,在提高灵敏度的同时,并不增加非特异性干扰;而且结合特性不会因反应试剂的高度稀释而受影响,使其在实际应用中可最大限度地降低反应试剂的非特异作用;
4.延长了试剂效期,避免浪费,有效节约成本。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
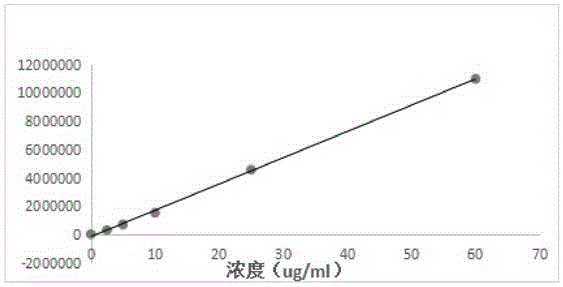
图1为体系1曲线拟合;
图2为体系2曲线拟合。
具体实施方式
下面结合附图对本发明的具体实施方式作进一步说明。在此需要说明的是,对于这些实施方式的说明用于帮助理解本发明,但并不构成对本发明的限定。此外,在以下说明中,省略了对公知结构、技术及操作的描述,以避免不必要地混淆本发明的概念。另外,下面所描述的本发明各个实施方式中所涉及的技术特征只要彼此之间未构成冲突就可以相互组合。
本发明中,未特别注明单位的比例与含量,固体组分为质量比例与含量,液体组分为体积比例与含量。
实施例1
一种磁微粒化学发光法人皮质醇测定试剂盒,包括相互独立包装的磁分离试剂、生物素化cortisol单克隆抗体、碱性磷酸酶标记cortisol衍生物、校准品和质控品;
a、所述生物素化cortisol单克隆抗体通过包括以下步骤的操作制备而成:
sa1:准确称量0.3mg生物素-nhs并用dmso溶解至终浓度为4.5mg/ml,制得生物素-nhs的dmso溶液;
sa2:准确称量0.9mgcortisol单克隆抗体并加入所述生物素-nhs的dmso溶液中,充分混匀,室温反应1.5h;
sa3:用截留分子量为500的透析袋,并用ph为7.5的0.15m的pbs缓冲液作为透析缓冲液,对sa2中反应产物进行透析处理;
sa4:用抗试剂缓冲液将sa3制得的混合物稀释至0.45μg/ml即得;
b、所述碱性磷酸酶标记cortisol衍生物通过包括以下步骤的操作制备而成:
sb1:用0.1m的pbs缓冲液作为透析缓冲液将检测cortisol衍生物进行透析处理后用2-it进行活化;
sb2:将碱磷酶用smcc进行活化;
sb3:将活化后的所述检测cortisol衍生物和所述碱磷酶混合后在2℃反应16h;
sb4:将sb3制备的反应物用层析柱进行纯化,收集i峰ii峰并混合,制得抗体-碱磷酶;
sb5:用抗试剂缓冲液将所述抗体-碱磷酶稀释至0.09μg/ml即得;
c、所述校准品和所述质控品的成分相同,且均通过包括用cortisol校准品缓冲液将cortisol纯品稀释成最终浓度为0ug/ml、2.5ug/ml、5ug/ml、10ug/ml、25ug/ml和60ug/ml的溶液;
所述cortisol校准品缓冲液通过向0.05m的ph为7.4的tris缓冲液中加入牛血清白蛋白和防腐剂制备而成,所述cortisol校准品缓冲液中所述牛血清白蛋白的体积百分比为0.5%,所述防腐剂的体积百分比为0.2%。
实施例2
一种磁微粒化学发光法人皮质醇测定试剂盒,包括相互独立包装的链霉亲和素磁珠、生物素化cortisol单克隆抗体、碱性磷酸酶标记cortisol衍生物、校准品和质控品;
a、所述生物素化cortisol单克隆抗体通过包括以下步骤的操作制备而成:
sa1:准确称量0.4mg生物素-nhs并用dmso溶解至终浓度为5mg/ml,制得生物素-nhs的dmso溶液;
sa2:准确称量1mg鼠cortisol单克隆抗体并加入所述生物素-nhs的dmso溶液中,充分混匀,所述鼠cortisol单克隆抗体与所述生物素-nhs的摩尔比为1:20;室温反应2h;
sa3:用截留分子量为500的透析袋,并用ph为7.5的0.15m的pbs缓冲液作为透析缓冲液,对sa2中反应产物进行透析处理;
sa4:用抗试剂缓冲液将sa3制得的混合物稀释至0.5μg/ml即得;
b、所述碱性磷酸酶标记cortisol衍生物通过包括以下步骤的操作制备而成:
sb1:用0.1m的pbs缓冲液作为透析缓冲液将检测cortisol衍生物进行透析处理后用2-it进行活化;
sb2:将碱磷酶用smcc进行活化;
sb3:将活化后的所述检测cortisol衍生物和所述碱磷酶混合后在4℃反应18h;
sb4:将sb3制备的反应物用层析柱进行纯化,收集i峰ii峰并混合,制得抗体-碱磷酶;
sb5:用抗试剂缓冲液将所述抗体-碱磷酶稀释至0.1μg/ml即得;
c、所述校准品和所述质控品的成分相同,且均通过包括用cortisol校准品缓冲液将cortisol纯品稀释成最终浓度为0ug/ml、2.5ug/ml、5ug/ml、10ug/ml、25ug/ml和60ug/ml的溶液;
所述cortisol校准品缓冲液通过向0.05m的ph为7.4的tris缓冲液中加入牛血清白蛋白和防腐剂制备而成,所述cortisol校准品缓冲液中所述牛血清白蛋白的体积百分比为0.5%,所述防腐剂的体积百分比为0.2%。
实施例3
一种磁微粒化学发光法人皮质醇测定试剂盒,包括相互独立包装的磁分离试剂、生物素化cortisol单克隆抗体、碱性磷酸酶标记cortisol衍生物、校准品和质控品;
a、所述生物素化cortisol单克隆抗体通过包括以下步骤的操作制备而成:
sa1:准确称量0.5mg生物素-nhs并用dmso溶解至终浓度为5.5mg/ml,制得生物素-nhs的dmso溶液;
sa2:准确称量1.1mgcortisol单克隆抗体并加入所述生物素-nhs的dmso溶液中,充分混匀,室温反应2.5h;
sa3:用截留分子量为500的透析袋,并用ph为7.5的0.15m的pbs缓冲液作为透析缓冲液,对sa2中反应产物进行透析处理;
sa4:用抗试剂缓冲液将sa3制得的混合物稀释至0.55μg/ml即得;
b、所述碱性磷酸酶标记cortisol衍生物通过包括以下步骤的操作制备而成:
sb1:用0.1m的pbs缓冲液作为透析缓冲液将检测cortisol衍生物进行透析处理后用2-it进行活化;
sb2:将碱磷酶用smcc进行活化;
sb3:将活化后的所述检测cortisol衍生物和所述碱磷酶混合后在8℃反应20h;
sb4:将sb3制备的反应物用层析柱进行纯化,收集i峰ii峰并混合,制得抗体-碱磷酶;
sb5:用抗试剂缓冲液将所述抗体-碱磷酶稀释至0.11μg/ml即得;
c、所述校准品和所述质控品的成分相同,且均通过包括用cortisol校准品缓冲液将cortisol纯品稀释成最终浓度为0ug/ml、2.5ug/ml、5ug/ml、10ug/ml、25ug/ml和60ug/ml的溶液;
所述cortisol校准品缓冲液通过向0.05m的ph为7.4的tris缓冲液中加入牛血清白蛋白和防腐剂制备而成,所述cortisol校准品缓冲液中所述牛血清白蛋白的体积百分比为0.5%,所述防腐剂的体积百分比为0.2%。
实施例4
磁微粒化学发光法人皮质醇测定试剂盒的使用方法,以实施例2制备的人皮质醇测定试剂盒进行测定,包括以下步骤:
sd1:准确称取待检测样本30μl、所述生物素化cortisol单克隆抗体30μl和所述碱性磷酸酶标记cortisol衍生物30μl充分混合并在37℃条件下孵育30min;
sd2:向sd1制得的反应物中加入所述磁分离试剂30μl充分混合并孵育5min;
sd3:对sd2制得的反应物磁分离2min,去除上清保留底物;
sd4:对所述底物洗涤3次,每次用300μl洗液;
sd5:用200μl所述cortisol校准品缓冲液将所述底物稀释后用全自动发光分析仪测值。
本发明同时用生物素化cortisol单克隆抗体-链霉亲和素磁珠(体系1),cortisol单克隆抗体包被的羧基化的磁微粒(体系2),分别用两个体系对0ug/ml、2.5ug/ml、5ug/ml、10ug/ml、25ug/ml和60ug/ml的cortisol样品做检测,同时测试同一组样本,并与给值进行比对,数据如下表所示:
表1.不同体系下测值与给值对比以及测值之间对比
体系1和体系2的曲线拟合如图1和图2所示,由结果可以看出,不同体系测值与给值相关性都在0.9以上,说明相关性良好,且不同体系之间测值相关性大于0.9,两种体系测值一致。
以上结合附图对本发明的实施方式作了详细说明,但本发明不限于所描述的实施方式。对于本领域的技术人员而言,在不脱离本发明原理和精神的情况下,在没有做出创造性劳动前提下,对这些实施方式进行多种变化、修改、替换和变型,仍落入本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!