一种复合前列腺特异性抗原试剂盒及其使用方法与流程
本发明涉及医学检测试剂相关
技术领域:
,特别涉及一种复合前列腺特异性抗原试剂盒及其使用方法。
背景技术:
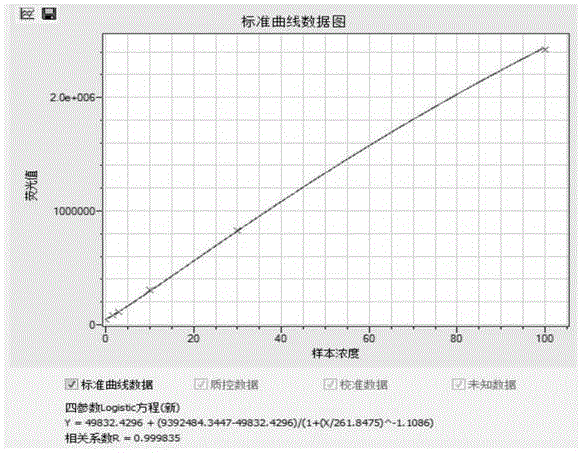
:前列腺特异性抗原(psa),是一种具有组织特异性的糜蛋白酶样的丝氨酸蛋白酶,由前列腺上皮细胞合成分泌至精液中。血清中psa主要以游离态(f-psa)和结合态(c-psa)两种形式存在,后者包括act-psa和α2m-psa(不具备免疫反应活性)。因此在临床上检测的t-psa通常为f-psa和act-psa。在健康男性体内,只有很少量的psa会进渗漏到循环血中,血清中的psa浓度通常都不足精浆的百万分之一;在前列腺疾病中,由于psa渗漏增加或者异常分泌至循环血中,因而通常psa的血清水平会升高。前列腺癌(pc)和前列腺增生(bph)是男性常见的前列腺疾病。近年来,pc的患病率呈增长趋势。前列腺抗原是前列腺癌监测和评估的较具有临床价值的肿瘤标志物,然而psa属器官特异性抗原,而非前列腺癌特异。bph和pc的psa水平在4-10ng/ml时有较大部分重叠,因此很难根据psa水平将二者区分。目前,f-psa/t-psa被广泛应用于pc诊断,但由于f-psa含量较低且不稳定带来比率误差,影响诊断特异性。研究发现前列腺疾病患者血清内psa大多数与丝氨酸酶的抑制物α1抗胰凝乳蛋白酶(act)形成复合物。pc患者血清act-psa的比例比bph患者高,act-psa/psa比值是诊断前列腺癌更灵敏的指标。通过pc与bph患者的临床数据分析发现,t-psa无显著性差异,而c-psa则有显著性差异,对于pc检测,c-psa特异性明显高于t-psa,稳定性优于f-psa。由于f-psa含量低、测试不稳定而导致的比值误差,多数的bph患者需要进行活检,才能避免pc患者被漏检或误诊,不仅操作不方便,还容易给患者造成痛苦。技术实现要素:针对现有技术存在前述的技术问题,本发明提供一种复合前列腺特异性抗原试剂盒及其使用方法。本发明提供的复合前列腺特异性抗原试剂盒引入的测定方法,是在磁微粒化学发光免疫分析平台基础上进行开发的,通过抗原抗体间的免疫反应去除待测物中游离前列腺特异性抗原,随后用特异性抗体结合待测物中的复合前列腺特异性抗原,与磁微粒试剂结合后在磁场条件下分离,结合物通过酶促发光反应,在化学发光测定仪中进行发光强度测定。通过浓度与发光强度剂量曲线,计算该发光强度对应的复合前列腺特异性抗原含量。一种复合前列腺特异性抗原试剂盒,包括c-psa校准品、c-psa质控品、c-psa预处理液、c-psa抗试剂、磁微粒试剂、化学发光底物液和清洗液,所述c-psa校准品、所述c-psa质控品、所述c-psa预处理液、所述c-psa抗试剂、所述磁微粒试剂、所述化学发光底物液和所述清洗液分别独立包装;所述c-psa校准品通过c-psa抗原与第一缓冲液充分混合制备而成;所述c-psa预处理液通过游离前列腺特异性抗原抗体与第二缓冲液充分混合制备而成;所述c-psa抗试剂通过碱性磷酸酶标记的psa单克隆抗体和异硫氰酸荧光素标记的psa单克隆抗体,添加至所述第二缓冲液充分混合制备而成;所述磁微粒试剂通过第三缓冲液将羊抗异硫氰酸荧光素抗体标记的磁微粒稀释并充分混合制备而成;所述化学发光底物液通过第四缓冲液将apls避光稀释并充分混合制备而成;所述清洗液通过纯化水将第五缓冲液稀释制备而成。进一步的,所述第一缓冲液通过包括以下步骤的操作制备而成:按重量份准确称取以下组分:0.3~0.4份磷酸二氢钾、1.5~2.5份磷酸氢二钾、0.5~1.5份氯化钾、0.5~1.5份硫酸新霉素和190~210份甘油,分别加入630~650重量份的新生牛血清中,在室温下搅拌50~70min,调ph至7.5±0.05,然后加纯水至溶液的重量为1000重量份。进一步的,所述第二缓冲液通过包括以下步骤的操作制备而成:按重量份准确称取以下组分:12~12.22份tris、5.6~6份氯化钠、13~13.72份氯化锌、0.1~0.3份氯化镁、1.5~2.5份动物血清和4~6份bsa,分别加入680~720重量份的纯水中,室温搅拌16~20h后调ph至8.0±0.05;加纯水至溶液的总重量为1000重量份。进一步的,所述第三缓冲液通过包括以下步骤的操作制备而成:按重量份准确称取以下组分:6~6.04份tris、4.95~4.99份甲基纤维醚、0.9~1.1份tween-20、0.9~1.1份硫酸新霉素和4.7~5.3份bsa,分别加入680~720重量份的纯水中,室温搅拌50~70min后调ph至8.0±0.05;加纯水至溶液的总重量为1000重量份。进一步的,所述第四缓冲液通过包括以下步骤的操作制备而成:按重量份准确称取以下组分:36~36.6份tris、0.008~0.012份亚硫酸钠、0.8~1.2份sds、3~3.6份光泽精和0.2~0.4份tween-20,分别加入790~810重量份纯水中,充分溶解后调ph至8.8±0.05;加纯水至溶液的总重量为1000重量份。进一步的,所述第五缓冲液通过包括以下步骤的操作制备而成:按重量份准确称取以下组分:12~12.22份tris、312.23~312.63份氯化钠、27.54~27.94份tween-20、0.9~1.1份bronidox和0.9~1.1份tritonx-100,分别加入680~720重量份的纯水中,室温放置16~20h后调ph至8.0±0.05;加纯水至溶液的总重量为1000重量份。一种上述任一项所述的复合前列腺特异性抗原试剂盒的使用方法,包括以下步骤:s1:取3支反应管,分别加入30μl所述c-psa校准品、30μl所述c-psa质控品或30μl待测样本;s2:分别向3支所述反应管中加入60μl所述c-psa预处理液,混匀后37~44℃温浴5~15min;s3:再分别向3支所述反应管中加入60μl所述c-psa抗试剂,混匀后37~44℃温浴5~15min;s4:再分别向3支所述反应管中加入30μl所述磁微粒试剂,混匀后37~44℃温浴5min;s5:将经过s4处理的3支所述反应管在磁场作用下静置2~3min后去除上清液;s5:再分别向3支所述反应管中加入200~300μl所述清洗液,混匀后在磁场作用下静置2~3min后去除上清液;s6:再分别向3支所述反应管中加入150~200μl所述化学发光底物液,混匀后使用化学发光仪检测荧光值。进一步的,将s5步骤的操作重复2~3次。本发明具有如下优点:本发明针对现有临床检测中t-psa在pc与bph鉴别诊断中特异性低,f-psa含量低、测试不稳定问题,在现有磁微粒化学发光免疫分析的基础上进行开发设计;本发明通过去除样本中f-psa,直接检测样本中c-psa含量;c-psa在pc和bph样本中具有显著特异性,且其在血清中含量相对较高且稳定,使用该测试方法制备的试剂盒提高了pc和bph临床诊断的特异性,减少bph患者不必要的活检测试,同时降低了pc的漏检和误诊。附图说明为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。图1:校准品浓度荧光值曲线图;图2:本发明与进口厂家试剂盒临床比对图。具体实施方式下面结合附图对本发明的具体实施方式作进一步说明。在此需要说明的是,对于这些实施方式的说明用于帮助理解本发明,但并不构成对本发明的限定。此外,在以下说明中,省略了对公知结构、技术及操作的描述,以避免不必要地混淆本发明的概念。另外,下面所描述的本发明各个实施方式中所涉及的技术特征只要彼此之间未构成冲突就可以相互组合。需要说明的是,在本发明的描述中,对于本技术方案中的“第一”、“第二”等,仅为对相同或相似结构,或者起相似功能的对应结构的称谓区分,不是对这些结构重要性的排列,也没有排序、或比较大小、或其他含义。本发明中,未特别注明单位的比例与含量,固体组分为质量比例与含量,液体组分为体积比例与含量。一种复合前列腺特异性抗原试剂盒,包括c-psa校准品、c-psa质控品、c-psa预处理液、c-psa抗试剂、磁微粒试剂、化学发光底物液和清洗液;其制备方法如以下实施例所示:实施例1c-psa校准品通过c-psa抗原与第一缓冲液充分混合,配制成a-f浓度点为0、1.5、3、10、30、100ng/ml,贴签2℃保存,效期15个月;其中,第一缓冲液通过包括以下步骤的操作制备而成:按重量份准确称取以下组分:0.3份磷酸二氢钾、1.5份磷酸氢二钾、0.5份氯化钾、0.5份硫酸新霉素和190份甘油,分别加入630重量份的新生牛血清中,在室温下搅拌50min,调ph至7.45,然后加纯水至溶液的重量为1000重量份;c-psa质控品的配置方法与c-psa校准品相同,配置3.5和30ng/ml两种浓度;c-psa预处理液通过游离前列腺特异性抗原抗体与第二缓冲液充分混合,配制成0.5μg/ml,配制浓度可根据抗体效价适度调整,确保测试时f点随抗体浓度升高,荧光值不发生变化;充分混匀后,过滤、贴签2℃保存,效期15个月;其中,第二缓冲液通过包括以下步骤的操作制备而成:按重量份准确称取以下组分:12份tris、5.6份氯化钠、13份氯化锌、0.1份氯化镁、1.5份动物血清和4份bsa,分别加入680重量份的纯水中,室温搅拌16h后调ph至7.95;加纯水至溶液的总重量为1000重量份;c-psa抗试剂通过碱性磷酸酶(ap)标记的psa单克隆抗体和异硫氰酸荧光素(fitc)标记的psa单克隆抗体,分别添加至第二缓冲液,配制出的两种溶液的浓度都是0.5μg/ml,确保f点发光值在1500万左右;然后将两种溶液等体积混匀;贴签、避光2℃保存,效期15个月;磁微粒试剂通过第三缓冲液将羊抗异硫氰酸荧光素抗体标记的磁微粒稀释并充分混合,配制成1.0μg/ml;充分混匀后,贴签2℃保存,效期18个月;其中,第三缓冲液通过包括以下步骤的操作制备而成:按重量份准确称取以下组分:6份tris、4.95份甲基纤维醚、0.9份tween-20、0.9份硫酸新霉素和4.7份bsa,分别加入680重量份的纯水中,室温搅拌50min后调ph至7.95;加纯水至溶液的总重量为1000重量份;化学发光底物液通过第四缓冲液将apls避光稀释并充分混合,配制成浓度为120mg/l;充分混匀后,过滤、贴签、避光2℃保存,效期15个月;其中,第四缓冲液通过包括以下步骤的操作制备而成:按重量份准确称取以下组分:36份tris、0.008份亚硫酸钠、0.8份sds、3份光泽精和0.2份tween-20,分别加入790重量份纯水中,充分溶解后调ph至8.75;加纯水至溶液的总重量为1000重量份;清洗液通过纯化水将第五缓冲液进行15倍稀释;其中,第五缓冲液通过包括以下步骤的操作制备而成:按重量份准确称取以下组分:12份tris、312.23份氯化钠、27.54份tween-20、0.9份bronidox和0.9份tritonx-100,分别加入680重量份的纯水中,室温放置16h后调ph至7.95;加纯水至溶液的总重量为1000重量份;将前述配置的c-psa校准品、c-psa质控品、c-psa预处理液、c-psa抗试剂、磁微粒试剂、化学发光底物液和清洗液分别独立包装,形成复合前列腺特异性抗原试剂盒。实施例2c-psa校准品通过c-psa抗原与第一缓冲液充分混合,配制成a-f浓度点为0、1.5、3、10、30、100ng/ml,贴签4℃保存,效期15个月;其中,第一缓冲液通过包括以下步骤的操作制备而成:按重量份准确称取以下组分:0.35份磷酸二氢钾、2份磷酸氢二钾、1份氯化钾、1份硫酸新霉素和200份甘油,分别加入640重量份的新生牛血清中,在室温下搅拌60min,调ph至7.5,然后加纯水至溶液的重量为1000重量份;c-psa质控品的配置方法与c-psa校准品相同,配置3.5和30ng/ml两种浓度;c-psa预处理液通过游离前列腺特异性抗原抗体与第二缓冲液充分混合,配制成0.8μg/ml,配制浓度可根据抗体效价适度调整,确保测试时f点随抗体浓度升高,荧光值不发生变化;充分混匀后,过滤、贴签4℃保存,效期15个月;其中,第二缓冲液通过包括以下步骤的操作制备而成:按重量份准确称取以下组分:12.11份tris、5.8份氯化钠、13.36份氯化锌、0.2份氯化镁、2份动物血清和5份bsa,分别加入700重量份的纯水中,室温搅拌18h后调ph至8.0;加纯水至溶液的总重量为1000重量份;c-psa抗试剂通过碱性磷酸酶(ap)标记的psa单克隆抗体和异硫氰酸荧光素(fitc)标记的psa单克隆抗体,分别添加至第二缓冲液,配制出的两种溶液的浓度都是0.8μg/ml,确保f点发光值在1500万左右;然后将两种溶液等体积混匀;贴签、避光4℃保存,效期15个月;磁微粒试剂通过第三缓冲液将羊抗异硫氰酸荧光素抗体标记的磁微粒稀释并充分混合,配制成1.0μg/ml;充分混匀后,贴签4℃保存,效期18个月;其中,第三缓冲液通过包括以下步骤的操作制备而成:按重量份准确称取以下组分:6.02份tris、4.97份甲基纤维醚、1份tween-20、1份硫酸新霉素和5份bsa,分别加入700重量份的纯水中,室温搅拌60min后调ph至8.0;加纯水至溶液的总重量为1000重量份;化学发光底物液通过第四缓冲液将apls避光稀释并充分混合,配制成浓度为120mg/l;充分混匀后,过滤、贴签、避光4℃保存,效期15个月;其中,第四缓冲液通过包括以下步骤的操作制备而成:按重量份准确称取以下组分:36.3份tris、0.01份亚硫酸钠、1份sds、3.3份光泽精和0.3份tween-20,分别加入800重量份纯水中,充分溶解后调ph至8.8;加纯水至溶液的总重量为1000重量份;清洗液通过纯化水将第五缓冲液进行15倍稀释;其中,第五缓冲液通过包括以下步骤的操作制备而成:按重量份准确称取以下组分:12.11份tris、312.43份氯化钠、27.74份tween-20、1份bronidox和1份tritonx-100,分别加入700重量份的纯水中,室温放置18h后调ph至8.0;加纯水至溶液的总重量为1000重量份;将前述配置的c-psa校准品、c-psa质控品、c-psa预处理液、c-psa抗试剂、磁微粒试剂、化学发光底物液和清洗液分别独立包装,形成复合前列腺特异性抗原试剂盒。实施例3c-psa校准品通过c-psa抗原与第一缓冲液充分混合,配制成a-f浓度点为0、1.5、3、10、30、100ng/ml,贴签8℃保存,效期15个月;其中,第一缓冲液通过包括以下步骤的操作制备而成:按重量份准确称取以下组分:0.4份磷酸二氢钾、2.5份磷酸氢二钾、1.5份氯化钾、1.5份硫酸新霉素和210份甘油,分别加入650重量份的新生牛血清中,在室温下搅拌70min,调ph至7.55,然后加纯水至溶液的重量为1000重量份;c-psa质控品的配置方法与c-psa校准品相同,配置3.5和30ng/ml两种浓度;c-psa预处理液通过游离前列腺特异性抗原抗体与第二缓冲液充分混合,配制成1.0μg/ml,配制浓度可根据抗体效价适度调整,确保测试时f点随抗体浓度升高,荧光值不发生变化;充分混匀后,过滤、贴签8℃保存,效期15个月;其中,第二缓冲液通过包括以下步骤的操作制备而成:按重量份准确称取以下组分:12.22份tris、6份氯化钠、13.72份氯化锌、0.3份氯化镁、2.5份动物血清和6份bsa,分别加入720重量份的纯水中,室温搅拌20h后调ph至8.05;加纯水至溶液的总重量为1000重量份;c-psa抗试剂通过碱性磷酸酶(ap)标记的psa单克隆抗体和异硫氰酸荧光素(fitc)标记的psa单克隆抗体,分别添加至第二缓冲液,配制出的两种溶液的浓度都是1.0μg/ml,确保f点发光值在1500万左右;然后将两种溶液等体积混匀;贴签、避光8℃保存,效期15个月;磁微粒试剂通过第三缓冲液将羊抗异硫氰酸荧光素抗体标记的磁微粒稀释并充分混合,配制成1.0μg/ml;充分混匀后,贴签8℃保存,效期18个月;其中,第三缓冲液通过包括以下步骤的操作制备而成:按重量份准确称取以下组分:6.04份tris、4.99份甲基纤维醚、1.1份tween-20、1.1份硫酸新霉素和5.3份bsa,分别加入720重量份的纯水中,室温搅拌70min后调ph至8.05;加纯水至溶液的总重量为1000重量份;化学发光底物液通过第四缓冲液将apls避光稀释并充分混合,配制成浓度为120mg/l;充分混匀后,过滤、贴签、避光8℃保存,效期15个月;其中,第四缓冲液通过包括以下步骤的操作制备而成:按重量份准确称取以下组分:36.6份tris、0.012份亚硫酸钠、1.2份sds、3.6份光泽精和0.4份tween-20,分别加入810重量份纯水中,充分溶解后调ph至8.85;加纯水至溶液的总重量为1000重量份;清洗液通过纯化水将第五缓冲液进行15倍稀释;其中,第五缓冲液通过包括以下步骤的操作制备而成:按重量份准确称取以下组分:12.22份tris、312.63份氯化钠、27.94份tween-20、1.1份bronidox和1.1份tritonx-100,分别加入720重量份的纯水中,室温放置20h后调ph至8.05;加纯水至溶液的总重量为1000重量份;将前述配置的c-psa校准品、c-psa质控品、c-psa预处理液、c-psa抗试剂、磁微粒试剂、化学发光底物液和清洗液分别独立包装,形成复合前列腺特异性抗原试剂盒。实施例4:复合前列腺特异性抗原试剂盒的使用方法,亦即用该复合前列腺特异性抗原试剂盒进行检测的方法,包括以下步骤(本实施例中采用的试剂盒为通过实施例2制备所得):将实施例2制备的试剂盒各组分及待测样本室温混匀30min;s1:取3支反应管,分别加入30μlc-psa校准品、30μlc-psa质控品或30μl待测样本;s2:分别向3支反应管中加入60μlc-psa预处理液,混匀后37℃温浴5min,具体实施时,可以在37~44℃温浴5~15min之间任意选择温度和时间;s3:再分别向3支反应管中加入60μlc-psa抗试剂,混匀后37℃温浴5min,具体实施时,可以在37~44℃温浴5~15min之间任意选择温度和时间;s4:再分别向3支反应管中加入30μl磁微粒试剂,混匀后37℃温浴5min具体实施时温度可以是37~44℃之间的任一温度;s5:将经过s4处理的3支反应管在磁场作用下静置2min后去除上清液,具体实施时可以是2~3min之间的任一时间;s5:再分别向3支反应管中加入200~300μl清洗液,混匀后在磁场作用下静置2min后去除上清液,具体实施时可以是2~3min之间的任一时间;为了提高精度,还可以将本步骤的操作重复2~3次;s6:再分别向3支反应管中加入150μl化学发光底物液,混匀后使用化学发光仪检测荧光值,具体实施时,加的化学发光底物液可以在150~200μl之间任意选择。检测结果:1、检测曲线:c-psa校准品、c-psa质控品、c-psa预处理液、c-psa抗试剂、磁微粒试剂、化学发光底物液和清洗液,根据c-psa校准品浓度及测试的荧光值,利用四参数方程绘制曲线,即为检测曲线。该试剂盒在0.01-100ng/ml之间的线性为0.999835,见附图1。2、灵敏度测试:对零校准点进行20次重复测试,计算20次测定值的平均值(m)及标准差(sd),将m+2sd带入曲线,所得的浓度值即为该试剂盒的灵敏度。本检测试剂盒的灵敏度为≤0.01ng/ml。校准品arlu校准品arlu管140260管1143139管238780管1239960管339937管1340920管437772管1437135管542210管1541609管641170管1641643管742754管1738015管839132管1841764管936863管1941542管1039625管2037219平均值m40072标准差sd1951m+2sd43975最低检测限0.013、精密度测试:随机选取低高值样本各一例作为待测样本,每例样本重复测试10次,计算其平均值(m)、标准差(sd)及精密度(cv)。本检测试剂盒的精密度≤5%。4、特异性测试分别对150ng/mlcea样本和1200iu/mlafp样本进行测试,测试结果均<0.01。本检测试剂盒对cea(150ng/ml)与afp(1200iu/ml)无交叉反应。5、临床试验:选取已知进口试剂盒测值的临床样本100例,使用本检测试剂盒进行测试,并与进口厂家试剂盒测试结果进行比对。比对结果如附图2。6、试剂盒性能指标:本试剂盒的检测范围为0.01-100ng/ml,检测范围内曲线线性≥0.99;本试剂盒的灵敏度为≤0.01ng/ml;测试精密度不大于5%;与进口试剂盒的相关性为0.997、符合率为100%。以上结合附图对本发明的实施方式作了详细说明,但本发明不限于所描述的实施方式。对于本领域的技术人员而言,在不脱离本发明原理和精神的情况下,在没有做出创造性劳动前提下,对这些实施方式进行多种变化、修改、替换和变型,仍落入本发明的保护范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1