一种新冠状病毒抗体检测试剂盒、检测方法和用途与流程
本发明属于抗体检测技术领域,具体涉及一种新冠状病毒抗体检测试剂盒、检测方法和用途。
背景技术:
2019-ncov病毒也是一种由外膜糖蛋白包裹起来的正义rna病毒,但它在病毒进化树中属于新的分支,是一种全新的冠状病毒。研究表明该病毒具有明显的人传人特性,相对2003年爆发的sars病毒,具有更高的传染性,其感染平均潜伏期是4.8天,其症状爆发到可分离到病毒的平均时间是2.9天,比sars的4.2天低,需要采用比sars更严厉的防疫措施。据研究报道,2019-ncov病毒的基因组虽然和sars相似度只有79%,但在蛋白质水平上,它们具有很高的相似度。通过三维结构模拟,发现2019-ncov病毒的棘突蛋白(s蛋白)具有和sars病毒相类似的受体结合部位,可能也是通过和人细胞上的ace2蛋白结合进而感染人。
感染新冠病毒的患者,早期轻微症状包括干咳、发热、乏力、头昏和胸闷等,病情严重的,后期会迅速发展为急性呼吸衰竭,进而引发患者的其它并发症,导致死亡。目前新冠病毒患者的确诊主要包括发热等临床症状排查、肺部炎症的ct检验、血清生化指标的监控和核酸rna的检测以及临床医生的诊断。因此必须要有更特异性,更可靠的检测手段。目前的核酸检测手段,样本需采集咽拭子或肺泡灌洗液,存在气溶胶污染等安全性问题,对于医护人员是很大的挑战,同时核酸检测还存在rna易降解,容易出现假阴性结果。
技术实现要素:
为了解决或改善现有技术中存在的rna保存时间短易降解、容易出现假阴性、特异性差和可靠性差等技术问题的至少一项,本发明的目的在于提供一种新冠状病毒抗体检测试剂盒、检测方法和用途。
本发明的一个目的所采用的技术方案为:
一种新冠状病毒抗体检测试剂盒,包括r1试剂、r2试剂、磁微粒试剂和化学发光底物。
进一步的,还包括质控剂和用于校准曲线的校准剂;所述校准剂和质控剂均为缓冲液。
进一步的,所述r2试剂中含有浓度为0.05-1μg/ml的碱性磷酸酶标记的链酶亲合素。
进一步的,所述r1试剂中含有浓度为0.05-2μg/ml的biotin标记的2019-ncov抗原复合物。
进一步的,还包括用于配制清洗液的清洗浓缩液。
进一步的,所述磁微粒试剂中含有浓度为0.05-5μg/ml的包被有anti-humanigm抗体的磁微粒。
进一步的,所述化学发光底物为3-(2-螺旋金刚烷)-4-甲氧基-4-(3-磷氧酰)-苯基-1,2-二氧环乙烷二钠盐。
本发明的另一个目的采用的技术方案为:
一种新冠状病毒抗体检测方法,包括步骤:以n蛋白和s蛋白的融合蛋白作为检测的复合物,使用磁微粒化学发光法,通过sa级联放大对新冠状病毒抗体检测。
进一步的,所述的一种新冠状病毒抗体检测方法,包括步骤:
生成复合物:包被有anti-humanigm抗体的磁微粒、样本中的新冠状病毒抗体以及生物素标记的抗原三者反应,得到含有复合物的混合物;
生成固相抗体-抗体-生物素抗原-sa-ap复合物:将所述混合物进行清洗,去除未结合的生物素化抗原及其它物质,得到复合物;复合物与碱性磷酸酶标记的链酶亲合素进行反应,得到含有未结合的sa-ap的固相抗体-抗体-生物素抗原-sa-ap复合物;
检测:对所述含有未结合的sa-ap的固相抗体-抗体-生物素抗原-sa-ap复合物清洗除去未结合的sa-ap,得到固相抗体-抗体-生物素抗原-sa-ap复合物;固相抗体-抗体-生物素抗原-sa-ap复合物与amppd反应,进行检测。
本发明的再另一个目的采用的技术方案为:
所述的试剂盒或所述的检测方法用于新冠状病毒抗体的用途。
本发明的有益效果为:本发明的一种新冠状病毒抗体检测试剂盒、检测方法和用途,基于传统捕获法和磁微粒化学发光检测方法改进得到;其中,检测方法具有灵敏度高、特异性强、通量大、速度快、自动化程度高等明显的优点;同时结合免疫学上的抗体igm和igg检测,能做到感染患者的初期筛查及阳性患者临床确诊,并跟踪预后监控;此外本发明检测样本为血清或血浆,样本易采集,安全性较高,样本中的抗体不易降解,保存期限更长;本发明的试剂盒和检测方法能够用于新冠状病毒抗体的检测。
附图说明
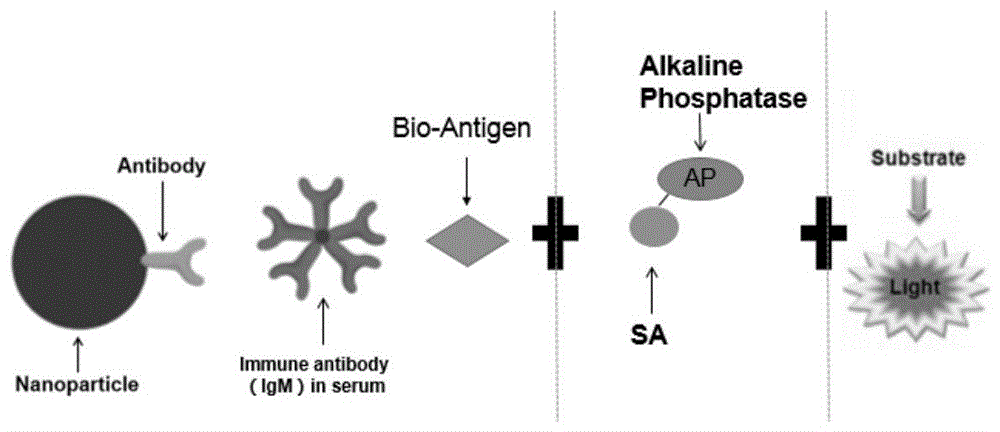
图12019-ncovigm抗体磁微粒化学发光原理示意图。
图2传统捕获法原理图。
具体实施方式
下面结合附图及具体实施例对本发明做进一步阐释。
优选地,以下实施例中的r1试剂是由biotin标记的2019-ncov抗原复合物及其缓冲液配制而成,其中,biotin标记的2019-ncov抗原复合物的浓度为0.05-2μg/ml;其缓冲液包括:浓度为0.01-0.1m的三羟甲基氨基甲烷(tris);所述三羟甲基氨基甲烷(tris)中含有质量分数为0.5-5%的牛血清白蛋白(bsa)、质量分数为0.1-2%酪蛋白、质量分数为0.05%-0.5%的吐温20(tween-20)和质量分数为0.5-5%的海藻糖。
优选地,以下实施例中的r2试剂是由碱性磷酸酶标记的链酶亲合素及其缓冲液配制而成;其中,碱性磷酸酶标记的链酶亲合素的浓度为0.05-1μg/ml,其缓冲液包括:浓度为0.01-0.1m的三羟甲基氨基甲烷(tris);所述三羟甲基氨基甲烷(tris)中含有0.1-5mm的mg2+、0.01-1mm的zn2+、质量分数为0.5-5%的牛血清白蛋白(bsa),质量分数为0.05%-0.5%的吐温20(tween-20)、质量分数为0.5-5%的海藻糖和质量分数为0.5-5%的丙三醇。
优选地,以下实施例中所述磁微粒试剂是由包被有anti-humanigm抗体的磁微粒及其缓冲液配制而成;其中,磁微粒试剂的浓度为0.05-5μg/ml。
优选地,以下实施例中配制校准剂和质控剂所用的缓冲液包括:浓度为0.01-0.1m的三羟甲基氨基甲烷(tris);所述三羟甲基氨基甲烷(tris)中含有质量分数为0.5-5%的牛血清白蛋白(bsa)、质量分数为0.05%-0.5%的吐温20(tween-20)和质量分数为0.5-5%的蔗糖。
本发明中(amppd)为3-(2-螺旋金刚烷)-4-甲氧基-4-(3-磷氧酰)-苯基-1,2-二氧环乙烷二钠盐;(ap)为碱性磷酸酶;(sa)为链酶亲合素。
以下实施例中的r1、r2、磁微粒试剂、校准剂和质控剂所使用的缓冲液还可以采用其它常规的缓冲液代替。
实施例1
一种新冠状病毒抗体检测试剂盒,包括r1试剂、r2试剂、磁微粒试剂和化学发光底物。
优选地,所述r1试剂中含有浓度为0.05μg/ml的biotin标记的2019-ncov抗原复合物;r2试剂中含有浓度为0.05μg/ml的碱性磷酸酶标记的链酶亲合素。所述试剂盒采用图1所示的原理进行检测。
图2为传统的捕获法的检测原理。对比图1和图2可知,传统的捕获法采用anti-humanigm抗体的磁微粒、样本中的新冠状病毒抗体与未经生物素标记的抗原反应,生成ap-抗原复合物进行检测;本发明采用包被有anti-humanigm抗体的磁微粒、样本中的新冠状病毒抗体以及生物素标记的抗原三者反应,生成复合物,再加入sa-ap的复合物,反应生成固相抗体-抗体-生物素抗原-sa-ap复合物进行检测。
实施例2
一种新冠状病毒抗体检测试剂盒,包括r1试剂、r2试剂、磁微粒试剂和化学发光底物。
优选地,所述r1试剂中含有浓度为2μg/ml的biotin标记的2019-ncov抗原复合物;r2试剂中含有浓度为1μg/ml的碱性磷酸酶标记的链酶亲合素。所述试剂盒采用图1所示的原理进行检测。图2为传统的捕获法的检测原理。
优选地,所述试剂盒还包括质控剂和用于校准曲线的校准剂;所述校准剂和质控剂均为缓冲液。
对比图1和图2可知,传统的捕获法采用anti-humanigm抗体的磁微粒、样本中的新冠状病毒抗体与未经生物素标记的抗原反应,生成ap-抗原复合物进行检测;本发明采用包被有anti-humanigm抗体的磁微粒、样本中的新冠状病毒抗体以及生物素标记的抗原三者反应,生成复合物,再加入sa-ap的复合物,反应生成固相抗体-抗体-生物素抗原-sa-ap复合物进行检测。
实施例3
一种新冠状病毒抗体检测试剂盒,包括r1试剂、r2试剂、磁微粒试剂和化学发光底物。
优选地,所述r1试剂中含有浓度为1μg/ml的biotin标记的2019-ncov抗原复合物;r2试剂中含有浓度为0.08μg/ml的碱性磷酸酶标记的链酶亲合素。所述试剂盒采用图1所示的原理进行检测。
对比图1和图2可知,传统的捕获法采用anti-humanigm抗体的磁微粒、样本中的新冠状病毒抗体与未经生物素标记的抗原反应,生成ap-抗原复合物进行检测;本发明采用包被有anti-humanigm抗体的磁微粒、样本中的新冠状病毒抗体以及生物素标记的抗原三者反应,生成复合物,再加入sa-ap的复合物,反应生成固相抗体-抗体-生物素抗原-sa-ap复合物进行检测。
优选地,所述试剂盒还包括质控剂和用于校准曲线的校准剂;所述校准剂和质控剂均为缓冲液。
优选地,所述试剂盒还包括用于配制清洗液的清洗浓缩液。
实施例4
一种新冠状病毒抗体检测试剂盒,包括r1试剂、r2试剂、磁微粒试剂和化学发光底物。
优选地,r1试剂中含有浓度为0.05μg/ml的biotin标记的2019-ncov抗原复合物;r2试剂中含有浓度为0.05g/ml的碱性磷酸酶标记的链酶亲合素;所述磁微粒试剂中含有浓度为0.05μg/ml的包被有anti-humanigm抗体的磁微粒。
所述试剂盒采用图1所示的原理进行检测。
对比图1和图2可知,传统的捕获法采用anti-humanigm抗体的磁微粒、样本中的新冠状病毒抗体与未经生物素标记的抗原反应,生成ap-抗原复合物进行检测;本发明采用包被有anti-humanigm抗体的磁微粒、样本中的新冠状病毒抗体以及生物素标记的抗原三者反应,生成复合物,再加入sa-ap的复合物,反应生成固相抗体-抗体-生物素抗原-sa-ap复合物进行检测。
优选地,所述试剂盒还包括质控剂和用于校准曲线的校准剂;所述校准剂和质控剂均为缓冲液;所述试剂盒还包括用于配制清洗液的清洗浓缩液。
实施例5
一种新冠状病毒抗体检测试剂盒,包括r1试剂、r2试剂、磁微粒试剂和化学发光底物。
优选地,r1试剂中含有浓度为2μg/ml的biotin标记的2019-ncov抗原复合物;r2试剂中含有浓度为1μg/ml的碱性磷酸酶标记的链酶亲合素;所述磁微粒试剂中含有浓度为5μg/ml的包被有anti-humanigm抗体的磁微粒;所述化学发光底物为3-(2-螺旋金刚烷)-4-甲氧基-4-(3-磷氧酰)-苯基-1,2-二氧环乙烷二钠盐。所述试剂盒采用图1所示的原理进行检测。
对比图1和图2可知,传统的捕获法采用anti-humanigm抗体的磁微粒、样本中的新冠状病毒抗体与未经生物素标记的抗原反应,生成ap-抗原复合物进行检测;本发明采用包被有anti-humanigm抗体的磁微粒、样本中的新冠状病毒抗体以及生物素标记的抗原三者反应,生成复合物,再加入sa-ap的复合物,反应生成固相抗体-抗体-生物素抗原-sa-ap复合物进行检测。
优选地,所述试剂盒还包括质控剂和用于校准曲线的校准剂;所述校准剂和质控剂均为缓冲液;所述试剂盒还包括用于配制清洗液的清洗浓缩液。
实施例6
一种新冠状病毒抗体检测方法,包括步骤:以n蛋白和s蛋白的融合蛋白作为检测的复合物,使用磁微粒化学发光法,通过sa级联放大对新冠状病毒抗体检测。
实施例7
一种新冠状病毒抗体检测方法,包括步骤:
生成复合物:包被有anti-humanigm抗体的磁微粒、样本中的新冠状病毒抗体以及生物素标记的抗原三者反应,得到含有复合物的混合物;
生成固相抗体-抗体-生物素抗原-sa-ap复合物:将所述混合物进行清洗,去除未结合的生物素化抗原及其它物质,得到复合物;复合物与碱性磷酸酶标记的链酶亲合素进行反应,得到含有未结合的sa-ap的固相抗体-抗体-生物素抗原-sa-ap复合物;
检测:对所述含有未结合的sa-ap的固相抗体-抗体-生物素抗原-sa-ap复合物清洗除去未结合的sa-ap,得到固相抗体-抗体-生物素抗原-sa-ap复合物;固相抗体-抗体-生物素抗原-sa-ap复合物与amppd反应,进行检测。
本发明基于传统捕获法和磁微粒化学发光检测方法,利用n蛋白和s蛋白的融合蛋白作为复合物进行检测,提高了检测的灵敏度;进一步的,利用sa的级联放大作用,增强了传统捕获法的检测灵敏度;利用磁微粒化学发光法进行试剂盒的开发,检测时间短,20分钟内出结果,重复性好,能够实现全自动操作。
实施例8新冠状病毒抗体检测试剂盒的性能评估
本实施例的一种新冠状病毒抗体检测试剂盒,包括含有biotin标记的2019-ncov抗原复合物、含有碱性磷酸酶(ap)标记的链酶亲合素(sa)的试剂、含有包被有anti-humanigm抗体的磁微粒的试剂和3-(2-螺旋金刚烷)-4-甲氧基-4-(3-磷氧酰)-苯基-1,2-二氧环乙烷二钠盐;具体如下表1和2所示。
表12019-ncovigm抗体检测试剂盒主要成分
优选地,r1试剂中含有浓度为1μg/ml的biotin标记的2019-ncov抗原复合物;r2试剂中含有浓度为1μg/ml的碱性磷酸酶标记的链酶亲合素;所述磁微粒试剂中含有浓度为1μg/ml的包被有anti-humanigm抗体的磁微粒;所述化学发光底物为3-(2-螺旋金刚烷)-4-甲氧基-4-(3-磷氧酰)-苯基-1,2-二氧环乙烷二钠盐。所述试剂盒采用图1所示的原理进行检测。
本实施例的检测方法,采用试剂盒中的试剂,通过以下步骤进行检测:
生成复合物:包被有anti-humanigm抗体的磁微粒、样本中的新冠状病毒抗体以及生物素标记的抗原三者反应,得到含有复合物的混合物;
生成固相抗体-抗体-生物素抗原-sa-ap复合物:将所述混合物进行清洗,去除未结合的生物素化抗原及其它物质,得到复合物;复合物与碱性磷酸酶标记的链酶亲合素进行反应,得到含有未结合的sa-ap的固相抗体-抗体-生物素抗原-sa-ap复合物;
检测:对所述含有未结合的sa-ap的固相抗体-抗体-生物素抗原-sa-ap复合物清洗除去未结合的sa-ap,得到固相抗体-抗体-生物素抗原-sa-ap复合物;固相抗体-抗体-生物素抗原-sa-ap复合物与amppd反应,进行检测。
所述试剂盒采用图1所示的原理,对58例临床诊断为2019-ncov的样本进行测定和113例随机健康人体检样本进行了测定。
样本检测的操作流程如下:将20ul样本、50ulr1试剂和50ul磁微粒试剂(m)混匀后孵育5分钟、清洗3次;然后加入100ulr2试剂,孵育5分钟、清洗3次;而后加入200ul底物反应5分钟,进行检测。
对检测结果的分析具体如下:
(1)阳性符合率
阳性符合率:本发明试剂盒对58例临床诊断为2019-ncov的样本进行了测定。结果表明,本发明igg试剂盒阳性符合率98.3%(表2),igm试剂盒阳性符合率84.5%(表3),说明本试剂盒临床阳性检出率高。
表22019-ncovigg检测试剂盒临床样本比对
表32019-ncovigm检测试剂盒临床样本比对
(2)阴性符合率
阴性符合率:本发明试剂盒对113例随机健康人体检样本进行了测定。结果表明,本发明igg试剂盒阴性符合率100%(113/113),igm试剂盒阴性符合率100%(113/113),说明本试剂盒临床阴性符合率高。
(3)精密度:分别对高、中、低值质控品进行测定,每天两次,分上下午检测,每次进行4个重复,共检测10天,每种浓度共测定80次,计算变异系数,检查试剂在高值、中值和低值标本时的测定精密度。结果表明变异系数都在8%以内,重复性好。
(4)稳定性:2019-ncovigg检测试剂盒以及2019-ncovigm检测试剂盒(m,r2)37℃分别放置7天,测定高、中、低3种浓度质控的信号保留率。结果均>95%,将试剂表明试剂盒稳定好,符合临床要求。
(5)特异性:对高、中、低不同浓度值的血清添加不同浓度的胆红素、血红蛋白、类风湿因子、脂、rf、hama检测结果显示,添加物质对本试剂盒检测结果没有影响。
综上,本实施例的试剂盒或所述的检测方法可以用于新冠状病毒抗体的用途。
本发明不局限于上述可选的实施方式,任何人在本发明的启示下都可得出其他各种形式的产品。上述具体实施方式不应理解成对本发明的保护范围的限制,本发明的保护范围应当以权利要求书中界定的为准,并且说明书可以用于解释权利要求书。
- 还没有人留言评论。精彩留言会获得点赞!