确定多肽二硫键位置的方法与流程
本发明涉及分析化学领域,具体地,涉及确定多肽二硫键位置的方法。
背景技术:
二硫键是由多肽链内或链间的两个半胱氨酸侧链巯基(-sh)共价交联所形成的一种非常重要的翻译后修饰。在生物医药领域中,越来越多的蛋白质或多肽作为生物制剂或疫苗用来治疗各种各样的疾病。这些生物制剂包含包括激素类、生长因子、和单克隆抗体等,这些生物分子大多含有二硫键。含二硫键的药物在合成中容易发生二硫键的交换和重排,这些副反应可导致非原生二硫键的形成、蛋白质的聚集进而可能诱发免疫原性,使药物失活。因此,对多肽和蛋白质类药物中的二硫键的定位和分析成为生物医药领域的研究重点之一。全球肽类和蛋白类药物发展迅速,二硫键的表征已成为生物制药安全性和有效性质量审评中不可或缺的重要环节。
对于二硫键的定位方法主要包括x射线衍射晶体法(x-raycrystallography)、核磁共振波谱法(nmr)、edman降解法、质谱法。x射线衍射晶体法利用蛋白质晶体衍射图中的二硫键间连续的电子密度情况实现蛋白质中的二硫键定位。核磁共振波谱法依据形成二硫键的两半胱氨酸间的ha和hβ在空间上因二硫键的存在而产生noe相互作用。上述这两种方法可在分子水平上提供二硫键的信息,但对样品量要求很大,并且对样品纯度要求很高。另外,x射线衍射晶体还依赖于高度有序的蛋白结晶。edman降解则无法直接对含有链内二硫键和n端被封闭的多肽和蛋白质进行测序。
由此,确定二硫键位置的方法有待改进。
技术实现要素:
本发明旨在至少解决现有技术中存在的技术问题之一。为此,本发明的一个目的在于提出一种确定多肽二硫键位置的方法,无需烷基化,定位方法简单、快速、绿色,易操作,对人体的危害小。
根据本发明的一个方面,本发明提供了一种确定多肽二硫键位置的方法。根据本发明的实施例,该方法包括:将多肽样本进行第一液相色谱串联质谱检测,以便得到第一液相色谱串联质谱检测结果;将所述多肽样本与还原剂和有机酸溶液混合,在第一预定时间得到部分还原产物,在第二预定时间得到完全还原产物;将所述部分还原产物进行第二液相色谱串联质谱检测,以便得到第二液相色谱串联质谱检测结果;将所述完全还原产物进行第三液相色谱串联质谱检测,以便得到第三液相色谱串联质谱检测结果;基于所述第一液相色谱串联质谱检测结果、所述第二液相色谱串联质谱检测结果和所述第三液相色谱串联质谱检测结果确定所述多肽二硫键位置。
根据本发明实施例的确定多肽二硫键位置的方法,通过在还原过程中添加了有机酸达到无需进行烷基化处理的目的以及通过对于质谱数据新的处理方式,使得方法解析难度较小,无需完全还原反应,避免了使用高毒性的二硫苏糖醇(dtt)直接完全还原,绿色环保,显著降低了人体危害性,简化流程,降低成本,操作简单快捷。并且,在定位待测样品中二硫键的同时能获得错配体中的二硫键的信息,填补了对于多肽错配体中二硫键信息表征的空白。
另外,根据本发明上述实施例的确定多肽二硫键位置的方法还可以具有如下附加的技术特征:
根据本发明的实施例,所述多肽样本的浓度为80-120μg/g,优选地,为100μg/g。
根据本发明的实施例,所述还原剂为三(2-羧乙基)膦。
根据本发明的实施例,所述还原剂与所述多肽样本的摩尔比例为4-6∶1。
根据本发明的实施例,所述有机酸为三氟乙酸或甲酸,优先地,为甲酸,更优选地,为0.5%的甲酸溶液。
根据本发明的实施例,所述甲酸的加入量为所述多肽样本与所述还原剂体积之和的0.8-1.2倍。
根据本发明的实施例,所述第一预定时间为1.5-2.5小时,所述第二预定时间为3.5-5小时。
根据本发明的实施例,所述第二液相色谱串联质谱检测结果与所述第三液相色谱串联质谱检测结果中相同子离子存在-2da的质量差,则所述子离子处存在二硫键。
根据本发明的实施例,相同子离子在所述第二液相色谱串联质谱检测结果不出现,并且在所述第三液相色谱串联质谱检测结果中出现并相对离子强度大于5%,则所述子离子位于二硫键内部。
根据本发明的实施例,所述液相色谱串联质谱检测的条件:第一液相色谱串联质谱检测的液相色谱串联质谱检测条件为:检测方式为全扫描模式fullscan;离子源为esi源;质谱扫描范围:150-2000,第二液相色谱串联质谱检测与第三液相色谱串联质谱检测的检测条件均为:液相色谱串联质谱检测方式:串联液相色谱串联质谱检测模式(hcd和cid模式);窗口宽度(isowidth):0.9-1.0;质谱扫描范围:150-2000。
根据本发明的实施例,所述多肽样本含有1-4个二硫键。
本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本发明的实践了解到。
附图说明
本发明的上述和/或附加的方面和优点从结合下面附图对实施例的描述中将变得明显和容易理解,其中:
图1显示了根据本发明一个实施例的利那洛肽的结构示意图;
图2显示了根据本发明一个实施例的利那洛肽样品的色谱检测结果示意图;
图3显示了根据本发明一个实施例的利那洛肽样品的质谱检测结果示意图;
图4显示了根据本发明一个实施例的部分还原产物的色谱检测结果示意图;
图5显示了根据本发明一个实施例的部分还原产物的质谱检测结果示意图;
图6显示了根据本发明一个实施例的部分还原产物的二级质谱(cid)检测结果示意图;
图7显示了根据本发明一个实施例的ms-product网站上所预测的完全还原后的利那洛肽各理论b/y子离子的结果示意图;
图8显示了根据本发明一个实施例的部分还原产物中3号二硫键的位置示意图;
图9显示了根据本发明一个实施例的完全还原产物的二级质谱(cid)检测结果示意图;
图10显示了根据本发明一个实施例的确认利那洛肽样品3号二硫键的位置示意图;
图11显示了根据本发明一个实施例的化合物二硫键成键可能性示意图,其中,a为情况1,b为情况2,c为情况3;
图12显示了根据本发明一个实施例的化合物情况1的预测的质谱检测结果示意图;
图13显示了根据本发明一个实施例的化合物进行hcd分析的二级质谱检测结果示意图;
图14显示了根据本发明一个实施例的完全还原的产物的hcd分析的二级质谱检测结果示意图;
图15显示了根据本发明一个实施例的化合物的二硫键成键分析示意图,其中,a为情况2,b为情况3;
图16显示了根据本发明一个实施例的修饰反应后产物加入甲酸发生部分还原反应放置时2小时后另一个其中一个序列中仅存在一个二硫键的还原产物峰的色谱示意图;
图17显示了根据本发明一个实施例的修饰反应后产物加入甲酸发生部分还原反应放置时2小时后另一个其中一个序列中仅存在一个二硫键的还原产物峰的hcd分析的二级质谱检测结果在m/z0-650质量轴的局部放大示意图。
具体实施方式
下面详细描述本发明的实施例,所述实施例的示例在附图中示出,其中自始至终相同或类似的标号表示相同或类似的元件或具有相同或类似功能的元件。下面通过参考附图描述的实施例是示例性的,仅用于解释本发明,而不能理解为对本发明的限制。
需要说明的是,术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括一个或者更多个该特征。进一步地,在本发明的描述中,除非另有说明,“多个”的含义是两个或两个以上。
根据本发明的一个方面,本发明提供了一种确定多肽二硫键位置的方法。根据本发明实施例的确定多肽二硫键位置的方法,无需进行烷基化处理,简化流程,降低成本,并且,在定位待测样品中二硫键的同时能获得错配体中的二硫键的信息。此外,该方法在还原过程中添加了有机酸,避免了使用高毒性的二硫苏糖醇(dtt)直接完全还原,绿色环保。
根据本发明实施例的确定多肽二硫键位置的方法,多肽样品需样量小,纯度要求低,操作简单快捷。
为了便于理解上述确定多肽二硫键位置的方法,在此,根据本发明的实施例,对该确定多肽二硫键位置的方法进行解释说明,该方法包括:
s100第一液相色谱串联质谱检测
根据本发明的实施例,将多肽样本进行第一液相色谱串联质谱检测,以便得到第一液相色谱串联质谱检测结果,该第一谱检测主要用于获得待测样品的分子量和保留时间等一些关于样品本身的基本信息,以确认样品无误。
根据本发明的实施例,该多肽样本含有1-4个二硫键。
根据本发明的实施例,该多肽样本的浓度为80-120μg/g,优选地,为100μg/g。由此,该浓度可以有利于第一第二液相色谱质谱检测中相应离子的强度较高以获得分辨率比较为优异的谱图,同时又不至于消耗大量样品,显著降低该方法的耗样量。
其中,需要说明的是,本发明实施例的多肽样本通常为已知氨基酸序列的多肽,该方法依据于第二质谱第三质谱检测中产物子离子的出现和不出现来进行推定定位二硫键的,因此需要根据所提供的序列寻找相应序列位置上的离子推断定位二硫键,因此已知序列是十分必要的。
s200还原处理
根据本发明的实施例,将所述多肽样本与还原剂和有机酸溶液混合,在第一预定时间得到部分还原产物,在第二预定时间得到完全还原产物,通过两步还原,分别得到部分还原产物和完全还原产物,加入有机酸能消除后续的烷基化反应,同时做不加有机酸的对照组实验即可获得错配体,通过后续实验便可定位错配体中二硫键信息,无需进行烷基化处理。由此,该还原处理简化流程,降低成本,并且,在定位待测样品中二硫键的同时能获得错配体中的二硫键的信息。
根据本发明的实施例,该还原剂为三(2-羧乙基)膦。由此,三(2-羧乙基)膦(tcep)对二硫键还原反应的活性强,而且几乎没有副反应,与其他还原剂相比,tcep和其他生化试剂有更好的兼容性,并且能在更宽的ph范围包括酸性条件下使用,从而有效减少二硫键交换的发生,虽然它不易挥发,但进行二硫键还原所需的tcep浓度较低,并不妨碍随后的质谱分析,可以实现二硫键的部分还原反应,并且低毒。
根据本发明的实施例,该有机酸为三氟乙酸或甲酸,优先地,为甲酸,更优选地,为0.5%的甲酸溶液。由此,有效抑制二硫键交换等副反应。
根据本发明的实施例,该甲酸的加入量为所述多肽样本与所述还原剂体积之和的0.8-1.2倍。发明人研究发现,该甲酸加入比例可以有效抑制巯基-二硫键交换副反应所需的ph值,显著减小巯基-二硫键交换副反应产生的错配体对二硫键的定位的干扰。
根据本发明的实施例,该还原剂与多肽样本的摩尔比例为4-6∶1。由此,该比例可以满足达到部分还原的目的,并且在各个相应的预定时间内获得可以产生质谱信号强度足够的部分还原产物和完全还原产物。
根据本发明的实施例,该第一预定时间为1.5-2.5小时,优选为2小时。由此,有利于反应物充分被部分还原,又避免还原过度,被完全还原。根据本发明的实施例,该第二预定时间为3.5-5小时。由此,有利于反应物充分被完全还原。
s300第二液相色谱串联质谱检测
根据本发明的实施例,将所述部分还原产物进行第二液相色谱串联质谱检测,该第二液相质谱检测的目的是用于区分不同还原程度的还原产物,主要寻找分子内仅含一个二硫键的还原产物峰,并将满足条件的部分还原产物进行二级质谱hcd或cid分析,得到第二液相色谱串联质谱检测结果,该第二液相色谱串联质谱检测结果即为部分还原产物的质谱结果。
s400第三液相色谱串联质谱检测
根据本发明的实施例,将完全还原产物进行第三液相色谱串联质谱检测,得到第三液相色谱串联质谱检测结果,该第三液相色谱串联质谱检测结果即为完全还原产物的质谱结果。
根据本发明的实施例,第一、第二和第三液相色谱串联质谱检测为液相色谱串联高分辨轨道阱质谱,例如可以是液相色谱仪1250系列串联quadrupoleiontrap(ltq)-orbitrapvelospro质谱仪。根据本发明的实施例,该液相色谱串联质谱检测进行色谱分离和一级质谱分析。在阳离子模式下对不同还原程度的部分还原产物进行分离和分子量的测定。本方法选择部分还原产物中仅含有一个二硫键的产物(对应取样分析在放置时间为2小时混合溶液)和完全还原产物(对应取样分析在放置时间为4小时混合溶液)进行二硫键定位。一级质谱数据与二级质谱数据的查看均通过液相色谱串联高分辨轨道阱质谱仪自带的
根据本发明的实施例,对部分还原产物中仅含有一个二硫键的产物和完全还原产物在阳离子模式下进行hcd和cid二级质谱分析,将b/y子离子与网站ms-product(网址:http://prospector2.ucsf.edu/prospector/cgi-bin/msform.cgi?form=msproduct)的预测离子进行比对,归属b/y子离子。其中,hcd谱图主要关注低质量端子离子,cid谱图主要关注高质量端子离子,两者结果可相互印证和补充。根据完全还原产物的二级质谱碎裂谱图,选取具有对定位二硫键有意义的丰度较高的特征离子。通过判断这些对定位二硫键有意义的丰度较高的特征离子的出现与未出现来定位二硫键。同时这些特征离子的丰度又可以作为评价该方法结果准确性的置信程度。
根据本发明的实施例,该液相色谱串联质谱检测的条件:第一液相色谱串联质谱检测的液相色谱串联质谱检测条件为:检测方式为全扫描模式fullscan;离子源为esi源;质谱扫描范围:150-2000,另外,离子源温度、鞘气流速、辅助气流速和毛细管电压需要根据样本的具体情况进行具体优化。根据本发明的实施例,第二液相色谱串联质谱检测与第三液相色谱串联质谱检测的检测条件均为:液相色谱串联质谱检测方式:串联液相色谱串联质谱检测模式(hcd和cid模式);窗口宽度:0.9-1.0;质谱扫描范围:150-2000,另外,归一化碰撞能nce值需根据具体样本情况进行优化,离子源温度、鞘气流速、辅助气流速和毛细管电压与第一液相色谱串联质谱检测相同。所有上述参数优化方式为待测多肽样品水溶液(10μg/g左右即可)采用注射泵直接进样方式在阳离子模式下,依次变动数值优化电喷雾电压、雾化气流速、辅助气流速、毛细管电压等重要质谱参数以及二级质谱hcd和cid的归一化碰撞能(nce),使得质谱相对离子强度响应值最大以获得分析样品的更佳离子化效率和高分辨率的二级质谱图。
s500二硫键定位
根据本发明的实施例,基于第一液相色谱串联质谱检测结果、第二液相色谱串联质谱检测结果和第三液相色谱串联质谱检测结果,将上述三个液相色谱串联质谱检测结果进行比对,确定多肽二硫键位置。
根据本发明的实施例,该第二液相色谱串联质谱检测结果与第三液相色谱串联质谱检测结果中相同子离子存在-2da的质量差,因为第二液相色谱串联质谱检测所选取的部分还原产物中仅有一个二硫键存在,其余二硫键均被还原,而第三液相色谱串联质谱检测的是完全还原产物。因此通过两次液相色谱串联质谱检测的结果对比,则确定该子离子序列内存在二硫键。若该子离子序列内存在两个半胱氨酸,则所存在的二硫键为这两个半胱氨酸所形成的。若该子离子序列内存在多个半胱氨酸,需结合下面的另一判断依据剔除不可能的排列组合方式,直至最后确定唯一的正确的成键方式。
根据本发明的实施例,相同子离子在第二液相色谱串联质谱检测结果不出现,并且在第三液相色谱串联质谱检测结果中出现并相对离子强度大于5%,则所述子离子位于二硫键内部。其中,需要说明的是,本文中“相对强度”的参照对象整个质谱图中丰度最高的粒子,设定丰度最高的离子的强度为100%。为了便于理解,在此对该判断二硫键的方法进行进一步解释,子离子在第二液相色谱串联质谱检测结果不出现,可能存在三种情况:1.子离子处于二硫键内部,因为在二硫键存在的情况下,实施在第二液相色谱串联质谱实验,二硫键内部所包含的所有序列离子是无法通过二级质谱检测出来的,因为不论是hcd还是cid在正离子模式下都无法将二硫键断裂。2.子离子所处位置本身不断裂。3.断裂位置产生的子离子强度太低,仪器检测不到。因此通过在第三液相色谱串联质谱检测结果中出现并相对离子强度大于5%这一限定条件,排除2、3两种情况。此时子离子在第二液相色谱串联质谱检测结果不出现,一定是由于子离子处于二硫键内部导致其信息被二硫键“屏蔽”。
下面参考具体实施例,对本发明进行说明,需要说明的是,这些实施例仅仅是说明性的,而不能理解为对本发明的限制。
下面将结合实施例对本发明的方案进行解释。本领域技术人员将会理解,下面的实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品,例如可以采购自sigma公司。
实施例1
本实施例中,以确认利那洛肽中二硫键为例,来验证本发明实施例的确定多肽二硫键位置的方法对定位二硫键的准确性和简便性,其中,利那洛肽的结构详见图1,具体方法如下:
1、第一液相色谱串联质谱检测为了获得较好的信号,对esi中的鞘气流速、辅助气流速、喷雾电压以及毛细管温度和二级质谱碎裂的nce能量进行了优化。通过针泵直接进样优化实验,esi中的鞘气流速为35arb、辅助气流速1arb、喷雾电压+3.1kv和毛细管温度310℃时信号响应更优;二级质谱碎裂的nce能量对于hcd,23%为优选,对于cid,20%为优选。
色谱流动相分别为:a相为水加0.1%的甲酸,b相为乙腈加0.1%的甲酸。采用液相分离梯度如下:b相20%线性增加到35%,用时60min。
在该色谱梯度和质谱实验参数设置下,进行第一液相色谱串联质谱检测。检测结果如图2和3所示,确认样品无误并得到利那洛肽样品分子量和保留时间等信息。
2、部分还原处理
配制浓度为100μg/g的利那洛肽水溶液,按照摩尔比5:1(还原剂:多肽)的比例配制还原剂三(2-羧乙基)膦等体积水溶液。将待测样多肽溶液与二硫键还原剂三(2-羧乙基)膦(tcep)水溶液混合以进行二硫键的部分还原反应;同时立即在混合后的反应液中加入混合溶液总体积0.5%的甲酸,静置2h。
3、第二液相色谱-质谱检测
将步骤2中静置后的溶液进行第二液相色谱-质谱检测,其中,第二液相色谱-质谱检测与第一液相色谱-质谱检测的检测条件相同,用于寻找序列中仅存在一个二硫键的还原产物,色谱结果如图4所示,结果表明部分还原产物的序列中仅存在一个二硫键的还原产物色谱峰,质谱结果如图5所示,结果表明保留时间在18.21min的仅存在一个二硫键的还原产物。
4、第三液相色谱-质谱检测
对步骤2中第二液相色谱-质谱检测中保留时间在18.21min这个序列中仅含一个二硫键的还原产物进行第三液相色谱-质谱检测,其中,第三液相色谱-质谱检测与第一液相色谱-质谱检测的检测条件相同,检测结果如图6所示,结果表明保留时间在18.21min质谱峰的仅存在一个二硫键的还原产物的二级质谱图(cid),并将该结果与ms-product预测的子离子(图7所示)进行对照,发现b4、y10和b13均与完全还原的利那洛肽各相同位置相差-2da,由此,预测在此序列中存在一个二硫键,如图8所示。
通过与放置4h后获得的全还原那洛肽二级质谱图(见图9)对比,发现在全还原那洛肽二级质谱图中b7、y7和y4未出现在保留时间在18.21min这个序列中仅含一个二硫键的还原产物二级质谱图(图6)中,证明这三个位置处于二硫键内部,从而,成功确认在此序列中存在3号二硫键,如图10所示。
5、1号二硫键和2号二硫键的确定
由于已知3号二硫键的存在,剩余4个半胱氨酸形成2个二硫键的组合方式一共只有3种,如图11所示。
对这三种情况逐一分析。首先对于情况1(图11a),若样品中二硫键的成键方式如情况1所示,由于b3和b4离子未处于二硫键内部,可以通过直接进样的方式将未还原的样品进行二级质谱碎裂,即可得到b3和b4离子(如图12)。因此配制浓度为100μg/g的利那洛肽水溶液,通过直接进样的方式将样品水溶液通过质谱仪注射泵直接进入质谱进行二级质谱分析。这里的二级质谱分析采用hcd。因为cid会出现质量截止效应,存在一些低质量端的子离子的信息缺失问题。
图12情况1中二硫键的成键模式,由于b3和b4离子未处于二硫键内部,可以通过直接进样的方式将未还原的样品进行二级质谱碎裂,即可得到b3和b4离子。若得到b3和b4离子则证明为情况1中的二硫键成键模式。若得不到,则不是情况1。通过直接进样的方式将样品水溶液通过质谱仪注射泵直接进入质谱进行hcd二级质谱分析,如图13所示,在相应质量区域内并未找到b3和b4离子,表明该化合物二硫键情况与情况1不同。
同时,在做一组对照实验,对照完全还原的利那洛肽样品的hcd谱图,排除子离子所处位置本身不断裂和断裂位置产生的子离子强度太低,仪器检测不到这两种可能的干扰。如图14所示,完全还原的利那洛肽样品的hcd谱图是可以找到b3和b4离子。因此排除情况1中的二硫键的成键模式。
因此样品中的二硫键成键模式只有可能是情况2(图11b)或者情况3(图11c)。下面对情况2和情况3进行分析。不论是情况2中cys1-cys10和情况3中的cys2-cys10还是情况2中cys1-cys6和情况3中的cys2-cys6,均都依赖与1位和2位的半胱氨酸间的断裂,即b1离子的出现或者不出现即可判断是情况2还是情况3,如图15所示。
但注意观察图7中ms-product网站上所预测的完全还原后的利那洛肽各理论b/y子离子中并没有理论预测的b1离子。这是因为利那洛肽样品本身序列的特殊性,因为在多肽序列n端无修饰的情况下,任何多肽序列的b1离子都不出现。而恰巧该多肽序列的第1位和第2位氨基酸均为半胱氨酸,因此导致判断二硫键成键模式的关键离子b1不论如何都不会断裂。因此需要实施n端修饰反应以使得相应多肽样品的b1离子出现。
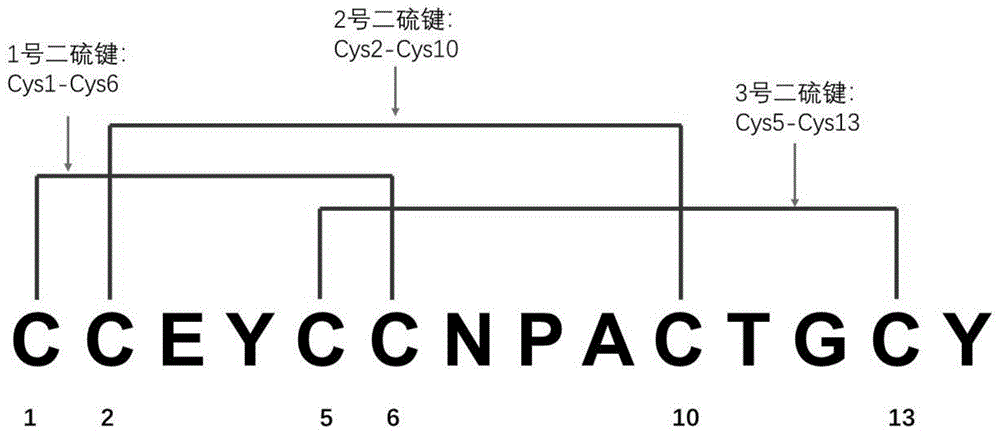
采用如前所述的步骤2的部分还原处理方法和梯度,获得另一个其中一个序列中仅存在一个二硫键的还原产物,如图16所示,对其进行第三液相质谱分析,因为主要是看低质量端的b1离子是否存在,因此采用hcd二级质谱分析。如图17所示,在该还原产物的hcd谱图在在m/z0-650质量轴的放大图中仅发现y1离子而并未发现存在b1离子。因此可以断定该样品中二硫键的成键模式位情况3而非情况2。也就是利那洛肽样品中的二硫键模式为图1所示,为cys1-cys6、cys2-cys10和cys5-cys13。
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不一定指的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任何的一个或多个实施例或示例中以合适的方式结合。
尽管已经示出和描述了本发明的实施例,本领域的普通技术人员可以理解:在不脱离本发明的原理和宗旨的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由权利要求及其等同物限定。
- 还没有人留言评论。精彩留言会获得点赞!