提取柱的制作方法
本申请是发明名称为“提取柱”、申请日为2016年6月10日、申请号为201680034142.7的中国专利申请的分案申请。
本发明涉及一种用于从样品提取组分的装置和系统,并且更具体地,涉及一种提取柱和包括提取柱的一次性末端。
背景技术:
通常,基于蛋白质组的液体层析质谱学(液相色谱-质谱)是在被称作自下而上的蛋白质组的处理中将缩氨酸设定为分析物。在该处理中,利用蛋白酶使蛋白质消化成缩氨酸。该消化的持续时间可以是漫长的并且经常需要整夜培养。在临床设定中,需要短的样品处理时间。自上而下的蛋白质组引入了其中可以利用液相色谱-质谱分析原样蛋白质等的选项。这类蛋白质组不要求漫长的消化,使其更适合用于临床使用以及自动系统中。然而,仍必须从样品中的另一个非蛋白质组分中提取蛋白质细粒。可以利用提取柱从样品中的其它组分中提取蛋白质。优选地,该提取柱将允许自动样品制备并直接集成到液相色谱中。
通常,吸管末端和相似消耗品被销售、运送并被插入到已知的用于对每个末端进行定位与定向的托盘或者其它装置中的自动分析器中。然而,更简便且便宜的是将末端包装在容器中并随容器运送,其中末端以随机顺序被大批量包装成诸如袋子或者盒子中。通常,吸管末端是具有尖端和开口端的锥形形状,这导致当以随机顺序和方位松散地存储时,这些末端堆叠并堆积。这使得自动系统在某时很难拾取一个吸管末端,并且堆叠的末端可能导致自动系统卡住。这种通常所说的“随机封装”的另一个问题在于包括提取介质的吸管末端的纤细端部可能由于接触其它末端而被损坏。
此外,由于提取介质和通道壁的壁之间的接口的问题有时会出现样品流绕过提取介质而使得柱没有效果。
技术实现要素:
这里说明了一种提取柱和系统,该提取柱和系统解决了一个或多个问题或者在上面认识到的需要。在一个实施例中,提取柱包括具有储存部分的柱本体、提取介质部分和套环部分。储存部分包括入口和储存室。提取介质部分包括细长套筒,该细长套筒具有限定空腔的内表面。提取介质部分具有与储存室流体连通的入口端和被设置成远离入口端的出口端。提取介质被设置在细长套筒的空腔中。套环部分与细长套筒一起在共同的方向上轴向延伸。套环部分具有末端,该末端与细长套筒的出口端间隔开并至少轴向延伸至由细长套筒的出口端限定平面。在本发明的实施例中,套环部分的末端轴向延伸超过由细长套筒的出口端限定的平面,而在一些可选实施例中,套环部分的末端以足以防止细长套筒的出口端被第二提取柱的任何部分接触的距离轴向延伸超过由细长套筒的出口端限定的平面。在本发明的实施例中,储存部分的入口具有不大于并可能小于套环部分的末端的外径的内径。提取柱的实施例可选地包括邻近入口从储存部分向外突出的肩状部。提取介质的实施例可以包括固相提取介质,例如聚合体整体料、或多个无孔珠、多孔珠、或其混合物。多孔珠或无孔珠可以通过二次变形和/或通过使用粘合剂粘合在一起,从而形成整体支持,该粘合剂可以例如包括胶乳配方。
本发明的其它方面涉及一种系统,该系统包括与样品端口相结合的提取柱的实施例,该样品端口具有被配置成容纳提取柱的细长套筒的第一腔室。该系统可选地包括液体输送装置,例如陶瓷探针。该系统还可以可选地包括分析装置,例如质谱仪、液相色谱装置、及其结合。
另外,说明了外壳的实施例,该外壳包括其中设置有介质的床,其中介质通过层与外壳的内表面分离,该层被配置成大致防止样品流绕过介质。
将参照以下示例性实施例的详细说明连同附图认识本发明的不同的其它目的、优点和特征。
附图说明
那些合并到此说明书中并构成此说明书的一部分的附图显示了本发明的实施例,并且连同上面给出的本发明的发明内容以及下面给出的详细说明用来说明本发明。
图1是根据本发明实施例的提取柱的分解立体图;
图2是图1的处于组装状态下的提取柱的纵向横截面的立体图;
图3是根据本发明实施例的包括液体输送装置、提取柱、样品端口、和分析装置的一部分的系统的实施例的一部分的纵向横截面侧视图;
图4是根据本发明实施例的提取柱和一部分可选液体输送装置的纵向横截面侧视图;
图5是根据本发明实施例的包括液体输送装置、提取柱的可选实施例、样品、和一部分分析装置的系统的实施例的一部分的纵向横截面侧视图;
图6是图4的样品端口的示意图;图6a是图4的样品端口的侧视图;
图6b是沿线6b-6b截得的图4的样品端口的纵向横截面侧视图;
图7是在液体流动通过多孔提取介质的过程中提取柱中的背压的图表;
图8a是从样品中获得的色谱,该样品包含从根据本发明实施例的提取柱洗脱的5种蛋白质的混合物;
图8b是从样品中获得的质谱,该样品包含从根据本发明实施例的提取柱洗脱的5种蛋白质的混合物;
图9是胰岛素的色谱,该胰岛素从根据本发明实施例的提取柱洗脱的样品而获得;
图10是泛素的色谱,该泛素从根据本发明实施例的提取柱洗脱的样品而获得;
图11是肌红蛋白的色谱,该肌红蛋白从根据本发明实施例的提取柱洗脱的样品而获得;
图12是碳酸酐酶的色谱,该碳酸酐酶从根据本发明实施例的提取柱洗脱的样品而获得;
图13是根据本发明实施例的提取介质和通道壁之间的中间位置的层的扫描电子显微镜图像;以及
图14是根据本发明实施例的色谱图的比较,示出了从利用第二介质抵靠通道壁保持提取介质所获得的结果相对于没有使用第二介质所获得的结果的差值。
具体实施方式
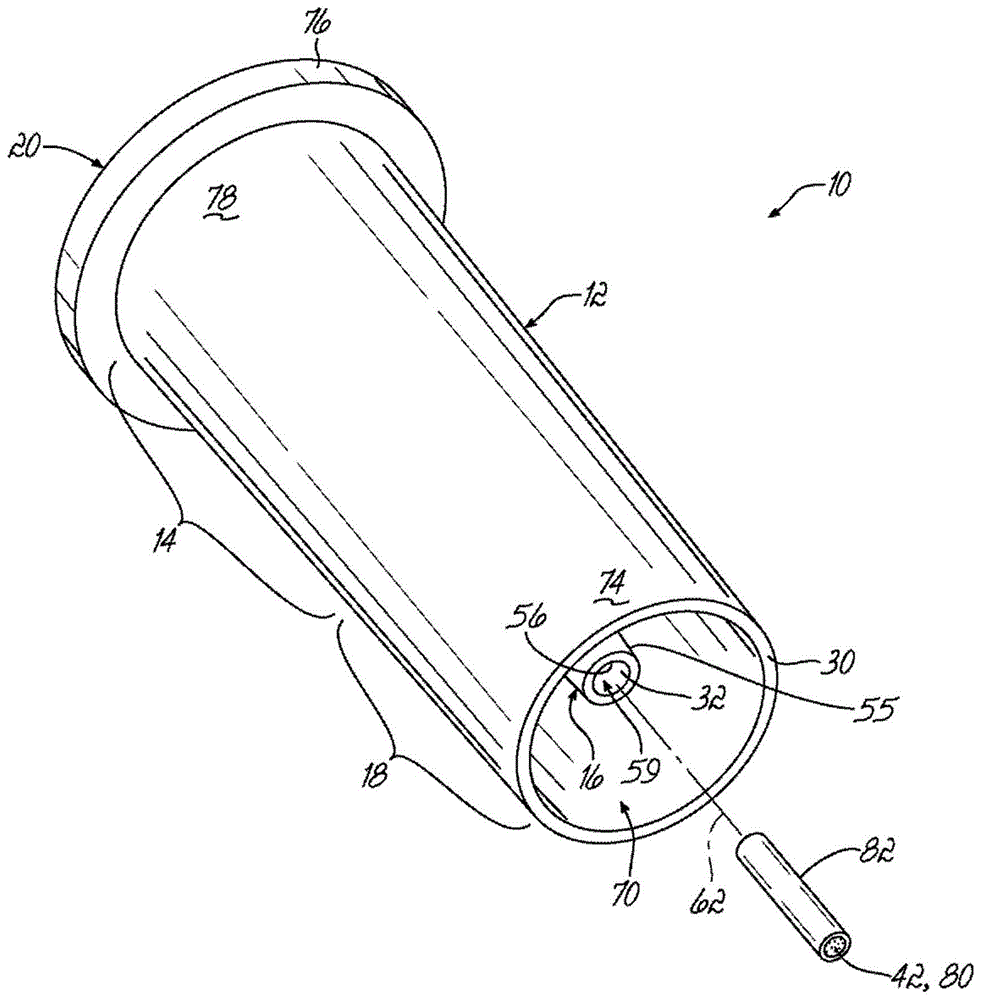
参照图1和2,本发明的实施例涉及提取柱10,该提取柱10用于从样品提取诸如蛋白质或者蛋白质片段的组分,该样品包含诸如蛋白质、缩氨酸、碳水化合物、类脂、核酸、盐、和小分子的组分的混合物。提取柱10包括柱本体12,柱本体12具有储存部分14、提取介质部分16和套环18。
储存部分14通常位于柱本体12的近端20,并包括入口24和用作储存室26的空腔。储存室26由储存部分14的内表面28限定并与提取介质部分16的大致位于柱本体12的远端30处的空腔32流体连通。储存室26能够保持大量液体。在实施例中,储存室26的容积足以保持需要用于填装提取介质42的液体的体积、将被提取的样品的体积、洗液的体积、和洗脱溶液的体积。例如,在一些提取方法中,必须在强制样品通过位于提取介质部分16的空腔32中的提取介质42之前利用适合的溶剂稀释样品。通常,稀释样品的步骤在单独的容器中执行。在本示例性实施例中,储存室26的体积足以在正压力被施加到储存室26以将样品传送至提取介质之前在储存室26中直接稀释样品。在本发明的实施例中,储存室26具有从大约50μl至大约1500μl的范围的体积。
在图1-3图示的示例性实施例中,储存室26的内表面28包括接近入口24的提供储存室26的大部分容积的第一部分34和接近提取介质部分16的第二部分38。在图1-3图示的示例性实施例中,储存室26的第一部分34的内表面28通常具有截头圆锥形形状并且在第一部分34的近端处内径id1和第一部分34的远端36处的内径id2之间具有小于大约10度的会聚角,或者在可选实施例中,该会聚角小于4度。如在此使用的,该会聚角是涉及的表面和本结构的中心轴线之间的角度,在这种情况下,该中心轴线是柱本体12的中心轴线62。
如图4所示,储存室26可以具有被配置成相对于液体操作装置41进行密封的形状,这可以在储存室26中产生正空气压力以迫使储存室26中的液体通过提取介质42。例如,第一部分34的邻接近端20外表面43可以被配置成与液体操作装置41的芯轴45上的o形环44相接合并与o形环44形成一密封件。在可选例中,储存室26的第一部分34的内表面28可以被配置成与液体操作装置的芯轴的o形环或者外表面接合并与o形环或者外表面形成一密封件。
如图2和3所示,储存室26的第二部分38可以具有漏斗形状并具有朝向提取介质部分16向内渐缩的环形壁。在可选实施例中,第二部分38可以具有截头圆锥形形状。该漏斗形状或者截头圆锥形形状缩小了第二部分38的内径并有助于引导液体输送装置46的端部到适当位置以形成液体输送装置46和提取柱10之间的紧密密封。储存室26的第二部分38在第二部分38的近端48处的内径id3和第二部分38的远端50处的内径id4之间具有会聚角。在示例性实施例中,储存室的第一部分34的会聚角小于储存室26的第二部分38的会聚角。
在图1至3中例示的实施例中,储存室26的第二部分38包括进一步减少储存室26的直径的支架52,这是因为支架52过渡到储存室26和提取介质部分16的空腔32之间的流体通路54中。支架52用作密封表面以形成与液体输送装置46(例如吸管末端或者类似中空陶瓷探针的中空探针)的密封。在一些实施例中,储存室部分的远端处的内表面还可有助于与液体输送装置46形成的密封。当如图3所示而定位的液体输送装置46抵靠支架52利用足以形成柱本体12和液体输送装置46之间的密封的作用力被推进时(并且在一些实施例中,抵靠邻接支架52的储存室26的第二部分38的远端50处的内表面40被推进时)形成密封。施加到液体输送装置46的作用力可以使支架46和/或邻接支架52的储存室26的第二部分38的远端50处的内表面40的塑料结构变形成液体输送装置46的形状以建立液体输送装置46和提取柱10之间的密封。在图1-3的示例性实施例中的支架52被图示出具有大致截头圆锥形形状,该大致截头圆锥形形状具有以大约45度至大约90度的范围会聚的钝角。
在图5中图示的可选实施例中,第二部分38没有支架并作为替代直接过渡到提取介质部分16的空腔32。在该示例性可选实施例中,液体输送装置46形成相对于提取介质42的近端53的密封。第二部分38的远端50处的内表面40可以接合液体输送装置46的一部分并促进液体46和提取介质42之间的密封。在该可选实施例中,支架57定位在柱本体12的提取介质部分16的细长套筒55的空腔32的出口端60处。支架57减少了细长套筒55的空腔32的出口端60的通孔59的内径。
在实施例中,形成在液体输送装置46和提取柱10之间的密封允许从液体输送装置46传送至提取柱10的样品的不超过大约10%的体积的渗漏。在另一个实施例中,在大约70巴到大约200巴的注射压力下,形成在液体输送装置46和提取柱10之间的密封允许从液体输送装置46传送至提取柱10的样品的不超过大约10%的体积的渗漏。
图2-4中图示的实施例包括储存室26和提取介质部分16的空腔32之间的流体通路54。在该示例性实施例中,流体通路54具有截头圆锥形形状,并且会聚角通常小于大约10度,而在可选实施例中小于大约1度。流体通路54具有在提供足够的流以防止由限制通过流体通路54的流体所引起的背压增长的同时使流体通路54的体积最小化的长度和内径。流体通路54的体积被最小化以使提取柱中的无用容积最小化。在实施例中,流体通路54的体积不超过大约1000nl并且可以在大约1nl至大约50nl的范围内。
提取介质部分16包括具有内表面56的细长套筒55,内表面56限定空腔32,提取介质42设置在空腔32中。空腔32包括与储存室26流体连通的入口端58以及出口端60,出口端60具有远离入口端58设置的通孔59。在实施例中,空腔32具有截头圆锥形形状,该截头圆锥形形状具有小于大约5度的会聚角,并且在一个可选实施例中,会聚角可以具有大约0.2度至1度的范围。在另一个可选实施例中,截头圆锥形形状的空腔32的会聚角可以为大约0.4度。在具有截头圆锥形形状空腔32的实施例中,空腔32的较大直径端部朝向提取介质42的插入点开口。用于可选实施例的空腔32的内径还具有大约0.5毫米至大约2.0毫米的范围,并且优选地具有大约0.75毫米至大约0.85毫米的范围。柱本体12具有中心轴线62,中心轴线62延伸穿过提取介质部分16的空腔32。空腔32具有沿入口端58和出口端60之间的中心轴线62的长度l1。在实施例中,空腔32的长度l1具有大约1毫米至10毫米的范围。在另一个实施例中,空腔32的长度l1具有大约3毫米至大约5毫米的范围,并且优选地具有大约3.5毫米至大约4.5毫米的范围。在实施例中,空腔的长度l1与细长套筒55的长度相对应。
提取介质部分16还具有外表面66,该提取介质部分16的底部部分被配置以与样品分析系统(图3)的样品端口68形成密封。在实施例中,外表面66具有在细长套筒55的出口端60处变窄的大致截头圆锥形形状。细长套筒55在出口端60处可以具有大约1毫米至大约2毫米的范围的外径。在另一个实施例中,细长套筒55在出口端60处具有大约1.2毫米至大约1.5毫米的范围的外径。在另一个实施例中,细长套筒55在出口端60处具有大约1.4毫米的外径。细长套筒55的外表面66可以具有大约1度至大约20度的范围的会聚角,并且优选地,具有大约5度至大约15度的范围的会聚角。在细长套筒55的实施例中,形成细长套筒55的壁的厚度从空腔32的出口端60向空腔32的入口端58增加。
柱本体12的套环18在于细长套筒55共同的方向上轴向延伸。在图1-4图示的实施例中,套环18具有邻近第一部分34和第二部分38之间的过渡连接至储存室部分14的外表面78的封闭端72。在图示的实施例中,套环18的外表面74与储存室部分14的外表面78相连续。储存室部分14和套环18的外表面78、74可以在小于15度的会聚角的情况下渐缩,而在可选实施例中,该会聚角具有大约0.1度至大约5度的范围。
套环18具有与细长套筒55的出口端60间隔开的开口末端70。细长套筒55的出口端60限定平面p1。套环18的末端70限定至少延伸至由细长套筒55的出口端60限定的平面p1的平面p2。在实施例中,套环18的末端70的平面p2延伸超过细长套筒55的出口端60的平面p1。图1-4中图示的实施例中,套环18的末端70的平面p2延伸超过细长套筒55的出口端60的平面p1距离d1,该距离d1足以防止细长套筒55的出口端60接触第二提取柱的任何部分。例如,距离d1可以具有大约0.1毫米至大约2毫米的范围,这取决于套环18的末端70处的内径id5、和套环18的末端70处的较小外径od1或者柱本体12的近端20处的外径od2,并且距离d1足以防止细长套筒55的出口端60被第二提取柱的任何部分接触。当提取柱10松散地存储在袋子或者盒子中时,该结构防止对细长套筒55的出口端60的损害。平面p2延伸超过平面p1的额外优势在于当提取柱10在被自动样品分析系统处理时防止细长套筒55的出口端60的污染。例如,运送自动分析系统中的提取柱10的方法具有使提取柱10通过导管或者软管从系统中的一个位置降落至另一个位置。如果细长套筒55的出口端60被暴露(即,不被套环18保护),如果出口端60接触运送管或者软管的表面,则具有出口端60的转移污染的显著风险。本发明的套环18防止细长套筒的出口端60与运送软管的表面的接触,并由此减少了在相同软管中运送的不同提取柱之间的转移污染的风险。
套环18的末端70具有外径od1,而储存室26的入口24具有内径id1,使得套环18的末端70可以不被完全地插入到储存室26的入口24中。在实施例中,储存室的入口24的内径id1不大于套环18的末端70的外径od1。在另一个实施例中,储存室的入口24的内径id1小于套环18的末端70的外径od1。类似地,柱本体12的近端20具有外径od2,而套环18的开口末端70具有内径id5,使得柱本体12的近端20可以不被完全地插入到套环18的开口末端70中。在图1-4图示的实施例中,柱本体12的近端20处的外径od2包括可选肩状部76。在实施例中,套环18的开口末端70的内径id5不大于柱本体12的近端20的外径od2。在另一个实施例中,套环18的开口末端70的内径id5小于柱本体12的近端20的外径od2。当多个提取柱10被存储在一起且被随机封装在诸如袋子或者盒子中时,如果发生提取柱的一个端部能够配合第二提取柱的端部中的开口内的情况,则提取柱10不会一个堆叠在另一个提取柱的内部。提取柱10的这方面使得自动系统明显更容易地一次拾取一个提取柱10,并允许提取柱10被自动系统使用而不需要分类并放置到托架中。因此,提取柱10可以被成批松散地包装、销售、存储和插入到自动分析系统中而不需要将他们按照规定位置和规定方位包装在托架或者托盘中,由此提高了效率、节省了金钱、空间和劳动力。
在图1-4所示的实施例中,柱本体12的近端20包括邻近入口24从储存部分14的外表面74向外突出的可选肩状部76。肩状部76增加了柱本体12的近端20的外径并提供可以由自动装置使用以在处理过程中或者如果需要将提取柱10悬挂在托盘或者托架系统中时悬挂提取柱10的表面。
提取介质42被设置在提取介质部分16的空腔32中。提取介质42允许从混合样品中提取需要的组分。提取介质42可以从混合生物样品中的其它组分中通过色析法分离蛋白质。提取介质42的实施例能够可逆地结合诸如具有大约1kda至大约200kda范围的分子量的缩氨酸和蛋白质的小分子或者大分子。当样品以大约50μl/min至200μl/min范围内的流动速率通过提取介质42时,提取介质42能够可逆地结合大约10μl至大约100ml的范围内的样品体积中的至少1μg的蛋白质。提取介质42还可以基于适合的特征洗脱适合的组分,例如基于组分的分子量、疏水性、电荷、或者用于提取介质42某方面的组分的亲合力。在实施例中,当利用大约1μl至大约100μl范围内体积的洗脱溶剂以大约0.1μl/min至大约20μl/min的范围内的流量进行洗脱时,提取介质42能够从混合样品洗脱至少20%的蛋白质结合。
在实施例中,提取介质42是固相提取介质,并且更具体地,是具有允许足够的样品流动通过多孔单块介质80而没有生成不良高背压的高内部孔隙的多孔单块介质80。在实施例中,背压在200μl/min的流量下不超过大约5巴。多孔单块介质80优选地能够承受至少200巴。多孔单块介质80的孔隙结构的益处在于其对于样品具有曲折通路,这在快流量下允许迅速的对流质量传递。此外,多孔单块介质80不需要熔料以将其位置保持在柱本体12内。
多孔单块介质80可以被制备成外壳内部的连续床,诸如管82的一段。这导致在将管82切割成多段时,多孔单块介质80存在于用作提取介质42的微型柱的整个长度。
在图1-4图示的实施例中,提取介质42是从提取介质部分16的细长套筒55的出口端60插入到柱本体12的提取介质部分16的空腔32中的多孔单块介质80。在图5所示的实施例中,提取介质42是由于细长套筒55的出口端60处存在有支架57而从空腔32的入口端58插入到柱本体12的提取介质部分16的空腔32中的多孔单块介质80。在管82内部制备多孔单块介质80和将管82切割以形成微型柱的益处在于该方法在诸如出现多孔单块介质被允许直接聚合在吸管末端内部时,避免在空气和聚合多孔单块介质之间的边界处形成半渗透或者无孔层。半渗透或者无孔层会对产生的多孔单块介质的流动特性造成不利的影响。在其中多孔单块介质直接形成在提取介质部分16的空腔32内部的实施例中,半渗透或者无孔层的副作用可以通过形成穿过多孔单块介质的中心的通路以增加通过提取介质的样品的流量而被减少。然而,待收集的高比例的组分会保留在通路中并绕过多孔单块介质,因此需要样品通过介质的多个通道,用于最大提取。相比之下,制备多孔单块介质80(管82在多孔单块介质内部被切割成部分)产生了多孔圆柱,其中横跨直径以及沿多孔单块介质80的长度的孔隙结构和孔隙度都是均匀的。该制备过程使得样品流通过多孔单块介质80而不会受到半渗透或者无孔表面的阻碍,并横跨多孔单块介质80产生大致均匀的结合,从而在通过多孔单块介质80的单个通道中提供适合组分的最大提取。
多孔单块介质80外部上的管82提供保护层,该保护层帮助处理多孔单块介质80。例如,在制造提取柱10的过程中,柱本体12可以独立于多孔单块介质80而形成。然后,多孔单块介质80被插入到柱本体12的提取介质部分16的空腔32中。在其中多孔单块介质80形成为管82的部分的实施例中,管82允许多孔单块介质80被更容易地处理,用于插入到提取介质部分16的空腔32中。另外,当多孔单块介质80插入到储存部分14的空腔32中时,管82的壁可以用作支持多孔单块介质80并可以用作抵靠空腔32的内表面的密封表面,从而防止多孔单块介质80周围的回流。
当形成为管82的一部分的多孔单块介质80插入到储存部分14的空腔32中时,管82压缩多孔单块介质80周围以防止多孔单块介质80从管82被挤出。
多孔单块介质80可以任选地被连接至管82的内表面以提高对多孔单块介质80的提取的阻力。例如,管82的内表面可以被处理以建立用于聚合多孔单块介质80的共价结合连接点。为了激活诸如聚乙烯酮醚(peek)管的管的内表面,管的内部可以用包含诸如乙腈或者丙腈(烷基腈衍生物)的溶剂和诸如vazo-64或者vazo-55(wakov-70)的偶氮基类别引发剂的反应溶液以大约1%至大约10%(体积)的范围内的浓度填充。填充的管可以接着被加热至最少溶剂的10小时半衰期温度的80%,例如vazo-64在64摄氏温度下具有10小时分解半衰期。反应可以被允许进行至少30分钟。反应溶液可以由新的反应溶液替换并且被允许进行至少30分钟的额外持续时间。在实施例中,管的端部被密封产生至少5psi的内部背压。在另一个实施例中,反应溶液在环境压力下被连续再装满。然后,从管移除反应溶液,并且允许利用一束氮气干燥管。干燥之后,聚合混合物被注射到被激活的管的内腔中。在多孔单块介质80的聚合过程中,管的内表面上的激活连接点被合并成提取介质。
在一些实施例中,管82的内表面可以具有介质,应用该介质以进一步提高提取介质到管82的结合。管82的内表面可以涂有材料,该材料通过大致除去整体料介质80和管82的壁表面之间的间隙或者孔道而改善性能,其中间隙或者孔道的消除基本上防止样品流绕过整体料介质80。在一些实施例中,涂层包括形成整体料介质80和管82的内表面之间的障碍的无孔层,该涂层可以利用上述的“激活”处理成至少2个双结合的聚合乙烯系单体而被施加。例如,管82的表面可以包括在聚合反应之前经由引发剂激活的聚乙烯酮醚(peek)管。如上所述,可以使用乙腈或者丙腈溶剂和诸如vazo-64或者vazo-55(wakov-70)的偶氮基类别引发剂。激活出现在管82的表面和至少一个乙烯基基团之间,这使得单体锚定至表面。然后开始乙烯系单体的锚定交联的聚合,并且产生在表面上沉淀形成层的扩散聚合体。聚合层因为条件而形成,使得聚合体沉淀在表面上而不是在溶解状态中聚集以形成整体料结构。在本示例中,层的厚度至少部分地取决于激活溶液中的乙烯基交联的浓度。
那些本领域技术人员将认识到聚合条件可以根据结果而受到影响。在不同应用中,乙烯系单体可以在具有引发剂的溶剂中包含大约1%至大约50%浓度(体积)的范围浓度。如果使用太多的单元结构,结果可以包括横跨管直径的凝胶或者网状物的形成,而不是层的形成。在本示例中,该结果还可以取决于通道内径,其中较小通道需要较低浓度的乙烯系单体,用于成功聚合成适合的层。例如,具有大约1毫米的内径的通道可以允许从大约30%至大约40%的单体浓度,而大约0.50毫米的内径可以允许从大约10%至大约20%的单体浓度。此外,诸如聚合时间和温度的其它条件可以影响结果。
在说明的实施例中,管82利用如上所述的聚合体层激活,然后被混合物填充以形成连续的整体介质80。至少部分地由于空间位阻,仅用于聚合体层的乙烯系单体的双结合的一部分在聚合过程中合并,而双结合的其余部分在整体料介质80的成形处理过程中经由共聚作用合并到整体料介质80中。
当peek管用作示例性管时,也可以使用包括周期烯烃共聚物(“coc”)和诸如乙烯四氟乙烯(etfe)、氟化乙烯丙烯(fep)及其它荧光灯聚合体的荧光灯聚合体的其它类型的聚合物管。此外,可以使用熔融石英管,熔融石英管通过在熔融石英水解之后共价结合包含硅烷化试剂的丙烯酸盐或异丁烯酸而被激活。
管82可以具有大约0.1毫米至大约1毫米的范围的内径。在实施例中,管82的内径具有大约0.4毫米至大约0.6毫米的范围。在另一个实施例中,管的内径大约为0.5毫米。具有内部形成多孔介质的管82可以被切割成一定长度,当与管的内径相结合时,该长度的管提供用于多孔提取介质的适合的体积。在实施例中,具有多孔单块介质80的管82的长度被切割成具有大约6毫米至大约2毫米的范围的部分,而在可选实施例中,长度具有大约3毫米至大约5毫米的范围,或者大约为4毫米。当多孔提取介质聚合之后,可以利用诸如idexa-350管切割器将管切割成具有适合的长度。
在一些实施例中,多孔珠或者无孔珠可以结合在一起以通过二级修饰和/或通过利用粘合剂形成整体介质80,粘合剂可以例如包括胶乳配制、其中实例在美国第7,303,671号名称为“流动通过多孔整体料的离子交换结合颗粒”的专利中被说明,出于所有目的,其全部内容通过在此处被参考引用而合并于此。
在相同或者可选实施例中,多孔单块介质80可以通过在具有引发剂和气孔形成溶剂(成孔剂)的情况下聚合包括适合单体的混合物而制备。产生的多孔单块介质80具有小孔,小孔具有大约50nm至大约20,000nm的直径范围。多孔单块介质80可以具有大约50nm-200nm或者大约750-10000nm的范围的小孔。多孔单块介质80可以是聚合体小球,该聚合体小球具有从大约20nm至大约10,000nm的范围的直径。多孔单块介质80应该能够承受至少大约200巴的压力。
单体可以选自包含单体的乙烯基、包含单体的丙烯酸盐、包含单体的异丁烯酸、丙烯酰胺、聚烯烃、聚酯、聚氨基甲酸酯、聚酰胺、氟代乙烯及其组合。包含单体的乙烯基可以包括诸如一乙烯基代芳族单体和二乙烯基代芳族单体及其组合的乙烯基芳族单体。示例性乙烯基芳族单体包括二乙烯基苯、苯乙烯、诸如乙基苯乙烯的烷基代苯乙烯、α-甲基苯乙烯、烷基代α-甲基苯乙烯、诸如氯甲基苯乙烯的卤素代α-甲基苯乙烯、及其组合。烷基取代物可以包括高达18的碳原子。包含单体的丙烯酸盐包括单-、双-、和三-丙烯酸盐。异丁烯酸单体包括诸如甲基丙烯酸缩水甘油酯、二甲基丙烯酸乙酯、三甲醇基丙烷、异丁烯酸盐、甲基丙烯酸羟乙酯的单-、双-、和三-异丁烯酸。在实施例中,单体或者至少两个单体的混合物以大约10%vol.至大约60%vol.的量大致存在于聚合混合物中,而在可选实施例中,以大约20%vol.至大约70%vol.的量存在。
成孔剂可以选自多种不同类型的材料。例如,适合的液体成孔剂包括脂肪族烃、芳烃、酯、酒精、酮、能媒、可溶性聚合物的溶液、及其混合物。示例性成孔剂包括2,2,4-三甲基戊烷、具有1至12个碳原子的酒精、甲苯、醋酸丁酯、1,4,丁二醇、水、丙酮、己烷、环己烷、环己醇、四氢呋喃(thf)、及其组合。在实施例中,成孔剂以大约20%vol.至大约90%vol.的量存在于聚合混合物中,而在可选实施例中,以大约60%vol.至大约80%vol.的量存在。
引发剂可以包括热聚合引发剂、传统自由基引发聚合引发剂、光引发剂、和氧化还原引发剂。适合的引发剂的实例包括诸如oo-t形-戊基-o-(2乙基己基)一氧化二碳酸酯(monoperoxycarbonate)、过氧二碳酸二丙基酯、和过氧化苯甲酰、诸如偶氮二异丁腈(杜邦vazo-64)的偶氮化合物、2,2′偶氮二异丁腈(2-脒基丙烷)、二氢氯化物、和2,2′偶氮二异丁腈(异丁酰胺)二水合物、和过硫酸铵和四甲基乙二胺(tmeda)。在实施例中,引发剂以大约0.2%的单体重量至大约5%的单体重量的量存在于聚合混合物中,而在可选实施例中,以大约%1的单体重量至大约2%的单体重量的量存在。
聚合混合物的组分根据常规技术混合并被注射到管的内部以被允许聚合。例如,在实施例中,管被聚合混合物填充并被施加大约100psi的压力。由于引发剂在聚合过程中分解时会形成氮气,所以加压帮助防止聚合混合物中的气泡形成。在其它实施例中,管由聚合混合物填充,并且在允许进行聚合时密封管的两端。密封管的两端致使聚合进行时管内部中的压力增加,这防止氮气气泡的形成。在又一个实施例中,管由聚合混合物填充,而管的一个端部被密封且管的另一个端部打开并放入指管。填充的管在聚合步骤过程中受热。定位指管中的管的开口端在聚合过程中在混合物受热时允许液体膨胀,这防止由加热所引起的压力增加,该压力增加会对多孔单块介质的孔隙度产生不利影响。在使用光引发剂的实施例中,填充的管可以经历紫外线照射。多孔单块介质的实例及其制造方法在第7,922,908号美国专利中被说明,所述专利通过引用在此全文并入。
多孔单块介质还可以被功能化。例如,多孔单块介质80可以被制备其中环氧化环氧衍生物或者卤化物功能可以与胺或者硫化物起反应,从而产生例如阴离子交换介质,或者与例如羧酸、磷酸、磺酸起反应以产生阳离子交换介质。然后,这些组可以被进一步改变以允许蛋白质、缩氨酸或者免疫球蛋白的连接,从而产生亲合性离析和提取介质。环氧基团可以直接或者在转换成醛之后与蛋白质、缩氨酸或者免疫球蛋白反应。可能的其它亲合性介质包括固定化金属离子亲和层析(imac)状态和硼酸盐状态。
适合用作多孔单块介质80的示例性多孔材料和这种材料的制造方法在美国专利第5,334,310和5,633,290号中被说明,每个专利通过引用在此全文并入。
在可选实施例中,提取介质42可以包括多个多孔珠和/或无孔珠,诸如包含在提取介质部分16的空腔32中的玻璃、硅石、或者聚合珠。在该实施例中,空腔的入口端可以包括第一熔块,而空腔的出口端可以包括第二熔块。熔块具有防止珠从空腔漏出的功能。足够的珠被封装入空腔中以允许足够的流动速率,同时不会产生不良的背压。示例性珠在美国专利第6,783,672号中被说明,所述专利通过引用在此全文并入。
在使用过程中,在样品通过提取柱10之前,提取介质42被润湿溶剂润湿。在其中提取介质42包括多孔单块介质80的实施例中,多孔单块介质80被足够体积的润湿溶剂润湿,该润湿溶剂可以包括诸如乙腈(丙烯腈)的有机溶剂和诸如0.2%体积的蚁酸(fa)的含水组分。通常,使用大约10μl至大约100μl的润湿溶剂润湿多孔单块介质80。然后,多孔单块介质80通过平衡溶剂被平衡,该平衡溶剂可以包括水和大约0.2%体积的fa。通常,使用大约10μl至大约100μl的平衡溶剂平衡多孔单块介质80。然后,体积在10μl至100μl的范围内的包含诸如蛋白质的令人感兴趣的混合物的样本被迫使通过提取柱10中的多孔单块介质80。来自样品的流可以任选地被收集用于补充分析。接着,利用包括水和大约0.1%体积至大约0.2%体积的fa的洗液洗涤多孔单块介质80。通常,大约10μl大约大约100μl的洗液用于洗涤被收集在多孔单块介质80中的样品。然后利用洗脱溶液洗脱通过多孔单块介质80收集的混合物。洗脱溶液的内容和体积和洗脱时间可以基于适合的洗脱方式而改变。其中快速洗脱是适合的,洗脱溶液可以包括水、大约20%-60%体积范围内的有机混合物、和大约0.2%体积的fa;大约1μl至大约100μl的洗脱溶液用于洗脱来自多孔单块介质80的捕捉混合物。包括样品的液体溶液可以被快速推进通过提取介质42。提取介质42中结合的混合物快速出现,并且洗脱时间取决于适合的应用。常液洗脱或者利用快梯度的洗脱能够具有极快的表现,这可以用于其中适合高流通量的情况下的自动系统。当利用高分解质谱学组合时,能够利用快洗脱识别诸如蛋白质的混合物。这种方法是有用的,其中快速分析方法需要诸如微生物识别。当需要更详细的分析时,可以缓慢地执行洗脱,允许根据诸如分子量、电荷、疏水性相互作用、或者与提取柱10的组分相反应的其它亲合性类型的适合特征从提取柱10顺序洗脱出混合物。可以利用短(例如,大约5分钟)或者长(例如大约30分钟)洗脱梯度完成慢洗脱。例如,在实施例中,洗脱溶剂中的有机组分的百分比可以连续增加或者逐渐遍及整个梯度,以允许洗脱持续适当的时间。更长的洗脱持续时间能够分析单个目标混合物,例如微生物样品中的抗生素抗性标记或者来自活组织检查的癌症生物标记。对有效混合物离析应用梯度的可能性允许用户避免使用昂贵且耗时的分析柱。分析柱需要使用倍数时间的洗涤步骤以避免从一个样品转移至另一个样品。本提取柱10是可处理的并且使用户能够避免清洗步骤以及从一个样品转移至下一个样品。
洗脱的混合物可以被收集用于随后的分析,或者优选地,经由样品端口68(将在下方进行更详细地说明)直接通到分析系统中。洗脱样品直接通到分析系统中具有以下优势:提取柱10从样品迅速提取混合物的能力;以及提取柱10基于诸如分子量、电荷、疏水性相互作用、或者与柱的组分相反应的其它亲合性类型的适合特征色析法地洗脱混合物的能力。示例性分析系统是液相色谱(lc)系统。当提取柱10用于将混合物直接洗脱到lc系统中时,提取柱10必须能够承受lc系统中使用的高压。另外,lc系统中的液体流量可以非常低,因此空隙和无用容积需要最小化。本提取柱10的实施例通过将提取介质42定位在储存室26的密封表面和提取介质部分16的出口端60之间以及使密封表面和提取介质42之间的流体通路的体积最小化而实现空隙和无用容积最小化。利用这种结构,样品实质上从提取介质以最小的液体体积直接通到液相色谱系统的样品端口中。
参照3和5至6b,提取柱10可以被使用与样品端口68连接,作为样品分析系统的一部分。样品端口68具有被配置成密封地接合提取柱10的近端部分94和被配置成接合样品分析系统的部件的远端部分96。近端部分94包括被配置成容纳提取柱10的提取介质部分16的细长套筒55的第一腔室98。远端部分96具有被配置成容纳样品分析系统92的部件的第二腔室100。第一腔室98经由低容量流体通路104与第二腔室100流体连通。在实施例中,第一腔室98和第二腔室100之间的流体通路104具有大约0.5微升或更少的体积。
第一腔室98具有内表面106,内表面106与提取柱10的提取介质部分16的套筒的外表面66的大小和形状相对应。在实施例中,内表面106具有大致截头圆锥形形状。此外,第一腔室98具有密封表面108,在密封表面108的远端形成流体通路104。从样品端口68的近端110至密封表面108测量,第一腔室98具有深度d2。第一腔室98的深度d2小于提取介质部分16的细长套筒55的长度l1,使得当作用力(例如通过液体输送装置46施加到提取柱10的作用力)施加到提取柱10时,出口端60和细长套筒55的外表面66接合并与样品端日68的第一腔室98的内表面106和/或密封表面108形成密封。在实施例中,提取柱10和样品端口68之间形成的密封允许从提取柱10被传送至样品端口68的样品具有不超过大约10%的样品体积的渗漏。在另一个实施例中,液体输送装置46和提取柱10之间形成的密封允许在大约70巴至大约200巴范围内的压力下从提取柱10被传送至样品端口68的样品具有不超过大约10%的样品体积的渗漏。
样品端口68的近端部分94具有比提取柱10的套环18的开口末端70的内径更小的外径。因此当提取柱10定位在样品端口68上时,套环18将包围样品端口68的近端部分94的外表面112的至少一部分。近端部分94以一定距离从远端部分96突起,该距离防止对细长套筒55的出口端60和样品端口68的第一腔室98的内表面106和/或密封表面108之间形成的密封进行干扰。
样品端口68的远端部分96具有通常大于近端部分94的外径的外径。远端部分96的第二腔室100被配置成容纳样品分析系统的部件,即能够将洗脱的样品输送至分析装置。第二腔室100被配置成密封接合样品分析系统的部件。在实施例中,第二腔室100具有螺纹结构。在实施例中,容纳在第二腔室中的部件是能够将洗脱的样品输送至分析系统的管114。示例性分析系统包括液相色谱系统。
实例1
利用由形成在部分的peek管中的多孔单块介质所形成的提取介质微型柱制备提取柱。多孔单块介质由聚合混合物而制备,该聚合混合物包括混合物的37.5重量百分比的单体(55重量百分比的二乙烯基苯和45重量百分比的乙基乙烯基苯)、每单体重量的1.75重量百分比的引发剂(偶氮二异丁腈(杜邦vazo-64))、和混合物的62.5重量百分比的成孔剂。聚合混合物被注射到管的激活部分的内腔中,并允许在76摄氏温度下聚合18小时。
peek管道的内表面在聚合混合物注射之前被激活,使得多孔提取介质将在聚合过程中共价地结合至管的内表面。为了激活管的内表面,peek管由反应溶液填充,该反应溶液包含溶剂、乙腈或者丙腈(烷基腈衍生物)和具有1-10%浓度的诸如vazo-64或者vazo-55(wakov-70)偶氮基类别引发剂。然后,填充的peek管被加热到10小时半衰期温度的最少80%,例如vazo-55在55摄氏温度下具有10小时的分解半衰期。该反应允许进行30分钟。反应溶液被新的反应溶液替换并允许进行额外30分钟。反应溶液从管中被移除并且允许利用一束氮气干燥管。干燥之后,聚合混合物被注射到激活的管的内腔中。
在多孔提取介质被聚合之后,利用idexa-350管切割器将管切割成适合的长度。
使用具有0.75毫米、1毫米、0.5毫米、和0.4毫米的内径的peek管。多孔单块介质形成在管的内腔中,并且利用idexa-350管切割器将管切割成具有2毫米、4毫米、5毫米、或者6毫米的长度的部分以形成提取介质微型柱。提取介质微型柱被插入到柱本体的提取介质部分的空腔中,以形成具有表1中所示的尺寸的提取柱。具有表1中的提取介质微型柱2、3、和4的尺寸的提取柱利用细菌样品进行测试,如下所述。
通过提取大肠杆菌制备试验样品。该提取由包含50%体积的蚁酸(fa)和25%体积的乙腈(丙烯腈)的溶剂中的赖氨酸大肠杆菌制备。fa和acn浓度被调节至37.5%体积的丙烯腈和25%体积的蚁酸。该试验样品中的蛋白质浓度基于bca分析确定在2mg/ml和3mg/ml之间。试验样品被稀释,并且0.5μg或者1μg的蛋白质被应用于提取柱。
在将试验样品应用到提取柱之前,用具有0.2%体积的fa的50μl的acn润湿多孔单块介质。然后,用包含水和0.2%体积的fa的50μl的溶液平衡多孔单块介质。具有总量为0.5μg或者1μg的蛋白质的样品(体积在50μl至100μl的范围内)被推进通过提取柱中的多孔单块介质。来自样品的流被收集用于分析。利用50μl的包含水和0.1%体积的fa的溶液洗涤多孔单块介质。利用10μl的包含水、60%体积的丙烯腈、和0.2%体积的fa的溶液从多孔单块介质洗脱蛋白质样品。洗脱的蛋白质被收集用于分析。
流通(ft)的样品和洗脱的样品被分析用于蛋白质浓度。在一些结果中,多个样品(3-5)的洗脱物在被分析之前结合并被局部干燥至大约其原始体积的1/3,随后根据结合的结果计算每提取柱的蛋白质量。利用超微量生物bca检测法(赛默飞世尔科技)确定蛋白质浓度。利用与在ft和洗脱样品中使用的相同的fa和acn浓度制备牛血清清蛋白标准曲线。在表2中提供结果。
接着通过聚丙烯酰胺凝胶电泳分析流通和洗脱样品。在分析之前结合和干燥来自5种样品的流通和洗脱。样品在具有从4%至20%的梯度的凝胶上流动。然后对凝胶进行银着色并进行分析。结果(未示出)与蛋白质检验结果相一致。
实例2
包含蛋白质混合物(包括胰岛素、泛素、肌红蛋白、碳酸酐酶、和牛血清清蛋白)的样品在具有37.5%体积的丙烯腈和25%体积的蚁酸的溶液中被制备。样品中的总蛋白质为0.5μg。在提取柱上测试样品,该提取柱如实例1所述被制备,具有表1中第5号提取柱的尺寸。提取柱的多孔提取介质被润湿并被平衡,施加样品,并且提取柱中的多孔提取介质如实例1中所述的被洗涤。在初轮试验中,在监控提取末端内部的压力同时手动洗脱样品。可以观察到50μl的样品可以在短于15秒的时间内被推进通过提取柱,如图7所示,末端中产生的背压可以用于监控全部液体通过多孔提取介质时的瞬间。
然后使用自动样品器使液体通过提取柱。由液体传送探针施加的作用力测量以识别需要形成液体输送装置与提取柱之间的密封以及提取柱与样品端口到液相色谱系统之间的密封的作用力的量。具体涉及在液相色谱系统的高操作背压下在这些部件之间形成密封,该背压通常在大约70巴至大约200巴的范围内。可以观察到由液体传送探针施加到提取柱的30n的作用力足够在210巴的背压下形成部件之间的密封。
在另外的试验中,在洗脱步骤过程中,提取柱被插入到液相色谱系统的样品端口中,并利用包含50%体积的丙烯腈和0.2体积的蚁酸的水溶液以1.5μl/min的速率洗脱。图8a是从来自蛋白质混合物的洗脱的样品获得的色谱。图8b是从洗脱的蛋白质混合物获得的质谱。图9是从洗脱的胰岛素样品获得的色谱。图10是从洗脱的泛素样品获得的色谱。图11是从洗脱的肌红蛋白样品获得的色谱。图12是从洗脱的碳酸酐酶样品获得的色谱。
当已经通过说明书的一个或更多实施例说明本发明时,并且在非常详细地说明实施例时,这些不意谓限制或者以任何方式限制所附权利要求的保护范围成这种细节。对本领域的技术人员来说,其他优点和修改将是显而易见的。因此,本发明的较宽的方面不局限于具体细节、代表的设备和方法、和显示和说明的说明性实例。因此,可以在不背离常规发明构思的保护范围或者精神的情况下对这些细节进行改变。
实例3
图13提供显示通过层1305与管壁1310分离的整体料介质80的扫描电子显微镜图像的示例性实例。图13还显示了在其中材料交会的接口处合并到整体料介质80的元素中的无孔层1305。在图13的实例中,层1305被配置成使液体流转向返回到大多数介质80中而不是沿壁1310流动。
图14提供了通过在色谱反相高压液相层析应用中具有涂层和不具有该涂层而获得的结果的相对比的示例性实例。顶部记录线显示了在不适用聚合体层的情况下由制备在peek管中获得的整体料介质80的结果。降低的峰值不对称性显示出在分析物堵塞之前洗脱分析物流体的一部分。这在分析物流体的一部分被允许通过较小阻力通路(例如通过壁流)绕过整体料介质80时产生。底部记录线显示缺少了前端指示全部分析物流体通过大部分整体料介质80的峰值。
分离条件:
流动相a:95/5水/乙腈(v/v)中的0.1%的三氟乙酰丙酮
流动相b:95/5乙腈/水(v/v)中的0.08%的三氟乙酰丙酮
梯度:9分钟内1%至99%b,3分钟内99%b
流动速率:0.20ml/min温度:30℃
检测:紫外线214nm
注射量:1.0μl
- 还没有人留言评论。精彩留言会获得点赞!