一种加速细胞沉降的显微成像装置的制作方法
1.本实用新型涉及显微成像技术领域,尤其涉及一种加速细胞沉降的显微成像装置。
背景技术:
2.显微成像装置是一种用于对微生物组织进行光学放大,通过图像采集芯片的感光区域观测和记录,来实现液基细胞样品的检测及进行形态分析。传统的光学显微镜受制于视野和分辨率之间的矛盾,即将微生物组织的放大的倍数越大,能够看到更细微的微生物组织图像,但是同时所能观测到视野范围也会缩小。
3.在现有技术中的显微成像装置中,大多采用了计数池的结构,例如中国专利cn201520807546.8公开了一种显微镜,包括显微镜平台、计数池平台组件,计数池平台组件上设有计数池及连通计数池的输液管,显微镜平台上固定有框架,计数池平台组件位于框架内并被压持在显微镜平台上。该专利就是在传统光学显微镜的基础上,在物镜下方设置一个计数池,以此代替传统的手工制作玻片和涂片。但是这套方法只是解决了制片复杂和质量不稳定的问题,还是依赖于传统的光学显微镜的观测,无法实现全视野的显微观测,在限定的检测时间范围内只能选取部分视野进行抽样观测和分析,从而使得检测分析的精确度下降;同时,传统的光学显微镜的体积较大,价格也十分昂贵。此外,中国专利cn201811030915.1公开了一种明场和荧光双模态的显微成像系统,其采用图像传感器芯片采集待检测样品的图像。显微成像系统包括图像传感器芯片和微流腔室,微流腔室的底部没有直接与图像传感器芯片接触,而是在图像传感器芯片和微流腔室之间设置了滤光片,图像传感器芯片在采集图像的过程中,可能会发生光的折射,从而影响图像采集的质量。
4.在图像传感器芯片采集细胞图像之前,需要将注入微流腔室中的细胞静置,使得细胞自然沉降到一个稳定的高度,便于对焦。但是不同大小的细胞最终稳定在液体中的高度稍有差异,而且等待细胞悬液在微流腔室中自然沉降的时间很长,而且即使稳定后也仍然有很多细胞所处的高度有差异。因此,现需一种具有加速细胞沉降功能的显微成像装置来减少细胞沉降的时间,以便于图像传感器芯片快速采集到清晰的显微图像。
技术实现要素:
5.针对现有技术中存在的上述问题,现提供一种加速细胞沉降的显微成像装置。
6.具体技术方案如下:
7.本实用新型包括一种加速细胞沉降的显微成像装置,包括:一图像采集芯片,所述图像采集芯片包括一感光区域,用于采集一液基细胞样品的图像信息;至少一个微流腔室,设置于所述感光区域上,且所述微流腔室的下表面与所述感光区域的上表面贴合,所述微流腔室的下表面为透明状,所述微流腔室用于装载所述液基细胞样品;
8.每个所述微流腔室包括:
9.一中空腔体;
10.两个通孔,两个所述通孔对称设置于所述微流腔室的两侧,并分别与所述中空腔体的两端连通,两个所述通孔的位置高于所述微流腔室的下表面,分别用于输入和输出所述液基细胞样品;
11.所述显微成像装置还包括:
12.两片导电薄膜,分别覆盖于所述微流腔室的上表面和下表面,两片所述导电薄膜呈透明状,且两片所述导电薄膜的极性相反,在两片所述导电薄膜形成的电场作用下加速所述液基细胞样品中的细胞沉降至所述微流腔室的底部。
13.优选的,所述显微成像装置包括多个所述微流腔室,两片所述导电薄膜包括:
14.第一导电薄膜,所述第一导电薄膜包括多片第一导电子薄膜,每片所述第一导电子薄膜分别覆盖于对应的一个所述微流腔室的上表面;
15.第二导电薄膜,所述第二导电薄膜包括多片第二导电子薄膜,每片所述第二导电子薄膜分别覆盖于对应的一个所述微流腔室的下表面。
16.优选的,当所述微流腔室内注入的所述液基细胞样品带负电荷时,所述第一导电薄膜的极性为负极,所述第二导电薄膜的极性为正极;
17.当所述微流腔室内注入的所述液基细胞样品带正电荷时,所述第一导电薄膜的极性为正极,所述第二导电薄膜的极性为负极。
18.优选的,当所述微流腔室内的所述液基细胞样品带负电荷时,对应的所述第一导电薄膜的极性为负极,对应的所述第二导电薄膜的极性为正极;
19.当所述微流腔室的所述液基细胞样品带正电荷时,对应的所述第一导电薄膜的极性为正极,对应的所述第二导电薄膜的极性为负极。
20.优选的,所述导电薄膜的材料为掺锡氧化铟或铝掺杂氧化锌。
21.优选的,包括一载物平台,所述载物平台的上表面具有一凹陷部,所述感光区域设置于所述凹陷部。
22.优选的,所述微流腔室朝向所述感光区域的一面具有一突出部,所述突出部的底部与所述凹陷部的尺寸适配,以使所述突出部卡嵌于所述凹陷部内,且所述突出部的下表面与所述感光区域贴合。
23.优选的,所述突出部为倒梯形。
24.优选的,两个所述通孔分别高于所述突出部的上表面。
25.优选的,所述中空腔体的厚度为50~200μm。
26.优选的,所述微流腔室的整体呈透明状。
27.优选的,所述突出部的顶角的角度为90~180
°
。
28.优选的,所述突出部的厚度不小于200μm。
29.优选的,所述中空腔体的形状为椭圆形或圆形或矩形或圆角平行四边形。
30.优选的,所述微流腔室采用透明玻璃或透明的有机聚合物制成。
31.优选的,所述液基细胞样品先经荧光素酶基因标记,再与荧光素底物混合后进入所述微流腔室。
32.优选的,所述显微成像装置的上方设有一led灯。
33.优选的,所述显微成像装置还包括一遮光罩,与所述led灯适配,并且所述遮光罩的尺寸与所述微流腔室的尺寸适配,以使所述遮光罩能够包裹所述微流腔室。
34.优选的,所述图像采集芯片的感光区域包括探测器阵列,所述探测器阵列包括复数个探测器单元,且所述探测器单元的数量不小于1千万。
35.优选的,每个所述探测器单元的尺寸不大于1μm。
36.优选的,所述图像采集芯片的感光区域包括复数个引脚,所述引脚分别从所述凹陷部的两侧引出。
37.优选的,所述显微成像装置还包括一图像处理器,所述感光区域通过复数个所述引脚与所述图像处理器的输入端连接,所述图像处理器用于对采集的所述图像信息进行处理。
38.优选的,其特征在于,所述显微成像装置还包括一显示器,所述显示器的输入端与所述图像处理器的输出端连接,用于显示处理后的所述图像信息。
39.优选的,所述显微成像装置包括两个所述微流腔室,两个所述微流腔室并列设置于所述载物平台的所述凹陷部。
40.本实用新型技术方案的有益效果在于:采用本实用新型实施例中的显微成像装置,使得微流腔室的下表面贴合图像采集芯片的感光区域,缩短了感光区域与液基细胞样品之间的距离,使得感光区域更贴近液基细胞样品,从而提高了显微图像的质量;此外,由于在微流腔室的上下表面设置了极性相反的电极薄膜,在液基细胞样品注入到微流腔室后,两片电极薄膜形成的单向电场加速细胞沉降的速度,以解决自然沉降导致沉降时间久的技术问题,并可将细胞全部推至微流腔室的底部;此外,导电薄膜为透明的导电材料,也不会影响光线的传输,可以与现有的显微成像装置兼容。
附图说明
41.参考所附附图,以更加充分地描述本实用新型的实施例。然而,所附附图仅用于说明和阐述,并不构成对本实用新型范围的限制。
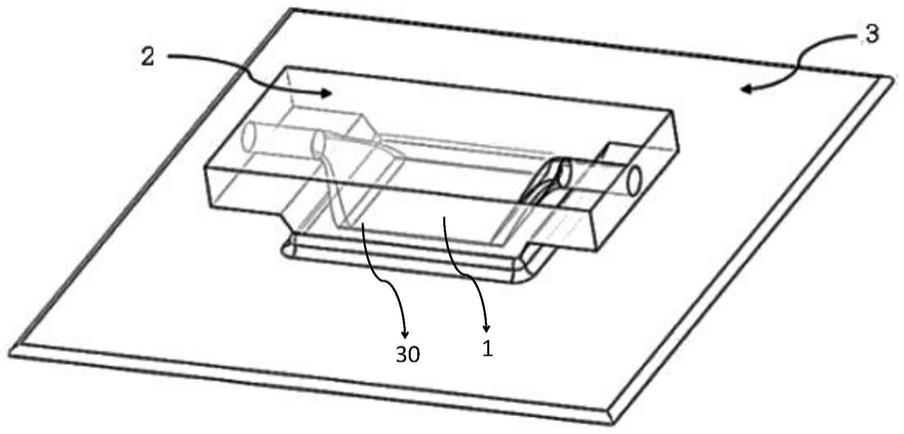
42.图1为本实用新型实施例中的显微成像装置的整体结构示意图;
43.图2为现有技术中的图像采集芯片的感光区域的引脚封装的结构示意图;
44.图3为本实用新型实施例中的图像采集芯片的感光区域的引脚封装的结构示意图;
45.图4为本实用新型实施例中的微流腔室于第一观测角度的结构示意图;
46.图5为本实用新型实施例中的微流腔室于第二观测角度的结构示意图;
47.图6为本实用新型实施例中的微流腔室的侧视图;
48.图7为本实用新型实施例中的微流腔室的俯视图;
49.图8为本实用新型实施例中的图像采集芯片的感光区域的探测器阵列的结构示意图;
50.图9为本实用新型实施例中的半浮栅晶体管的结构示意图;
51.图10为本实用新型实施例中的复合介质栅光敏探测器的结构示意图;
52.图11为本实用新型实施例中基于复合介质栅的双器件光敏探测单元的第一类结构;
53.图12为本实用新型实施例中基于复合介质栅的双器件光敏探测单元的第二类结构;
54.图13为本实用新型实施例中基于复合介质栅的双器件光敏探测单元的第三类结构;
55.图14为本实用新型实施例中基于复合介质栅的双器件光敏探测单元的第四类结构;
56.图15为本实用新型实施例中的分裂栅型mosfet成像探测器的结构示意图;
57.图16为本实用新型实施例中的具有两个微流腔室的显微成像装置的结构示意图;
58.图17为利用本实用新型实施例中的显微成像装置采集到的人体血液样本稀释液的显微成像结果。
具体实施方式
59.下面将结合本实用新型实施例中的附图,对本实用新型实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本实用新型一部分实施例,而不是全部的实施例。基于本实用新型中的实施例,本领域普通技术人员在没有作出创造性劳动的前提下所获得的所有其他实施例,都属于本实用新型保护的范围。
60.需要说明的是,在不冲突的情况下,本实用新型中的实施例及实施例中的特征可以相互组合。
61.下面结合附图和具体实施例对本实用新型作进一步说明,但不作为本实用新型的限定。
62.实施例一
63.本实用新型第一实施例提供一种加速细胞沉降的显微成像装置,如图1所示,包括:
64.一图像采集芯片,图像采集芯片包括感光区域1,用于采集一液基细胞样品的图像信息;
65.至少一个微流腔室2,设置于感光区域1上,且微流腔室2的下表面与感光区域1的上表面贴合,微流腔室2的下表面为透明状,微流腔室2用于装载液基细胞样品;
66.每个微流腔室2包括:
67.一中空腔体20;
68.两个通孔21,两个通孔对称设置于微流腔室2的两侧,并分别与中空腔体20的两端连通,两个通孔21的位置高于微流腔室2的下表面,分别用于输入和输出液基细胞样品。
69.显微成像装置还包括:
70.两片导电薄膜(图3所示201、202),分别覆盖于微流腔室2的上表面和下表面,两片导电薄膜呈透明状,且两片导电薄膜的极性相反,在两片导电薄膜形成的电场作用下加速液基细胞样品中的细胞沉降至微流腔室2的底部。
71.具体地,在本实施例中,如图1所示,显微成像装置包括一个图像采集芯片和一个微流腔室2,微流腔室2的下表面与图像采集芯片的感光区域1的上表面完全贴合,并且微流腔室2的下表面与图像采集芯片的感光区域1的形状及尺寸适配,微流腔室2的底部呈完全透明的状态,使得微流腔室2底部的液基细胞样品能够完全暴露于图像采集芯片的感光区域1的采集范围内,从而实现全视野的显微观测和分析,同时,由于微流腔室2的下表面与图像采集芯片的感光区域1的上表面完全贴合,缩短了两者之间的距离,减少光线折射对成像
结果的影响,有效地提升了采集图像的质量。
72.具体地,微流腔室2包括两个通孔21,其中第一通孔21a用于注入液基细胞样品,在完成对液基细胞样品的图像采集及分析后,再通过另一侧的第二通孔21b将液基细胞样品从微流腔室2内输出。此外,由于通孔21与图像采集芯片的感光区域1平行设置,在对微流腔室2进行清洗时,也可以通过其中一侧的通孔输入清洗液,再通过另一侧的通孔将清洗液排放出,有利于清洗液的排放。通过在微流腔室2的两侧设置通孔可以使得微流腔室可以反复多次使用。
73.具体地,在本实施例中,显微成像装置包括至少一个用于液基细胞样品流通的微流腔室2,由于两片导电薄膜的极性相反,在两片导电薄膜之间的区域内形成单向电场,微流腔室2位于单向电场内,在向微流腔室2注入细胞样品后,细胞在电场的作用下,被推至微流腔室2的底部,相比自然沉降,可以有效地减少沉降时间。
74.需要说明的是,导电薄膜的设置位置与细胞自带电荷的极性相关。细胞通常自带负电荷,因此,在微流腔室2的上表面设置极性为负极的导电薄膜,在微流腔室2的下表面设置极性为正极的导电薄膜,液基细胞样品在注入到微流腔室2后,会朝向极性为正极的导电薄膜加速运动,从而提升细胞沉降的速度。同理,如果细胞自带正电荷,则可以在微流腔室2的上表面设置极性为正极的导电薄膜,在微流腔室2的下表面设置极性为负极的导电薄膜,从而迫使细胞被推至微流腔室的底部,以解决细胞不沉降或沉降速度慢的问题。
75.在一种较优的实施例中,两片导电薄膜包括:
76.第一导电薄膜,第一导电薄膜包括多片第一导电子薄膜,每片第一导电子薄膜分别覆盖于对应的一个微流腔室的上表面;
77.第二导电薄膜,第二导电薄膜包括多片第二导电子薄膜,每片第二导电子薄膜分别覆盖于对应的一个微流腔室的下表面。
78.具体地,通常显微成像装置上设有多个微流腔室,本实施例优选针对每个微流腔室所对应的区域设置导电薄膜,微流腔室的上表面可以多片导电子薄膜,相比覆盖一整片导电薄膜,可减少导电薄膜的覆盖面积,节省原材料。
79.在一种较优的实施例中,导电薄膜的材料为掺锡氧化铟(indiumtin oxide),一般简称为ito。需要说明的是,选用ito材料仅为本实用新型较优的实施例,本实用新型并不限定导电薄膜的材料,也可以选用其他透明的可导电材料,例如铝掺杂氧化锌(aluminum doped zinc oxid,简称azo)等透明材料,采用透明材料不会影响光线的传输,避免影响显微图像的质量。
80.作为优选的实施方式,如图1所示,显微成像装置包括一载物平台3,载物平台3的上表面具有一凹陷部30,感光区域1设置于凹陷部30;
81.微流腔室2朝向图像采集芯片的感光区域1的一面具有一突出部22,突出部22的底部与凹陷部30的尺寸适配,以使突出部22卡嵌于凹陷部30内,且突出部22的下表面与图像采集芯片的感光区域1贴合。
82.具体地,在本实施例中,如图1所示,载物平台3的上表面具有凹陷部30,图像采集芯片的感光区域1设置于凹陷部30,凹陷部30的形状和尺寸与感光区域1匹配。如图6和图7所示,凹槽部30的四周用于封装图像采集芯片的感光区域1的引脚。需要说明的是,载物平台3为一整块图像采集芯片,由于图像采集芯片在封装时,需要使用封装胶将管壳封装固定
于图像采集芯片的外围区域,这样的封装方式使得图像采集芯片的外围区域凸起,从而形成了这样的一个凹陷部30。图像采集芯片的感光区域位于凹陷部30,从而造成现有技术中微流腔室的底部无法直接与感光区域接触的问题。
83.具体地,如图4和5所示,本实施例中的微流腔室2具有突出部22,突出部22呈倒梯形状,突出部22的形状和尺寸也和图像采集芯片的感光区域1适配,使得突出部22卡嵌于凹陷部30内,从而使得突出部22的下表面与图像采集芯片的感光区域1的上表面贴合,从而缩短两者之间的距离,提高成像质量。
84.需要说明的是,在本实施例中,可以将突出部22的底部设计为透明状,也可以将微流腔室2设计为完全透明状,透明部位可采用透明玻璃或透明的有机聚合物制成。
85.作为优选的实施方式,微流腔室的厚度不小于1mm,本实施例中优选为5mm;
86.中空腔体20的厚度为50~200μm,本实施例中优选为120μm;
87.突出部22的厚度不小于200μm,本实施例中优选为350μm;
88.突出部22的顶角的角度为90
°
~180
°
之间,本实施例中优选为120
°
。
89.作为优选的实施方式,如图8所示,图像采集芯片的感光区域1包括复数个探测器单元10组成的探测器阵列,探测器单元10的数量不小于1千万,每个探测器单元10的尺寸不大于1μm。
90.具体地,图像采集芯片的感光区域的单个探测器单元的尺寸优选为0.9μm,探测器单元的数量优选为1.4千万,用以保证液基细胞样品显微成像时的全视野和高分辨率。
91.作为优选的实施方式,探测器单元10可以采用半浮栅晶体管或复合介质栅光敏探测器或基于复合介质栅的双器件光敏探测单元或分裂栅型mosfet成像探测器;
92.具体地,当探测器单元采用半浮栅晶体管时,可以采用文献(wang p,lin x,liu l,et al.a semi
‑
floating gate transistor for low
‑
voltage ultrafast memory and sensing operation.[j].science(new york,n.y.),2013,341(6146):640
‑
643.)中公开的半浮栅晶体管结构,也可以采用中国专利cn201410201614.6的半浮栅晶体管结构,其包括p型的半导体衬底,半导体衬底中通过离子注入形成n+型源极,通过两步离子注入形成大的n+型漏极。如图9所示,半导体衬底上方依次设有底层介质、半浮栅、顶层介质以及控制栅,底层介质层覆盖于p型衬底的上表面,并设置于源极和漏极之间,半浮栅层覆盖于底层介质层的上表面,并且底层介质层的中间位置通过刻蚀形成一个凹槽,使得半浮栅层与漏极直接接触。传统的浮栅晶体管的擦写操作是通过外加高电压来控制电子隧穿过绝缘介质层,而半浮栅晶体管采用了硅体内tfet的量子隧穿效应以及采用pn结二极管来替代传统的氧化硅数据擦写窗口。
[0093]
具体地,当探测器单元10采用复合介质栅光敏探测器时,可以采用中国专利cn200910024504.6公开的光敏复合介质栅mosfet探测器。如图10所示,该光敏探测器包括一个p型半导体衬底,半导体衬底的正上方依次设有底层介质层、电荷存储层、顶层介质层以及控制栅层,半导体衬底中通过离子注入掺杂形成n型源极和漏极,并且源极和漏极分别设置于底层介质层的两侧。通过在控制栅施加一个大于阈值电压的栅极电压,源极和漏极之间电压差为0,p型衬底和源端设置一个大的电压差在衬底上产生相对宽的耗尽区,这样衬底中产生的冷的电子在耗尽区中电场的作用下向着栅极方向加速获得能量,当这个能量大于衬底和底层介质层之间的势垒时,电子直接越过这个势垒进入到底层介质层,并且在
底层介质层电场的作用下以很高的速度向着栅极方向运动,产生栅极的注入电流。
[0094]
具体地,当探测器单元采用基于复合介质栅的双器件光敏探测单元时,具体可以采用中国专利cn201610592997.3公开的基于复合介质栅的双器件光敏探测单元,如图13和图14所示,双器件光敏探测单元包括感光控制栅和读取控制栅,分别具有感光功能和读取信息功能。该双器件光敏探测单元包括复合介质栅mos
‑
c和复合介质栅mosfet两个部分,且这两个部分形成于同一p型半导体衬底的上方,复合介质栅mos
‑
c部分用于感光,复合介质栅mosfet部分用于读取信息。如图11所示,复合介质栅mos
‑
c部分包括在p型半导体衬底上方依次叠设的电荷耦合层、顶层介质层和控制栅,其中,在p型半导体衬底中设有n型注入层;如图12所示,n型注入层设置于电荷耦合层的下方,并与电荷耦合层接触,复合介质栅mosfet部分包括在p型半导体衬底上方依次叠设的底层介质层、电荷耦合层、顶层介质层和控制栅,在底层介质层的下方的衬底内设有阈值调节注入区;p型半导体衬底中,n型注入层与n型源极区、n型漏极区之间通过设置浅槽隔离区和p+型注入区隔开。在双器件光敏探测单元工作时,控制栅施加0偏压,衬底加负偏压脉冲,在衬底中形成耗尽层,当光入射到耗尽层中光子被半导体吸收时,产生光电子,光电子在栅极电压的驱使下移动到衬底和栅氧界面处,在该界面处聚集,使得读取晶体管阈值电压变化,以此表征光电子数目,将光信号转化成可量化的电信号。
[0095]
具体地,探测器单元还可以采用分裂栅型mosfet成像探测器,例如中国专利cn201210349285.0公开的分裂栅型mosfet成像探测器。如图15所示,该成像探测器的结构包括一个p型的半导体衬底,衬底上方分别设有两层绝缘介质材料和控制栅,底层介质层和顶层介质层之间设有电荷存储层。控制栅或衬底至少有一处设有透明或半透明的窗口,以使探测器探测波长范围内的光线。控制栅的两侧分别设有一个选择栅,选择栅与衬底之间设有一底层介质层,选择栅底部的绝缘介质层材料和厚度与控制栅底部的底层介质层相同。两个选择栅所控制的衬底的外围p型衬底上设有n型半导体区,构成分裂栅mosfet的源极和漏极。两个选择栅设在控制栅的两侧,且选择栅、控制栅和电荷存储层之间用绝缘介质材料隔开,且将控制栅所控制的衬底与成像探测器的源极和漏极隔开。与控制栅接触的顶层介质层是阻止电荷存储层中存储的电荷流失到控制栅的材料,与衬底p型半导体材料接触的底层介质层可以有效地隔离控制栅控制下的衬底沟道与电荷存储层,在栅极电压足够高或入射光子能量较高时,把沟道中的电子扫入电荷存储层。在控制栅上施加正偏压脉冲,在衬底上加负偏压脉冲,同时在两个选择栅上加一个负偏压脉冲,这样在控制栅控制下的衬底中形成一个耗尽层,当光入射到耗尽层中光子被半导体吸收时,就会产生光电子,光电子在栅极电压的驱使下移动到沟道和底层介质层的界面处。由于两个选择栅施加了一个负偏压,这样就在选择栅控制的衬底中形成了一个高电子势垒,这个高电子势垒将控制栅控制下的衬底与n型源极和漏极有效地隔离开,保证了衬底耗尽层中收集的光电子不会向源极和漏极方向流失,同时源极和漏极中的电子也受到这个高势垒的阻碍不得进入衬底耗尽层中。当控制栅所施加正偏压足够大时,衬底耗尽层中收集的光电子将通过f
‑
n隧穿的方式进入电荷存储层;如果入射光子能量足够高,大于半导体与底层介质层的禁带宽度,光电子将可以通过直接隧穿的方式进入电荷存储层。在搜集光电子阶段,源极和漏极可以适当施加大小合适的正偏压,或者直接浮空。
[0096]
作为优选的实施方式,显微成像装置还包括:
[0097]
一led灯,设置于显微成像装置上;
[0098]
一图像处理器,图像采集芯片的感光区域通过复数个引脚与图像处理器的输入端连接,图像处理器用于对采集的图像信息进行处理;
[0099]
一显示器,显示器的输入端与图像处理器的输出端连接,用于显示处理后的图像信息。
[0100]
具体地,在本实施例中,在进行明场拍照时,需要使用led灯提高液基细胞样品所处环境的亮度,光源照射到液基细胞样品后产生投影并被感光区域记录下来,以使图像采集芯片的感光区域采集到的显微图像更为清晰。
[0101]
需要说明的是,当仅仅微流腔室的下表面呈透明状时,led灯设置于微流腔室的内部,以使led灯产生的光线能够照射到液基细胞样品上;当微流腔室整体呈完全透明状时,led灯设置于微流腔室的上方,led灯产生的光线透过微流腔室照射到液基细胞样品上。
[0102]
作为优选的实施方式,显微成像装置还包括:
[0103]
一led灯,设置于显微成像装置上;
[0104]
一遮光罩,与led灯的尺寸适配,同时遮光罩的尺寸与微流腔室的尺寸适配,以使遮光罩能够包裹微流腔室;
[0105]
一图像处理器,图像采集芯片的感光区域通过多个引脚与图像处理器的输入端连接,图像处理器用于对采集的显微图像数据进行处理;
[0106]
一显示器,显示器的输入端与图像处理器的输出端连接,用于显示处理后的图像数据。
[0107]
具体地,显微成像装置可以支持明场拍摄和暗场拍摄两种采集方式。在进行暗场拍照时,无需使用led灯。在将液基细胞样品注入微流腔室之前,可以先使用荧光素酶基因对其进行标记,再将标记后的液基细胞样品与荧光素底物混合后注入微流腔室。遮光罩包裹整个微流腔室,使得微流腔室处于完全黑暗的环境下,其目的在于使用液基细胞样品自发的荧光的成像。遮光罩材料可以优选为不透光的塑料或不透光的金属或不透光的其他高分子材料等。图像处理器用于对显微图像进行降噪等优化处理,从而提升成像效果;显示器用于接收图像处理器处理后的图像数据,并显示最终的显微成像结果,如图17所示,检测人员可以根据显示器的显示出的成像结果,对显微图像的尺寸、显示方式等参数进行调整,便于检测人员对液基细胞样品进行进一步的观测和分析。本实施例中的图像处理器或显示器还可以设置一个图像存储器,用于建立图像数据库,储存经过图像处理器之后的图像数据和分析结果。
[0108]
实施例二
[0109]
本实用新型第二实施例提供一种液基细胞样品的显微成像装置,如图1所示,包括:
[0110]
一图像采集芯片的感光区域1,用于采集一液基细胞样品的图像信息;
[0111]
至少一个微流腔室2,设置于图像采集芯片的感光区域1上,且微流腔室2的下表面与图像采集芯片的感光区域1的上表面贴合,微流腔室2的下表面为透明状,微流腔室2用于装载液基细胞样品;
[0112]
每个微流腔室2包括:
[0113]
一中空腔体20;
[0114]
两个通孔21,两个通孔对称设置于微流腔室2的两侧,并分别与中空腔体20的两端连通,两个通孔21的位置高于微流腔室2的下表面,分别用于输入和输出液基细胞样品;
[0115]
一载物平台3,载物平台3的上表面具有一凹陷部30,图像采集芯片的感光区域1设置于凹陷部30;
[0116]
微流腔室2朝向图像采集芯片的感光区域1的一面具有一突出部22,突出部22的底部与凹陷部30的尺寸适配,以使突出部22卡嵌于凹陷部30内,且突出部22的下表面与图像采集芯片的感光区域1贴合;
[0117]
如图3所示,图像采集芯片的感光区域1包括复数个引脚11,引脚11分别从凹陷部30的两侧引出。
[0118]
具体地,图像采集芯片的感光区域1’包括复数个引脚11’,用于连接图像处理器等外部设备,如图2所示,在现有技术中,图像采集芯片的感光区域1’的引脚11’从图像采集芯片的感光区域1’的两侧引出,在对引脚进行封装后,封装后的引脚的上表面与图2所示的微流腔室2’的下表面齐平,导致微流腔室2’与图像采集芯片的感光区域1’之间具有一定的间隙,从而导致采集的显微图像的质量较差。
[0119]
进一步地,针对上述技术问题,本实施例中提出了一种新型的引脚封装结构,如图4所示,由于本实施例中的微流腔室2具有突出部22,且突出部22呈倒梯形状,使得突出部22的两侧保留一定的空间,可以将引脚11从两侧的空间引出,在后续对引脚11进行封装后,即使封装后的引脚与微流腔室2’的下表面齐平也不会对图像采集造成影响。此外,突出部22的底部设有第二导电薄膜202,与微流腔室2的上表面的第一导电薄膜201的极性相反,第一导电薄膜201和第二导电薄膜202之间形成的单向电场使得注入微流腔室2内的液基细胞样品中的细胞加速沉降。
[0120]
实施例三
[0121]
本实用新型第三实施例提供一种液基细胞样品的显微成像装置,如图16所示,包括:
[0122]
一图像采集芯片的感光区域1,用于采集一液基细胞样品的图像信息;
[0123]
两个微流腔室2,设置于感光区域1上,且每个微流腔室2的下表面与感光区域1的上表面贴合,微流腔室2的下表面为透明状,微流腔室2用于装载液基细胞样品;
[0124]
每个微流腔室2包括:
[0125]
一中空腔体20;
[0126]
两个通孔21,两个通孔对称设置于微流腔室2的两侧,并分别与中空腔体20的两端连通,两个通孔21的位置高于微流腔室2的下表面,分别用于输入和输出液基细胞样品;
[0127]
一载物平台3,载物平台3的上表面具有一凹陷部30,图像采集芯片的感光区域1设置于凹陷部30;
[0128]
微流腔室2朝向图像采集芯片的感光区域1的一面具有一突出部22,突出部22的底部与凹陷部30的尺寸适配,以使突出部22卡嵌于凹陷部30内,且突出部22的下表面与图像采集芯片的感光区域1贴合;
[0129]
两个微流腔室2并列设置于载物平台3的凹陷部30。
[0130]
具体地,如图16所示,两个微流腔室2并列设置,可以采用一个图像采集芯片的感光区域1同时对两个微流腔室2内的液基细胞样品进行检测;也可以在凹陷部30底部设置两
块图像采集芯片的感光区域1,分别对两个微流腔室2内的液基细胞样品进行检测。
[0131]
需要说明的是,本实施例中设置两个并列的微流腔室2仅为一种较优的实施例,还可以根据实际需要设置数量更多的微流腔室和/或设置更多的图像采集芯片的感光区域1,微流腔室2和图像采集芯片的感光区域1的数量并不能作为对本实用新型的限定。
[0132]
本实用新型技术方案的有益效果在于:采用本实用新型实施例中的显微成像装置,使得微流腔室的下表面贴合图像采集芯片的感光区域,缩短了感光区域与液基细胞样品之间的距离,使得感光区域更贴近液基细胞样品,从而提高了显微图像的质量;此外,由于在微流腔室的上下表面设置了极性相反的电极薄膜,在液基细胞样品注入到微流腔室后,两片电极薄膜形成的单向电场加速细胞沉降的速度,以解决自然沉降导致沉降时间久的技术问题,并可将细胞全部推至微流腔室的底部;此外,导电薄膜为透明的导电材料,也不会影响光线的传输,可以与现有的显微成像装置兼容。
[0133]
以上所述仅为本实用新型较佳的实施例,并非因此限制本实用新型的实施方式及保护范围,对于本领域技术人员而言,应当能够意识到凡运用本实用新型说明书及图示内容所作出的等同替换和显而易见的变化所得到的方案,均应当包含在本实用新型的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1