确定含气相组分化学反应临界时刻及热力状态参数的方法
1.本公开属于检测分析技术领域,具体涉及一种确定含气相组分化学反应临界时刻及热力状态参数的方法。
背景技术:
2.反应过程临界时刻与状态(起始点或者终止点),涉及众多学科和领域,如药物、含能材料、电池材料等样品性能研究,对催化反应、脱附吸附、燃烧、氧化、还原等反应过程的热力学/动力学解析均具有重要意义,对于反应过程的机理解析和动力学研究,准确获得反应过程的临界点与临界状态均很重要。
3.目前反应过程临界时刻与状态检测分析方法是检测反应过程中物质的质量或能量的动态变化,如热分析检测固液相物质质量总和随温度变化,即热重曲线(tg),而tg曲线的微分曲线(dtg)则间接表示了气相、固液相物质总和的变化速率;而热分析中能量变化用差示扫描量热(dsc) 或差热(dta)表示。获得上述动态曲线后,采用国际标准iso 11357-1 规定的切线法(也可称为外推法),通过数学推导得到临界时刻与状态。其它类型的反应过程参照上述方法执行。
4.上述检测分析方法的存在以下问题:
5.以物质总体变化为研究对象,根本未区分特定反应过程的特征。由于以物质的质量与能量动态变化为总体标量,但物质的质量与能量动态变化与反应过程并不完全代表单一反应,其变化往往是多重反应的结果。反之,一种物质可能同时参与多种反应过程。而物质质量与能量变化是标量参数,并不能区分多种反应过程,所以简单地以物质质量与能量动态变化为对象并不能客观体现待分析反应过程的固有特征,如该反应的化学计量关系。
6.切线法获得的结果不具有反应过程在起始与终止点处的临界特征物理内涵,存在原理性失真与极大人为误差。根据国际标准iso 11357-1规定的方法——切线法,解析反应过程临界时刻或状态的数学处理内涵是:在某点基于泰勒级数展开,忽略二阶及二阶以上的展开项,形成一阶的切线,由切线与基线的交叉点确定临界时刻与状态。此数学处理过程一方面造成切线法本身就存在固有的高阶误差,另一方面其获得的值也不具备真实的临界物理内涵,导致原理性的失真。
技术实现要素:
7.有鉴于此,本公开提供一种确定含气相组分化学反应临界时刻及热力状态参数的方法,以期部分地解决上述技术问题。
8.本公开实施例提供了一种确定含气相组分化学反应临界时刻的方法,包括:确定含气相组分化学反应中第一物质的第一化学计量数和第一质量变化量,以及第二物质的第二化学计量数和第二质量变化量,其中,上述第一物质、第二物质均包括以下至少之一:上述化学反应中的气相组分、上述化学反应中的固相组分、上述化学反应中的液相组分;根据上述第一质量变化量和上述第一化学计量数确定第一反应执行速率,根据上述第二质量变
化量和上述第二化学计量数确定第二反应执行速率;根据上述第一反应执行速率和上述第二反应执行速率得到用于表征含气相组分化学反应的反应临界时刻的化学计量关系窗函数;根据上述化学计量关系窗函数确定上述反应的临界时刻。
9.根据本公开实施例,上述确定含气相组分化学反应中第一物质的第一化学计量数和第一质量变化量以及第二物质的第二化学计量数和第二质量变化量,包括:获取上述含气相组分化学反应的热失重数据和质谱数据;根据上述热失重数据和上述质谱数据确定上述第一质量变化量和上述第二质量变化量;根据上述第一质量变化量确定第一摩尔变化量,根据上述第二质量变化量确定第二摩尔变化量;根据上述第一摩尔变化量与上述第二摩尔变化量的比确定上述第一化学计量数和上述第二化学计量数;其中,根据上述质谱数据确定上述第二质量变化量,包括:根据上述质谱数据采用等效特征图谱法确定上述第二质量变化量。
10.根据本公开实施例,上述根据上述第一质量变化量和上述第一化学计量数确定第一反应执行速率,根据上述第二质量变化量和上述第二化学计量数确定第二反应执行速率,包括:根据上述第一质量变化量确定第一摩尔变化量;根据上述第一摩尔变化量与上述第一化学计量数的比确定上述第一反应执行速率;根据上述第二质量变化量确定第二摩尔变化量;根据上述第二摩尔变化量与上述第二化学计量数的比确定上述第二反应执行速率。
11.根据本公开实施例,上述第一反应执行速率和上述第二反应执行速率得到用于表征含气相组分化学反应的反应临界时刻的化学计量关系窗函数,包括:根据上述第一反应执行速率和上述第二反应执行速率的比得到用于表征含气相组分化学反应的反应临界时刻的化学计量关系窗函数。
12.根据本公开实施例,上述根据上述第一反应执行速率和上述第二反应执行速率得到用于表征含气相组分化学反应的反应临界时刻的化学计量关系窗函数,包括:根据第一物质的反应执行速率与第二物质的反应执行速率的比得到化学计量关系正窗函数;根据上述第二物质的反应执行速率与上述第一物质的反应执行速率得到化学计量关系反窗函数;根据上述化学计量关系正窗函数与上述化学计量关系反窗函数的平均数得到用于表征含气相组分化学反应的反应临界时刻的化学计量关系窗函数。
13.根据本公开实施例,上述化学计量关系窗函数在非反应执行时间区间呈现波动式噪声信号,上述化学计量关系窗函数在反应执行时间区间呈现平台式确定性信号;上述根据上述化学计量关系窗函数确定上述反应的临界时刻,包括:根据上述波动式随机噪声信号与上述平台式确定性信号的转折点确定上述反应的临界时刻。
14.根据本公开实施例,上述平台式确定性信号包括上述化学计量关系窗函数的函数值为1的直线信号。
15.根据本公开实施例,本公开还提供一种确定含气相组分化学反应临界时刻的热力状态参数的方法,包括:获取含气相组分化学反应热力状态参数随时间变化曲线;根据上述热力状态参数随时间变化曲线和上述的化学计量关系窗函数,确定反应临界时刻的热力状态参数。
16.根据本公开实施例,上述热力状态参数包括以下至少之一:温度、压力。
17.本公开通过含气相组分的化学反应中不同组分的反应执行速率构建化学计量关
系窗函数,利用不同组分的反应执行速率仅在反应执行期间呈现一致性的特性,通过化学计量关系窗函数确定反应的临界时刻。
附图说明
18.图1示意性地示出了相关技术中反应特征温度分析示意图;
19.图2示意性地示出了切线法中客观误差与主观误差示意图;
20.图3示意性地示出了以燃烧反应为例的化学反应机理关系窗函数示意图;
21.图4示意性地示出了确定含气相组分化学反应临界时刻的热力状态参数的方法流程示意图;
22.图5示意性地示出了caco3分解反应失重速率和co2产率曲线;
23.图6示意性地示出了caco3分解反应的化学计量关系窗函数曲线;
24.图7示意性地示出了非线性升温caco3分解反应的失重速率和co2产率曲线;
25.图8示意性地示出了非线性升温caco3分解反应的化学计量关系窗函数曲线;
26.图9示意性地示出了碳粉燃烧的物质质量变化量随时间变化的曲线;
27.图10示意性地示出了碳粉燃烧的物质摩尔变化量随时间变化的曲线;
28.图11示意性地示出了碳粉燃烧反应中各物质的化学计量关系窗函数曲线;
29.图12示意性地示出了cas反应过程气相组分的离子流强度变化曲线;
30.图13示意性地示出了cas反应过程气相组分的离子流强度变化的三维图谱;
31.图14示意性地示出了cas反应过程气相组分的质量变化曲线;
32.图15示意性地示出了cas反应过程气相组分的摩尔变化曲线;
33.图16示意性地示出了cas反应过程气相组分摩尔变化量的比随时间变化的曲线;
34.图17示意性地示出了cas反应过程化学计量关系窗函数曲线。
具体实施方式
35.为使本公开的目的、技术方案和优点更加清楚明白,以下结合具体实施例,并参照附图,对本公开作进一步的详细说明。
36.相关技术中,反应临界时刻与状态的检测分析方法存在以下三方面的原理性缺陷:
37.(1)无法识别反应过程的执行。目前研究方法以物质的质量与能量动态变化为研究对象,但物质质量与能量动态变化与某一反应过程并不具有严格的线性对应关系,其可能对应单一反应,也可能对应多重反应,由于质量与能量属于标量参数,若出现多重交叉反应过程时,并不能有效分辨出各个反应的变化特征。例如,tg与dtg检测固液相物质质量的总体变化,而dsc与dta检测反应过程的能量动态变化,两类信号都属于所有固液相物质质量或能量参数变化的总体合并信息,甚至无法分辨反应物与产物,更无法识别不同的交叉反应过程。若采用实时连续检测的气体分析手段,如质谱、红外、电化学、激光类可连续检测的分析仪器,其中质谱的信号为离子流强度,根本未与气体物理参数直接关联,而红外、电化学、激光类分析设备给出的是气体的浓度信号,利用浓度很难与反应过程的质量变化结合,更无法直接对应解析反应过程的化学计量关系。若以浓度作为反应过程质量动态变化特征为基础,人为假定其代表某一反应过程,对于具有多重反应的变化过程,即使可利用切
线法得到某一临界时刻与状态,但是它没有任何意义。
38.(2)切线法客观上引入数学高阶误差:国际标准iso11357-1规定检测分析方法——切线法的数学意义实际上是:选择反应过程的失重量(tg) 曲线为例,以反应执行期间的某一时刻作为基准点,如图1所示,针对图 1中dtg曲线中特定温度范围,按照标准规定为“(对一个峰)内插虚拟基线和峰侧附件的拐点处绘制的切线的交汇点或(对一个步骤)外推开始基线和步骤的拐点绘制的切线的交汇点”,同理可以解析反应的终止温度点。如图2所示的圆圈位置,在基准点处进行泰勒(taylor)级数展开,忽略二阶及二阶以上的展开项,保留一阶展开项,形成一阶的直线切线,以此代替原有检测曲线,寻找其与原有检测曲线基线的交叉点,认定其为反应过程的启动时刻,如图2中的33.5min时刻为一阶切线法获得的临界时刻,该时刻的温度即为反应过程的启动临界温度t
onset
。由于反应过程遵循阿伦尼乌兹定律,导致反应过程的任何一种动态变化曲线基本呈现为指数型函数,指数型函数的高阶项始终存在,若直接使用一阶函数代替,则主观上忽略高阶展开项,从数学意义上其本身已经引入了极大高阶误差。如同样对图2中的失重量(tg)动态变化信号,在相同的基准点处继续保留二阶与三阶泰勒级数展开项,忽略四阶及其以上高阶项,形成三阶切线,三阶切线与基线形成的临界时刻,较一阶切线提前了1.5min,这客观的说明国际标准iso11357-1规定的切线法本身存在原理性的高阶客观误差。
39.(3)切线法存在严重的路径依赖,主观上引入了极大人为误差:目前国际标准iso 11357-1规定的切线法需要依靠反应执行过程的发生路径,具有严重的路径依赖特性,如图2中人为选择基准点,若基准点位置改变则分析结果截然不同。而临界时刻应为反应过程固有的特征参数,不与随后发生的执行工况、外部条件变化产生关联。但由已发生的状态求解临界状态,在检测分析过程中首先须确定切线的基准点,也就是泰勒级数展开时的基点,因为反应过程的执行路径会受到升温速率、样品质量、测试数据采集等因素的极大影响,同时该基准点的选择还取决于主观人为因素,不同条件下与不同检测人员得到的检测分析结果差异极大,且存在较大的人为干扰因素。
40.当任一反应过程开始发生,就已经具有固定的化学计量关系特征,而化学计量关系是反应过程中各种反应物及产物彼此之间的固定比例关系,检测出反应过程化学计量关系是确认反应过程的关键和前提。
41.目前的检测方法存在诸多的原理性缺陷,核心在于没有真正基于反应过程特征建立临界时刻的物理内涵,这样,不论从概念、手段、数据处理等各方面均存在极大的偏差。因此,需要构建一种新的基于反应过程特征参数的检测分析方法,而化学计量关系科学体现了不同反应过程的特征参数,由此可形成基于化学反应计量关系窗函数的检测分析方法。
42.本公开实施例以反应过程临界时刻与状态前后的反应特征参数的转变为出发点,构建化学反应计量关系窗函数,由此确定临界时刻与状态。若以反应过程的起始点为例,理想状况下反应前化学计量关系不存在,那么检测数据中反应所涉及组分产率的化学计量关系比值在[-∞,+∞]范围内随机振荡;反应执行期间则遵循固定的化学计量关系,通过数据归一化处理,反应执行期间反应所涉及组分产率的化学计量关系比值为1;反应起始点前后将出现显著的归一化化学计量关系比值的跳变,由此间断转折点确定临界时刻,以临界时刻确定反应过程的临界状态。此方法利用了归一化的化学反应计量关系比值,构建了具有逻辑函数属性的时间窗函数,因此称为化学反应计量关系窗函数法。如图3所示的燃烧反
应,反应物为燃料r及o2,生成物为rxoy,ts、te分别为反应起始与终止时刻,swf(t) 正是化学反应计量关系窗函数,其本身具有逻辑函数的属性。反应过程的终止点分析过程基本相同,具体检测分析原理、数据分析流程、应用实例分别予以说明。
[0043]
本公开实施例提供了一种确定含气相组分化学反应临界时刻的方法,包括:确定含气相组分化学反应中第一物质的第一化学计量数和第一质量变化量,以及第二物质的第二化学计量数和第二质量变化量,其中,上述第一物质、第二物质均包括以下至少之一:上述化学反应中的气相组分、上述化学反应中的固相组分、上述化学反应中的液相组分;根据上述第一质量变化量和上述第一化学计量数确定第一反应执行速率,根据上述第二质量变化量和上述第二化学计量数确定第二反应执行速率;根据上述第一反应执行速率和上述第二反应执行速率得到用于表征含气相组分化学反应的反应临界时刻的化学计量关系窗函数;根据上述化学计量关系窗函数确定上述反应的临界时刻。
[0044]
根据本公开实施例,以通用的化学反应方程式(一)为例:
[0045]
aa+bb
→
cc+dd
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(一)
[0046]
其中,a、b、c、d代表参与反应的组分,a、b、c、d代表对应物质的化学计量数值。因此,参与反应过程的所有物质的摩尔变化量的比等于式(一)中化学计量数。如式(二)所示:
[0047][0048]
其中,式(二)中分别为物质i(其中i=a,b,c,d)的质量变化量、摩尔变化量与分子量,其数据来自第一步的定量分析结果,但此时公式下标对应反应过程物质种类标签。由于反应物具有消耗属性,产物属于生成属性,因此公式(4)中化学计量关系a、b加
“‑”
号转换为负值,而c、d仍为正值。
[0049]
因此,根据物质物质i(其中i=a,b,c,d)的质量变化量、摩尔变化量与分子量可以得到物质i的反应执行速率,如式(三)所示:
[0050][0051]
其中,svi=-a,-b,c,d,i分别对应物质标签a、b、c、d。
[0052]
当参与反应的物质是固相组分或液相组分时,由于每一种固相组分或液相组分的质量变化量不可以通过检测获得,因此可以采用参与反应的多种物质的组合来计算组合物的反应执行率,如式(四)所示:
[0053][0054]
其中,i、j分别对应物质a、b、c、d中两种,即i≠j。
[0055]
虽然式(三)和式(四)采用的不同的方式得到反应执行速率,但是,由于同一反应过程的反应执行速率随时间变化呈现一致性,因此:
[0056]
λi(t)=λj(t)=λ
i&j
(t)(i≠j)
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(五)
[0057]
利用反应过程不同执行速率在反应执行期间随时间变化的动态一致性,求各反应时刻不同反应执行速率的比值,得到化学计量关系窗函数 swf(t),如式(六)所示:
[0058][0059]
由于化学计量关系窗函数swf(t)具有逻辑函数的属性,其在反应执行期间呈现数值为1的一致性平台特征,因此通过化学计量关系窗函数可以确定反应的临界时刻。
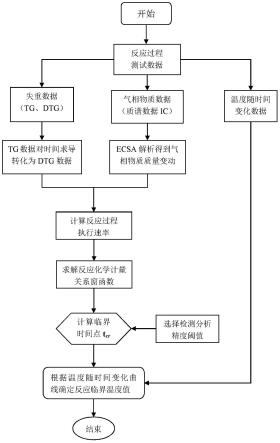
[0060]
本公开实施例中,通过含气相组分的化学反应中不同组分的反应执行速率构建化学计量关系窗函数,利用不同组分的反应执行速率仅在反应执行期间呈现一致性的特性,通过化学计量关系窗函数确定反应的临界时刻。
[0061]
根据本公开实施例,上述确定含气相组分化学反应中第一物质的第一化学计量数和第一质量变化量以及第二物质的第二化学计量数和第二质量变化量,包括:获取上述含气相组分化学反应的热失重数据和质谱数据;根据上述热失重数据和上述质谱数据确定上述第一质量变化量和上述第二质量变化量;根据上述第一质量变化量确定第一摩尔变化量,根据上述第二质量变化量确定第二摩尔变化量;根据上述第一摩尔变化量与上述第二摩尔变化量的比确定上述第一化学计量数和上述第二化学计量数;其中,根据上述质谱数据确定上述第二质量变化量,包括:根据上述质谱数据采用等效特征图谱法确定上述第二质量变化量。
[0062]
根据本公开实施例,在含气相组分化学反应中,对于参与反应的固相组分或液相组分通常采用热失重数据来解析得到固相组分或液相组分的质量变化量,对于气相组分则直接由质谱数据解析得到气相组分的质量变化量。
[0063]
根据本公开实施例,针对反应中的固相组分或液相组分,由于无法检测得到单一组分的质量变动曲线,因此利用热分析天平得到固、液相物质总体质量变动曲线tg/dtg,通过进一步计算获得固、液相物质总体摩尔变化量通过反应过程中涉及的固、液相组分总体的摩尔变化量的比得到化学反应中的化学计量数。
[0064]
根据本公开实施例,针对反应中的气相组分,采用质谱连续监测反应过程所有气相组分信号,利用质谱定量分析技术-等效特征图谱法ecsa (equivalent characteristic spectrum analysis),对气相组分的质谱测试数据解析,计算出气相组分的质量变化量(反应物的产率为负数,即消耗率)。以反应过程起始点的检测分析为例,基于质谱检测得到的气相组分k的离子流强度为分析对象,由于离子流强度并不能直接代表物质的绝对质量,须利用等效特征图谱法ecsa解析,获得气相组分k的摩尔变化量公式下标k代表针对质谱定量解析过程的气相组分自然排序标签,即:
[0065][0066]
其中,中为参照气体r的摩尔流量,分别为气相组分k质谱特征离子流向量、参照气体r的质谱特征离子流强度,a
r,k
为气相组分k 相对于参照气体r的相对灵敏度矩阵,为a
r,k
的逆矩阵,两者都是对角矩阵。根据气相组分k的分子量wk,可通过式(八)计算其质量变化量算其质量变化量
[0067]
本公开实施例中,通过参与反应的各组分的质量变化量确定摩尔变化量,根据摩尔变化量确定化学计量数,由于化学计量数是化学反应的特征参数,因此,能够准确表征反应的执行过程。
[0068]
根据本公开实施例,上述根据上述第一质量变化量和上述第一化学计量数确定第一反应执行速率,根据上述第二质量变化量和上述第二化学计量数确定第二反应执行速率,包括:根据上述第一质量变化量确定第一摩尔变化量;根据上述第一摩尔变化量与上述第一化学计量数的比确定上述第一反应执行速率;根据上述第二质量变化量确定第二摩尔变化量;根据上述第二摩尔变化量与上述第二化学计量数的比确定上述第二反应执行速率。
[0069]
本公开实施例中,利用同一反应中,反应中各组分的质量变化量随时间的变化,在反应执行期间必然遵循该反应的化学计量关系,因此以摩尔变化量与化学计量数的比定义反应执行速率,可以利用了归一化的化学反应计量关系比值,构建了具有逻辑函数属性的时间窗函数。
[0070]
根据本公开实施例,上述第一反应执行速率和上述第二反应执行速率得到用于表征含气相组分化学反应的反应临界时刻的化学计量关系窗函数,包括:根据上述第一反应执行速率和上述第二反应执行速率的比得到用于表征含气相组分化学反应的反应临界时刻的化学计量关系窗函数。
[0071]
本公开实施例中,利用反应过程不同执行速率在反应期间随时间变化的动态一致性,求各时刻不同执行速率的比值,得到用于表征反应临界时刻的化学计量关系窗函数。
[0072]
根据本公开实施例,上述根据上述第一反应执行速率和上述第二反应执行速率得到用于表征含气相组分化学反应的反应临界时刻的化学计量关系窗函数,包括:根据第一物质的反应执行速率与第二物质的反应执行速率的比得到化学计量关系正窗函数;根据上述第二物质的反应执行速率与上述第一物质的反应执行速率得到化学计量关系反窗函数;根据上述化学计量关系正窗函数与上述化学计量关系反窗函数的平均数得到用于表征含气相组分化学反应的反应临界时刻的化学计量关系窗函数。
[0073]
本公开实施例中,针对同一化学反应,理论上,物质i与物质j的正反窗函数彼此成对出现且相等,如式(九)所示:
[0074]
swf
i,j
(t)=swf
j,i
(t)
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(九)
[0075]
因此,为了更精准地分析反应过程临界时刻,可以采用计算物质i与物质j的正反窗函数的平均值,作为最终的窗函数swf(t),如式(十)所示:
[0076][0077]
根据本公开实施例,上述化学计量关系窗函数在非反应执行时间区间呈现波动式噪声信号,上述化学计量关系窗函数在反应执行时间区间呈现平台式确定性信号;上述根据上述化学计量关系窗函数确定上述反应的临界时刻,包括:根据上述波动式随机噪声信号与上述平台式确定性信号的转折点确定上述反应的临界时刻。
[0078]
根据本公开实施例,上述平台式确定性信号包括上述化学计量关系窗函数的函数值为1的直线信号。
[0079]
根据本公开实施例,反应的临界时刻包括以下至少之一:反应启动时刻、反应终止
时刻。
[0080]
根据本公开实施例,在反应过程非反应执行时间区间,即反应起始时刻ts之前与终止te时刻之后,swf(t)的理论值应为不存在,实际分析结果为在[-∞,+∞]内随机振荡,呈现为明显的随机噪声信号特征,对时间的均值无限接近于或等于0。
[0081]
根据本公开实施例,在反应执行时间区间,即反应起始ts与终止时刻te之间,swf(t)理论上应为1,实际分析结果为无限接近或等于1,呈现为明显的确定性信号特征,其对时间的方差接近于0。若swf(t)不为1,则说明存在多个反应过程,需要解析多重反应过程。
[0082]
根据本公开实施例,化学计量关系窗行数swf(t)体现出反应特征参数,即化学计量关系,具有针对特定反应的特征函数属性。其在反应执行期间呈现数值为1且一致性极佳的平台特征。其逻辑函数的内在本质并不在于函数值,而是临界时刻t
cr
,即反应启动ts与终止时刻te。如式(十一)~ (十三)所示:
[0083]
swf(t)=1,ts<t<teꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(十一)
[0084]
swf(t)=0,t=ts,teꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(十二)
[0085]
swf(t)∈[-∞,+∞],t<ts,t>teꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(十三)
[0086]
因此,利用化学计量关系窗函数swf(t)的平台特性可准确判断反应起始点和终止点时刻,进一步通过该时刻可求解对应温度值。
[0087]
根据本公开实施例,本公开还提供一种确定含气相组分化学反应临界时刻的热力状态参数的方法,包括:获取含气相组分化学反应热力状态参数随时间变化曲线;根据上述热力状态参数随时间变化曲线上述的化学计量关系窗函数,确定反应临界时刻的热力状态参数。
[0088]
根据本公开实施例,上述热力状态参数包括以下至少之一:温度、压力。
[0089]
图4示意性地示出了确定含气相组分化学反应临界时刻的热力状态参数的方法流程示意图。
[0090]
如图4所示,利用化学计量关系窗函数确定含气相组分化学反应临界时刻的热力状态参数主要包括以下步骤:
[0091]
步骤1,获得反应过程测试数据,包括失重数据、气相物质数据和温度随时间变化数据。
[0092]
步骤2,对于失重的tg数据,需要微分处理后变换为dtg数据。对于气相物质数据,通过质谱定量分析方法——等效特征图谱法(ecsa),将离子流强度ic解析为所有气相组分的摩尔变化量/流量变动曲线进一步换算为质量变化量/流量变动曲线对于具有初始量基线的组分,如注入固定流量的气体,则以其注入气体流量为基线,减去基线后获得气体的质量变化量(即消耗速率),即
[0093]
步骤3,根据步骤2的结果按照式(三)、式(四)确定不同物质的反应执行速率。
[0094]
步骤4,根据步骤3的结果按照式(六)、式(九)、式(十)确定化学计量关系窗函数swf(t),获得时间间断点——临界时刻t
cr
,根据临界时刻t
cr
与温度的变化关系,确定出反应过程的临界温度。
[0095]
本公开实施例中,充分利用化学反应过程的特征参数——化学计量关系,可区分多重分析过程,并能明确指向特定的反应过程,而不是总包反应过程。
[0096]
本公开实施例中,化学计量关系窗函数中临界时刻前后具有明显的关系转折特性。即使反应临界时刻前后,各类检测信号呈现出近似无限光滑特性,即信号信噪比s/n极低,但化学计量关系窗函数仍表现出反应过程特征参数的突变。
[0097]
本公开实施例中,化学计量关系窗函数仅为临界时刻的函数,函数形式简单且意义明确,如式(十一)所示,即化学计量关系窗函数本身就是起始与终止两个临界时刻,两个时刻之间关系为1,其它区域为[-∞,+∞] 之间随机振荡。
[0098]
下面结合具体应用实施例对本公开进行详细说明。
[0099]
本公开提供的方法适用于含有气相组分的反应过程,根据气相组分参与反应的情况可以大致分为以下三类:
[0100]
i类反应:反应物含气相组分:即注入气体参与反应过程,如氧化反应,可以表示为:
[0101]
aa(s)+bb(g)
↑→
cc(s)+dd(s)
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(十四)
[0102]
ii类反应:产物含气相组分:
[0103]
aa(s)+bb(s)
→
cc(s)+dd(g)
↑ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(十五)
[0104]
iii类反应:反应物和产物均含有气相组分:
[0105]
aa(s)+bb(g)
↑→
cc(s)+dd(g)
↑ꢀꢀꢀꢀꢀꢀꢀꢀ
(十六)
[0106]
实施例1
[0107]
以典型的caco3热分解过程为例,该反应属于ii类反应过程,产物含气相组分,利用质谱检测解析获得的气相组分的产率数据和固相dtg的数据求解反应过程的化学计量关系窗函数。
[0108]
caco3热分解过程的测试条件为:caco3为优级纯,样品重量10mg,升温速率10k/min,载气氛围为99.999%高纯he,流量为200ml/min。
[0109]
图5示意性地示出了caco3分解反应失重速率和co2产率曲线。
[0110]
如图5所示,co2产率曲线与固相失重速率曲线吻合较好,动态特征一致,验证了气相定量解析的准确性,为下一步获得准确化学反应计量关系提供数据。
[0111]
图6示意性地示出了caco3分解反应的化学计量关系窗函数曲线。
[0112]
如图6所示,化学计量关系窗函数曲线在反应执行前[t,ts]和执行后[te, t]区域内化学计量窗函数swf(t)的值在[-∞,+∞]区域内随机变动,在反应执行期间,化学计量窗函数swf(t)为固定值1,利用化学计量窗函数的跳变特性可以准确的获得临界点起始时刻和终止时刻。进一步获得起始时刻和终止时刻对应的温度值,即起始温度548.1℃,终止温度773.1℃。
[0113]
本公开实施例中得到反应过程特征温度——起始温度与终止温度,原则上不受任何人为因素干扰,更不存在直观误差。同样,由于检测分析过程利用的是化学计量关系窗函数的跳变特征,且特征温度的确定依靠的是对应时刻,所以检测分析过程既遵循了化学反应过程的特定规律,又有效避免了路径依赖的特性,并在数学及信号处理方面具有明确的物理内涵。
[0114]
实施例2
[0115]
为了证明该解析方法的稳定性,不受实验条件的影响,仍以典型的 caco3调制升温热分解过程为例,该反应属于ii类反应过程,产物含气相组分,利用质谱检测解析获得的
气相组分质量变化量和固相dtg的数据求解反应过程的化学计量关系窗函数。
[0116]
caco3调制升温热分解过程的测试条件为:caco3为优级纯,样品重量10mg,温度范围在500℃到650℃内变动三次,升温速率10k/min,载气氛围为99.999%高纯he,流量为200ml/min。
[0117]
图7示意性地示出了非线性升温caco3分解反应的失重速率和co2产率曲线。
[0118]
如图7所示,在四次升降温过程中caco3热分解反应随着温度变化反复开始和停止,co2产率曲线与固相失重速率曲线吻合较好,动态特征一致,验证了气相定量解析的准确性,为下一步获得准确化学反应计量关系提供数据。
[0119]
图8示意性地示出了非线性升温caco3分解反应的化学计量关系窗函数曲线。
[0120]
如图8所示,在四段反应执行期间,化学计量窗函数swf(t)为固定值 1,非反应执行时间区域化学计量窗函数swf(t)的值在[-∞,+∞]区域内随机变动,利用化学计量窗函数的跳变特性可以准确的获得临界点起始时刻和终止时刻。
[0121]
实施例3
[0122]
以典型的c粉燃烧过程为例,该反应属于i类反应过程,反应物包含注入气体o2,需要准确解析注入气体的消耗量,利用质谱检测解析获得的气相组分o2、co2定量数据和固相dtg的数据,求解后可获得反应过程的化学计量关系窗函数swf(t)。
[0123]
c粉燃烧过程的测试条件为:碳粉为分析纯,粒径为20μm,样品重量10mg,温度范围30℃到1100℃,升温速率10k/min,载气氛围为99.999%高纯ar,高纯氧为99.999%,ar流量为65ml/min,氧气流量为5ml/min。
[0124]
图9示意性地示出了碳粉燃烧的物质质量变化量随时间变化的曲线。
[0125]
如图9所示,随着反应启动,固相物质c粉的失重曲线、o2的消耗曲线及产物co2产率曲线吻合较好,与燃烧反应中反应物消耗与产物生成动态特征一致。
[0126]
图10示意性地示出了碳粉燃烧的物质摩尔变化量随时间变化的曲线。
[0127]
如图10所示,随着反应启动,固相物质c粉的失重曲线、o2的消耗曲线及产物co2产率曲线吻合较好,与燃烧反应中反应物消耗与产物生成动态特征一致。
[0128]
利用获得的气相和固相的质量变化量转化为摩尔变化量,然后获得各物质碳粉c、o2、co2的摩尔变化量的比。利用各物质的摩尔变化量的比可得到不同物质间的化学计量关系窗函数swf(t)。
[0129]
图11示意性地示出了碳粉燃烧反应中各物质的化学计量关系窗函数曲线。
[0130]
如图11所示,碳粉与co2,碳粉与o2,o2与co2化学计量关系窗函数swf(t),三种窗函数具有很好的一致性,在反应执行前[t,ts]和执行后[te, t]区域内化学计量关系窗函数的值在[-∞,+∞]区域内随机振动,在反应执行期间,化学计量窗函数为固定值1。对三类化学计量窗函数所获得的起始时刻和终止时刻求解平均值,并对应可计算出反应起始与终止温度值,即起始时刻76.2min所对应温度489.2℃,终止时刻111.8min所对应的温度 846.3℃。
[0131]
实施例4
[0132]
iii类反应过程实例以典型的cas反应过程为例,该反应过程中反应物和产物均含气相组分,气相组分之间的变动互相干扰,此类反应不能利用浓度相对量解析,需利用质谱检测解析获得的气相so2、co、co2定量数据和固相dtg的数据分别解析可获得反应过程的化学计量关系窗函数。
[0133]
图12示意性地示出了cas反应过程气相组分的离子流强度变化曲线。
[0134]
图13示意性地示出了cas反应过程气相组分的离子流强度变化的三维图谱。
[0135]
如图12、13所示,在反应执行期间各气相组分的离子流强度均有所增强,无法反映出co2作为反应性气体的消耗,说明离子流强度作为相对量无法准确判断出物质变动的真实动态特征。
[0136]
图14示意性地示出了cas反应过程气相组分的质量变化曲线。
[0137]
如图14所示,各物质的质量变化量可以直接得到反应的动态变化特征,随着反应的执行,反应物co2开始消耗,质量变化量为负并增强,同时生成物co和so2质量流量开始增加,各物质的动态特征一致。
[0138]
图15示意性地示出了cas反应过程气相组分的摩尔变化曲线。
[0139]
如图15所示,各物质的摩尔变化量可以直接得到反应的动态变化特征,随着反应的执行,反应物co2开始消耗,摩尔变化量为负并增强,同时生成物co和so2摩尔流量开始增加,各物质的动态特征一致。
[0140]
图16示意性地示出了cas反应过程气相组分摩尔变化量的比随时间变化的曲线。
[0141]
如图16所示,co2/co、co2/so2的摩尔变化量的比值在一段时间内呈现平稳趋势,而在其他时间区域呈现波动趋势。
[0142]
图17示意性地示出了cas反应过程化学计量关系窗函数曲线。
[0143]
如图17所示,各物质摩尔变化量的比获得的化学计量窗函数具有很好的一致性,利用其跳变特性得到的反应临界时刻相同。说明该方法不受各气体物质间的干扰,具有很好的稳定性。
[0144]
综上可以看出,本公开实施例提供的方法符合反应过程启动与终止点的临界特性,遵守反应热力学与动力学规律,具备明确的物理内涵,而非单纯的数学处理。有效消除了路径依赖特性,针对反应过程动态特征,基于化学计量窗函数的跳变特性解析临界点,与反应执行过程无关。
[0145]
本公开实施例提供的方法,解析对象针对反应过程动态特征而不是物质,解析的反应过程临界点具有明确的物理意义,且化学计量关系窗函数有利于准确判断反应过程的本质特征;解析方法不受人为因素的干扰,具有很高的精度、可靠性、重复性、再现性。
[0146]
本公开实施例提供的方法,化学计量关系窗函数可由参与反应过程各类组分产率彼此之间比值形成,可适用于解析多重反应中不同反应过程的临界时刻与状态,且该方法不存在数据依赖特性,没有依靠反应过程执行期间的数据协助处理,临界点的意义明确,精度与可靠性高。
[0147]
本公开实施例提供的方法,数据处理内涵明确,利用化学反应计量关系窗函数的逻辑函数属性与反应进程起始或终止时刻直接映射,易于实现智能化与标准化数据处理。
[0148]
本公开实施例提供的方法,适用于各类含气相组分的反应过程,如气相组分参与反应的过程、生成气相组分的反应、或反应物和产物均含有气相组分的过程等各类反应过程,如氧化、燃烧、气化、热解等,数据处理流程完全相同。
[0149]
以上所述的具体实施例,对本公开的目的、技术方案和有益效果进行了进一步详细说明,应理解的是,以上所述仅为本公开的具体实施例而已,并不用于限制本公开,凡在本公开的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本公开的保护
范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1