一种免疫印迹膜洗脱液及其使用方法
1.本发明涉及抗体检测领域,具体是一种免疫印迹膜洗脱液及其使用方法。
背景技术:
2.自1981 年尼尔伯奈特首次将蛋白免疫印迹法称为western blotting(wb) 以来,该实验技术被广泛用于生物化学、分子生物学等研究领域。western blotting又称免疫印迹(immunoblotting),是根据抗原抗体的特异性结合检测复杂样品中的某种蛋白的方法。该法是在凝胶电泳和固相免疫测定技术基础上发展起来的一种新的免疫生化技术。基本步骤是根据蛋白质分子量大小、先利用凝胶sds-page 电泳分离蛋白质样品,转移到固相载体——例如硝酸纤维素薄膜(nc)上。固相载体可以吸附蛋白质,并保持电泳分离的多肽类型及其生物学活性不变。转移后的nc膜就称为一个印迹(blot),用蛋白溶液(如5%bsa或脱脂奶粉溶液)处理,封闭nc膜上的疏水结合位点,紧接着就是孵育一抗及二抗,最后dab或化学发光法显影。该方法具有高分辨力和固相免疫测定抗原抗体反应的高特异性和敏感性。
3.进行凝胶电泳并使用平行上样免疫印迹分析来检测新的一抗或抗体浓度非常耗费时间和金钱,因此印迹膜的如何重复利用成为了科研人员关注的焦点问题。重复利用指的是可以在显影定影完成以后重新洗脱(stripping buffer),然后重新封闭检测新的抗原,继续一抗(可以是不同的,前提是目的蛋白在印迹膜上)二抗孵育,显影定影。虽然已经报道了多种用于印迹膜重复使用的灭活于hrp活性的方法,包括 h2o
2 ,叠氮化钠,3,3-二氨基联苯胺或 vector sg和乙酸,但这些方法有其自身的局限性。而很多stripping buffer(中文翻译为:洗脱液;再生液;去除液)可以造成印迹膜上面蛋白的丢失,引起检测信号消失,误导科研人员。另外,一般情况下,结合了蛋白质或抗原的固相载体只能进行一次蛋白质免疫印迹实验,但是,抗原抗体的结合是分子表面的离子键,疏水键等结合,在一定条件下(如强酸性、h2o2等)形成的复合物是不牢固的,可以解离。
技术实现要素:
4.本发明的目的是为了克服现有技术存在的缺点和不足,而提供一种蛋白质免疫印迹膜再生液及其使用方法。本发明所采取的技术方案如下:一种免疫印迹膜洗脱液,所述免疫印迹膜洗脱液包括:羟甲基氨基甲烷(tris)
ꢀꢀꢀꢀ
0.12%-0.22% ;edta(乙二胺四乙酸)
ꢀꢀ
0.037%-0.047% ;tween 20
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
0.005%-0.01% ;将上述原料用ddh2o溶解,调整ph值为9.5-10.0;本洗脱液可在室温(rt)下保存数月。
5.还提供上述免疫印迹膜洗脱液的使用方法:将蛋白质转移到nc印迹膜后,然后将nc膜用ddh2o漂洗一次(5min);而后将nc膜转移到盛有洗脱液的50ml离心管中后,再将50ml离心管再放入水里进行煮沸(95℃左右),待
水沸腾后再计时,10-25min后即可取出nc膜。然后对nc膜继续漂洗一次(5min)。后续按照常规程序继续进行wb操作。
6.本发明的有益效果如下:本发明不仅可以移除亲和结合的一抗和二抗,还可以使未检测的靶抗原仍保留印迹膜上,从而达到良好的再次重复使用印迹膜的效果。无需为了对不同标靶进行检测而进行多次凝胶电泳,通过本方法可以重复洗脱nc膜至少5次,而且新抗原检测信号保持不变,从而避免浪费稀少或昂贵的样品。
附图说明
7.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,根据这些附图获得其他的附图仍属于本发明的范畴。
8.图1为在western中完成了电转移蛋白的nc膜,继续孵育vinculin一抗及二抗,最后进行化学发光检测显影,出现vinculin条带的图像(图1.a1; 图1.b1);然后分别用洗脱液洗脱10min与25min,再用双蒸水漂洗,再次曝光得到的图像 (图1.a2;图1.b2);将洗脱好的nc膜继续按照常规western blot操作方法处理后,再次进行曝光得到的图像(图1.a3; 图1.b3),将洗脱液处理的nc膜再次孵育vinculin一抗,化学曝光得到的图像(图1.a4; 图1.b4)。
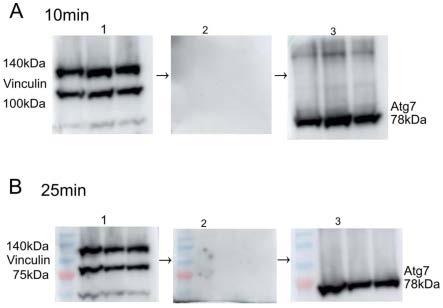
9.图2为按照同样的实验方法,vinculin蛋白western blot 的显影图像 (图2.a1; 图2.b1);然后nc膜用双蒸水漂洗5min,然后用含tween 20的洗脱液处理后的图像 (图2.a2; 图2.b2);最后按照常规western blot进行操作,再次孵育atg7一抗后atg7条带的显影图像 (图2.a3; 图2.b3)。
10.图3为通过正常western blot操作的显影图像(图3.a1; 图3.b1; 图3.c1),含tween 20的洗脱液处理后不同蛋白显影后条带信号变化情况(图3.a2; 图3.b2; 图3.c2)。
11.图4为电转移蛋白vinculin的显影图像(图4.a1) ,用含tween 20的洗脱液将电转移蛋白vinculin的nc膜分别剥膜5次后的图像(图4.a2; 图4.a4;图4.a6;图4.a8;图4.a10),每次剥膜后进行新的不同类抗原(分别为atg7,caspase-3, uba5, jnk, erk1/2)检测的显影图像 (分别对应图4.a3; 图4.a5;图4.a7;图4.a9;图4.a11)。
12.图5为使用斑点印记方法, hrp化学方法显影图像 (图5.a1;图5.b1);再次用含tween 20的洗脱液处理不同时间(10min;25min),而后用双蒸水漂洗,再去曝光得到的显影图像(图5.a2;图5.b2)。
具体实施方式
13.为使本发明的目的、技术方案和优点更加清楚,下面将结合附图对本发明作进一步地详细描述。
14.本发明所提到的方向和位置用语,例如「上」、「下」、「前」、「后」、「左」、「右」、「内」、「外」、「顶部」、「底部」、「侧面」等,仅是参考附图的方向或位置。因此,使用的方向和位置用语是用以说明及理解本发明,而非对本发明保护范围的限制。
15.1.实验材料和方法
tris碱(索莱宝,中国);tween-20(索莱宝,中国);0.45μm 孔径的 nc 膜 (millipore, massachusetts, united states)beyoecl star 化学发光底物;bradford 蛋白检测试剂盒;ripa 缓冲液(碧云天生物技术,shanghai,china) ;3色蛋白负载标记(toroivd,shanghai,china);4周龄23克成年雄性 c57bl/6j 小鼠,gem pharma tech co. ,ltd (许可生产号码: scxk-(su)
ꢀ‑
2018-0008; 中国南京);本研究获得温州医科大学医学伦理委员会伦理学批准。所有实验程序均经温州医科大学动物护理与使用委员会认可(编号:2021-0020),将小鼠维持在摄氏24-25度,昼夜循环(12/12小时) ,并提供水和食物。
16.2. 缩写室温,rt; 辣根过氧化物酶,hrp;硝酸纤维素膜,nc膜。
17.3.实施方法3.1斑点杂交试验在含5% 脱脂牛奶的缓冲盐水 (0.1% tween 20 (tbst)中,以80ng/μl 的浓度制备稀释的hrp偶联的羊抗兔igg。然后我们在 nc 膜上用1μl 稀释的抗体-hrp点样,并在室温下风干30分钟后再分别进行10min及25min洗脱液处理。处理后,立即将膜在双蒸水中洗涤5分钟并浸润在双蒸水中,直至检测前取出并加入酶底物进行检测(蛋白质面向上)。
18.3.2wb分析wb依照现有手段进行
[1][2]
。取出小鼠肝脏切成小块,将片段在 ripa 裂解液(50mm tris-hcl,150mm nacl,1% triton x-100. 1%脱氧胆酸钠,0.1% sds,正钒酸钠,氟化钠,亮肽蛋白,ph=7.4; 碧云天生物技术[ p0013b])在冰上孵育,然后使用超声(voshin-650w; voshin,无锡,中国)分散,直到裂解物变得清晰,将肝脏裂解物以13,000 g 在4℃ 下离心30分钟并收集上清液。使用蛋白质检测试剂盒(p0006c; 碧云天生物技术)测定总蛋白质浓度。蛋白质(15μg)经聚丙烯酰胺凝胶(tris-glycine sds-polyacrylamide)电泳分离并转移到 nc膜上。将膜放在溶于 tbst 的5% 脱脂牛奶中室温下1小时后,经 tbst洗涤1小时后,并与初级抗体(见表1)在4℃孵育过夜。然后用 tbst 洗涤 nc 或 pvdf 膜,并在 tbst 中与hrp偶联的山羊抗小鼠igg 和hrp偶联的山羊抗兔igg 二级抗体(见表1)一起孵育1小时,并使用 beyoecl star 增强化学发光试剂可视化蛋白质信号。最后,使用amersham成像仪680(通用电气医疗生物科学公司,乌普萨拉,瑞典)获得了至少600 dpi 质量的图像。在重新检测之前,用双蒸水洗涤5分钟以除去化学发光底物,并用不同孵育时间的洗脱液处理。最后,为了平行比较,所有程序都在相同条件下进行。
[0019]
4.实施例:(1)配置洗脱液:将0.12%-0.22%的羟甲基氨基甲烷、0.037%-0.047% 的edta、0.005%-0.01% 的tween 20用ddh2o溶解,调ph值9.5~10.0;(2)使用方法:将蛋白质转移到nc印迹膜后,再将nc膜用ddh2o漂洗一次(5min);而后将nc膜转移到盛有洗脱液的50ml离心管中后,再将50ml离心管再放入水里进行煮沸(95℃左右),待水沸腾后再计时,共10min或25min后就可以取出nc膜。然后对nc膜继续漂洗一次(5min)。后面即可按照常规程序继续进行wb操作。
[0020]
如表2所示,对比例1使用未添加tween-20的洗脱液洗脱nc膜后,在不同时间点,重新检测相同抗原并进行比较;如图1所示,在western中完成了电转移蛋白的nc膜,继续孵育vinculin一抗及二抗,最后进行化学发光检测显影,出现vinculin条带(图1.a1; 图1.b1)。
然后分别进行洗脱液处理10min与25min。处理完毕后,再用双蒸水漂洗5min后,再次曝光。发现洗脱液10min处理组上面还有较多黑点(图1.a2),而洗脱液25min处理组黑点较少(图1.b2)。这说明洗脱液处理印迹膜25min可以使膜背景更干净。然后将洗脱好的nc膜继续按照常规western blot操作方法处理(封闭,tbst洗涤)后,再次进行曝光,结果发现无论是10min还是25min洗脱液处理组,nc膜背景都很干净(图1.a3; 图1.b3),我们推测这可能与tbst里面还有tween-20(一种非离子型表面活性剂)有关。最后我们将这2组洗脱液处理的nc膜再次孵育vinculin一抗,4℃。第二天化学曝光显像后发现vinculin条带再次出现,而且经洗脱液处理后的vinculin条带信号强度似乎比未经洗脱液处理的更为显著(图1.a4; 图1.b4)。
[0021]
如图2所示,实施例1使用添加tween-20的洗脱液洗脱nc膜后,在不同时间点,重新检测不同抗原并进行比较;按照对比例1中同样的实验方法,vinculin蛋白western blot 显影后(图2.a1; 图2.b1),nc膜使用双蒸水漂洗5min,然后用含tween-20的洗脱液处理,发现10min与25min处理组背景都很干净(图2.a2; 图2.b2)。最后按照常规western blot进行操作,再次孵育atg7一抗,过夜,第二天atg7条带很清楚地显影在nc膜上面(图2.a3; 图2.b3)。因此推断得到,在洗脱液中加入tween 20可以明显改进洗脱液的使用效果。
[0022]
待实施例1中的洗脱液洗脱印迹膜后,检测洗脱液对印迹膜上面的蛋白含量的影响;如图3所示,为了探究实施例1中的洗脱液是否会造成印迹膜上蛋白的丢失,我们通过正常western blot操作组(图3.a1; 图3.b1; 图3.c1)与洗脱液处理组(图3.a2; 图3.b2; 图3.c2)平行比较不同蛋白显影后条带信号变化情况,发现大分子量蛋白vinculin,中等分子量蛋白p-jnk及小分子量蛋白caspase 3,最后条带检测信号均未发生变化。因此,可以认为添加tween-20的洗脱液不会造成印迹膜上面蛋白的丢失,这些蛋白还包括磷酸化修饰的蛋白。
[0023]
为了探究添加tween-20的洗脱液是否能够反复剥膜多少次,用含tween-20的洗脱液反复洗脱nc膜后,再次检测抗原信号的效果。如图4所示,我们用洗脱液将电转移蛋白vinculin(图4.a1)的nc膜进行剥膜5次(图4.a2; 图4.a4;图4.a6;图4.a8;图4.a10),每次剥膜后再进行新的不同类抗原检测,分别是atg7,caspase-3, uba5, jnk, erk1/2 (图4.a3; 图4.a5;图4.a7;图4.a9;图4.a11)。实验结果表明,同一张nc膜经该洗脱液反复洗脱后,依旧可以很清楚检测到新抗原,而且条带背景清晰,抗原检测信号正常。m,代表分子量。
[0024]
辣根过氧化物酶底物进行化学发光免疫印迹检测,是当前最常见、最灵敏的方法,但是这些显色底物不会沉淀并与印迹膜表面永久结合。
[0025]
使用斑点印记方法探究本发明实施例1中洗脱液洗脱印迹膜的机理,如图5所示,发现hrp化学方法显影后(图5.a1;图5.b1),再次用含tween-20的洗脱液处理不同时间(10min;25min),而后继续进行双蒸水漂洗5min一次,然后再去曝光(图5.a2;图5.b2),发现依旧可以显影。这部分实验结果表明,含tween-20的洗脱液剥膜机理与hrp的灭活没有关系,很可能通过直接去除nc膜上面的一抗二抗而起作用。
[0026]
5.引用文献[1]wang, j. l., li, m. q., zhang, j. j., xu, c. j., a sensitive and reversible staining of proteins on blot membranes;biotechnic & histochemistry : official publication of the biological stain commission 2021, 1-11.
[2] wang, j. l., chen, w. g., zhang, j. j., xu, c. j., journal of molecular histology 2021, 52, 521-537.以上所揭露的仅为本发明较佳实施例而已,当然不能以此来限定本发明之权利范围,因此依本发明权利要求所作的等同变化,仍属本发明所涵盖的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1