测定化学物质的免疫原性反应特性的方法与流程
本发明涉及测定包含化学物质的药物的反应特性的方法。
背景技术:
1、化学物质,诸如药物并且尤其是生物药物,已经成为越来越重要的治疗药物类别,因为它们在治疗许多严重疾病,诸如自身免疫性疾病、癌症和糖尿病中提供了主要益处。主要优点是高特异性和内源性化合物(如胰岛素和红细胞生成素)的有效替代或取代。然而,化学物质诸如生物药物的治疗效果可能因人而异。因此,可能需要对个体进行监测,以测量个体中的治疗药物浓度,以及监测针对治疗的不需要的免疫原性反应的发作,正式称为免疫原性。
2、免疫原性的后果范围从没有明显的不利作用到严重的副作用,诸如降低治疗效果甚至过敏反应。另外,给定个体的免疫原性反应可能随时间而变化,例如随一生中的治疗方案而变化、随激素相关周期而变化和/或根据个体的身体和/或心理状态而变化。
3、在生物学上,这可能通过循环抗药物抗体(ada)的产生和/或存在而表现出来。ada包括中和药物的生物活性的中和抗体(nab)和与药物结合的非中和抗体(非-nab),后者可能会改变药代动力学和/或药效学,从而影响其疗效。中和抗体和非中和抗体两种都可能通过增强清除率(从而缩短血清半衰期)或相反通过延长血清半衰期和产品活性来改变产品的药代动力学。
4、用于检测和定量ada的分析试验具有临床意义,并作为药物反应和治疗方案选择的重要衡量标准。因此,有必要采用合适的分析方法来检测和表征ada,以确保患者安全和治疗效果。然而,目前的试验经常是在与人类生物学不相似的条件下进行的。通常,免疫原性评估依赖于使用基于细胞的试验或基于表面的配体结合试验的相对信号读数,所述基于表面的配体结合试验为诸如酶联免疫吸附试验(elisa)、介观尺度发现(msd)和表面等离子体共振(spr),其中相互作用配偶体之一(例如药物分子)固定在表面上。大多数试验不能直接区分非-nab或nab的存在,因此需要多种试验和正交技术。另外,许多现有技术方法非常麻烦和/或耗时。
5、样品中治疗药物分子的存在(即药物耐受性)也可能对试验性能产生负面影响。因此,理想的方法将提供在生物相关条件下(例如在生物基质中和药物分子存在下)免疫原性的绝对测量,包括评估ada类型(即非-nab或nab)。
6、w0 2021/046316描述用于检测测试样品中的抗药物抗体(ada)诸如抗cl-抑制剂抗体(cl inh-ada)的免疫试验。所述免疫试验包括以下步骤:(i)将所提供的测试样品中的抗药物抗体与药物进行酸解离;(ii)中和含有解离的药物-ada复合物的测试样品;(iii)将样品与过量结合亲和力示踪的药物一起孵育;(iv)在亲和力结合底物表面上捕获所得的ada结合亲和力示踪的药物复合物;(v)添加标记的抗人类抗体;以及(vi)定量捕获的亲和力示踪的药物-ada复合物。poulsen,n.n.等人“用于探测系统性红斑狼疮患者抗dsdna抗体结合异质性的流动诱导的分散分析:迈向诊断和患者分层的新方法(flow-induceddispersion analysis for probing anti-dsdna antibody binding heterogeneity insystemic lupus erythematosus patients:toward a new approach for diagnosis andpatient stratification)”。analytical chemistry,2016,88.18:9056-9061描述用于检测免疫反应的方法,该方法通过使用流动诱导的分散分析检测针对荧光示踪的双链dna(dsdna)的自身抗体检测免疫反应。
7、通过使用固定浓度的荧光示踪的dsdna和多个不同浓度的针对dsdna的模型抗体提供参考标准曲线。此后,基于标准曲线测定了来自狼疮患者的六个血浆样品中针对示踪的dsdna的自身抗体。
8、pedersen,m.e.等人,“使用流动诱导的分散分析对阿达木单抗和tnf-α相互作用进行基于尺寸的表征:亲和力稳定的多重结合物种的评估(size-based characterizationof adalimumab and tnf-αinteractions using flow induced dispersion analysis:assessment of avidity-stabilized multiple bound species)”scientific reports,2021,11.1:1—10;https://doi.org/10.1038/s41598-021-84113-z,描述使用流动诱导的分散分析(fida)在预孵育的缓冲液样品中溶液内表征tnf-α和阿达木单抗的相互作用,并基于示踪的tnf-α的流体动力学半径测定样品中阿达木单抗的浓度。最初,在不存在阿达木单抗的情况下测量示踪的tnf-α的流体动力学半径(尺寸),因此测量未结合的tnf-α的尺寸,证实分子的结构完整性。随着阿达木单抗浓度的增加,tnf-α的表观尺寸由于更高的结合程度而增加。
9、us2013/0344621描述用于测定样品中一种或多种抗药物抗体(ada)同种型的试验方法。该方法涉及示踪药物(优选荧光示踪),将荧光示踪的药物与样品(患者血浆或血清样品)一起孵育,并使用色谱法根据尺寸分离荧光示踪的药物及其与抗药物抗体形成的复合物。该方法相当麻烦且耗时。
10、wo 98/39656描述用于检测样品中免疫反应分子存在的方法,其包括将样品与孵育混合物中的一种或多种免疫反应参比分子的标准溶液接触,以便能够在免疫反应参比分子和用于检测的免疫反应分子之间形成免疫复合物,以及通过将孵育混合物的组分的分子量、电荷和形式的一个或多个物理参数与标准溶液的组分的相同物理参数进行比较来测定免疫复合物是否已形成,其中测定免疫复合物是否已形成是通过孵育混合物的组分的柱层析分离来实现的,以与前述分离相同的方式对标准溶液的组分进行柱层析分离,并比较两次分离的洗脱模式,其中孵育混合物中免疫反应参比分子的洗脱速度相对于标准溶液中相同免疫反应参比分子的洗脱速度的变化表明免疫复合物的形成。
技术实现思路
1、本发明的目的是提供一种可靠且相对快速的方法,该方法用于测定包含化学物质的药物的反应特性,尤其是测定指示样品中ada存在的反应特性。
2、在一个实施方案中,目的是提供一种可靠且相对快速的用于测定对化学物质的体内免疫原性反应的方法。
3、在一个实施方案中,目的是提供一种可靠且相对快速的用于测定对化学物质的体外免疫原性反应的方法。在一个实施方案中,目的是提供一种免疫学筛选方法。
4、在一个实施方案中,目的是提供一种可靠且相对快速的用于测定包含化学物质的药物的反应特性的方法,其中反应特性指示样品中ada的存在和类型。
5、在一个实施方案中,目的是提供一种可靠且相对快速的用于测定包含化学物质的药物的反应特性的方法,其中反应特性指示样品中ada的量。
6、在一个实施方案中,目的是提供一种可靠且相对快速的用于测定包含化学物质的药物的反应特性的方法,其中反应特性指示个体对药物的易感性和/或免疫原性反应。
7、在一个实施方案中,目的是提供一种可靠且相对快速的用于测定包含化学物质的药物的反应特性的方法,其中反应特性指示维持或调整药物给药分布和/或指示终止用该药物的治疗。
8、在一个实施方案中,目的是提供一种可靠且快速的用于测定动物中物质的反应特性的方法,其中反应特性指示与该物质相关的不利作用。
9、这些和其它目的已经通过如权利要求中限定的和如本文以下所述的发明或其实施方案解决。
10、已经发现,本发明或其实施方案具有许多另外的优点,根据以下描述这对于技术人员而言将是清楚的。
11、短语“分子相互作用”是指分子之间以及一个或多个分子内的任何非共价相互作用。
12、术语“化学物质”在本文中用于指至少部分溶解或可溶解在生物液体样品中的任何化学物质。实际上,化学物质可以是任何被怀疑能够触发免疫原性反应的化学物质。化学物质方便地是分子或复合物,诸如抗原。
13、术语“药物”在本文中用于指活性剂,诸如药物或适合于药物的活性剂。
14、除非另有说明,术语“靶标”在本文中用于指化学物质的靶标。
15、术语“结合配偶体”在本文中用于指能够与化学物质非共价相互作用的任何分子或分子组。
16、结合配偶体方便地与化学物质的靶标、靶标类似物和/或分子或复合物相同(除了标记物),所述分子或复合物具有与靶标相同或对应的化学物质(多个)结合位点。结合配偶体可以例如是靶标分子的片段。
17、术语“光学标记物”在本文中用于指能够被光学读取器装置检测到的任何内在或外在标记物。在一个实施方案中,标记物包含元素、元素组、部分和/或包含这些中的一种或多种的任何组合,其中标记物能够被读取器装置直接检测和/或在受到外部和/或内部来源的影响之后被读取器装置检测。
18、术语“读取器装置”是指能够检测信号诸如光学信号的任何检测器或检测器系统。
19、术语“缓冲液”指在使用缓冲液的情况下抵抗ph值变化的水溶液。缓冲液有利地包含弱酸及其盐或弱碱及其盐的水溶液。
20、除非另有规定,缓冲液体系的ph值在20℃下测定。缓冲液体系最稳定的ph值是缓冲液能力最大的值,即ph=pka值
21、术语“测试”和“试验”可以互换使用。
22、应该强调的是,当在本文中使用时,术语“包含(comprises)/包含(comprising)”应被解释为开放术语,即它应被理解为指定存在具体陈述的(多个)特征,诸如(多个)要素、(多个)单元、(多个)整数、(多个)步骤、(多个)组件及其(多个)组合,但是不排除一个或多个其它陈述的特征的存在或添加。
23、提及“一些实施方案”或“实施方案”意味着结合这样的(多个)实施方案描述的具体的(多个)特征、(多个)结构或(多个)特性包括在所公开主题的至少一个实施方案中。因此,短语“在一些实施方案中”或“在一个实施方案中”在整个说明书各处的出现不一定指相同的(多个)实施方案。此外,技术人员将理解,在权利要求所限定的本发明的范围内,具体特征、结构或特性可以以任何合适的方式组合。
24、术语“基本上”在本文应该理解为指包括普通的产品差异和公差。
25、在整个说明书或权利要求书中,除非上下文另有说明或要求,单数包括复数。
26、本文描述的本发明的所有特征和本发明的实施方案,包括范围和优选范围,可以在本发明的范围内以各种方式组合,除非有不组合这样的特征的特定原因。
27、已经发现,本发明的方法提供相对快速且有效的用于测定对化学物质的免疫原性反应的工具,其中免疫原性反应可以是体外免疫原性反应或体内免疫原性反应。该方法可以例如用作用于筛选药物候选物的筛选方法、用作用于评估个体对药物候选物的潜在免疫原性反应的预测试方法、用作用于测定个体的免疫原性反应的对照方法。基于本文提供的公开内容,权利要求中限定的方法的其它有益应用对技术人员来说将是清楚的。
28、另外,该方法不需要包含化学物质和/或结合配偶体的复合物的任何分离。具体地,发现一些抗药物抗体仅与药物弱结合。因此,使用分离如色谱尺寸排阻将不能检测弱结合的抗药物抗体,因为它们将在分离过程中与药物解离。本发明提供的解决方案也适合于测定与药物仅弱结合的抗药物抗体。测定化学物质的免疫原性反应特性的方法包括
29、·获得包含化学物质的生物液体样品,
30、·从至少一部分生物液体样品中提供至少一种制备的样品,
31、·对于每个制备的样品,使制备的样品的至少一个测试部分经受流动,该流动涉及制备的样品的测试部分与化学物质的结合配偶体接触,其中所述结合配偶体包括光学标记物,
32、·进行光学标记物的至少一次读出,并基于此测定与制备的样品接触的标记的结合配偶体的特性流动参数
33、·将测定的特性流动参数与相应的参考值进行比较,并测定化学物质的免疫原性反应特性。
34、生物液体样品可以是来自个体的样品,或者其可以是来自个体的混合物的样品,例如来自标准细胞培养物的生物液体样品。在该方法包括筛选方法的情况下,后者可能特别合适。
35、在一个实施方案中,生物液体样品是来自个体,优选来自哺乳动物的样品。有利地,生物液体样品是从人;家畜诸如山羊、牛、美洲驼、猪、绵羊或羊驼;啮齿动物诸如小鼠或大鼠;兔形目动物诸如兔子和/或宠物诸如马、狗或猫获得的液体样品。
36、由于免疫原性反应可在个体的任何液体中引发,生物液体样品原则上可以是来自活哺乳动物或其细胞培养物的任何生物液体。
37、有利地,生物液体样品选自细胞外液、细胞内液、血液、尿液、精液(semen)(精液(seminal fluid))、阴道分泌物、脑脊液(csf)、滑液、胸膜液(胸膜腔灌洗液)、心包液、腹膜液、羊水、唾液、鼻腔液、粘液、耳液、胃液、母乳、细胞培养液或其任意组合。
38、已经发现应用化学物质的标记的(也经常称为示踪的)结合配偶体是非常有益的,患者将完全不受任何示踪的影响-即化学物质或免疫原性反应产生的任何任选的抗体都不需要示踪。
39、有利地,化学物质至少部分可溶解于生物液体样品中。优选地,化学物质包括化学活性实体、化学活性分子或化学活性复合物。
40、化学物质例如可以是化学活性实体,诸如药物的药学/生物学活性成分或用于药物的药学/生物学活性成分。
41、化学物质的实例包括蛋白质、肽、生物学活性聚合物剂、生物学活性无机剂、生物学活性金属剂或其任意组合。
42、在一个实施方案中,化学物质包括生物药物,该生物药物优选地选自细胞因子、抗体、酶、激素、免疫调节剂、疫苗剂。
43、在一个实施方案中,生物药物包括单克隆抗体。
44、如上所述,已经发现,对于许多生物药物来说,可能存在发生不期望的免疫原性反应的相当大的风险,因此在化学物质包含生物药物的情况下,本文所呈现的方法是特别优选的。
45、在一个实施方案中,化学物质是用于治疗癌症、心血管疾病、代谢疾病或神经退行性疾病中的至少一种的活性剂。用于治疗这种疾病所施用的药物经常长期给予个体,诸如几周、几个月或甚至几年,并且已经发现用包含化学物质的药物治疗的个体的免疫原性反应经常会随时间而改变。经常需要使用昂贵且经常耗时的方法定期测试个体的免疫原性反应。本发明的方法为这种应用提供非常有益的方法。
46、本方法的一个非常有益的性质是该方法不仅可以被施用于测定免疫原性反应(即非免疫原性反应或免疫原性反应),而且该方法还可以被施用于测定抗药物抗体(ada)产生的水平,特别有益的是该方法同时可以被施用于测定产生哪种类型的ada,即中和抗体(nab)或非中和抗体(非-nab)。
47、不受理论的束缚,据信在化学物质以正常和期望的模式起作用的情况下,即在反应是非免疫原性反应的情况下,化学物质将根据正常反应动力学和以已知或未知的kd值(平衡解离常数)与标记的结合配偶体形式的靶标反应。在中和抗体(nab)的情况下,取决于中和抗体(nab)的水平,大部分化学物质将与中和抗体(nab)结合,并阻断与标记的结合配偶体的反应,这意味着较少的化学物质自由地与标记的结合配偶体反应,从而使样品中未结合的标记的结合配偶体的量增加。在非中和抗体(非-nab)的情况下,取决于非中和抗体(非-nab)的水平,大部分化学物质将与非中和抗体(非-nab)结合,但不会阻断与标记的结合配偶体的反应,这意味着将存在化学物质、非中和抗体(非-nab)和标记的结合配偶体的复合物。
48、因此,通过检测标记的结合配偶体的流动特性,可以测定反应动力学和平衡结合,从而可以测定化学物质的免疫原性反应。
49、提供至少一个制备的样品的步骤可以有利地包括稀释生物液体样品以降低化学物质的浓度。已经发现更准确地检测化学物质的状态,从而更准确地检测潜在的免疫原性反应和任选的ada的产生。
50、提供至少一个制备的样品的步骤可以包括将生物液体样品稀释至生物液体样品的选定浓度或稀释至化学物质的选定或估计浓度。
51、如上所述,稀释度可以相对于生物液体样品的浓度或化学物质的选定或估计浓度来设定。优选地,参考值与生物液体样品的相应浓度或化学物质的选定或估计浓度相关联。
52、有利地,提供至少一个制备的样品的步骤包括向该部分生物液体样品中添加缓冲液体系,优选地以提供期望的生物液体样品的浓度或化学物质的选定/估计浓度。取决于期望的测定精度,两个或多个制备的样品具有不同生物液体样品的浓度或不同浓度的化学物质的选定/估计浓度。
53、在一个实施方案中,从生物液体样品提供至少一个制备的样品包括从体液样品提供多个制备的样品。有利地,其中多个制备的样品包括至少2个,诸如至少3个,诸如4至100个具有不同选定生物液体样品浓度的制备的样品。
54、在多个制备的样品包括具有不同选定生物液体样品浓度的样品的情况下,这些样品将具有不同化学物质的浓度(化学物质不存在的情况除外)
55、短语“生物液体样品的浓度/化学物质的浓度”在下文中用于指“生物液体样品的浓度和/或化学物质的浓度,其可以有利地被已知或估计。
56、已经发现免疫原性反应的检测在生物液体样品的一些浓度或化学物质的选定/估计浓度下比在其其它浓度下更准确。
57、因此,提供具有不同生物液体样品的浓度/化学物质的浓度的制备的样品,以识别用于进行测定的最佳生物液体样品的浓度/化学物质的浓度反应模式可能是有益的。在测定包括在几种不同生物液体样品的浓度/化学物质的浓度下的测定的情况下,可以观察到更详细的反应模式。另外,可能在非常早期的阶段揭示免疫原性反应。
58、在该方法包括提供具有不同生物液体样品的浓度/化学物质的浓度的两个或更多个制备的样品的情况下,制备的样品的各个参考值可以有利地以参考结合曲线诸如作为化学物质的浓度的函数的特性流动参数的结合曲线的形式提供,所述特性流动参数例如是化学物质和标记的结合配偶体的流体动力学半径参数或分散参数。
59、然后,可以提供各个制备的样品的测定的特性流动参数作为测定的结合曲线,并且可以确定测定的结合曲线相对于参考结合曲线的优度,并且可以提供化学物质的测定的免疫原性反应特性。
60、缓冲液体系是技术人员熟知的,并且可以方便地包括缓冲液ph值为约4至约8的缓冲液体系。优选地,缓冲液体系选自磷酸盐缓冲液体系、pbs(磷酸盐缓冲盐水)缓冲液体系、三(三(羟甲基)氨基甲烷)缓冲液体系和hepes((4-(2-羟乙基)-1-哌嗪乙磺酸)缓冲液体系。
61、如下面将进一步解释的,标记的结合配偶体可以被添加到制备的样品中,或者标记的结合配偶体可以被分配到载液中,该载液在流动步骤中与制备的样品的测试样品部分接触。
62、为了增加准确度,从制备的样品中提供两个或更多相同的测试样品,用以进行一式两份、一式三份或进一步复制的测定。
63、使制备的样品经受流动的步骤优选包括使样品经受层流。有利地,层流被提供足够的时间以进行光学标记物的至少一次读出,优选地,在制备的样品已经处于层流中的情况下,光学标记物的读出在至少5秒钟,诸如至少10秒钟,诸如至少30秒钟,诸如至少1分钟,诸如至少5分钟之后进行。
64、特性流动参数原则上可以是依赖于含有标记的结合配偶体的分子或复合物的分子尺寸或平均分子尺寸的任何流动参数,诸如任何质量传递参数。
65、在特性流动参数包括分散参数、扩散参数如扩散系数、流体动力学半径参数或其任何衍生物的情况下,可以特别获得非常准确的测定。优选地,特性流动参数包括标记的结合配偶体和包含标记的结合配偶体的复合物的加权平均流体动力学半径以及标记的结合配偶体和包含标记的结合配偶体的复合物的加权平均离差或其任何衍生物中的至少一个。
66、一般而言,该方法可以以不同的方式实施,所述方式包括a)在将测试部分引入流动之前,将标记的结合配偶体提供到制备的样品的测试部分中,b)在测试部分已经被引入流动通道之后,任选地其中流动已经被启动,将标记的结合配偶体添加至测试部分,以及c)在测试部分流动的同时,使例如在载液中的标记的结合配偶体与制备的样品的测试部分接触。如上所述,该流动有利地为层流。应当注意,该三种模式可以以任何合适的方式组合。
67、测试部分可以是制备的样品或制备的样品的一部分。为了增加准确度,期望从制备的样品中提供几个测试部分,用以进行2次、3次、4次或更多次测定,并应用测定的平均结果。
68、在一个实施方案中,根据第三模式测试制备的样品的两个或更多个测试部分,其中标记的结合配偶体的浓度在各个测试部分的测试中不同。
69、有利地,该方法包括在制备的样品或其测试部分经受流动之前将标记的结合配偶体添加至制备的样品中,或者该方法包括使标记的结合配偶体在流动通道中与制备的样品接触。
70、在一个实施方案中,将标记的结合配偶体以选定的浓度添加至制备的样品中,优选将标记的结合配偶体与缓冲液的添加一起添加至制备的样品中。
71、标记的结合配偶体可以有利地过量添加。
72、在一个实施方案中,标记的结合配偶体以达到制备的样品中的浓度的量添加,该浓度是天然存在的靶标组分的估计浓度的至少两倍,诸如至少三倍。
73、在一个实施方案中,从生物液体样品提供至少一个制备的样品包括从体液样品提供多个制备的样品,其中多个制备的样品中的每一个的标记的结合配偶体的选定摩尔浓度是相同的或变化至多10mol%,优选地,所有制备的样品的标记的结合配偶体的选定摩尔浓度是相同的或变化至多10mol%,任选地,两个或更多个制备的样品的标记的结合配偶体的选定摩尔浓度彼此不同。
74、在一个实施方案中,标记的结合配偶体以提供其摩尔浓度为化学物质的估计摩尔浓度的至少1%的量添加,优选地,标记的结合配偶体以提供其摩尔浓度为化学物质的估计摩尔浓度的至少5%,诸如至少10%,诸如至少25%,诸如100%或更高的量添加。
75、为了确保以提供高信噪比的化学物质的量进行测定,期望对具有不同化学物质的浓度的测试部分进行测试。因此,如果化学物质非常高,即使一些化学物质被非中和抗体(非-nab)中和,标记的结合配偶体也可能与化学物质结合,从而其可能使得难以检测潜在的非中和抗体(非-nab)。另一方面,如果化学物质的浓度太低,可能根本难以检测到清晰的信号。
76、在优选的实施方案中,从生物液体样品提供至少一个制备的样品包括通过添加缓冲液体系从体液样品提供多个制备的样品,其中各个制备的样品被提供为具有不同的生物液体样品的浓度,优选地,多个制备的样品通过制备稀释系列来提供。
77、在一个实施方案中,特性流动参数的测定通过一种方法来进行,该方法包括使至少一种制备的样品的测试部分和至少一种载液在公共通道中经受层流,其中测试部分与载液界面接触,检测光学标记物的浓度分布并测定特性流动参数。
78、载液可以有利地是缓冲液体系或包含缓冲液体系。缓冲液体系可以例如如上所述。有利地,载液的缓冲液体系具有相同的ph值,并且优选与制备的样品的任选的缓冲液体系相同。
79、在一个实施方案中,载液包含选自化学物质(诸如靶标)和/或对应于(生物类似物)或等同于化学物质的标记的化学物质的另外结合配偶体的另外的活性组分,其中另外的活性组分是未标记的或优选用与标记的结合配偶体的标记物不同的标记物进行标记的。由此可以获得关于免疫原性反应的另外的信息。
80、在一个实施方案中,将至少一种制备的样品的测试部分和至少一种载液沿着公共通道的长度以相应的部分一个接一个地供给到公共通道中,之后使该部分经受层流。测试部分和载液的另外的“塞(plug)”可以以交替的方式供给到通道中。测试部分的每个“塞”可以是相同的或不同的-例如,如上所述的不同测试部分。因此,可以非常快速地提供测试部分的多个测试。
81、如上所述,结合配偶体可以存在于测试部分和载液中的任何一个中。
82、在一个实施方案中,该方法包括在将样品供给到公共通道中之前将标记的结合配偶体添加至制备的样品中。
83、在一个实施方案中,该方法包括在将载液供给到公共通道之前将标记的结合配偶体添加至载液中。
84、在一个实施方案中,将至少一个制备的样品的测试部分供给到公共通道中并与通道中的载液混合,其中载液包含标记的结合配偶体。
85、在一个实施方案中,该方法包括将载液的第一部分供给到公共通道中,将测试部分供给到公共通道中以与载液的第一部分界面接触,以及将载液的第二部分供给到公共通道中以与测试部分界面接触,并使该部分经受层流。
86、在一个实施方案中,提供测试部分和载液以形成层流的相邻层。例如,这可以通过将测试部分和载液供给到公共通道中以彼此相邻且彼此接触地处于层流中来提供。
87、在一个实施方案中,使用包括公共通道和两个或更多个输入通道部分的多分叉通道布置来进行特性流动参数的测定,所述输入通道部分在位于下游的汇合位置汇合以形成公共通道,其中通过将测试部分供给到输入通道部分之一并将载液供给到一个或多个其它的输入通道部分,并且在合并位置下游的公共通道中测试部分与载液界面接触的情况下提供层流,使测试部分和载液经受层流。该方法对于测定分散参数形式的特性流动参数可能非常有效。
88、光学可读标记物可以是任何类型的光学标记物,诸如本领域已知的标记物。在一个实施方案中,光学可读标记物是优选在优选约190nm至约700nm的紫外/可见光波长范围工作的光吸收标记物和/或荧光标记物和/或化学发光标记物。
89、浓度分布的读出原则上可以通过任何方法进行,诸如通过用于进行光学读取的已知方法进行。读出可以例如通过使用读取器装置进行,所述读取器装置包括电子检测器,诸如光电倍增管(pmt)、电荷耦合检测器(ccd光敏电阻)和/或光电二极管,如雪崩光电二极管。
90、在一个实施方案中,当测试部分和载液在检测位置处的通道中处于层流时,在通道的检测位置处进行标记物浓度分布的读出。因此,可以以快速且有效的方式获得非常准确的读数。
91、为了提供显著的信号,期望在读出时该部分和载液处于层流,并且优选地在读出之前至少一段时间处于层流。
92、有利地,在进行标记物浓度分布的检测之前,测试部分和载液处于层流至少5秒钟,诸如至少10秒钟,诸如至少100秒钟,诸如至少200秒钟,诸如0.5-25分钟,诸如1-10分钟。
93、公共通道可以是适于使测试部分经受流动,优选地适于向测试部分和载液提供层流的任何种类的通道。
94、公共通道可以有利地是微流体通道,例如形成微流体设备的一部分的微流体通道。
95、公共通道可有利地具有约1mm或更小,诸如约0.5mm或更小,诸如约0.1mm或更小,诸如约75μm或更小的最大内部尺寸,优选地通道具有圆形或椭圆形横截面形状。
96、在一个实施方案中,通道沿着至少长度部分,诸如沿着其整个长度,具有相等的(多个)内部尺寸。
97、在一个实施方案中,通道具有锥形通道长度部分,诸如变窄的通道长度部分和/或变宽的通道长度部分。
98、在一个实施方案中,液体部分在相同或不同的压力下诸如在至少50毫巴的一个或多个压力下被供给到通道中,优选地在长达约60分钟或更长的时间段内,诸如约5秒钟至约5分钟的时间段内,将各个液体部分中的每一个填充到通道中。
99、在一个实施方案中,流速为约0.1厘米/分钟至约50厘米/秒,诸如约1厘米/分钟至约25厘米/秒,诸如约5厘米/分钟至约10厘米/秒,诸如约10厘米/分钟至约5厘米/秒。
100、在一个实施方案中,如共同未决申请pct/dk2021/050079中所述的装置,不同之处在于评估系统的计算机系统被编程为执行上述方法。另外,该装置未被设置为执行条件跳转。
101、有利地,温度保持恒定,优选温度为5至37℃,诸如15至30℃。
102、已经发现,制备的样品在经受层流之前不需要经受孵育时间,然而,当结合配偶体在其测试部分经受流动之前被添加至制备的样品时,使制备的样品经受孵育可能是有益的,从而减少所需的流动时间。
103、在一个实施方案中,每个制备的样品在经受层流之前经受孵育时间,其中在提供层流之前孵育时间为至少5秒钟,诸如至少10秒钟,诸如0.5-10分钟,例如1-5分钟。
104、在一个实施方案中,使一个或多个制备的样品经受更长的孵育时间,诸如1小时或更长,例如过夜孵育,诸如16-24小时。
105、各个参考值有利地包括代表非免疫原性反应的值,该非免疫原性反应优选没有或具有微量水平的化学物质的中和抗体(nab)和非中和抗体(非-nab)。供选择地,(多个)参考值可以选择为代表具有显著水平的非中和抗体(非-nab)的免疫原性反应的(多个)值,或者(多个)参考值可以选择为代表具有显著水平的中和抗体(nab)的免疫原性反应的(多个)值。
106、在一个实施方案中,各个参考值以参考结合曲线诸如作为化学物质的浓度的函数的特性流动参数的结合曲线的形式提供,所述特性流动参数例如是化学物质和标记的结合配偶体的流体动力学半径参数或分散参数,优选没有或有微量水平的化学物质的中和抗体(nab)和非中和抗体(非-nab)。
107、参考值可以通过计算或其组合从先前的测定中提供。
108、在一个实施方案中,各个参考值包括至少一个从先前对来自具有非免疫原性反应的个体的一个或多个生物液体样品进行的测定中获得的参考值。优选地,参考值的先前测定是针对生物液体样品和/或化学物质的相应浓度获得的并与之相关联。
109、已经发现非常有益的是,至少一个参考值代表对没有抗药物抗体或仅有微量或可接受水平的化学物质的中和抗体(nab)和/或非中和抗体(非-nab)的生物液体测定的正常反应。
110、特别地,已经发现使用代表正常反应的一个或多个参考值在测定免疫原性反应特性,特别是测定免疫原性反应是阳性(无不利作用)还是阴性(有(多个)不利作用的风险)方面提供增加的准确度。特别地,可以降低假阳性的风险。
111、在一个实施方案中,在测定的特性流动参数是数字测定的情况下,使用代表正常反应的一个或多个参考值提供有效且准确的基础,其用于将免疫原性反应特性分类成例如免疫原性反应的水平和/或免疫原性反应的特征,诸如非免疫原性反应、包括中和抗体(nab)形成的免疫原性反应和/或包括非中和抗体(非-nab)形成的免疫原性反应。
112、在一个实施方案中,各个参考值包括至少一个计算的参考值,优选基于化学物质的分子尺寸、标记的结合配偶体的分子尺寸、化学物质和标记的结合配偶体的kd值(平衡解离常数)、标记的结合配偶体和/或包含标记的结合配偶体和化学物质的复合物的分散和/或其任何衍生物、制备的样品和/或载液的粘度中的一个或多个。例如,分子尺寸可以作为流体动力学半径或由分子扩散率来测定。
113、在一个实施方案中,各个参考值包括参考结合曲线和/或从中获得的参考值。参考结合曲线可以例如分别基于标记的结合配偶体和标记的结合配偶体-化学物质复合物的平衡解离常数(kd)和流体动力学半径参数或分散参数。
114、可以提供与标记的结合配偶体、化学物质的分子尺寸和浓度和/或kd值的集合相关的参考值列表用于一般应用。对于一些标记的结合配偶体、化学物质的分子尺寸和浓度和/或kd值的集合,列出的参考值可在rcsb蛋白质数据库https://www.rcsb.org/中找到。
115、在一个实施方案中,各个参考值包括通过计算的和/或测定的参考值的回归分析获得的至少一个参考值。
116、为了提供测定的特性流动参数的快速光栅,可能期望提供给定化学物质/标记的结合配偶体对的因子分类。这种光栅系统对于快速免疫原性反应测定可能非常有益,并且在该方法包括筛选方法的情况下特别有益。
117、在一个实施方案中,各个参考值包括由与生物液体样品的选定浓度或化学物质的选定浓度相关联的反应因子分类提供的至少一个参考值。优选地,反应因子分类包括指示非免疫原性反应的因子范围、指示包括中和抗体(nab)形成的免疫原性反应的因子范围和/或指示包括非中和抗体(非-nab)形成的免疫原性反应的因子范围的指示。
118、有利地,由与生物液体样品的选定浓度或化学物质的选定浓度相关联的反应因子分类提供的一个或多个诸如全部各个参考值是分别表示对以下进行测定的各个响应的参考值:
119、a)没有抗药物抗体或仅有微量或可接受水平的化学物质的中和抗体(nab)和/或非中和抗体(非-nab)的生物液体,
120、b)具有选定水平的化学物质的中和抗体的生物液体,以及
121、c)具有选定水平的化学物质的非中和抗体(非-nab)的生物液体。
122、在一个实施方案中,b)和/或c)可以具有两个或更多个具有不同选定水平的子水平。
123、在一个实施方案中,该方法包括用于治疗涉及靶标分子的医学病症的药物候选物(诸如活性剂)形式的化学物质的体外测试,其中该方法包括根据选定的程序用药物候选物处理包含靶标的细胞培养物,并从细胞培养物中获得生物液体样品,优选地,该方法还包括测定药物候选物是否通过作为药物候选物,例如用于进一步分析、用于开始临床测试、用于批准使用等。
124、选定的程序可以是任何程序,例如在一段时间内使细胞培养物一次或几次经受选定的药物浓度。在一个实施方案中,选定的程序可以对应于估计的给药计划,例如包括剂量/给药时间等。
125、所述筛选方法可以包括例如以高通量的方式筛选多种药物候选物,例如用于排除具有产生不期望的免疫原性反应的高风险的药物或用于检测各种条件下的免疫原性反应。
126、在一个实施方案中,提供每种药物候选物的制备的样品包括向选定浓度的生物液体样品或选定浓度的药物候选物中添加缓冲液体系,其中将测定的特性流动参数与各个参考值进行比较并测定化学物质对(多个)药物候选物的免疫原性反应特性的步骤包括将测定的特性流动参数与和生物液体样品的或药物候选物的选定浓度相关的反应因子分类进行比较,并将测定的免疫原性反应分类为非免疫原性反应、包含中和抗体(nab)形成的免疫原性反应或包含非中和抗体(非-nab)形成的免疫原性反应。
127、对于非常粗略和快速的分类,对生物液体样品的单一浓度/化学物质的浓度进行测试可能就足够了。为了改善准确度,可能期望对几种生物液体样品的浓度/化学物质的浓度进行测试。
128、在一个实施方案中,对至少两种不同选定浓度的生物液体样品或药物候选物进行各自的测定。
129、所述药物候选物可以有益地是用于开发用于治疗疾病诸如用于治疗癌症、心血管疾病、代谢性疾病或神经退行性疾病中的至少一种的药物的药物候选物。
130、有利地,药物候选物是用于治疗个体的病症的药物候选物,并且样品诸如生物液体和/或细胞培养物是个体的样品。
131、在一个实施方案中,所述样品是接受用该药物候选物的治疗的预检查的个体的样品,并且其中测定的反应特性指示该个体的产生由该药物候选物触发的不期望的免疫原性反应的风险。
132、该方法可优选被施用于测定例如当个体用化学物质治疗时,在免疫原性反应或免疫原性反应的变化方面监测个体。
133、在一个优选的实施方案中,生物液体样品是从根据药物给药方案经受用该化学物质的治疗的个体中获得的样品,并且其中测定的反应特性指示治疗的反应。
134、有利地,测定的反应特性指示治疗的反应是否涉及抗药物抗体(ada)的形成,并且优选指示ada产生的水平和/或治疗是否涉及中和抗体(nab)的形成或非中和抗体(非-nab)的形成。
135、在一个实施方案中,该方法包括将测定的免疫原性反应分类为非免疫原性反应、包含中和抗体(nab)形成的免疫原性反应或包含非中和抗体(非-nab)形成的免疫原性反应。
136、在一个实施方案中,测定的反应特性可以指示维持或调整药物给药方案。因此,基于测定的免疫原性反应特性,医生可以决定根据当前的药物给药方案继续对个体进行治疗,或者医生可以决定用调整的药物给药方案诸如减少给药剂量或降低给药频率继续治疗,或者在没有不期望的免疫原性反应指示的情况下,医生可以决定增加给药剂量或频率。
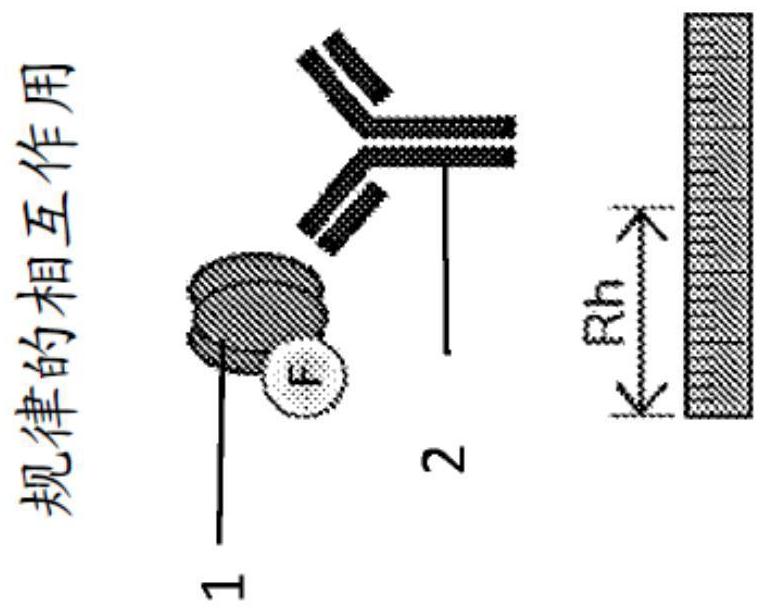
137、在一个实施方案中,测定的反应特性指示终止用该药物的治疗,并且基于此,医生可以决定终止治疗或改用另一种药物。
138、包括范围和优选范围的本(多个)发明及其实施方案的所有特征可以在本发明的范围内以各种方式组合,除非有特定原因不组合这种特征。
139、实施例和附图的简述
140、下面结合实施例和实施方案并参考附图进一步说明本发明。附图是示意性的,可能没有按比例绘制。给出实施例和实施方案仅仅是为了说明本发明,不应该解释为限制本发明的范围。
141、图1a、1b和1c是显示ada分类作为tnf-α(指示剂)和阿达木单抗(分析物)的表观流体动力学半径(rh)的函数的示意图。
142、图2图示说明评估系统的实施方案,该评估系统可被施用于进行本发明的方法实施方案的特性流动参数的评估。
143、图3图示说明实施例1a中使用的注射过程。
144、图4图示说明实施例1b中使用的注射过程。
145、图5图示说明实施例1c中使用的注射过程。
146、图6显示在实施例1a中测试的40份血清样品的特性流动参数的测定结果。
147、图7显示作为实施例1a中测定的血清浓度的函数的tnf-α-af488(100nm)单独+其复合物的流体动力学半径。
148、图8显示可以识别的30份被分类为nab阳性、正常反应者和非-nab阳性的测试血清样品。
149、图9显示实验组(30名患者)的归一化的药物反应因子(drfnorm)的分布。
150、图1a-1c图示说明标记的结合配偶体或包含标记的结合配偶体的复合物的流体动力学半径(rh)。标记的结合配偶体1由荧光标记f标记。在图1a中,标记的结合配偶体1结合至化学物质2。这表明有规律的相互作用。rh显示在图1a的底部。
151、在图1b中,标记的结合配偶体1结合至化学物质2。然而,化学物质2已经结合至非中和抗体(非-nab)3。这表明涉及非中和抗体(非-nab)的免疫原性反应。rh显示在图1b的底部,可以看出它大于正常相互作用的rh。
152、在图1c中,标记的结合配偶体是1是未结合的。这是因为化学物质2与中和抗体(nab 4)结合并被中和抗体(nab 4)中和。这表明涉及中和抗体(nab)的免疫原性反应。图1b底部所示的rh是标记的结合配偶体的rh,可以看出它小于正常相互作用的rh。
153、图2的评估系统包括具有隔室31的装置11,隔室31包括形成通道的微流体单元4。
154、隔室13包括多个用于容纳各个制备的样品和缓冲液的母样品容器17。样品容器17布置在支撑单元17a中。支撑单元17a有利地包括用于将各个母样品容器17中的液体温度控制到可选温度的温度控制器。隔室13包括抽取装置,该抽取装置包括连接到多个抽取管16的泵装置15。各个管16可以手动插入期望的母样品中。在一个实施方案中,装置11包括适于将(多个)管16插入选定的(多个)母样品容器中的机械臂。
155、在该实施方案的变型中,抽取装置包括单个抽取管,该单个抽取管可以从一个母样品容器移动到用于收集第一液体部分和第二液体部分以及任选的(多个)其它液体部分的另一个母样品容器。
156、装置11包括用于提供入口的进入隔室13中的铰链11b盖11a。
157、在该实施方案中,提供了具有窄直径的管形式的微流体单元14,用于确保(多个)测试样品的层流。管14连接到泵装置,使得泵能够以期望的压差将取出的母样品泵送到微流体单元14的通道中。
158、隔室13还包括形成计算机系统部分的计算机9。计算机适于控制装置11的元件。计算机19连接到读取器装置21,该读取器装置21定位成从微流体单元14的通道的读取位置14b进行光学读取。
159、隔室13包括用于控制隔室13中的温度以保持期望的温度的温度控制器18。
160、废物室20被定位用于收集用过的液体部分和通过微流体单元14的通道的任选的清洁流体。
161、在使用中,使用抽取装置的管16和泵装置15从各个选定的母样品容器17中抽取第一液体部分和第二液体部分。
162、液体部分被连续供给到微流体单元14的通道中,以在第一液体部分和第二液体部分之间提供界面接触。此后,液体部分被泵向读取装置21。
163、实施例
164、实施例1a.
165、在该实施例中,tnf-α是基于单克隆抗体的药物诸如阿达木单抗形式的化学物质的药物靶标。基于抗体的药物化合物的作用模式是结合和中和患者体内的tnf-α。
166、tnf-α使用荧光报告剂诸如alexa fluor 488、fitc、atto-488或类似物进行示踪。
167、材料和方法
168、重组人tnf-α(目录号ab155699)购自abcam(cambridge,united kingdom)。alexafluor 488(目录号a20181)示踪试剂盒购自thermo fisher(waltham,ma,usa)。二水合磷酸氢二钠和一水合磷酸二氢钠购自merck(darmstadt,germany)。纯净水(18.2mω-cm,25℃)从sg超清水净化系统(sg water,barsbuttel,germany)获得。制备67mm磷酸盐缓冲液(ph7.4),过滤(来自frisenette(knebel,denmark)的q-max 0.45μm尼龙注射器过滤器)并用作试验缓冲液。使用商业示踪试剂盒用alexa fluor 488示踪tnf-α。
169、fida(流动诱导的分散分析)实验在fida 1平台仪器上进行,该fida 1平台仪器采用发光二极管(led)诱导的荧光检测,激发波长:480nm,发射波长:>515nm。fida1平台仪器可从fida biosystems aps(copenhagen,denmark)购得。
170、来自fida biosystems的内径75μm、外径375μm、总长度100cm、检测窗口长度84cm的标准毛细管用于所有实验。毛细管在使用前涂覆有高灵敏度涂层试剂(从fidabiosystems可获得)。
171、对40名患者测定了化学物质阿达木单抗的免疫原性反应特性。5名患者,即患者1-5未用阿达木单抗治疗,5名患者,即患者6-10用阿达木单抗以外的另一种tnf抑制剂治疗,剩余30名患者用阿达木单抗治疗。向患者给予阿达木单抗的目的是达到恒定的阿达木单抗血清浓度。实际上,它可能变化高达50%。
172、通过添加试验缓冲液67mm磷酸盐缓冲液(ph 7.4)从每个血清样品中提供多个制备的样品,即8个制备的样品。8个制备的样品以稀释系列提供,缓冲液中的血清浓度以体积/体积%计:40、20、15、10、5、1、0.1和0.01。
173、以下逐步程序被施用于fida测定(即,使制备的样品的测试样品经受与标记的结合配偶体tnf-α-af488(也称为指示剂)接触的流动并读出),每个样品的总分析时间为5-6分钟。
174、首先,试验缓冲液(ph 7.4;67mm)用于在3500毫巴下冲洗和平衡hs涂覆的毛细管120秒。然后在3500毫巴下将制备的样品的第一部分填充到毛细管中,持续20-25秒,随后在50毫巴下注射已经混合了指示剂(浓度为100nm的tnf-α-af488)的制备的样品的第二部分(测试部分)10秒。最后,将包括测试部分的先前注射的部分与制备的样品的第三部分一起在400毫巴下转移至荧光检测器,持续180-240秒。
175、注射过程在图3中图示说明。箭头指示流动方向。
176、在该实施例中,制备的样品的第二部分是测试部分,如上所述,测试部分包含tnf-α-af488,其以制备的样品的第二2部分为前提。
177、应该注意的是,第一部分和第三部分可以用含或不含阿达木单抗的血清或缓冲液代替。
178、结合曲线形式的参考值
179、使用fida 1平台仪器在缓冲液中以及在健康(未治疗)个体的血浆中测定荧光示踪的tnf-α的流体动力学直径rh。数据分析在fida 1平台仪器附带的软件中进行。结果证实tnf-α的三聚体结构(rh=3.2nm)。用阿达木单抗滴定荧光示踪的tnf-α,以测定用作参考结合曲线的结合曲线。
180、试验一式三份进行。
181、结果
182、特性流动参数的测定结果如图6所示。
183、来自参考结合曲线的参考值被用作基准值。基于每个患者的值,测定药物反应是否为正常药物反应,是否存在非中和抗体(非-nab)或是否存在中和抗体(-nab)。
184、图7显示作为患者11-40的血清浓度(0-40%体积/体积)的函数的tnf-α-af488(100nm)单独+其复合物的流体动力学半径。虚线显示在20%体积/体积血浆中使用标准曲线的基准值。灰色区域表示8μg/ml(~54nm)阿达木单抗的稳态血清浓度的50%的偏差。
185、基于30名患者(11-40)的结果,测定每位患者的药物反应因子(drf)作为表观kd值。拟合优度基于与给定患者相关的测量值,是测量值与结合模型拟合程度的衡量标准。归一化的药物反应因子(drfnorm)被测定为drf和基准drf(正常反应)的比值。
186、如图8所示,可以识别出被分类为nab阳性、正常反应者和非-nab阳性的患者。
187、图9显示实验组(30名患者)的归一化的药物反应因子(drfnorm)的分布。
188、实施例1b
189、实施例1b类似于实施例1a,唯一的区别在于使用了不同的注射方法。这里,示踪的tnf-α和患者血清在毛细管中混合。
190、注射过程在图4中图示说明。
191、将制备的样品的第一部分,其在该实施例中为测试部分,在3500毫巴下填充到毛细管中,持续20-25秒,随后注射具有指示剂(浓度为100nm的tnf-α-af488)的缓冲液的第二部分。最后,将包括测试部分的先前注射的部分与制备的样品的第三部分一起在400毫巴下转移至荧光检测器,持续180-240秒。
192、图3中的注射方案允许探测缔合动力学。对于快速缔合动力学,结果将类似于实施例1a。然而,实施例1b具有非常有限的样品制备的另外的优势。
193、实施例1c
194、实施例1c类似于实施例1a,唯一的区别在于使用了不同的注射方法。这里,示踪的tnf-α和制备的测试部分被预混合并注射到毛细管中。然而,毛细管并不像1a和1b中那样填充有制备的样品。相反,使用缓冲溶液来移动样品。注射过程在图5中图示说明。
195、将一部分缓冲液在3500毫巴下填充到毛细管中,持续20-25秒,随后在50毫巴下注射已经混合了指示剂(浓度为100nm的tnf-α-af488)的制备的样品的测试部分10秒。最后,将包括测试部分的先前注射的部分与一部分缓冲液在400毫巴下移动至荧光检测器,持续180-240秒。
196、图5中的注射方案允许探测复合物的解离动力学。
197、实施例2
198、fida方法是允许计算响应的“第一原则”。因此,“正常”反应和药物活性可以用预先了解的kd和靶标(指示剂)和复合物的尺寸来计算。例如,指示剂和复合物的尺寸可以从具有原子坐标的pdb文件中计算出来。
199、实施例3
200、实施例1可以使用任何可溶性药物靶标和生物药物进行。在药物靶标是膜蛋白的情况下,使用纳米盘或洗涤剂/脂质来溶解蛋白可能是有利的。
201、实施例4
202、对病毒感染的免疫反应。
203、这里,靶标是病毒上的表面蛋白。否则,该实施例如实施例1那样进行。两种结果是显示没有针对病毒表面蛋白的抗体以及尺寸对应于与病毒自身抗体结合的区域的未感染的“非结合区域”。
204、实施例5
205、对疫苗接种的免疫反应。
206、该实施例类似于实施例4,但使用了人工疫苗蛋白。疫苗蛋白可以是疫苗上的表面蛋白或患者作为疫苗接种的一部分产生的蛋白。
207、实施例6
208、测量自身抗体的中和能力。
209、这里,靶标是荧光示踪的病毒表面蛋白(或它的部分),内源性细胞表面受体(receptor)是受体(acceptor)。指示剂和受体被添加到患者血清中以形成指示剂样品。受体样品由患者血清和受体组成。如实施例1进行血清滴定(指示剂浓度保持不变,受体在患者血清稀释液中变化。结合(非中和)抗体将显示出比预期更大的复合物尺寸(如实施例1),而中和抗体将导致不结合或结合中断(如实施例1)。
210、实施例7
211、在该实施例中,实施例6中的试验被颠倒,使得病毒表面蛋白是分析物,指示剂是荧光示踪的内源性细胞表面受体。
212、实施例8
213、用于靶标的内源性存在的校正。
214、在一些情况下,需要考虑未示踪的内源性靶标的存在。这可以通过简单地增加内源靶标的浓度来调整计算中的示踪的靶标浓度来实现。
215、实施例9
216、免疫性疾病
217、针对自身抗原(如蛋白质、dna等)的免疫反应和自身抗体。这里,靶标是自身抗原。否则,该实施例如实施例1那样进行。两种结果是显示没有针对自身抗原的抗体以及尺寸对应于与自身抗原结合的区域(免疫反应)的“无免疫反应/非结合区域”。
- 还没有人留言评论。精彩留言会获得点赞!