肝病的预诊检测的制作方法
本发明涉及病人的预诊,尤其是患有肝病的患者。更具体地,本发明涉及用于评估受试者死亡风险或肝脏相关事件风险的非侵入性的预诊方法。
背景技术:
流行病学数据突显了肝脏疾病在世界范围内产生显著的负担,包括在美国和欧洲。最普通的肝病由过量的酒精摄入引起,或者由感染丙型肝炎和乙型肝炎病毒所引起,并且与肥胖和代谢综合症(非酒精性脂肪肝)相关的比例逐渐提高。慢性肝病是发病和死亡的重要原因。
现有技术中,兴趣主要专注于诊断这些患者。例如,申请人申请了数个用于评估肝病的存在和/或严重性的方法的专利申请。这些方法为诊断方法,即详述了有关的肝脏组织活检及诊断纤维化、显著的纤维化或肝硬化的靶标。诊断方法中,通过与活检比较评估生物标记与纤维化阶段的关联。
诊断方法提供了关于纤维化严重性的有效信息。然而,进一步需要帮助患者做出临床监测的决定,并帮助早期识别具有肝脏相关并发症或死亡危险的患者。
该进一步需要可通过预诊方法实现,即基于一组对照患者的预期寿命或基于一组对照患者经受的并发症评估生物标记相关性的方法。
现有技术中,不同的评分与肝硬化的预诊相关,例如MELD评分和Child-Pugh评分。MELD评分(其中MELD代表晚期肝病模型)在于血清肝红素与肌酸酐水平、凝血酶原时间和肝病的病因的国际标准化比率(INR)的数学组合(Kamath等,Hepatology 2001;33:464-470)。Child-Pugh评分基于总肝红素、血清白蛋白、国际标准化比率(INR)或凝血酶原时间、腹水和肝脏性脑病的组合。
然而,MELD评分和Child-Pugh评分都仅涉及肝硬化的预诊(Metavir F4阶段),并且不能帮助患有较少纤维化程度的患者的预诊,例如Metavir F0、F1、F2或F3纤维化阶段。
其它最近的研究使用对酒精性肝病患者的存活率预测的诊断学测试。例如,Naveau等(Hepatology 2009,49(1):97-105)描述了在多变量分析中使用Fibrotest生物标记(诊断评分),用于产生称为Fibrotest预诊的预诊评分。
此外,Vergniol等(Gastroenterology 2011;140:1970-1979)研究了肝脏硬度、FibroTest、APRI或FIB-4用于预测肝病患者中存活或与肝脏相关的死亡的效率。Vergniol等推断肝脏硬度和FibroTest都可用于预测存活或与肝脏相关的死亡,并且他们的数学组合呈现显著的预诊准确性。然而,FibroTest、肝脏硬度和它们的组合的精确性之间没有统计上的差异。此外,Vergniol等未描述或给出用于评估肝脏相关事件危险性的预诊检测。
对预诊应用诊断性检测可能不会产生最精确的预诊。本发明旨在基于血液生物标记、临床标记、检测和/或物理数据的多变量数学组合,提出设计用于预诊的评分及方法。与现有技术的预诊检测相比,本发明的预诊检测容许评估死亡的风险,具有提高的准确性,并且进一步容许评估与肝脏相关事件的风险。
技术实现要素:
本发明涉及用于评估受试者的死亡风险或与肝脏相关事件风险的体外非侵入性预诊方法,所述方法包括:
a.从所述受试者获得下面的变量中的至少1种,优选至少2种:
ⅰ.在所述受试者的样品中测量的生物标记,优选地,所述生物标记选自包括以下的组中:血糖、总胆固醇、HDL胆固醇(HDL)、LDL胆固醇(LDL)、AST(天冬氨酸转氨酶)、ALT(丙氨酸转氨酶)、AST/ALT、AST.ALT、铁蛋白、血小板(PLT)、AST/PLT、凝血酶原时间(PT)或凝血酶原指数(PI)、透明质酸(HA或透明质酸盐)、血红蛋白、甘油三酯、α-2巨球蛋白(A2M)、γ-谷氨酰转肽酶(GGT)、尿素、肝红素、载脂蛋白A1(ApoA1)、III型原胶原N-末端前肽(P3NP)、γ-球蛋白(GBL)、钠(Na)、白蛋白(ALB)、铁蛋白(Fer)、葡萄糖(Glu)、碱性磷酸酶(ALP)、YKL-40(人类软骨糖蛋白39)、基质金属蛋白酶1的组织抑制剂(TIMP-1)、TGF、细胞角蛋白18和基质金属蛋白酶2(MMP-2)至9(MMP-9)、它们的比例及数学组合;
ⅱ.临床数据,优选选自以下的组中:体重、体质指数、年龄、性别、臀围、腹围或身高以及它们的数学组合;
ⅲ.二元标记,优选选自包括糖尿病、SVR、病因或NAFLD的组中;
ⅳ血液检测结果,优选选自包括FibroMeter、CirrhoMeter、ELF评分、FibroSpect、APRI、FIB-4和Hepascore的组中,其中,所述血液检测不是Fibrotest;
b.任选择地,通过多变量组合获得至少一个血液检测结果,优选用步骤(a)中获得的至少一个变量的二元逻辑回归,所述血液检测不是Fibrotest,
c.从医学影像或临床测量,优选根据弹性测定法,更优选根据振动控制的瞬时弹性成像(VCTE)获得至少一个物理数据,以及
d.以多变量时间相关模型数学地组合:
—步骤(a)中获得的所述至少一个变量和/或步骤(b)中获得的所述至少一个血液检测结果;以及
—步骤(c)中获得的所述至少一个物理数据,
从而获得预诊评分。
在一个实施方式中,所述至少一个物理数据为肝脏硬度测量(LSM),优选通过VCTE测量。
在一个实施方式中,步骤(a)中获得的所述至少一个变量是将用于获得血液检测结果的变量的组,所述血液检测结果选自包括以下的组中:FibroMeter、CirrhoMeter、ELF评分、FibroSpect、APRI、FIB-4和Hepascore,并且步骤(d)包括以多变量时间相关模型组合所述变量的组,以及/或者步骤(b)中获得的所述至少一个血液检测选自包括FibroMeter、CirrhoMeter、ELF评分、FibroSpect、APRI、FIB-4和Hepascore的组中。
在一个实施方式中,所述方法包括在步骤(d)中以多变量时间相关模型数学地组合下面所述的变量或至少下面所述的变量:
—凝血酶原指数、肝红素、尿素、透明质酸、LSM、年龄和性别,或者
—年龄、性别、病因、LSM、AST和尿素,或者
—年龄、性别、NAFLD、LSM、AST和尿素,或者
—年龄、性别、LSM、AST和尿素,或者
—年龄、性别、NAFLD、凝血酶原时间、肝红素、尿素和LSM,或者
—年龄、性别、NAFLD、凝血酶原时间、AST、尿素和LSM,或者
—年龄、性别、凝血酶原时间、肝红素、尿素、透明质酸和LSM,或者
—年龄、性别、凝血酶原时间、肝红素、尿素和LSM,或者
—年龄、性别、凝血酶原时间、AST、尿素和LSM,或者
—年龄、性别、病因、AST、尿素和LSM。
本发明的另一个目的是用于评估受试者与肝脏相关事件风险,尤其是并发症的体外非侵入性预诊方法,所述方法包括:获得并以多变量时间相关模型数学地组合:
a.至少一个生物标记,优选选自包括以下的组中:血糖、总胆固醇、HDL胆固醇(HDL)、LDL胆固醇(LDL)、AST(天冬氨酸转氨酶)、ALT(丙氨酸转氨酶)、AST/ALT、AST.ALT、铁蛋白、血小板(PLT)、AST/PLT、凝血酶原时间(PT)或凝血酶原指数(PI)、透明质酸(HA或透明质酸盐)、血红蛋白、甘油三酯、α-2巨球蛋白(A2M)、γ-谷氨酰转肽酶(GGT)、尿素、肝红素、载脂蛋白A1(ApoA1)、III型原胶原N-末端前肽(P3NP)、γ-球蛋白(GBL)、钠(Na)、白蛋白(ALB)、铁蛋白(Fer)、葡萄糖(Glu)、碱性磷酸酶(ALP)、YKL-40(人类软骨糖蛋白39)、基质金属蛋白酶1的组织抑制剂(TIMP-1)、TGF、细胞角蛋白18和基质金属蛋白酶2(MMP-2)至9(MMP-9)、它们的比例及数学组合;
b.任选择地,至少一个临床数据,优选选自包括体重、体质指数、年龄、性别、臀围、腹围或身高及其数学组合的组中;
c.任选择地,至少一个二元标记,优选选自包括糖尿病、持续病毒应答(SVR)、病因或NAFLD的组中,以及
d.任选择地,至少一个血液检测结果,优选选自包括FibroMeter、CirrhoMeter、ELF评分、FibroSpect、APRI、FIB-4和Hepascore的组中,
从而获得预诊评分。
在一个实施方式中,所述方法包括:以多变量时间相关模型数学地组合下面所述的变量或至少下面所述的变量:
—透明质酸、AST、SVR、血小板和GGT,或者
—透明质酸、血小板和SVR,或者
—透明质酸和SVR。
在一个实施方式中,所述方法进一步包括以多变量时间相关模型数学地组合来自医学影像或临床测量的至少一个物理数据,优选弹性测定法,更优选振动控制瞬时弹性成像(VCTE),甚至更优选地所述至少一个物理数据为通过振动控制瞬时弹性成像(VCTE)测定的LSM。
在一个实施方式中,所述多变量时间相关模型为COX模型,并且/或者,其中,所述多变量COX模型为定时的或时间依赖性,优选为时间依赖性。
本发明还涉及用于评估受试者的死亡风险和/或与肝脏相关事件风险的体外非侵入性预诊方法,所述方法包括:
a.从所述受试者获得第一血液检测结果,
b.从所述受试者获得第二血液检测结果,以及
c.以组合分类组合所述至少一个第一血液检测结果和所述至少一个第二血液检测结果,从而评估死亡风险和/或与肝脏相关事件的风险。
在一个实施方式中,所述第一血液检测为FibroMeter,并且所述第二血液检测结果为CirrhoMeter。
在一个实施方式中,死亡是全因死亡和/或与肝脏相关的死亡。
在一个实施方式中,所述与肝脏相关事件,尤其是并发症,选自包括以下的列表:腹水、脑病、黄疸、重度食管静脉曲张的发生、静脉曲张破裂出血、胃肠出血、肝脏肾综合症、肝脏细胞癌、肝脏移植、食管静脉曲张和门静脉高压。
在一个实施方式中,所述受试者患有肝病,所述肝病优选选自包括以下的列表:严重的波尔图隔膜(porto-septal)纤维化、严重的波尔图隔膜纤维化、小叶中心(centrolobular)纤维化、肝硬化、窦周纤维化,所述纤维化为酒精性或非酒精性来源,以及/或者所述受试者是患有慢性病的患者,优选所述慢性疾病选自包括以下的组中:慢性病毒性肝炎C、慢性病毒性肝炎B、慢性病毒性肝炎D、慢性病毒性肝炎E、非酒精性脂肪肝病(NAFLD)、慢性酒精性肝病、自身免疫肝炎、原发性胆汁性肝硬化、血色沉着病和威尔逊氏病(Wilson disease)的组。
在一个实施方式中,由计算机实施本发明的方法。
本发明的另一个目的为微处理器,其包括执行本发明的方法的计算机算法。
定义
在本发明中,下面的术语具有下述含义:
—“预诊”是指统计预测受试者在特定的时期内发生死亡或与肝脏相关事件(或者首次肝脏相关事件),例如在至少3个月的期间,优选3个月,6个月,9个月,或者1、2、3、4、5、6、7、8、9或10年期间的评估。因此,术语“预诊”涉及评估受试者死亡或与肝脏相关事件的特定风险。
—“与肝脏相关事件”是指需要特定治疗或照料的肝脏相关事件或并发症,或者涉及患者的肝病或病症的发展,包括但不限于黄疸、腹水、脑病、静脉曲张破裂出血、肝脏细胞癌、严重感染(像感染性休克)、肝脏肾综合症、肝脏肺综合症。
—本发明上下文中的“风险”是指在特定的时期将发生死亡或肝脏相关相关的可能性,并且可意味着受试者“绝对的”风险或“相对的”风险。绝对风险可参考相关时间群组的实际观测后测量(actual observationpost-measurement),或参考从相关时期内遵循的统计上有效的历史群组产生的指数值来测量。相对风险是指受试者的绝对风险与低风险群组的绝对风险或平均群体风险的比率,其可根据临床风险因子的评定方式而变化。通常还使用比值比,其是指定测试结果的阳性事件与阴性事件的比例(比值是根据公式p/(1-p),其中p是事件概率,而(1-p)是没有事件的概率)。在一个实施方式中,本发明的方法可进一步包括比较从所述受试者获得的预诊评分与对照评分的步骤。
—“评分”是指通过至少一个生物标记和/或至少一个临床数据和/或至少一个物理数据和/或至少一个二元标记和/或至少一个血液检测结果的数学组合(单变量或多变量变量)获得的任何数值。在一个实施方式中,评分是未绑定的数值。在另一个实施方式中,评分是通过数学函数获得的绑定的数值。优选地,0~1的评分范围。在一个实施方式中,评分中数学地组合的至少一个生物标记和/或至少一个临床数据和/或至少一个物理数据和/或至少一个二元标记和/或至少一个评分是独立的,即,给出的每条信息是不同的,并且未与他人给出的信息相联系。
—数字前的“约”意思是所述数值加减10%。
—“生物标记”是指可在受试者样品中测量的变量,其中,所述样品可为体液样品,例如血液、血清或鸟样,优选血液或血清样品。
—“临床数据”是指从受试者的外部观察获得的数据,不用使用实验室检测等。
—“二元标记”是指标记具有0或1的值(或者是或否)。
—“物理数据”是指通过物理方法获得的变量。
—“血液检测”相当于包括无创测量至少一个数据的检测,并且当测量所述至少两个数据时,数学地组合在评分内的至少两个数据。本发明中,所述数据可为生物标记、临床数据、物理数据、二元标记或它们的任何组合(例如,评分内的任何数学组合)。
具体实施方式
本发明涉及受试者中的体外预诊方法,优选涉及非侵入体外预诊方法,用于预测死亡(优选肝脏相关死亡)或肝脏相关事件,尤其是并发症。因此,还可定义本发明的方法为评估受试者中死亡风险或肝脏相关事件的风险的体外方法,尤其是并发症。本发明还涉及体外预诊方法,优选涉及非侵入体外预诊方法,用于确定受试者中死亡或肝脏相关事件增加的风险。通过反映识别能力的Harrell’s C指数评估本发明预诊方法的预测效力。
在一个实施方式中,本发明的预诊方法具有至少约0.70的Harrell’s C指数,优选至少约0.71、0.72、0.73、0.74、0.75、0.76、0.77、0.78、0.79、0.80、0.81、0.82、0.83、0.84、0.85、0.86、0.87、0.88、0.89、0.90、0.91、0.92、0.93、0.94、0.95、0.96、0.97、0.98、0.99或更大。
因此,本发明涉及用于评估受试者的死亡风险和/或与肝脏相关事件风险的体外预诊方法,优选地所述方法为非侵入性,所述方法包括:
a.从所述受试者获得至少1种下面的变量:
ⅰ.在所述受试者的样品中测量的生物标记;
ⅱ.临床数据;
ⅲ.二元标记;
ⅳ.血液检测结果;
b.任选择地,通过单变量组合获得至少一个血液检测结果,优选用步骤(a)中获得的至少一个变量的二元逻辑回归,所述血液检测不是Fibrotest,
c.从医学影像或临床测量,优选从弹性测定法,更优选振动控制的瞬时弹性成像(VCTE)获得至少一个物理数据,以及
d.以多变量时间相关模型数学地组合:
—步骤(a)中获得的所述至少一个变量和/或步骤(b)中获得的所述至少一个血液检测结果;以及
—步骤(c)中获得的所述至少一个物理数据,
从而获得预诊评分。
在一个实施方式中,步骤(b)中获得的所述血液检测不是APRI、FIB-4或Actitest。
在一个实施方式中,步骤(a)中获得至少2个,优选2、3、4、5、6、7、8或更多的变量。
在一个实施方式中,本发明的方法进一步包括根据步骤(d)中获得的预诊评分,评估受试者中死亡风险和/或与肝脏相关事件风险(尤其是并发症)的步骤。
在一个实施方式中,本发明的方法包括在步骤(d)中以多变量时间相关模型数学地组合步骤(a)中获得的所述至少一个变量和步骤(c)中获得的所述至少一个物理数据。
在另一个实施方式中,本发明的方法包括在步骤(d)中以多变量时间相关模型数学地组合步骤(b)中获得的所述至少一个血液检测和步骤(c)中获得的所述至少一个物理数据。
在一个实施方式中,术语“死亡”和“死亡率”都是指总的死亡和死亡率(还可称为全因死亡或死亡率)和/或肝脏相关死亡或死亡率。肝脏相关死亡的原因的实例包括但不限于与门静脉高压相关出血造成的死亡、与食管或胃静脉曲张相关出血造成的死亡、肝脏细胞癌、腹水、脑病、肝脏衰竭合并败血症、急性或慢性肝脏功能衰竭、肝脏肾综合症、肝脏肺综合症或其他肝脏代谢失调。
在一个实施方式中,术语“肝脏相关事件,尤其是并发症”是指需要特定治疗或照顾的与肝脏相关的事件后并发症,例如,诸如腹水、脑病、黄疸(可定义为血清肝红素>50μmol/l)、发生大的食管静脉曲张(优选具有≥5mm的直径,并且/或者优选直径≥25%的食管周长)、静脉曲张破裂出血、胃肠出血(例如,诸如由于门静脉高压)、肝脏肾综合症、肝脏肺综合症、肝脏细胞癌、肝脏移植、食管静脉曲张、门静脉高压大于或等于预定的阈值(例如,诸如肝脏静脉压力梯度大于或等于10mm Hg或大于等于12mm Hg)、严重感染(例如,诸如感染性休克)。
在一个实施方式中,术语“肝脏相关事件,尤其是并发症”是指肝脏疾病或病症在受试者中的发展,例如,诸如纤维化非硬化患者表现肝硬化,或者,对于患者,与预定阈值交叉的(例如,诸如FibroMeter结果大于或等于0.982,或者Fibroscan结果大于或等于14kPa)的事实。
根据本发明,死亡(包括全因死亡或与肝脏相关的死亡)不是指肝脏相关事件,尤其是并发症。
在一个实施方式中,本发明的方法用于预测患者中第一个肝脏相关事件,尤其是并发症。
在本发明的一个实施方式中,本发明的预诊方法用于评估截至评估日期在至少3个月的期间内,优选3个月、6个月、9个月,1、2、3、4、5、6、7、8、9或10年,死亡的风险或肝脏相关事件的风险。
在一个实施方式中,受试者是哺乳动物,优选人类。在一个实施方式中,受试者是雄性或雌性。在一个实施方式中,受试者是成年人或儿童。
在一个实施方式中,受试者被感染,优选被诊断出肝脏疾病或病症,因此可定义本发明的方法为预测肝脏疾病或病症的方法。
优选地,受试者为患者,即,受试者正等待接受,或正接受医疗护理,或者是/将是医疗过程的对象。
在一个实施方式中,受试者患有肝脏疾病或病症,优选选自包括以下的列表:严重的波尔图隔膜纤维化、严重的波尔图隔膜纤维化、小叶中心纤维化、肝硬化、窦周(persinusoidal)纤维化,所述纤维化为酒精性来源或非酒精性来源。
在一个实施方式中,所述受试者患有慢性病,优选地,所述慢性病选自包括以下的组中:慢性病毒性肝炎C、慢性病毒性肝炎B、慢性病毒性肝炎D、慢性病毒性肝炎E、非酒精性脂肪肝(NAFLD)、慢性酒精性肝病、自身免疫性肝炎、原发性胆汁性肝硬化、血色沉着病和威尔逊氏病。
生物标记的实例包括但不限于血糖、总胆固醇、HDL胆固醇(HDL)、LDL胆固醇(LDL)、AST(天冬氨酸转氨酶)、ALT(丙氨酸转氨酶)、AST/ALT(比例)、AST.ALT(产物)、铁蛋白、血小板(PLT)、AST/PLT(比例)、凝血酶原时间(PT)或凝血酶原指数(PI)、透明质酸(HA或透明质酸盐)、血红蛋白、甘油三酯、α-2巨球蛋白(A2M)、γ-谷氨酰转肽酶(GGT)、尿素、肝红素、载脂蛋白A1(ApoA1)、III型原胶原N-末端前肽(P3NP或P3P)、γ-球蛋白(GBL)、钠(Na)、白蛋白(ALB)、铁蛋白(Fer)、葡萄糖(Glu)、碱性磷酸酶(ALP)、YKL-40(人类软骨糖蛋白39)、基质金属蛋白酶1的组织抑制剂(TIMP-1)、TGF、细胞角蛋白18和基质金属蛋白酶2(MMP-2)至9(MMP-9)、触珠蛋白、它们的比例及数学组合。
临床数据的实例包括但不限于重量、体质指数、年龄、性别、臀围、腰围或身高,以及它们的数学组合,例如,诸如它们的比,例如臀围/腰围。
二元非侵入检测标记的实例包括但不限于糖尿病、SVR(其中,SVR代表持续的病毒应答,并定义为在完成慢性肝炎C病毒(HCV)感染的抗病毒治疗后病毒血症6周、优选12周、更优选24周)、病因和NAFLD。关于二元标记“病因”,技术人员已知所述变量为单个二元标记或多个二元标记,并且对于肝脏疾病,病因可为NAFLD、酒精、病毒或其他。因此,二元标记可以表述为NAFLD相对于其它(单个二元标记),或者NAFLD相对于参考病因,以及病毒相对于参考病因等(多个二元标记)。
在一个实施方式中,本发明的血液检测相当于选自包括以下的群组的血液检测:ELF、FibroSpectTM、APRI、FIB-4、Hepascore、FibrotestTM、FibroMeterTM、CirrhoMeterTM、CombiMeter、Elasto-FibroMeterTM、InflaMeterTM、Elasto-Fibrotest。由于这些血液检测为诊断性检测,所以它们基于多变量数学组合,例如,诸如二元逻辑回归。
ELF为基于透明质酸、P3P、TIMP-1和年龄的血液检测。
FibroSpectTM为基于透明质酸、TIMP-1和A2M的血液检测。
APRI为基于血小板和AST的血液检测。
FIB-4为基于血小板、AST、ALT和年龄的血液检测。
HEPASCORE为基于透明质酸、肝红素、α2-巨球蛋白、GGT、年龄和性别的血液检测。
FIBROTESTTM为基于α2-巨球蛋白、触珠蛋白、载脂蛋白A1、总肝红素、GGT、年龄和性别的血液检测。
ELASTO-FIBROTEST为用LSM测量,例如通过FibroscanTM测量的,基于FIBROTEST或FIBROTEST结果的变量的数学组合的检测。
FIBROMETERTM和CIRRHOMETERTM共同形成了一组血液检测,其内容依赖于慢性肝病的病因以及诊断目标(例如,诸如纤维化,显著的纤维化(中度的桥接纤维化)、严重的纤维化(大量的桥接纤维化)或肝硬化)。这个血液检测组称为FM家族,并在下表中详述。
FM:FibroMeter,CM:CirrhoMeter,
A2M:α-2巨球蛋白,HA:透明质酸,PI:凝血酶原指数,PLT:血小板,Fer:铁蛋白,Glu:葡萄糖
aHA可被GGT取代
COMBIMETERTM或Elasto-FibroMeterTM是基于FM家族变量或FM家族的检测结果与FIBROSCANTM结果的数学组合(如上文中的表格详述)的一组检测。在一个实施方式中,所述数学组合是二元逻辑回归。
在一个实施方式中,CombiMeterTM或Elasto-FibroMeterTM产生基于来自肝脏或脾弹性测定中的物理数据的数学组合的评分,物理数据例如来自FibroscanTM的分散指数,例如IQR或IQR/中值或中值,优选具有选自包括以下的列表的至少3种,优选至少4、5、6、7或更多种,更优选7或8或9种生物标记和/或临床证据的FibroscanTM中值:血糖、总胆固醇、HDL胆固醇(HDL)、LDL胆固醇(LDL)、AST(天冬氨酸转氨酶)、ALT(丙氨酸氨基转移酶)、AST/ALT、AST.ALT、铁蛋白、血小板(PLT)、AST/PLT、凝血酶原时间(PT)或凝血酶原指数(PI)、透明质酸(HA或透明质酸盐)、血红蛋白、甘油三酯、α-2巨球蛋白(A2M)、γ-谷氨酰转肽酶(GGT)、尿素、肝红素、载脂蛋白A1(ApoA1)、III型原胶原N-末端前肽(P3NP)、γ球蛋白(GBL)、钠(Na)、白蛋白(ALB)、铁蛋白(Fer)、葡萄糖(Glu)、碱性磷酸酶(ALP)、YKL-40(人类软骨糖蛋白39)、基质金属蛋白酶1的组织抑制剂(TIMP-1)、TGF、细胞角蛋白18和基质金属蛋白酶2(MMP-2)至9(MMP-9)、触珠蛋白、糖尿病、体重、体质指数、年龄、性别、臀围、腹围或身高,以及它们的比例及数学组合。
INFLAMETERTM是反映包括ALT、A2M、PI和血小板的坏死炎症活性的伴随检测。
在一个实施方式中,本发明的方法不包括在步骤(a)中获得FibrostestTM。
在一个实施方式中,本发明的方法不包括在步骤(a)和/或步骤(b)中获得ActitestTM。ACTITESTTM是基于α2-巨球蛋白、触珠蛋白、载脂蛋白A1、总肝红素、GGT、ALT、年龄和性别的血液检测。
在一个实施方式中,本发明的方法不包括在步骤(a)和/或步骤(b)中获得APRI。
在一个实施方式中,本发明的方法不包括在步骤(a)和/或步骤(b)中获得FIB-4。
在一个实施方式中,本发明的方法不包括或包含以多变量域数学地组合FibrostestTM结果和物理数据,例如由VCTE(例如,Fibroscan)测量的肝脏硬度测量(LSM)。
在一个实施方式中,本发明的方法包括在步骤(a)中获得并在步骤(d)中以多变量时间相关模型中数学组合物理数据与如上文所定义的血液检测的变量。
在一个实施方式中,本发明的方法包括在步骤(a)中获得并在步骤(d)中以多变量时间相关模型中数学组合物理数据与ELF,即透明质酸、P3P、TIMP-1和年龄的变量。
在一个实施方式中,本发明的方法包括在步骤(a)中获得并在步骤(d)中以多变量时间相关模型中数学组合物理数据与FibroSpectTM,即透明质酸、P3P、TIMP-1和A2M的变量。
在一个实施方式中,本发明的方法包括在步骤(a)中获得并在步骤(d)中以多变量时间相关模型中数学组合物理数据与APRI,即血小板和AST的变量。在一个实施方式中,本发明的方法不包括或包含在步骤(a)中获得并在步骤(d)中以多变量时间相关模型中数学组合物理数据与APRI,即血小板和AST的变量。
在一个实施方式中,本发明的方法包括在步骤(a)中获得并在步骤(d)中以多变量时间相关模型中数学组合物理数据与FIB-4,即血小板、ASAT、ALT和AST的变量。在一个实施方式中,本发明的方法不包括或包含在步骤(a)中获得并在步骤(d)中以多变量时间相关模型中数学组合物理数据与FIB-4,即血小板、ASAT、ALT和年龄的变量。
在一个实施方式中,本发明的方法包括在步骤(a)中获得并在步骤(d)中以多变量时间相关模型中数学组合物理数据与HEPASCORE,即透明质酸、肝红素、α2-巨球蛋白、GGT、年龄和性别的变量。
在一个实施方式中,本发明的方法包括在步骤(a)中获得并在步骤(d)中以多变量时间相关模型中数学组合物理数据与FIBROTESTTM,即α2-巨球蛋白、触珠蛋白、载脂蛋白A1、总肝红素、GGT、年龄和性别的变量。在一个实施方式中,本发明的方法不包括或包含在步骤(a)中获得并在步骤(d)中以多变量时间相关模型中数学组合物理数据与FIBROTESTTM,即α2-巨球蛋白、触珠蛋白、载脂蛋白A1、总肝红素、GGT、年龄和性别的变量。
在一个实施方式中,本发明的方法包括在步骤(a)中获得并在步骤(d)中以多变量时间相关模型中数学组合物理数据与ACTITESTTM,即α2-巨球蛋白、触珠蛋白、载脂蛋白A1、总肝红素、GGT、ALT、年龄和性别的变量。在一个实施方式中,本发明的方法不包括或包含在步骤(a)中获得并在步骤(d)中以多变量时间相关模型中数学组合物理数据与ACTITESTTM,即α2-巨球蛋白、触珠蛋白、载脂蛋白A1、总肝红素、GGT、ALT、年龄和性别的变量。
在一个实施方式中,本发明的方法包括在步骤(a)中获得并在步骤(d)中以多变量时间相关模型中数学组合物理数据与上面表中列出的FIBROMETERTM和/或CIRRHOMETERTM的变量。
在一个实施方式中,本发明的方法包括在步骤(a)中获得并在步骤(d)中以多变量时间相关模型中数学组合物理数据与上面提供的COMBIMETERTM或Elasto-FibroMeterTM的变量。
在一个实施方式中,本发明的方法包括在步骤(a)中获得并在步骤(d)中以多变量时间相关模型中数学组合物理数据与上面提供的Elasto-Fibrotestas的变量。
在一个实施方式中,本发明的方法包括在步骤(a)中获得并在步骤(d)中以多变量时间相关模型中数学组合物理数据与INFLAMETERTM,即ALT、A2M、PI和血小板的变量。
物理方法的实例包括但不限于医学成像数据和临床测量,例如,脾的测量,特别是脾长度。根据实施方式,物理方法选自包括超声波检查,特别是多普勒超声波检查和弹性超声波检查,以及速度测量超声波检查(使用所述数据的优选检测是振动控制的瞬时弹性成像(VCTE,也称为FibroscanTM)、ARFI、VTE、超音速弹性测量(超音速成像)、MRI(磁共振成像)和MNR(核磁共振),特别是MNR弹性测定法或速度测量法。
在一个实施方式中,物理方法是VCTE、ARFI、VTE、超音速弹性法或MRI硬度。
优选地,数据是弹性测量数据,优选肝脏硬度评价(LSE)数据或脾硬度评价,其可以例如由VCTE获得。根据本发明的优选实施方式,物理数据为肝脏硬度测量(LSM),优选地由VCTE测量。
在特定实施方式中,物理数据是通过VCTE(也称为FibroscanTM,法国巴黎)的肝脏硬度测量(LSM),优选地用M探针进行。优选地,检查条件是制造商推荐的条件,目的是获得至少3次,优选10次有效测量。结果可以表示为所有有效测量的中值(千帕),或者表示为IQR或表示为比率(IQR/中值)。
在本发明的一个实施方式中,本发明的方法包括执行VCTE,其涉及获得至少3个并且优选地10个有效测量,以及恢复对应于所有有效测量的千帕斯卡中值的物理数据。
在一个实施方式中,本发明的方法包括在步骤(d)中以多变量时间相关模型数学组合凝血酶原指数、肝红素、尿素、透明质酸、LSM、年龄和性别。
在一个实施方式中,本发明的方法包括在步骤(d)中以多变量时间相关模型数学组合年龄、性别、病因、LSM、AST和尿素。
在一个实施方式中,本发明的方法包括在步骤(d)中以多变量时间相关模型数学组合年龄、性别、NAFLD、LSM、AST和尿素。
在一个实施方式中,本发明的方法包括在步骤(d)中以多变量时间相关模型数学组合年龄、性别、LSM、AST和尿素。
在一个实施方式中,本发明的方法包括在步骤(d)中以多变量时间相关模型数学组合年龄、性别、NAFLD、凝血酶原时间、肝红素、尿素和LSM。
在一个实施方式中,本发明的方法包括在步骤(d)中以多变量时间相关模型数学组合年龄、性别、NAFLD、凝血酶原时间、AST、尿素和LSM。
在一个实施方式中,本发明的方法包括在步骤(d)中以多变量时间相关模型数学组合年龄、性别、凝血酶原时间、肝红素、尿素、透明质酸和LSM。
在一个实施方式中,本发明的方法包括在步骤(d)中以多变量时间相关模型数学组合年龄、性别、凝血酶原时间、肝红素、尿素和LSM。
在一个实施方式中,本发明的方法包括在步骤(d)中以多变量时间相关模型数学组合年龄、性别、凝血酶原时间、AST、尿素和LSM。
在一个实施方式中,本发明的方法包括在步骤(d)中以多变量时间相关模型数学组合年龄、性别、病因、AST、尿素和LSM。
本发明的另一个目的是用于评估受试者中肝脏相关事件,特别是并发症的风险的体外非侵入性预诊方法,包括获得并以多变量时间相关模型数学组合:
a.至少一个生物标记;
b.任选择地,至少一个临床数据;
c.任选择地,至少一个二元标记,以及
d.任选择地,至少一个血液检测结果,
从而获得预诊评分,
其中,生物标记、临床数据、二元标记和血液检测结果如上述。
在一个实施方式中,本发明的方法还包括根据预诊评分的值评估受试者中肝脏相关事件,特别是并发症的风险的步骤。
在一个实施方式中,本发明的方法还包括获得并以多变量时间相关模型数学组合物理数据与上面定义的血液检测变量。
在一个实施方式中,本发明的方法还包括获得并以多变量时间相关模型数学组合ELF,即透明质酸、P3P、TIMP-1和年龄的变量。
在一个实施方式中,本发明的方法还包括获得并以多变量时间相关模型数学组合FibroSpectTM,即透明质酸、TIMP-1和A2M的变量。
在一个实施方式中,本发明的方法还包括获得并以多变量时间相关模型数学组合APRI,即血小板和AST的变量。
在一个实施方式中,本发明的方法还包括获得并以多变量时间相关模型数学组合FIB-4,即血小板、ASAT、ALT和年龄的变量。
在一个实施方式中,本发明的方法还包括获得并以多变量时间相关模型数学组合HEPASCORE,即透明质酸、肝红素、α2-巨球蛋白、GGT、年龄和性别的变量。
在一个实施方式中,本发明的方法还包括获得并以多变量时间相关模型数学组合FIBROTESTTM,即α2-巨球蛋白、触珠蛋白、载脂蛋白A1、总肝红素、GGT、年龄和性别的变量。
在一个实施方式中,本发明的方法还包括获得并以多变量时间相关模型数学组合如上面表中列出的FIBROTESTTM和/或CIRRHOMETERTM的变量。
在一个实施方式中,本发明的方法还包括获得并以多变量时间相关模型数学组合如上面表中列出的COMBIMETERTM和/或Elasto-FibroMeterTM的变量。
在一个实施方式中,本发明的方法还包括获得并以多变量时间相关模型数学组合INFLAMETERTM,即ALT、A2M、PI和血小板的变量。
在本发明的一个实施方式中,所述方法还包括获得并以多变量时间相关模型数学组合透明质酸、AST、SVR、血小板和GGT。
在本发明的一个实施方式中,所述方法还包括获得并以多变量时间相关模型数学组合透明质酸、血小板和SVR。
在本发明的一个实施方式中,所述方法还包括获得并以多变量时间相关模型数学组合透明质酸和SVR。
在本发明的一个实施方式中,所述用于评估受试者中肝脏相关事件,特别是并发症的风险的体外非侵入性预诊方法进一步包括:
—获得至少一个物理数据,以及
—以多变量时间相关模型数学组合所述至少一个物理数据以及所述至少一个生物标记,以及任选择地所述至少一个临床数据、所述至少一个二元标记以及所述至少一个血液检测结果,从而获得预诊评分,
其中,所述物理数据如上所述。
在一个实施方式中,本发明的方法进一步包括根据预诊评分值评估受试者中肝脏相关事件,特别是并发症的风险的步骤。
在一个实施方式中,通过弹性测定法,更优选通过振动控制的瞬时弹性成像(VCTE)获得所述物理数据,甚至更优选地,所述至少一种物理数据为通过振动控制的瞬时弹性成像(VCTE)测量的LSM。
在本发明的一个实施方式中,所述方法包括获得并以多变量时间相关模型数学组合透明质酸、AST、SVR、血小板、GGT和LSM。
在本发明的一个实施方式中,所述方法包括获得并以多变量时间相关模型数学组合透明质酸、血小板、SVR和LSM。
在本发明的一个实施方式中,方法包括获得并以多变量时间相关模型数学组合透明质酸、SVR和LSM。
在一个实施方式中,多变量时间相关模型为COX比例风险回归模型。
在一个实施方式中,本发明的预诊评分基于时间固定的Cox模型,即本发明的方法仅包括选自生物标记、临床数据,二元标记和血液测试和/或物理数据的变量的一个测量,其通常在基线时间被记录。
在另一个实施方式中,本发明的预诊评分基于时间依赖的Cox模型,即本发明的方法包括选自以下变量的至少两个连续的测量:在包括基线时间的各个时间记录的生物标记、临床数据、二元标记和血液测试和/或物理数据。
在一个实施方式中,本发明的预诊方法进一步包括比较受试者获得的预诊评分与参考预诊评分的步骤。
根据本发明,预诊评分表明死亡或肝脏相关事件的风险。
在一个实施方式中,本发明的预诊方法还包括比较受试者获得的预诊评分与参考预诊评分。
在一个实施方式中,受试者获得的预诊评分与参考评分之间的差异或者无差异表明死亡或肝脏相关事件的风险增加。
在一个实施方式中,参考分数可以是指数分数,或可源自一个或多个风险预测算法或计算的死亡或肝脏相关事件的预诊指数。参考分数可与源自人群研究的数字或值相关,包括但不限于,具有相似纤维化水平的受试者,相同或相似年龄范围的受试者,相同或相似族群的受试者。
在本发明的一个实施方式中,参考分数来源于基本上健康的一个或多个受试者(即参考群体),即不受肝脏疾病或病症影响的受试者。在本发明的另一个实施方式中,参考分数源自受肝脏疾病或病症影响的一个或多个受试者(即参考群体)。
在本发明的一个实施方式中,与参考评分无异的从受试者获得的预诊评分表示死亡或肝脏相关事件的风险。优选地,在该实施方式中,参考分数源自基本上健康的受试者
在本发明的另一个实施方式中,从受试者获得的与参考评分无异的预诊评分表示死亡或肝脏相关事件的风险。优选地,在该实施方式中,参考评分来自肝脏疾病患者,更优选来自患有不良预诊的肝病患者。
在一个实施方式中,如果第一个值比第二个值大或小约10%、20%、30%、40%、50%、60%、70%、80%、90%、100%或更多,则第一个值被认为不同于第二个值。
在一个实施方式中,在用于获得参考分数的参考群体中测量的预诊分数以百分位数分类,其中由参考群体的所有受试者获得的预诊评分根据它们的数值按升序排列。在本发明的一个实施方式中,百分位数是受试者的百分位数,即每个百分位数包含相同数目的受试者。因此,第一个百分位数对应于具有最低预诊评分的受试者,而最后一个百分位数对应于具有最高预诊评分的受试者。
在一个实施方式中,参考分数对应于参考群体的第一百分位数的最高预诊分数。
在另一个实施方式中,参考评分对应于参考群体的第二、第三...或倒数第二百分位数的最高预诊评分。
在一个实施方式中,给出3个百分位数时,每个百分位数被称为三分位数。根据该实施方式,参考值对应于第一、第二三分位的最高预诊评分。
在另一个实施方式中,给出4个百分位数时,每个百分位数被称为四分位数。根据该实施方式,参考值对应于第一、第二、第三或第四五分位的最高预诊评分。
当绘制四个百分位数时,每个百分位数被命名为四分位数。根据该实施例,参考值对应于第一、第二或第三四分位数的最高预诊分数。
在另一个实施方式中,给出5个百分位数时,每个百分位数被称为五分位数。根据该实施方式,参考值对应于第一、第二、第三或第四五分位的最高预诊评分。
在本发明的一个实施方式中,本发明的预诊方法因此导致在分类的类别中对受试者进行分类,其中分类的每个类别对应于特定的死亡风险或肝脏相关事件。这样的分类,其中特定预诊评分对应于特定评估的风险,也是本发明的目的。
例如,本发明的预诊方法导致在包括5个类别的分类中对受试者进行分类,每个类别对应于五分位数:第一类(或五分位数)对应于5年内死亡或肝脏相关事件风险为0,第二类(或五分位数)对应于死亡或肝脏相关事件的风险高于0%且小于或等于25%,第三类(或五分位数)对应于死亡或的肝脏相关事件大于25%且小于或等于50%,第四类(或五分位数)对应于高于50%且小于或等于75%的死亡或肝脏相关事件的风险,并且第五即最后一类(或五分位数)对应于大于75%的死亡或肝脏相关事件的风险。
本发明还涉及用于评估受试者的死亡风险和/或与肝脏相关事件风险的体外非侵入性预诊方法,所述方法包括:
a.获得至少1种选自生物标记、临床数据、二元标记和血液检测结果的变量,以单变量模型组合它们,从而从所述受试者获得第一血液检测结果,
b.获得至少1种选自生物标记、临床数据、二元标记和血液检测结果的变量,以单变量模型组合它们,从而从所述受试者获得第二血液检测结果,
c.以组合的分类组合所述至少一个第一血液检测结果和所述至少一个第二血液检测结果,从而评估死亡风险和/或肝脏相关事件风险。
在本发明的一个实施方式中,第一血液检测是FibroMeter,而第二血液检测结果为CirrhoMeter。
在本发明的一个实施方式中,本发明的预诊方法因此导致在组合分类(其也可以被称为评分风险图表)的类别中对主体的分类,其中所述组合分类是表的形式,其中每个单元格与特定评估的死亡风险或肝脏相关事件相关。这样的得分风险图表也是本发明的目的。
在一个实施方式中,评分风险图为2维矩阵表,其中,每个维度相应于血液检测和/或物理方法。
其分类是使用对参考群体的参考而预先构建的。例如,进行Fibroscan可以导致受试者在3个纤维化阶段(F0-F1、F2-F3或F4)之一中分类。因此,得分风险图(线)的第一维对应于第一血液检测或物理方法的阶段,而第二维(列)对应于第二血液检测或物理方法的阶段。
在一个实施方式中,评分风险图包括对应于例如临床数据的附加维度,例如年龄和性别。
图13中示出了本发明的4维评分风险图表的实例,其由Fibroscan(LSM)、FibroMeter、年龄和性别的组合产生,其中风险图的每种情况对应于3年前全因死亡风险的百分比。
本发明的一个实施方式中,由计算机实施本发明的方法。
因此,本发明还涉及微处理器,包括执行本发明的预诊方法的计算机算法。
技术人员易于推断本发明的预诊评分指示的死亡或肝脏相关事件的特定风险,其可以由愿意为他/她的患者提供最佳医疗护理的医生使用。例如,存在高死亡或肝脏相关事件风险的患者比低风险患者需要更频繁的随访。
因此,本发明还涉及调节患者的治疗、医疗护理或随访的方法,其中,所述方法包括测量所述患者根据本发明的预诊评分。
本发明还涉及患者的治疗的监测方法,其中,所述方法包括测量所述患者根据本发明的预诊评分。
本发明还涉及治疗肝病患者的方法,优选慢性肝病患者,所述方法包括(i)测定所述患者根据本发明的预诊评分,以及(ii)根据步骤(i)中测量的预诊评分治疗所述患者。
此外,本发明的预诊评分可用于决定患者肝脏移植的优先顺序。
附图说明
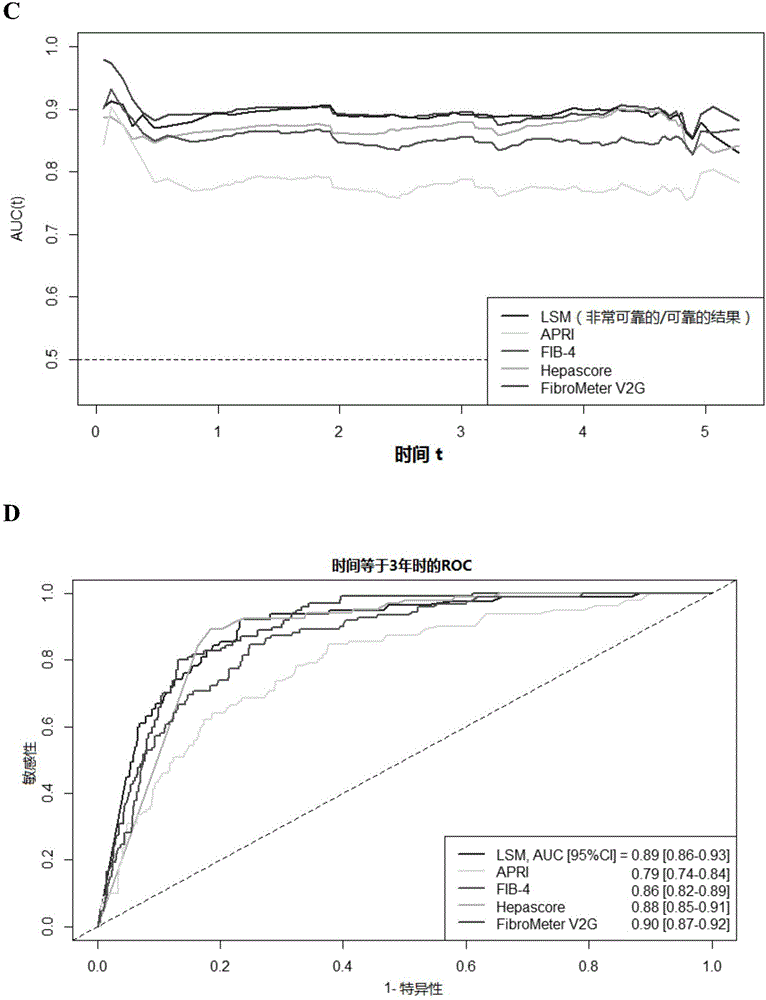
图1是显示每个非侵入性肝脏纤维化检测的时间依赖性AUROC(t)(A,C)和灵敏度(B,D)的组合图,用于预测1565名患者中的全因死亡率(A,B)和肝脏相关死亡率(C,D),所述患者具有在3个月的间隔内的非侵入性肝脏纤维化检测的可用数据。
图2是显示每个非侵入性肝脏纤维化检测的时间依赖性AUROC(t)和MELD评分的图的组合,用于预测在基线时为肝硬化的444名患者中的总死亡率(A)和肝脏相关死亡率(B),按LSM≥14kPa分类。
图3是根据慢性肝病的病因:(A~B)酒精性肝病,(C~D)慢性病毒性肝炎和(E~F)非酒精性脂肪肝,显示每个非侵入性肝脏纤维化检测的时间依赖性AUROC(t)的组合图,用于预测总死亡率(A(643名患者,181名死亡),C(478名患者,35名死亡)和E(313名患者),39例死亡)和肝脏相关死亡率(B(642名患者,85例死亡),D(474名患者,19例死亡)和F(311名患者,10例死亡)。
图4是显示在验证组(n=782)中以时间固定多变量模型的校准能力的评估的组合图,包括年龄、性别、LSM和FibroMeterv2G的基线结果。根据全因死亡(A)和肝脏相关死亡(B)的风险评分,将患者的观察到的(实线)和估计的(虚线)存活率分为5组。对于肝脏相关死亡率,由于事件数量少,组合前三个五分位数。第一上部曲线对应于第一个五分之一等。
图5是显示在验证组(782名患者,1342个存活数据点)中以时间依赖性多变量模型的校准能力的评估的组合图,包括年龄、性别、LSM和FibroMeterv2G的时变结果。根据全因死亡(A)和肝脏相关死亡(B)的风险评分,将患者的观察到的(实线)和估计的(虚线)存活率分为5组。对于肝脏相关死亡率,由于事件数量少,组合前三个五分位数。
图6是显示在随访期间首例显著的肝脏相关事件(A)和无肝脏相关死亡(B)的存活的累积发生率的组合图。
图7是显示作为Metavir纤维化(F)分期(A)或Fibrotest(B)、FibroMeterV2G(C)、CirrhoMeterV2G(D)分类类别的函数的首例显著的肝脏相关事件的累积发生率的组合图。Metavir F0至F3分期(p=0.174)之间无显著差异,因此肝脏活检仅鉴定出具有不同预诊的2个亚组:F0-3相对于F4(p<0.001)。诊断纤维化分类在临床实践中用于估计来自FibroMeterV2G或CirrhoMeterV2G结果的Metavir纤维化分期,其也是预诊量表(scale):与Fibrotest不同,FibroMeterV2G或CirrhoMeterV2G类型的增加与预诊逐渐恶化相关。第一上曲线对应于到更高的纤维化分期等。
图8是显示首例显著的肝脏相关事件(A)和无肝脏相关死亡的存活(B)的累积发生率的组合图,其作为由FIB4的2个推荐诊断截止值定义的3个亚组的函数(<1.45和>3.25)。第一条上曲线对应于较高的纤维化分期等。
图9是显示FibroMeter2GV(专用于严重的纤维化诊断)和CirrhoMeter2GV(用于肝硬化诊断)及其相应纤维化分类的散点图。这2个血液检测与CirrhoMeterV2G“拉伸”的高FibroMeterV2G值互补。可以区分两个不同的组:FM1-4类显示比CirrhoMeterV2G值更大的FibroMeterV2G值的范围,并且在FM5-7类中观察到相反情况。
图10是显示作为FM/CM分类的函数的首例显著的肝脏相关事件(A)和无肝脏相关死亡的存活(B)的累积发生率的组合图。FM/CM分类鉴定了5个具有显著不同预诊的患者亚组。A:第一条上曲线对应于较高的纤维化分期等。B:第一条较低的曲线对应于较高的纤维化分期等。
图11是显示作为Metavir纤维化(F)分期(A)或Fibrotest(B)、FibroMeter(C)、CirrhoMeter(D)分类类别的函数的无肝脏相关死亡的存活的组合图。第一条较低的曲线对应于较高的纤维化分期等。
图12是显示评价来自FibroMeterV2G和CirrhoMeterV2G诊断分类结果的肝脏相关预诊的图。在轻度疾病(即,包括在3个第一类的FibroMeterV2G分类)患者中,FibroMeterV2G分类用于鉴定2个预诊亚组。在晚期疾病患者(即,包括在FibroMeterV2G分类的最后4个类别中),CirrhoMeterV2G分类鉴定3个额外的预诊亚组。肝脏相关事件的发生率作为这些定义预诊FM/CM分类的5个预诊亚组的函数而逐渐增加。
图13是3年前全因死亡(1个生存)的风险图的组合。LSM:F0-F1<7kPa,F2-F3 7-13.9kPa,F4≥14kPa-FibroMeterV2G:F0-F1<0.3754,F2-F30.3754~0.8342,F4≥0.8343—A-B:男性全因死亡的风险图(A:年龄小于55,B:55岁或以上的年龄),C-D:女性全因死亡风险图(C:年龄小于55,D:年龄为55岁以上)。
实施例
通过下面的实施例进一步描述本发明。
实施例1:定时多变量预诊方法和时间依赖的多变量预诊方法
患者和方法
研究人群
我们计入2005年1月至 2009年12月在昂热大学医院的肝脏科因为慢性肝病咨询或住院且同意参与SNIFF群体(Score Non Invasif de Fibrose du Foie)的年龄大于18岁的受试者。无论患者慢性肝病的严重性或病因,在群体(cohort)中包括他们(HVC、HVB、酗酒、非酒精性脂肪肝、其他原因)。随访他们直至死亡或直到2011年1月1日。
肝脏纤维化的非侵入性评估
所有的患者在进入群体或随后的每次访问中通过血液检测或肝脏硬度测量或两者对肝脏纤维化进行非侵入性评估。
肝脏纤维化的血液检测–在我们医院的实验室中集中血液分析样品。测量生物参数(α-2巨球蛋白、血小板计数、天冬氨酸转氨酶、丙氨酸转氨酶、γ-谷氨酰胺转肽酶、肝红素、透明质酸、凝血酶原指数、尿素)允许计算至少一个下面用于肝脏纤维化的血液检测:APRI(Wai等,Hepatology 2003;38:518-26)、FIB-4(Sterling等,Hepatology 2006;43:1317-25)、Hepascore(Adams等,ClinChem 2005;51:1867-73)、FibroMeterV2G(Leroy等,ClinBiochem 2008;41:1368-76)。在肝硬化患者中还计算特别设计的MELD评分,以预测肝病晚期的患者中的短期死亡率(Kamath等,Hepatology 2001;33(2):464-70)。
肝脏硬度测量–用M探针进行通过超声诊断仪的肝硬化测量(LSM)(Echosens,法国巴黎)。检测条件是制造商建议的那些,目标为获得至少10个有效的测量。结果表示为全部有效测量的中位数(kilopascals),并且根据肝硬化水平:“非常可靠”(IQR/M≤0.10),“可靠”(0.10<IQR/M≤0.30或IQR/M>0.30,具有M<7.1kPa),“不可靠”(IQR/M>0.30,具有M>7.1kPa)通过使用四分间距至中值的比(IQR/M)分为“非常可信”、“可信”和“不可靠”。
端点评估
用于这些分析的感兴趣的端点为全因死亡率和与肝脏相关的死亡率。接下来记录死亡的日期和首要原因,并在2011年5月登记计算的国家死亡注册。从医院数据库获得通过该方式不能找到的那些患者的数据,并通过来自普通医生的信息确认。根据国际疾病分类(ICD-10)第10版编码死亡的原因,并汇集成类。
统计方法
使用SAS版本9.2(SAS Institute Inc.,美国北卡罗莱纳州卡里)以及R版本 3.0.2(奥地利维也纳,可从http://www.R-project.org/获得)进行统计分析。所有的检测是双向的,并认为p<0.05在统计学上是显著的。
适当地,数据表示为中位数(四分位距)、或频率(%)。使用Fisher’s精确检测对分类数据进行组比较,并且使用非参数Mann-Whitney U检测对连续变量进行进行组比较。使用具有对数秩比较的Kaplan-Meier分析来计算在基线的每个肝脏纤维化诊断检测的四分位数之间的中值存活时间和存活差异。
比较非侵入性纤维化检测的预诊准确性—首先,在整个随访期间通过Harrell's C指数评估非侵入性肝脏纤维化检测的预测性能。这种非参数测量对应于事件发生时间的结果(截尾存活数据)的二元结果AUC的延伸,并评估预测(这里是纤维化检测的基线值)和观察到的存活时间之间一致的量,不仅比较具有事件的受试者与不具有事件的受试者,而且比较具有在不同时间点发生的事件的受试者。C指数的结果在0.5(无预测能力)和1(完全一致性)之间变化。通过自举法(bootstrap method)计算每个C指数的95%置信区间,使用与原始数据集相同大小的1,000个随机样本(具有替换)。还使用自举重采样程序进行纤维化检测的C指数的配对比较。简而言之,计算1,000个自举样品的每一个的两个C指数之间的差异,以获得差异的自举95%置信区间。然后,使用来自该自举分布的标准误差的估计来计算C指数之间的标准化差异,并找到相应的p值。
此后,我们检查了非侵入性纤维化检测在0~5年的各个时间范围(不同的预测延迟)预测死亡风险的能力。使用timeROC R软件包计算和比较报告的AUC(t),它们基于在给定时间t的累积/动态ROC曲线定义,并且对右截尾进行校正。可以以不同的方式定义时间依赖性ROC和相应的AUC,通常被认为累积病例/动态控制定义是最相关的,因为临床医师通常希望区分在时间t之前具有事件的受试者(而不是在特定时间t,如在“事件案例”中定义)和在时间t(而不是在随后固定的预先指定的时间,例如研究结束时,如在“静态对照”中定义)中没有事件的对象。累积/动态AUC(t)的解释与标准AUC的相似:AUC(t)越高,检测区分在时间t之前做出事件的患者和其他患者的表现越好。
用于全因死亡和肝脏相关死亡的多变量预诊模型–我们将具有所有检测的1,565名患者的样本随机分成训练集(n=783)和验证集(n=782)。我们用训练集建立预诊模型。慢性肝病的年龄、性别、病因和所有非侵入性肝脏纤维化检测被评估为定时和时间依赖多变量Cox模型中的死亡的潜在预测因子。在时间固定模型中,仅考虑纤维化检测的基线值。时间依赖性模型另外使用肝脏纤维化检测的重复测量,直到随访结束的前1年。我们应用Murtaugh等人的方法(Hepatology 1994;20:126-34),以在模型中随时间更新协变量。我们假设在给定时间在患者上观察到的值在下一次测量之前保持不变,因为这对应于临床情况。通过在连续间隔中分开每个患者的随访并考虑在每个开始时可用的测量,为训练集产生1337个存活数据点,并为验证集产生1342个存活数据点。对于每个多变量模型,进行比例风险的评估。我们还检测了独立预测因子之间的单向交互作用,并且检查连续协变量在Cox模型中拟合适当的函数形式。
在校准和鉴别性能方面,在验证集中评估时间固定和时间依赖的预诊模型的准确性。通过比较根据估计的死亡风险分为5组(五分位数)的患者的观察到存活率的和估计的存活率来评估校准。根据Kaplan-Meier方法计算每个五分位组观察到的存活率。如其它地方所述计算估计的存活率(Ripoll等,Hepatology 2005;42:793-801):在每个五分位数亚组中计算多变量Cox模型中的每个变量(分类变量的最常见形态)的平均值,并定义预测的亚组存活率为计算的这些平均值的死亡风险评分(∑bimi,其中bi表示模型中每个变量的估计回归系数,并且mi表示亚组中变量的平均值)。通过Harrell的C指数评估预诊模型的辨别能力。
结果
患者的特征
在2009年12月总计3,352个患者参加群体,在表1中总结了他们主要的基线特征。超过三分之二的受试者为男性,参与时的平均年龄为54.9±14.3。42.7%患者慢性肝病的原因为过量的酒精消耗,而30.4%具有病毒性的慢性肝炎,19.0%具有非酒精性脂肪肝(NAFLD),并且剩余的7.9%患有其他病因。
在基线对3,079名患者(91.9%)中进行肝脏硬度测量,中值基线LSM结果为8.5[第一四分位数和第三四分位数:5.1~9.5]。超过2500名患者(>75%)的组中可获得每个肝脏纤维化血液检测。
表1.患者的特征
定量变量的结果表示为中位数(第一四分位数,第三四分位数)。LSM=肝脏硬度测量,NAFLD=非酒精性脂肪肝。
(a)费希尔精确检验(类别变量)或曼-怀-威三氏检验(定量变量)的p值。
在2011年1月1日,整个群体的平均随访持续时间为3.3年[四分位距(IQR)1.9~4.6]。在随访期间,588个患者(17.5%)死亡,258例死亡(7.7%)与肝脏相关。在1年、3年和5年的总生存率(无全因死亡)的Kaplan-Meie估计分别为91.6%、83.0%和75.5%。1年、3年和5年肝脏相关生存率(无肝脏相关死亡)分别为95.7%、92.5%和86.6%。
根据法国国家死亡登记处的数据,死亡的其他原因主要是与肝脏和肝脏内胆管无关的肿瘤(ICD-10C00-D48,C22除外,n=104),循环系统疾病(ICD-10I00-99,n=79),发病和死亡的外部原因(ICD-10V01-Y98,n=36),内分泌营养和代谢疾病(ICD-10E00-E90,n=17),除了肝脏外的消化系统疾病(ICD-10K00-K93,K70-K77除外,n=16)。12例患者死亡原因未知。
与死亡率的单变量关系
与在随访结束时活着的患者相比,死亡的患者具有完全不同的基线特征(表2):如在基线的所有非侵入性肝脏纤维化检测所反映,他们更老,并且更频繁地为男性,他们两次患上酒精性肝病,并在基线有更严重的疾病。根据每个肝脏纤维化检测值在基线的四分位数,Kaplan-Meier估计总生存率和肝脏相关生存率都显著不同(从数秩比较<0.0001的所有p值)。
表2.整个群体在随访结束时根据生命体征的基线特征的比较。
定量变量的结果表示为中位数(第一四分位数,第三四分位数)。LSM=肝脏硬度测量。
(a)全因死亡。
(b)费希尔精确检验(类别变量)或曼-怀-威三氏检验(定量变量)的p值。
(c)通过最近提出的可靠性标准分类:“非常可靠”(IQR/中值≤0.10)以及“可靠”(0.10<IQR/中值≤0.30或者IQR/中值>0.30,具有LSE中值<7.1kPa)。
比较纤维化检测预测死亡率的能力
在具有3个月间隔内所有检测的可用数据的包括的患者的子样本中进行非侵入性肝脏纤维化检测的预测能力的统计比较。这些1,565名患者的社会人口特征和慢性肝病的原因与群中的其他患者相比没有差异(表1)。但是具有所有检测的患者更近地被包含在族群中,因此具有稍短的随访持续时间:中值随访是2.8年[第一四分位数和第三四分位数:1.7~3.9]。他们还具有比未选择的患者更高的基线肝脏硬度中值,但是相反地,它们对于大多数肝脏纤维化血液测试具有更小的基线值。
对于全因死亡率和肝脏相关死率,通过Harrell’s C指数评估的APRI的总体预测能力比其它非侵入性肝脏纤维化检测低的多(表3)。
表3.非侵入性肝脏纤维化检测对死亡风险预测的总区分能力
通过自举法评估95%CI和C指数的差异。LSM=肝脏硬度测量,LSM-r=LSM结果分类为对于诊断目的非常可靠/可靠。
(a)显著小于LSM(p<0.0001)、FIB-4(p<0.0001)、Hepascore(p<0.0001)、FibroMeter V2G(p<0.0001)。
(b)显著大于LSM(p<0.040)、APRI(p<0.0001)、FIB-4(p<0.0001)、Hepascore(p=0.0086)那些。
(c)显著小于LSM(p<0.0001)、FIB-4(p<0.0001)、Hepascore(p<0.0001)、FibroMeterV2G(p<0.0001)。
(d)显著小于FibroMeterV2G(p<0.0001)和LSM非常可靠/可靠的结果(p<0.030)。
FibroMeterV2G在预测全因死亡率方面具有最优异的性能,与所有其他检测相比,观察到显著差异。当认为包括LSM的结果对于诊断目的不可靠时,LSM的全局预诊性能仅稍微改变。对于肝脏相关死亡率,FibroMeterV2G和LSM具有较高的预诊价值,与APRI和FIB-4相比有显著差异。根据时间依赖性AUC,肝脏纤维化检测随时间具有类似的预测准确度的趋势:如预期,检测的预测能力在测量后的几个月中是最大的,然后降低到保持相对稳定的性能水平,直到5年(图1)。总而言之,对于全因死亡率,AUC(t)>0.70,对于肝脏相关死亡率,AUC(t)从0.80至0.90。例如,为了预测所有原因的3年死亡,AUC(t=3)为:对于FibroMeterV2G为0.80(95%CI=[0.76~0.83]),对于Hepascore为0.77[0.74~0.81](p<0.001相对于FibroMeterV2G),对于LSM(p<0.028)为0.76[0.73~0.80],对于FIB4为0.76[0.72~0.79](p<0.001),并且对于APRI为p=0.67[0.62~0.71][p<0.001]。
我们进一步比较了448名LSM≥14KPa定义的肝硬化患者的子样本中肝脏纤维化检测的AUC(t)与的MELD评分。只有4例肝硬化患者在基线时没有可用的MELD数据,其余444例患者的时间依赖性ROC曲线分析结果如图2所示。在肝硬化患者中,对于预测在初始非侵入性检测后直至2年内的死亡,MELD评分具有比Hepascore和FIB-4更高的预诊能力,并且比用于在前18个月发生的死亡的LSM显著更好。相比之下,FibroMeterV2G和MELD之间的AUC(t)的差异不具有统计学显著性。为了预测肝脏相关死亡率,FibroMeterV2G和LSM在任何时间点与MELD都没有显著差异。如Harrell’s C指数概括,在根据其肝脏相关死亡的风险区分性肝硬化中,APRI和FIB-4比FibroMeterV2G(相对于APRI:p=0.0003,相对于FIB-4:p=0.026)和LSM(相对于APRI:p=0.026)低效。
还在慢性肝病的3个主要原因(慢性肝病(酒精性肝病(ALD)、慢性病毒性肝炎、NAFLD)之间分别进行了肝脏纤维化检测的比较分析。表3报告了时间依赖性AUC的结果。在具有ALD的患者中,FibroMeterV2G显示出比用于全因死亡预测的其他肝脏纤维化检测更好的性能(AUC(t)>0.70,t从0变化到接近5年)。总之,FibroMeterV2G和其他肝脏纤维化的C指数的所有配对比较导致p<0.05。对于肝脏相关死亡,只有FibroMeterV2G和Hepascore之间的C指数差异不具有统计学显著性。在具有慢性病毒性肝炎和NAFLD的患者中,所有肝脏纤维化检测(除了APRI)对于肝脏相关死亡具有良好的辨别能力(>0.80),而对于全因死亡,AUC(t)随时间的变化更大。特别地,检测的基线测量的预诊值随着NALFD患者的预测延迟的增加而略微减小。
仅基于基线肝脏纤维化检测的多变量预诊模型
将具有在基线的所有检测的1,565位患者的子样本随机分为训练集和验证集后进行多变量分析。这两个患者亚组的主要特征列于表4。
表4.随机选择的训练集和验证集之间的患者特征的比较
通过在训练集中的多变量分析,我们观察到每个血液纤维化检测和LSM是独立的预诊因素(数据未显示)。年龄和性别在所有多变量Cox模型中也是显著的,但不是慢性肝病的原因,也不是LSM结果的四分位距。根据Akaike信息标准(AIC),最佳多变量Cox模型是包括年龄、性别、LSM和FibroMeterV2G的模型,用于预测全因死亡率或肝病死亡率。没有发现独立预测因子之间的相互作用。表5中给出了使AIC减小的多变量模型的系数的细节。
表5.最佳多变量Cox模型减小了AIC,以基于时间固定方法(A)和时间依赖方法(B)预测死亡率。
图4A描述了验证集患者(来自验证集)的预诊模型(来自训练集)预测的总体存活曲线,其根据他们的风险评分分为5组(五分位数)。我们观察到预测的和观察到的总生存率之间的良好拟合:从五分位数1到五分位数5,3年时的预测总存活率为98.6%、94.3%、90.6%、80.5%和46.7%,而观察到的总存活率为99.0%、97.6%、93.0%、78.0%和50.9%。此外,组合LSM和FibroMeterV2G的预诊模型具有改善的辨别能力:验证集中的预诊模型的Harrell's C指数[95%CI]为0.834[0.805~0.863],相比之下,对于FibroMeterV2G仅0.791[0.756~0.826](p<0.0001),并且对于LSM为0.775[0.736~0.811](p=0.0013)。预诊多变量模型在ALD中具有比FibroMeterV2G和LSM更好的性能,并且在慢性病毒性肝炎中比FibroMeterV2G更有效,但不比LSM更有效(表6,未显示关于配对比较的详细内容)。
表6.通过Harrell的C指数[95%CI]评估多变量预诊模型(包括年龄、性别、LSM和FibroMeterV2G)在验证集(n=782)中的辨别能力。
通过自举法评估Harrell的95%CI。LSM=肝脏硬度测量,NAFLD=非酒精性脂肪肝。
观察到的和预测的存活(校准)之间的一致性不太令人满意(图4B):在最高风险的五分之一患者中低估了超过1年的肝脏相关存活的概率,而高估了具有稍低风险的患者的存活率(从第四个五分位数)。此外,与使用单一非侵入性肝脏纤维化检测相比,通过将预诊模型应用于验证集,没有提高精确度:与仅使用FibroMeterV2G(p=0.27)的0.857[0.815~0.895]和使用LSM(p=0.43)的0.848[0.785~0.896]相比,预诊模型的Harrell's C指数[95%CI]为0.867[0.828~0.902]。
定义肝脏纤维化检测的多变量预诊模型为时变协变量
进行非侵入性检测1至8次,从包括在族群中到随访结束前一年。测量之间的中值间隔长度为1.1年[第一四分位数和第三四分位数:0.6~1.7]。在将时间依赖性预诊模型应用于验证集之后,我们观察到预测的肝脏相关生存和观察到的肝脏相关生存之间的更好匹配(图5)。对于全因死亡率和肝脏相关死亡率,更新协变量的预诊模型也基于年龄、性别、LSM和FibroMeterV2G。这些时间依赖性多变量Cox模型的Harrell's C指数和95%CI在验证集中,对于预测全因死亡为0.837[0.808~0.865],并且对于预测肝脏相关死亡为0.879[0.840~0.914](表6)。在ALD患者中,对于预测肝脏相关死亡,C指数增加到0.832[0.774~0.881]。
然后我们基于年龄、性别、LSM和凝血酶原指数、肝红素、尿素、透明质酸,通过肝脏纤维化诊断检测和本发明的预诊模型的辨别能力比较总体预诊性能。在族群中包含的1565名具有所有非侵入性肝脏纤维化检测的患者中,通过Harrell指数[95%CI]评估预诊性能。结果示于表7中。
表7:肝脏纤维化诊断检测和本发明的预诊模型的Harrell’s C指数
通过自举法评估C指数的95%CI和差异。LSM=肝脏硬度测量,NAFLD=非酒精性脂肪肝,LSM-r=LSM结果对于诊断目的分为非常可靠/可靠。
(a)显著小于FibroMeterV2G(p<0.007)、EFMV2G(p<0.002)、EFMV3G(p<0.008)
(b)显著小于FibroMeterV2G(p<0.040)
(c)显著大于所有肝脏纤维化诊断试验(p<0.001)
(d)显著小于EFMV2G(p<0.030)
(e)显著大于CirrhoMeterV2G(p<0.012)、FibroMeterV3G(p<0.001)、CirrhoMeterV3G(p<0.001)
这些结果提供了关于肝脏纤维化诊断检测的预诊价值的新视角,在肝脏纤维化的初始评估后的5年期间的不同时间点比较他们鉴定具有较高死亡风险的患者的能力。此外,我们的结果表明,组合FibroMeterV2G和LSM提高预诊性能,更特别地,在ALD的患者中,其LSM的预诊值小于慢性肝病的其他病因。
实施例2:评估慢性肝炎C(CHC)患者的肝脏预诊
该研究的首要目的为比较几个血液纤维化检测和肝脏活检的预诊精确性,以预测大群体的长期随访CHC患者中与肝脏相关的事件。此外,第二个目的为评估血液纤维化检测的组合是否可改善肝脏预诊评估。
患者和方法
患者
我们先前使用了法国昂热大学医院(三级转诊中心)肝脏活检和血液纤维化检测的CHC患者的公开数据库(Calès等,Liver Int 2008;28:1352-62)。从1994至2007,如果患者患有定义为血清中的阳性抗肝炎C病毒抗体以及丙型肝炎病毒RNA的CHC,则包括他们。排除的标准为其它原因的慢性肝炎(乙型肝炎或HIV合并感染,参加的前5年中男性消耗>30g/d的酒精,或者女性消耗>20g/d的酒精、血色病、自身免疫性肝炎)或者肝硬化并发症(腹水、静脉曲张破裂出血、系统感染、肝脏细胞癌)。遵守目前赫尔辛基宣言伦理指南的研究方案,并且经IRB批准后,全部患者获得知情权。
随后的数据收集
随访开始于肝脏活检那一天,并结束于2011年1月1日。根据当前的EASL和AASLD指南,患者被随访并接受抗病毒治疗。在随访期间记录的数据包括:完成SVR、首次显著的肝脏相关事件的日期,以及死亡的日期和原因。定义SVR为在抗病毒治疗结束后6个月阴性丙型肝炎病毒RNA。所考虑的显著的肝脏相关事件(SLRE)是需要特殊治疗或护理的那些:腹水、脑病、黄疸(血清肝红素>50μmol/l)、重度食管静脉曲张的发生(直径≥5mm)、静脉曲张破裂出血、静脉曲张破裂出血、肝脏肾综合症和肝脏细胞癌。认为重度食管静脉曲张是显著的肝脏相关的事件,因为它们的发生显著影响治疗和预诊。随访数据记录在患者档案中;对于失去医院随访的病例,向患者或其全科医生要求随访数据。通过咨询国家死亡登记处获得所有患者的死亡日期和原因。移植的患者在肝脏移植的日期被检查为死亡。最后,在本研究中评价2个临床结果:SLRE作为主要终点(在第一次事件发生之日审查患者)以及肝脏相关死亡作为次要终点。
组织学评估
根据Metavir纤维化(F)分期评价肝脏纤维化。由两名资深肝病学专家独立完成初步病理检查,对不一致病例进行共识解读。病理学家不知道患者的特征和血液标记结果。
血液检测
在肝脏活检日期的约7天内对87.4%的病例中进行血液收集,而对其他病例中在之后不超过3个月内进行血液收集。所有血液检测在Angers医院的实验室中进行。
血液纤维化检测–根据公开的或获得专利的公式计算以下血液纤维化检测:APRI(Wai等,Hepatology 2003;38:518-26),FIB4(Sterling等,Hepatology 2006;43:1317-25),Hepascore(Adams等,ClinChem2005;51:1867-73),Fibrotest(Biopredictive,法国巴黎)(Castera等,Gastroenterology 2005;128:343-50),FibroMeterV2G(用于病毒的第二代,法国巴黎)(Leroy等,ClinBiochem 2008;41:1368-76)。我们还计算了CirrhoMeterV2G(Echosens,法国巴黎),其与FibroMeterV2G共享相同的标记,但是具有针对诊断肝硬化的特异性系数(Boursier等,Eur J GastroenterolHepatol 2009;21:28-38)。在临床实践中,使用它们的纤维化阶段分类来解释一些血液纤维化检测的结果,纤维化阶段分类根据检测结果估计Metavir F分期。Fibroest分类包括8个类别(此处称为FT1至FT8),FibroMeterV2G包括7个类别(FM1至FM7),以及CirrhoMeterV2G包括6个类别(CM1至CM6)。
统计分析
使用Kaplan-Meier方法测定存活曲线,并与对数秩检验比较。通过Harrell的C指数评价用于预测临床结果的辨别能力。Harrell的C指数是AUROC对事件发生时间(time-to-evetn)(存活)数据的延伸,并且评估预测的事件风险与观察到的生存时间之间的一致性。其结果从0变化到1:1表示完美的一致性(风险评分的鉴别力),0.5表示随机预测,并且小于0.5的值表示与预期相反方向的鉴别。对于所评估的每个检测,通过自举法计算Harrell C指数的95%置信区间,使用与原始数据集相同大小的1,000个随机样本(具有替换)。使用自举重采样程序进行C指数的配对比较。为了比较2个检测,我们计算了在从原始数据集中替换的1,000个随机选择样本中的每一个的C指数之间的差异。然后,获得差值的自举95%置信区间,并且我们使用来自该自举分布的标准误差的估计来计算C指数之间的标准化差异,并且找到相应的p值。大多数统计分析由专业统计学家(SB)使用SPSS版本18.0软件(IBM,美国纽约阿蒙克)和SAS 9.1(SAS Institute Inc.,美国北卡罗来纳州卡瑞)进行。
结果
患者
表8详述了包括的373个患者的主要基线特征。
表8:包括的患者的特征
定量变量的结果表示为中位数,括号内为第一四分位数和第三四分位数),并且分类变量表示为绝对数,括号内为百分数。SVR:持续的病毒应答。
a没有或不成功的抗病毒治疗
b仅考虑在随访期间的首例显著的肝脏相关事件
包括的平均肝脏活检长度为20mm(第一四分位数:15mm,第三四分位数:25mm)。47个患者(12.6%)在随访期间经历至少一次SLRE。首例SLRE为:重度静脉曲张(n=20)、肝脏细胞癌(n=13)、腹水(n=4)、黄疸(n=4)、肝脏性脑病(n=1)、静脉曲张破裂出血(n=1)、腹水以及黄疸(n=2)、腹水以及黄疸和脑病(n=2)。SLRE的平均随访是7.6年(四分位数范围:4.0~12.1;2972人—年)。平均随访时的首次SLRE的累积发生率为11.5%(图6a)。
50例患者在随访期间死亡;2例死亡原因未知,肝脏相关17例。另有6例肝脏移植患者。因此,认为23例患者的死亡与肝脏相关。由于死亡发生在首次SLRE后,所以死亡的平均随访时间长于SLRE:9.5年(四分位数范围:5.8~13.0;3508人—年)。平均随访时无肝脏相关死亡的存活率和总体存活率分别为:95.1%(图6b)和88.8%。
37.2%的患者在随访期间达到SVR,并且62.8%的患者没有抗病毒治疗或没有成功地抗病毒治疗。在获得SVR的患者的随访期间没有肝脏相关死亡,其中只有5例患有SLRE。这5个患者中的3个(2个具有Metavir F4和1个具有F3)在达到SVR之前发展出严重的食管静脉曲张。一个患者(包含的Metavir F2)在代谢综合症的情况下达到SVR 5年后具有严重的食管静脉曲张,因此归因于持续活动性非酒精性脂肪肝。在随访期间恢复过量饮酒的情况下,最后一个患者(包含的Metavir F3)在达到SVR之前具有黄疸和腹水。
预测首次SLRE
肝脏活检相对于血液检测
图7a示出了作为Metavir F分期的函数的首次SLRE的累积发生率。F4和F3分期之间的差异高度显著(p<0.001),但在F0至F3分期之间不显著(p=0.174)。
表9中描述了用于预测首例SLRE的肝脏活检(Metavir F)和血液纤维化检测的Harrell C指数(表10中详述了检测间的配对比较)。
表9:用于预测首例显著的肝脏相关事件和肝脏相关死亡的肝脏活检和血液纤维化检测的Harrell C指数
a比较Metavir F相对于血液检测:p=0.039相对于APRI,p=0.002相对于FIB4,p=0.005相对于FibroMeterV2G,p>0.340用于其它比较。
b比较Metavir F相对于血液检测:p=0.011相对于FIB4,p=0.078相对于FibroMeterV2G,p>0.190用于其它比较。
表10:用于预测首例显著的肝脏相关事件和肝脏相关死亡的血液纤维化检测和肝脏活检(Metavir F)的Harrell C指数的配对比较
显著性差异为粗体
简言之,Metavir F和6种血纤维化检测对于预测首次SLRE具有良好的的辨别能力(C指数>0.8)。6例血纤维化检测中的5例具有大于肝脏活检的C指数;这种增加对于FIB4(p=0.002)、FibroMeter(p=0.005)和APRI(p=0.039)是显著的。
为了相对于肝脏活检评估每个肝脏纤维化检测,我们进行了根据年龄、性别、HCV基因型(1相对于其他)和SVR而调节的连续多变量逐步前演Cox模型,包括Metavir F的每个血液检测,用于预测首次SLRE(表 11)。
表11:相对于Metavir F分期,评价血液纤维化检测用于预测肝脏相关结果。以根据年龄、性别、持续的病毒反应和HCV基因型调节的多变量逐步正演Cox模型用Metavir F分期引入每个评分(1相对于其他)。
每个血液纤维化检测为SLRE的独立预测因子(在第一步,除了Hepascore)。当在多变量分析中引入FibroMeter或CirrhoMeter时,不选择Metavir F作为SLRE的独立预测因子。这显示了FibroMeter或CirrhoMeter完全获得了独立预测,不需要任何显著的肝脏活检的另外预测。
总之,先前所有的结果显示了血液纤维化检测是预测因子,在用于在CHC患者中预测SRLE时至少如同Metavir F分期一样准确,并且对于一些,明显优于Metavir F分期。
纤维化分类
由于我们的结果显示了作为预诊标记的血液纤维化检测,所以他们应该个别化(individualize)不同预诊的患者亚组。这些亚组的鲁邦的后验确定将需要具有高事件率的大群组(>1000个患者),随后是外部验证。因此,我们选择评估血液检测纤维化分类的预诊意义。这有两个相关原因。首先,纤维化分类允许患者的先验分层。其次,已经开发了纤维化分类来估计纤维化分期,并且这个原始设计将验证其识别有风险的患者的能力。
图7b至7d显示作为Fibrotest、FibroMeter或CirrhoMeter纤维化分类的函数的首次SLRE的累积发生率。与Fibrotest不同,FibroMeter或CirrhoMeter类的增加与预诊的逐渐恶化相关。此外,包括在FM1或CM1类(每个16.7%的患者)中的患者具有良好的预诊,在随访期间没有SLRE。FIB4提供了用于预测首次SLRE的最高的Harrell C指数,但详细的纤维化分类不适用于该血液检测。因此,我们评估由其推荐的1.45和3.25这2个诊断截断值定义的3个亚组的预诊。有趣的是,这3个亚组具有显著不同的预诊(p<0.001,图8)。然而,包括在具有推定的最佳预诊(即FIB4<1.45)的亚组中的11名患者(4.6%)在随访期间经历了SLRE。
在临床实践中如何预测SLRE?
我们已经在横断面研究中显示,通过二元逻辑回归的纤维化检测的组合改善了肝脏纤维化的非侵入性诊断(Boursier等,Am J Gastroenterol2011;106:1255-63)。我们在本纵向研究中使用相同的设计来确定用于预测首次SLRE的血液纤维化检测的最互补的组合。
在多变量正演Cox模型中,包括6个血液纤维化检测:年龄、性别、SVR和HCV基因型(1相对于其他),首次SLRE的独立预测因子为CirrhoMeter(p<0.001)、FibroMeter(p=0.008)和SVR(p=0.010)。这个结果并不令人惊讶,因为FibroMeter和CirrhoMeter(第一个用于显著的纤维化,后者用于肝硬化)明显与CirrhoMeter“拉伸”的高FibroMeter值互补(图9)。在多变量分析中,FibroMeter和CirrhoMeter之间的相互作用是显著的(p=0.002)。此外,FM4和FM5类别之间的界线清楚地区分了两组:FM1-4类显示比CirrhoMeter值更大的FibroMeter值范围,在FM5-7类中观察到相反的情况(图9)。因此,我们在FM1-4和FM5-7组中分别重复多变量分析。包括SVR、FibroMeter和CirrhoMeter的多变量后演Cox模型显示了作为FM1-4组中首次SLRE的独立预测因素的FibroMeter(p=0.024)和SVR(p=0.040)。相比之下,CirrhoMeter(p<0.001)是FM5-7组中唯一的独立预测因子。这些结果表明FibroMeter在CHC的早期阶段更好地预测首次SLRE,而CirrhoMeter更好地预测晚期疾病患者。
这些结果导致我们评估包括在FM1-4类中的患者的FibroMeter分类与包括在FM5-7类中的患者的CirrhoMeter分类的组合。这种组合提供了10个中间类别(FM1-4和CM1-6,如果FM5-7)。由于显著不同的预诊(FM1;FM2/3,FM≥4+CM≤4,FM≥4+CM5,FM≥4+CM6)定义了新的FM/CM分类,所以将这10个中间类分成5个最终类。包括在FM/CM分类的5个类别中的患者的比率分别为第1至第5:16.7%、41.5%、27.2%、10.0%和4.6%。
FM/CM分类与肝脏活组织检查
如同Metavir F分期,FM/CM分类将患者分为5类,但是带来了几个优点。首先,在随访期间,FM/CM分类的相邻类别的首次SLRE的累积发生率之间显著不同(图10a),而Metavir F0与F3阶段之间没有显著差异(图7a)。第二,在包含在第一类FM/CM分类中的患者的随访期间没有发生SLRE,而根据基线肝脏活检的1个F0患者在随访期间患上黄疸。第三,包括在最高类别的FM/CM分类中的患者具有比肝脏活检所定义的肝硬化患者(图10a)明显更差的预诊(图7a)。最后,在包括Metavir F、FibroMeter、CirrhoMeter和FM/CM分类的多变量逐步正演Cox模型中,在多变量分析的第一步选择FM/CM分类作为SLRE的独立预测因子。
肝脏相关死亡
Metavir F4和F3阶段的无肝脏相关死亡的存活率之间有显著的差别(p<0.001),但在F0至F3阶段之间没有显著差异(p=0.456,图11a)。所有血液纤维化检测具有比肝脏活检更高的C指数(表9);这种增加对于FIB4是显著的(p=0.011,表10)。多变量逐步正演Cox模型连续地包括使用Metavir F分期的每个血液检测(表11),显示CirrhoMeter是唯一的对Metavir F没有独立作用的血液纤维化检测。
FibroMeter或CirrhoMeter分类增加的类型与随访期间肝脏相关死亡的逐渐增加相关(图11),并且最高级别的CirrhoMeter分类鉴定了非常高风险患者的亚组。对于第一个SLRE,FIB4提供了用于预测肝脏相关死亡的最高的Harrell C指数,并且使用推荐的诊断截止值,FIB4鉴定了具有显著不同预诊的3个亚组(图8b)。包含在具有推定的最佳预诊(即FIB4<1.45)的亚组中的3名患者(1.3%)在随访期间因肝脏相关原因死亡。
临床实践中评估与肝脏相关的死亡
在多变量正演Cox模型中,包括6个血液纤维化检测:年龄、性别和HCV基因型(在这个模型中未引入SVR,因为在SVR患者中没有死亡),CirrhoMeter是肝脏相关死亡的唯一独立预测因子(p<0.001)。在GVL类中包括的患者中没有发生肝脏相关死亡(图11d)。然而,CM1到CM5的相邻类别的无肝脏相关死亡的存活率之间没有显著差异;它仅在CM5和CM6类之间显著不同。
相比之下,第2和第3类之间以及在FM/CM分类的第4和第5类之间的无肝脏相关死亡的存活率显著不同(图10b)。最后,在包括MetavirF、FibroMeter、CirrhoMeter和FM/CM分类的多变量逐步正演Cox模型中,FM/CM分类是肝脏相关死亡的唯一独立预测因子。
临床实践中评估肝脏预诊
总之,通过两个补充检测的组合来最好地评估CHC中的肝脏预诊:在轻度疾病患者中的FibroMeter(针对纤维化)以及在晚期疾病患者中的CirrhoMeter(针对肝硬化)。两个检测提供了组合的FM/CM分类,其是首次SLRE以及肝脏相关死亡的最佳独立预测因子。图12中给出了作为FM/CM分类的函数的5年和10年SLRE或肝脏相关死亡的发生率(详见表12)。
表12:作为FM/CM分类的函数的首例显著的肝脏相关事件(SLRE)或肝脏相关死亡的累积发生率(%)。
a没有抗病毒治疗或者不成功的抗病毒治疗
b该情况下没有患者
我们的结果表明血液纤维化检测至少全面地如Metavir F分期一样准确地预测CHC患者的肝脏预诊。事实上,对于预测SLRE或肝脏相关死亡,血液纤维化检测都不具有显著低于肝脏活检的Harrell C指数。在包括用Metavir F分期的每个血液检测的多变量分析中,几乎所有血液纤维化检测是SLRE或肝脏相关死亡的独立预测因子,表明血液纤维化检测提供相关的预诊信息。此外,FibroMeter和CirrhoMeter是SLRE的独立预测因子,Metavir F对其无作用,如同CirrhoMeter对于肝脏相关死亡那样。
在评估的6个血液纤维化检测中,多变量分析将FibroMeter和CirrhoMeter鉴定为用于预测首次SLRE的最佳组合。这两个检测,前者特异性靶向显著的纤维化,后者特异性靶向肝硬化(Boursier等,Eur J Gastroenterol Hepatol 2009;21:28-38)是非常互补的(图9),并且它们的关联改善了首次SLRE的预测:FibroMeter在低纤维化水平更具预测性,而CirrhoMeter在高纤维化水平更具预测性,因为它如双速变速器那样扩大了检测尺度。最后,类似于肝硬化患者中的Child-Pugh评分或肝脏静脉压力梯度测量,CirrhoMeter可使高FibroMeter值分层,以改善对预诊显著不同的亚组的识别。在临床实践中,FibroMeter和CirrhoMeter包括相同的标记,但具有不同的系数,因此可被同时计算,无需额外的成本。因为它需要非常大的人群来鲁棒地确定后验预诊亚组,所以我们决定根据当前在临床实践中使用的先验性纤维化分类或诊断截断(cut-off)来对患者进行分层(stratify)。在该设置中,与Metavir F分期相比,FM/CM分类中的FibroMeter和CirrhoMeter纤维化分类的组合具有几个优点。首先,尽管Metavir F分期仅鉴定了两组具有不同预诊的患者(FO-3相对于F4),但是FM/CM分类鉴定了5个显著不同的组(图10a)。第二,与Metavir F分期相反,在FM/CM分类的较低类别中没有发生SLRE,因此定义了具有优异预诊的亚组。第三,最高类别的FM/CM鉴定了未被Metavir F分期鉴定的非常高风险患者的亚组。
FIB4是一种便宜且易于计算的血液纤维化检测,在我们的研究中显示出非常好的预诊准确性。可能是因为它被FibroMeter和CirrhoMeter的高互补作用掩盖了该端点,所以它不被多变量分析选作首次SLRE的独立预测因子。通过使用其2个推荐的诊断截断值,FIB4鉴定了其预诊显著不同的3个亚组的患者。然而,来自最佳预诊亚组的11名患者在随访期间经历SLRE,而相比之下,包括在第一类FibroMeter或CirrhoMeter分类中的患者不患有SLRE。这可能是由于对FIB4阈值的不当选择。实际上,在包括在FIB4的3个第一十分位数中的患者的随访期间没有发生SLRE。这表明FIB4也能够确定具有良好预诊的患者亚组,并且为此目的应该改进(refined)FIB4阈值。
总之,血液纤维化检测还是预诊检测,至少在患有CHC的患者的肝脏预诊的预测中如肝脏组织活检同样精确。两个互补血液检测的组合,一个针对纤维化(FibroMeter),并且另一个针对肝硬化(CirrhoMeter),比肝脏组织活检更准确,并且看来是用于临床实践预诊基准评估的简单和精确的方法。
- 还没有人留言评论。精彩留言会获得点赞!