肿瘤识别方法与流程
本发明涉及肿瘤良/恶识别技术领域,更具体地说,本发明涉及一种肿瘤识别方法。
背景技术:
肿瘤在图像上的临床表现为器官实质内存在若干个大小不等且形态结构不规则的组织区域,这些区域的边界分布较为模糊。小型肿瘤的病变区域内部密度相似,大多低于周围正常的肾实质组织,而肿瘤较大时可能会存在内部坏死或韩化的情况,使其密度呈现不均一性。基于肿瘤在图像上的临床表现,现有技术存在以下两类分割方法。
一类分割为基于模式识别技术的方法。其中在器官分割中较常用的为一种无监督算法—模糊c均值聚类,该方法通过优化一个表示像素点与c个聚类中心相似性的目标函数,获得全局极大值,得到最优聚类;由于其无监督的模糊集聚类后的标定特性,能很好的适应医学图像不确定性和模糊性的特点;但是,计算量较大,分割实现较为困难。
另一类分割方法为基于能量函数的方法,由于其结合了物理学、几何学和近似理论等特征元素,具有较强的理论基础,因而能够解决更为复杂的情况下的分割难题,也是今年来研究比较深入的方面。基于能量函数的方法,其基本解决分割问题的思路为,将图像分割问题转化为求解一个能量函数的问题,一般情况下,能量函数的值最小时,其得到的分割结果即是最优的。能量函数虽各不相同,按其特性却可分为两类。第一类能量函数为显函数的分割方法,此类能量函数直接描绘图像分割的目标的边缘轮廓。其能量曲线显示方式为,首先定义一条接近最终轮廓的曲线,通过对曲线进行曲线平滑力和张力能量和图像信息的能量加权达到最小值来获取目标轮廓。
虽然上述两种分割方法可以将人体器官的肿瘤进行分割,但是并不能对分割的肿瘤进行良/恶性识别以及恶性的分期识别,即不能提供更客观、定量的器官肿瘤识别方法。
技术实现要素:
针对上述技术中存在的不足之处,本发明提供一种肿瘤识别方法,可以对分割后的肿瘤进行良/恶性识别以及恶性分期的精确识别。
为了实现根据本发明的这些目的和其它优点,本发明通过以下技术方案实现:
本发明提供一种肿瘤识别方法,其包括以下步骤:
粗分割:对ct图像依次进行器官分割和血管分割,获得去除血管的器官ct图像;
构造测试样本数据集合:基于所述器官ct图像,依次构造动脉期、静脉期和延迟期的肿瘤区域子图集形成测试正样本数据集合、器官正常区域子图集构成测试负样本数据集合;
训练肿瘤分类器:对所述测试样本数据集合进行特征数据提取,训练出包括肿瘤良/恶识别与分期的肿瘤分类器;
待测ct图像的特征数据提取和肿瘤的识别与分期:依次对动脉期、静脉期和延迟期的待测ct图像进行特征数据提取形成待测特征数据集合,将所述待测特征数据集合输入所述肿瘤分类器进行肿瘤良/恶识别与分期。
优选的是,对ct图像进行器官分割的步骤,依次包括骨性结构分割、器官区域初始化、器官粗分割以及器官精分割;其中,所述器官精分割包括以下步骤:
构造能量函数:
其中,c1和c2为曲线内外区域的灰度平均值,u(x,y)表示断层图像(x,y)上的灰度值;
对于每一个含有器官的断层图像,以粗分割的结果作为精分割的初始边界,在预设的窄带d范围内对使用图割方法对曲线c进行演化,得到当前断层图像的分割结果;
下一个断层图像的粗分割结果作为初始分割边界,以上一断层的最终分割结果作为形状约束条件,重复图割方法对曲线c的演化,得到该断层图像的最终分割结果。
优选的是,所述血管分割,包括以下步骤:
非线性滤波和血管增强:分别对动脉期和静脉期的ct图像进行血管增强和滤波;
血管粗分割:在动脉期增强后的血管区域和静脉期增强后的血管区域分别选择一个或若干个种子点;分别对动脉期滤波后的图像和静脉期滤波后的图像使用区域增长法,获得动脉期和静脉期的ct图像中血管粗分割结果;
血管精确分割:构造区域、边缘和先验形状结合的水平集能量函数;分别以动脉期和静脉期的ct图像中血管粗分割结果为分割初始界面,精确分割动脉期和静脉期的ct图像中血管。
优选的是,构造测试样本数据集合,包括以下步骤:
依次对动脉期、静脉期以及延迟期的器官ct图像,手动分割肿瘤,构造肿瘤所在区域的外接长方体为第一长方体,对第一长方体进行长、宽、高方向的等比例拓展,获得延拓后的第二长方体;定义第二长方体减去第一长方体的区域为第二长方体中正常组织区域;
以肿瘤区域中的每个体素为中心构造第一子图,对每一个第一子图进行插值,形成第一插值子图集;
以第二长方体减去第一长方体的区域中的若干点为中心构造第二子图,对每个第二子图进行插值,形成第二插值子图集;
以器官的其他正常组织中的若干点为中心构造第三子图,对每个第三子图进行插值,形成第三插值子图集;
定义第一插值子图集为动脉期、静脉期以及延迟期的测试正样本数据集合,分别对第二插值子图集和第三插值子图集进行随机下采样,得到动脉期、静脉期以及延迟期的测试负样本数据集合。
优选的是,同一幅图像中,肿瘤区域中的体素与第二长方体减去第一长方体的区域中的若干点数量相同;第二长方体与第一长方体对应的长、宽、高比值大小为1-2。
优选的是,对测试样本数据集合进行特征数据提取,包括以下步骤:
按照动脉期、静脉期以及延迟期,分别对测试正样本数据集合以及测试负样本数据集合依次提取灰度特征、纹理特征、几何特征以及其他特征,形成动脉期特征集合、静脉期特征集合以及延迟期特征集合;
构造多时相差异特征集合:动脉期特征集合、静脉期特征集合以及延迟期特征集合中的元素分别减去其他对应时期特征集合中的对应元素的差值,形成三个差异特征集合。
优选的是,灰度特征至少包括肿瘤所在区域的最大ct值、最小ct值、ct值均值、ct值标准差、ct值三阶中心矩、ct值四阶中心矩、ct值五阶中心矩、ct值直方图;纹理特征至少包括hoggabor变换特征、多尺度hurst特征、lbp、灰度共生矩阵、相关系数、紧密度、灰度级运行长度矩阵、灰度区域大小矩阵;几何特征至少包括肿瘤所在三维区域的体积、肿瘤区域表面积、球度、延伸率、椭球率、细长度、矩形度、凹度比值、不规则度,肿瘤所在区域的外接长方体的尺寸,肿瘤表面的曲率;其他特征至少包括肿瘤区域的小波特征、能量、熵、尺寸区域可变性、clustershade、clustertendency、齐次性、最大似然率。
优选的是,灰度共生矩阵至少包括:共生矩阵矩、共生矩阵熵、共生矩阵;灰度级运行长度矩阵至少包括:灰度不均匀性、高灰度级运行重点、低灰度级运行重点、长期运行重点、长期运行高灰度级重点、长期运行低灰度及运行重点、运行长度不均匀性、运行率、短期运行重点,短期运行高灰度级重点、短期运行低灰度及运行重点;灰度区域大小矩阵至少包括:高亮度重点、高亮度大面积重点、高亮度小面积重点、亮度变化、大面积重点、低亮度重点、低亮度大面积重点、低亮度小面积重点、小面积重点、尺寸区域变化、区域百分比。
优选的是,训练出包括肿瘤良/恶识别与分期的肿瘤分类器,包括以下步骤:
向每一个分类器中分别输入将动脉期特征集合、静脉期特征集合、延迟期特征集合以及三个差异特征集合进行训练,获得肿瘤的六核分类器;
根据肿瘤分类器的分类结果定义肿瘤的良/恶与分期。
优选的是,特征数据提取前,还包括碘剂量校正,其包括以下步骤:
选取ct平扫图像中的动脉区域、静脉区域的平均ct值;
分别计算动脉期ct图像的动脉区域以及静脉期ct图像的静脉区域的平均ct值;
分别计算ct平扫图像与动脉期ct图像中动脉区域以及静脉期ct图像中静脉区域的ct均值差异;
依据器官在ct平扫图像中的ct值,分别计算碘计量校正后器官区域的动脉期ct值与静脉期ct值。
本发明至少包括以下有益效果:
本发明提供的肿瘤识别方法,基于依次构造动脉期、静脉期和延迟期的肿瘤区域子图集形成测试正样本数据集合、器官正常区域子图集构成测试负样本数据集合,对测试样本数据集进行特征数据提取,训练出包括肿瘤良/恶识别和分期的肿瘤分类器,可对待测ct图像进行肿瘤良/恶识别与分期,识别方法客观、定量、精确。
本发明的其它优点、目标和特征将部分通过下面的说明体现,部分还将通过对本发明的研究和实践而为本领域的技术人员所理解。
附图说明
图1为本发明所述的肿瘤识别流程示意图;
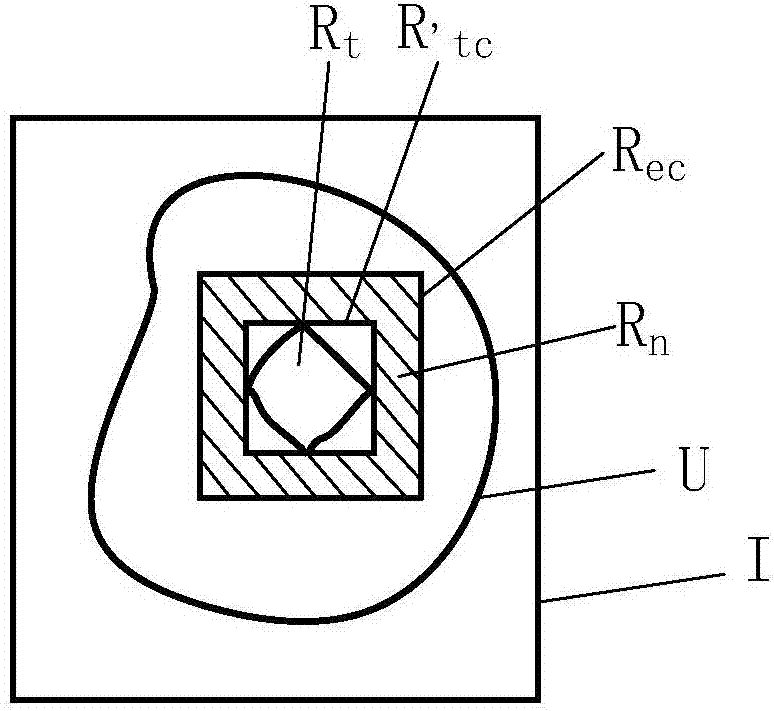
图2为本发明的构造肿瘤区域的第一长方体、第二长方体以及第三长方体的位置示意图。
具体实施方式
下面结合附图对本发明做进一步的详细说明,以令本领域技术人员参照说明书文字能够据以实施。
应当理解,本文所使用的诸如“具有”、“包含”以及“包括”术语并不配出一个或多个其它元件或其组合的存在或添加。
如图1所示,本发明提供一种肿瘤识别方法,其包括以下步骤:
s10,粗分割:对ct图像依次进行器官分割和血管分割,获得去除血管的器官ct图像。
s20,构造测试样本数据集合:基于器官ct图像,依次构造动脉期、静脉期和延迟期的肿瘤区域子图集形成测试正样本数据集合、器官正常区域子图集构成测试负样本数据集合;
s30,训练肿瘤分类器:对测试样本数据集合进行特征数据提取,训练出包括肿瘤良/恶识别与分期的肿瘤分类器;
s40,待测ct图像的特征数据提取和肿瘤的识别与分期:依次对动脉期、静脉期和延迟期的待测ct图像进行特征数据提取形成待测特征数据集合,将待测特征数据集合输入肿瘤分类器进行肿瘤良/恶识别与分期。
上述步骤s10中,作为一种优选实施方式,对ct图像进行器官分割,依次包括骨性结构分割、器官区域初始化、器官粗分割以及器官精分割,有利于为后续肿瘤分割提供精确分割的器官。
其中,器官区域初始化,指的是在每个断层ct图像上获得器官的位置,包括在每个断层ct图像上依次确定x方向、y方向上器官的起止点以及手动确认z方向上器官的区域。以肾脏器官为例,考虑到肾脏器官成对存在于人体,肾脏器官区域初始化,包括以下步骤:
s111,确定x方向左右肾的起止点:将骨性结构分割结果在x轴方向上投影,得到投影曲线;计算投影曲线上每一点在其邻域上的标准差,得到标准差分布曲线;在标准差分布曲线的左右两侧取其峰值,其在标准差分布曲线的最左侧,取其第一个峰值,记作xlmin,在其最右侧取其峰值,记作xrmin;在x方向的标准差分割曲线上取其最大峰值和次大峰值,位于左侧的记作xlmax,位于右侧的记作xrmax,则,xlmin和xlmin之间的区域即为左肾在x方向的所在区域;xrmin和xrmin之间的区域即为右肾在x方向的所在区域;
s112,确定y方向的肾脏起止点:将骨性结构分割结果在y轴方向上投影,得到投影曲线;计算投影曲线上每一点在其邻域上的标准差,得到标准差分布曲线;取标准差分布曲线上最大峰值后的波谷为定位点ymin;为了得到另一个定位点ymax,从y轴投影曲线上的ymin点开始以n为步长为向负方向做面积累加和曲线,记作c;曲线c的拐点,记作ymax,则,点ymin、ymax之间的区域为双肾所在区域。
s113,手动确认z方向上肾脏的所在区域,对区域中的每一个断层进行步骤s111和步骤s112的处理,得到每一个断层图像中的肾脏所在的位置。
其中,器官的粗分割,包括以下步骤:
s121,选取两侧肾脏的种子点,在平扫图像或延迟期图像中设置区域生长方法的生长规则,分割得到的结果作为肾脏分割的初始结果。生长规则为:手动选取的种子点s所在邻域的平均灰度记作gs;当前被标记为器官的体素记作p,其邻域范围内的灰度均值为gp;p邻域范围内的未被标记的体素记作px,其邻域范围内的灰度均值记作gx;若gx满足|gs-gx|<t1,且|gp-gx|<t2,则p被标记为器官,否则标记为背景;其中t1和t2是预设的阈值。
其中,器官精分割包括以下步骤:
s131,构造能量函数:
其中,c1和c2为曲线内外区域的灰度平均值,u(x,y)表示断层图像(x,y)上的灰度值;
s132,对于每一个含有器官的断层图像,以粗分割的结果作为精分割的初始边界,在预设的窄带d范围内对使用图割方法对曲线c进行演化,得到当前断层图像的分割结果;
s133,下一个断层图像的粗分割结果作为初始分割边界,以上一断层的最终分割结果作为形状约束条件,重复图割方法对曲线c的演化,得到该断层图像的最终分割结果。
上述实施方式中,通过步骤s131采用的构造能量函数的方法、步骤s132中涉及的图割方法对曲线c演化以及步骤s133中涉及的断层图像之间的重复图割方法,可以直接描绘断层图像分割的器官的边缘轮廓,分割精度高。
上述步骤s10中,作为一种优选实施方式,血管分割,包括以下步骤:
s141,非线性滤波和血管增强:分别对动脉期和静脉期的ct图像进行血管增强和滤波;
s142,血管粗分割:在动脉期增强后的血管区域和静脉期增强后的血管区域分别选择一个或若干个种子点;分别对动脉期滤波后的图像和静脉期滤波后的图像使用区域增长法,获得动脉期和静脉期的ct图像中血管粗分割结果;
s143,血管精确分割:构造区域、边缘和先验形状结合的水平集能量函数;分别以动脉期和静脉期的ct图像中血管粗分割结果为分割初始界面,精确分割动脉期和静脉期的ct图像中血管。
该实施方式中,在很多情况下,器官中的肿瘤附近存在很多血管,为了进一步提高肿瘤分割的精确性,先对器官上肿瘤附近的血管进行分割。定义动脉期ct图像增强的血管区域为v动e、滤波后的图像为i动ve,定义静脉期ct图像增强的血管区域为v静e、滤波后的图像为i静ve;则,在v动e区域中选择一个或若干个种子点,对i动ve使用区域增长方法,得到动脉期ct图像的血管粗分割结果,记做s’动;在v静e区域中选择一个或若干个种子点,对i静ve使用区域增长方法,得到静脉期ct图像的血管粗分割结果,记做s’静;以s’动为分割初始界面,精确分割动脉期ct图像中的血管,分割得到的血管记做s动;以s’静为分割初始界面,精确分割静脉期ct图像中的血管,分割得到的血管记做s静。
上述步骤s10中,作为优选,对ct图像依次进行器官分割和血管分割之前,还包括对ct图像进行预处理,预处理至少包括采用三维高斯平滑算法对ct三维序列图像进行平滑滤波处理,为器官分割和血管分割提供一个精确的ct图像基础。
上述步骤s20中,构造测试样本数据集合,包括以下步骤:
s21,依次对动脉期、静脉期以及延迟期的器官ct图像,手动分割肿瘤,构造肿瘤所在区域的外接长方体为第一长方体,对第一长方体进行长、宽、高方向的等比例拓展,获得延拓后的第二长方体;定义第二长方体减去第一长方体的区域为第二长方体中正常组织区域;
s22,以肿瘤区域中的每个体素为中心构造第一子图,对每一个第一子图进行插值,形成第一插值子图集;
s23,以第二长方体减去第一长方体的区域中的若干点为中心构造第二子图,对每个第二子图进行插值,形成第二插值子图集;
s24,以器官的其他正常组织中的若干点为中心构造第三子图,对每个第三子图进行插值,形成第三插值子图集;
s25,定义第一插值子图集为动脉期、静脉期以及延迟期的测试正样本数据集合,分别对第二插值子图集和第三插值子图集进行随机下采样,得到动脉期、静脉期以及延迟期的测试负样本数据集合。
其中,步骤s21中,以动脉期器官ct图像为例,如图2所示,ct图像为i,肿瘤为u,标记医生手动分割的肿瘤所在区域为rt;构造rt的外接长方体即第一长方体为r’tc,在长、宽、高方向对r’tc进行等比例延拓,延拓后的长方体即第二长方体,记做rec,定义rn=rec-r’tc,则rn为第二长方体rec中正常区域。rec和r’tc的长、宽、高比值为定值,作为优选,该值介于1~2。
步骤s22中,定义肿瘤区域rt的体素为pt,以pt为中心对每一个pt构造第一子图,第一子图大小为r’tx×r’ty×r’tz;通过插值方式,将第一子图插值为rx×ry×rz,插值后所有第一子图形成的集合即为第一插值子图集,记作it。
步骤s23中,在rn中随机选择若干点pn,以pn为中心,对每一个pn构造第二子图,第二子图大小为r’nx×r’ny×r’nz;通过插值的方式,将第二子图插值为rx×ry×rz,插值后所有第二子图形成的集合即为第二插值子图集,记做in。一般地,在同一幅图像中,选择pn的数量等于rt中肿瘤体素的数量;由pn构造的原始图和由pt构造的原始子图没有交集。
步骤s24中,在器官的其他正常组织中随机选择若干点po,以po为中心构造第三子图,第三子图大小为r’ox×r’oy×r’oz;通过插值的方式,将第三子图插值为rx×ry×rz,插值后所有第三子图形成的集合即为第三插值子图集,记做io。一般地,由po构造的原始图和由pt构造的原始子图没有交集。
步骤s21-s24中,分别对动脉期、静脉期以及延迟期的器官图像提取各自时相的子图插值集后,步骤s25中,定义第一插值子图集it为动脉期、静脉期以及延迟期的测试正样本数据集合,集合中的特征元素数量为n;分别对第二插值子图集和第三插值子图集进行随机下采样,下采样子图数量为n,得到动脉期、静脉期以及延迟期的测试负样本数据集合。
上述实施方式中,通过对动脉期、静脉期和延迟期的肿瘤区域或器官正常区域分别构造子图集,以分别形成测试正样本数据集合和测试负样本数据集合;对子图集中的每个子图进行插值处理,细化每一个子图,有利于后续对样本数据的特征数据进行高精度提取。
步骤s30中,对测试样本数据集合进行特征数据提取,包括以下步骤:
s31,按照动脉期、静脉期以及延迟期,分别对测试正样本数据集合以及测试负样本数据集合依次提取灰度特征、纹理特征、几何特征以及其他特征,形成动脉期特征集合、静脉期特征集合以及延迟期特征集合;
s32,构造多时相差异特征集合:动脉期特征集合、静脉期特征集合以及延迟期特征集合中的元素分别减去其他对应时期特征集合中的对应元素的差值,形成三个差异特征集合。
其中,步骤s31中,分别对测试正样本数据集合以及测试负样本数据集合依次提取多种类型的特征,为后续训练分类器提供多样化特征训练基础。因此,灰度特征至少包括肿瘤所在区域的最大ct值、最小ct值、ct值均值、ct值标准差、ct值三阶中心矩、ct值四阶中心矩、ct值五阶中心矩、ct值直方图;纹理特征至少包括hoggabor变换特征、多尺度hurst特征、lbp、灰度共生矩阵、相关系数、紧密度、灰度级运行长度矩阵、灰度区域大小矩阵;作为更进一步优选,灰度共生矩阵至少包括:共生矩阵矩、共生矩阵熵、共生矩阵;灰度级运行长度矩阵至少包括:灰度不均匀性、高灰度级运行重点、低灰度级运行重点、长期运行重点、长期运行高灰度级重点、长期运行低灰度及运行重点、运行长度不均匀性、运行率、短期运行重点,短期运行高灰度级重点、短期运行低灰度及运行重点;灰度区域大小矩阵至少包括:高亮度重点、高亮度大面积重点、高亮度小面积重点、亮度变化、大面积重点、低亮度重点、低亮度大面积重点、低亮度小面积重点、小面积重点、尺寸区域变化、区域百分比;几何特征至少包括肿瘤所在三维区域的体积、肿瘤区域表面积、球度、延伸率、椭球率、细长度、矩形度、凹度比值、不规则度,肿瘤所在区域的外接长方体的尺寸,肿瘤表面的曲率;其他特征至少包括肿瘤区域的小波特征、能量、熵、尺寸区域可变性、clustershade、clustertendency、齐次性、最大似然率。
步骤s32中,定义动脉期特征集合为f动、静脉期特征集合为f静以及延迟期特征集合为f消,则f动、f静以及f消中的特征元素分别减去其他对应特征元素的差值形成的三个差异特征集合,即为:f动-静=f动-f静,f动-消=f动-f消,f静-消=f静-f消。相比于周围正常的组织,很多恶性肿瘤具有较快的代谢,使得ct造影剂进出肿瘤的速度和正常组织不一样。比如在肾脏肿瘤,ct造影剂具有“快进快出”的特点,即造影剂在动脉期会快速地进入肿瘤,使得肿瘤在动脉期有明显的增强;而在静脉期和延迟期,造影剂会快速地从肿瘤中出来,使得肿瘤在静脉期和延迟期的增强不明显。因此,步骤s32中,通过动脉期特征集合、静脉期特征集合以及延迟期特征集合中的特征元素分别减去其他对应特征元素的差值,形成三个差异特征集合,以构造多时相的特征,有利于识别恶性肿瘤。
步骤s30中,训练出包括肿瘤良/恶识别与分期的肿瘤分类器,包括以下步骤:
s33,向每一个分类器中分别输入将动脉期特征集合、静脉期特征集合、延迟期特征集合以及三个差异特征集合进行训练,获得肿瘤的六核分类器;
s34,根据肿瘤分类器的分类结果定义肿瘤的良/恶与分期。
上述步骤s33中,向每一个分类器中分别输入将动脉期特征集合、静脉期特征集合、延迟期特征集合以及三个差异特征集合进行训练,即每一个分类器中分别输入步骤s32中提及的f动、f静、f消、f动-静、f动-消以及f静-消,进行训练,最终的分类结果记为p=∑iαipi,α为每一个分类器的权重,pi为每一个分类器判定为的正样本的概率,p为6个分类器集成之后判定为正样本的概率,若p>t,则判定为正样本,反之为负样本。
上述步骤s34中,根据肿瘤的六核分类器进行分类的结果,定义肿瘤的良/恶与分期,则通过该肿瘤的六核分类器,可以对待测ct图像进行肿瘤良/恶识别与分期,识别方法客观、定量、精确。至于如何设置肿瘤分类器的分类结果的阈值,以分别对应到肿瘤良/恶以及分期的识别,本发明不做具体限定,根据不同器官的肿瘤特性具体设置即可。
步骤s30和步骤s40中涉及的特征数据提取前,还包括:
s50,碘剂量校正。其包括以下步骤:
选取ct平扫图像中的动脉区域、静脉区域的平均ct值,分别记作v动和v静;
分别计算动脉期ct图像的动脉区域以及静脉期ct图像的静脉区域的平均ct值,分别记作v’动和v’静;
分别计算ct平扫图像与动脉期ct图像中动脉区域以及静脉期ct图像中静脉区域的ct均值差异,分别记作δv动和δv静,则,δv动=v动-v’动;,即δv静=v静-v’动;
依据器官在ct平扫图像中的ct值,分别计算碘计量校正后器官区域的动脉期ct值与静脉期ct值,分别记作v动器官和v静器官,则,v动器官=v平扫器官+δv动,v静器官=v平扫器官+δv静。
该实施方式中,通过步骤s50进行碘剂量校正,有利于消除碘剂添加对特征数据的读取造成影响而进一步影响特征数据提取的准确性。
本发明提供的肿瘤识别方法,基于依次构造动脉期、静脉期和延迟期的肿瘤区域子图集形成测试正样本数据集合、器官正常区域子图集构成测试负样本数据集合,对测试样本数据集进行特征数据提取,训练出包括肿瘤良/恶识别和分期的肿瘤分类器,可对待测ct图像进行肿瘤良/恶识别与分期,识别方法客观、定量、精确。
尽管本发明的实施方案已公开如上,但其并不仅仅限于说明书和实施方式中所列运用。它完全可以被适用于各种适合本发明的领域。对于熟悉本领域的人员而言可容易地实现另外的修改。因此在不背离权利要求及等同范围所限定的一般概念下,本发明并不限于特定的细节和这里示出与描述的图例。
- 还没有人留言评论。精彩留言会获得点赞!