一种锂离子电池性能的测定与改进方法与流程
本发明属于锂离子电池
技术领域:
,尤其涉及一种锂离子电池性能的测定与改进方法。
背景技术:
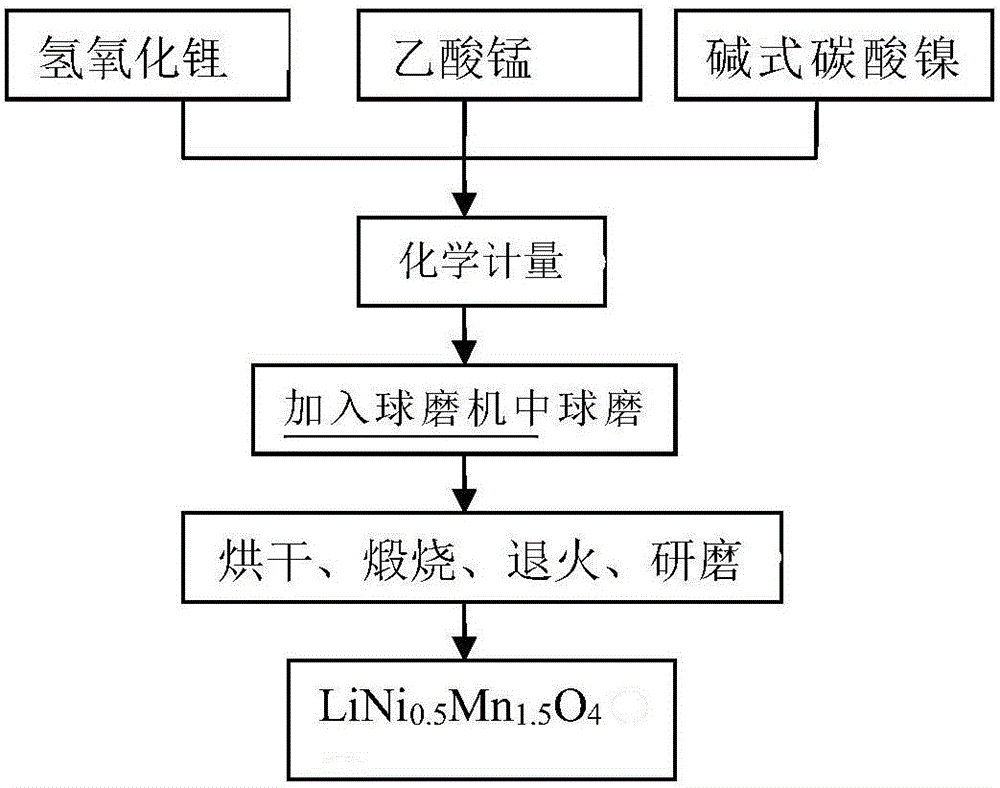
:当代社会,人类对能源、信息与材料的需求越来越高,人类社会经济发展与能源短缺的矛盾日益尖锐。如果继续大量使用化石燃料,将会加剧空气污染和温室效应等问题,还会造成能源枯竭现象出现。为了解决能源危机,保证经济可持续的发展,并且保护我们赖以生存的地球,科学家们致力于新能源的研究,例如太阳能等,然而,这些能量源在时间和空间上是不稳定的,常常受到天气、环境、时间的影响,需要适当转换和存储后才能保证其发电量的稳定,才能充分利用这些能源。因此,作为良好的储能装置,锂离子电池受到了许多科研人员的关注,锂离子电池一直是最有效的能源,具有较高的开路电压,放电容量大,循环寿命长,环境友好的特点。随着锂离子电池的不断开发研究以及商业化,锂离子电池被广泛运用,已成为人类日常生活中不可缺少的用品。锂离子电池负极材料通常为石墨,其性能已非常优异。而正极材料的性能却不太理想,因此其性能将会直接影响电池的综合性能。锂电池常见的正极材料有多种,其中,LiNiO2、LiCoO2、LiMn2O4、LiFePO4、LiMnO2等正极材料是目前研究比较深入的材料。不同正极材料对锂离子电池的性能有很大影响,其成本也决定了电池的成本。LiCoO2材料的理论容量有270mAh/g,然而实验测得的实际容量却远小于理论值,基本上约为135mAh/g。其中主要的原因是:为了防止钴酸锂的结构在过充电和过放电过程中的结构破坏和电池的安全性能,限制了充放电的截至电压,钴酸锂材料中只有一半的锂离子实际可用,导致钴酸锂正极材料的实际容量只有理论容量的一半。现在通常采用的改善电池电化学性能的办法为是引入一定量的其他离子来增加LiCoO2的结构的稳定性,增加电池的实际容量,并且有利于材料的可逆程度的提高。但是我国Co资源匮乏,导致该材料价格昂贵,并且具有一定的毒性,不利于电池的开发利用。LiNiO2的理论容量为275mAh/g,而它的实际容量可以达到180mAh/g左右。LiNiO2材料原料丰富、价格相对便宜,但是LiNiO2的制备工艺过于复杂,在充放电过程中会发生相变,导致容量衰减,在非氧气氛围中燃烧会产生大量杂质相。电池的热稳定性能差,容易导致安全事故的发生,因此也限制了该材料的商业化应用。LiMnO2材料的结构为层状结构,理论容量为285mAh/g,而实验测量的实际容量约为180mAh/g,放电电压约3V。该材料在充放电过程中结构不稳定,引起材料体积变化,影响材料的循环性能,Mn3+的存在导致姜泰勒效应发生。LiMn2O4理论容量为148mAh/g,实际容量约115mAh/g。相对Co和Ni,我国Mn资源丰富,价格低廉,无毒,环境友好等优点[15-19]。但LiMn2O4材料无法避免姜泰勒效应的发生,锂离子扩散性能减弱,导电性下降,循环性能较差,容量衰减快等问题,而且容易发生锰的溶解,电解液分解等,通常为了改善其性能,可以掺入过渡金属。LiFePO4具有橄榄石型结构,理论容量为170mAh/g,实际容量为109mAh/g左右。LiFePO4价格低,安全,稳定,但容量不高,体积比容量低,而且材料的电导率低,需要通过表面修饰等手段加以改进。综上所述,现有锂离子电池的正极材料成本较高,制备复杂,克容量等电化学性能需要改进。技术实现要素:本发明的目的在于提供一种锂离子电池性能的测定与改进方法,旨在解决现有锂离子电池的正极材料成本较高,制备复杂,克容量等电化学性能比较差的问题。本发明是这样实现的,一种LiCr0.1Ni0.5Mn1.4O3.95F0.05材料,所述LiCr0.1Ni0.5Mn1.4O3.95F0.05材料由氟化锂0.05mol、氢氧化锂0.95mol、硝酸镍0.5mol、碳酸锰1.4mol、硝酸铬0.1mol和一水合柠檬酸1mol组成。本发明的另一目的在于提供一种所述LiCr0.1Ni0.5Mn1.4O3.95F0.05材料的合成方法,所述LiCr0.1Ni0.5Mn1.4O3.95F0.05材料的合成方法包括以下步骤:步骤一,以氟化锂、氢氧化锂、硝酸镍、碳酸锰、硝酸铬、一水合柠檬酸为原料按化学计量比准确称量,研磨均匀混合配成悬浊液以后缓慢加入到一定量的柠檬酸溶液(400ml)中;步骤二,在加入悬浊液的同时进行水浴加热,保持80℃并且不断搅拌4h,使其能混合均匀充分反应;步骤三,在90℃的水浴加热条件下,持续搅拌混合溶液,直至溶液变成粘稠状;步骤四,然后用电热鼓风干燥箱在80℃的条件下烘干直至形成干凝胶;将干凝胶磨碎后,在管式电阻炉中分别在450℃条件下恒温预烧8h、800℃煅烧15h、650℃退火处理12h;步骤五,在电阻炉内冷却至室温,研磨得到LiCr0.1Ni0.5Mn1.4O3.95F0.05。本发明的另一目的在于提供一种由所述LiCr0.1Ni0.5Mn1.4O3.95F0.05材料制备的电池正极材料。本发明的另一目的在于提供一种由所述电池正极材料制备的锂电池。本发明的另一目的在于提供一种由所述电池正极材料制备的电池。进一步,所述电池的制备方法包括以下步骤:第一步,将PTFE、炭黑、正极材料按质量比1:1:8称量,先将PTFE放入烧杯中,滴入少量酒精,混合均匀;第二步,然后把炭黑与正极材料放入其中,滴加10ml的酒精,充分搅拌混合,之后用超声仪分散10min,使其混合均匀,放入鼓风干燥箱中在80℃条件下干燥至粘稠状,碾成电极片;第三步,取纽扣电池大小的一部分电极片,放在纽扣电池底壳上,用压片机压片后放入真空干燥箱中干燥6小时以上;第四步,取出后,将正极材料、隔膜、锂片、电解液等材料送入小型扣式封口机中,以上面制备的圆形电极片为正极,一定大小的圆形锂片为负极,隔膜和电解液为原料制备纽扣电池;制备完毕后,用封口机将电池封好。本发明的另一目的在于提供一种安装有所述电池的电动汽车。本发明的另一目的在于提供一种安装有所述电池的电动车。本发明的另一目的在于提供一种安装有所述电池的汽车。本发明提供的锂离子电池性能的测定与改进方法,本发明拟通过不同方法合成LiNi0.5Mn1.5O4,探究其性能;在LiNi0.5Mn1.5O4中掺入Cr、F,用溶胶凝胶法制备出材料LiCr0.1Ni0.5Mn1.4O3.95F0.05,该材料相对未掺杂材料而言,0.1C倍率下,放电容量为137mAh/g,接近理论值,而且容量保持率高,具有优良的电化学性能。我国是Mn资源大国,Mn资源在我国储存量大,相对Co而言,Mn资源的价格便宜,此外,该锰源的正极材料具有电化学性能好,操作方便,环境危害小等优点。附图说明图1是本发明实施例提供的合成LiCr0.1Ni0.5Mn1.4O3.95F0.05的流程图。图2是本发明实施例提供的球磨法合成LiNi0.5Mn1.5O4流程图。图3是本发明实施例提供的溶胶凝胶法合成LiCr0.1Ni0.5Mn1.4O3.95F0.05流程图。图4是本发明实施例提供的LiNi0.5Mn1.5O4的TG/DTA曲线示意图。图5是本发明实施例提供的LiNi0.5Mn1.5O4XRD分析示意图。图6是本发明实施例提供的不同放大倍数下的LiNi0.5Mn1.5O4形貌示意图;图中;(a)是10000倍(b)是20000倍。图7是本发明实施例提供的样品LiNi0.5Mn1.5O4在不同倍率下的充放电曲线示意图。图8是本发明实施例提供的样品LiNi0.5Mn1.5O4在不同倍率下的循环性能曲线示意图。图9是本发明实施例提供的LiCr0.1Ni0.5Mn1.4O3.95F0.05的TG/DTA曲线示意图。图10是本发明实施例提供的LiCr0.1Ni0.5Mn1.4O3.95F0.05XRD分析示意图。图11是本发明实施例提供的不同放大倍数下的LiCr0.1Ni0.5Mn1.4O3.95F0.05形貌示意图;图中:(a)是14000倍;(b)是20000倍;(c)是20000倍;(d)是2000倍。图12是本发明实施例提供的样品LiCr0.1Ni0.5Mn1.4O3.95F0.05在不同倍率下的充放电曲线示意图。图13是本发明实施例提供的样品LiCr0.1Ni0.5Mn1.4O3.95F0.05在不同倍率下的循环性能曲线示意图。图14是本发明实施例提供的LiNi0.5Mn1.5O4和LiCr0.1Ni0.5Mn1.4O3.95F0.050.1C倍率充放电曲线对比示意图。图15是本发明实施例提供的LiNi0.5Mn1.5O4和LiCr0.1Ni0.5Mn1.4O3.95F0.050.2C倍率充放电曲线对比示意图。图16是本发明实施例提供的LiNi0.5Mn1.5O4和LiCr0.1Ni0.5Mn1.4O3.95F0.050.4C倍率充放电曲线对比示意图。图17是本发明实施例提供的LiNi0.5Mn1.5O4和LiCr0.1Ni0.5Mn1.4O3.95F0.05不同倍率下循环性能对比示意图。具体实施方式为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。下面结合附图对本发明的应用原理作详细的描述。如图1所示,本发明实施例提供的合成LiCr0.1Ni0.5Mn1.4O3.95F0.05方法包括以下步骤:S101:以氟化锂、氢氧化锂、硝酸镍、碳酸锰、硝酸铬、一水合柠檬酸为原料按化学计量比准确称量,研磨均匀混合配成悬浊液以后缓慢加入到一定量的柠檬酸(柠檬酸的总量为各金属离子物质的量之和)溶液中,在加入悬浊液的同时进行水浴加热并且不断搅拌,使其能混合均匀充分反应;S102:在90℃的水浴加热条件下,持续搅拌混合溶液,直至溶液变成粘稠状,然后用电热鼓风干燥箱在80℃的条件下烘干直至形成干凝胶;将干凝胶磨碎后,在管式电阻炉中分别在450℃条件下恒温预烧8h、800℃煅烧15h、650℃退火处理12h;在电阻炉内冷却至室温,研磨得到LiCr0.1Ni0.5Mn1.4O3.95F0.05。下面结合实验对本发明的应用原理作进一步的描述。1实验部分1.1主要的化学试剂与实验仪器本发明中的化学原料(试剂)详见表1表1化学名分子式分子量规格厂家氟化锂LiF25.94CP氢氧化锂LiOH·H2O41.96AR碱式碳酸镍NiCO3·2Ni(OH)2·4H2O376.23AR上海展云化工有限公司硝酸镍Ni(NO3)2·6H2O290.8AR温州市华侨化学试剂有限公司碳酸锰MnCO3114.95CP上海展云化工有限公司硝酸铝Al(NO3)3·9H2O375.13AR上海振欣试剂厂硝酸铬Cr(NO3)3·9H2O400.15AR上海展云化工有限公司一水合柠檬酸C6H8O7·H2O210.14AR江苏强盛功能化学股份有限公司氟化镍NiF2·4H2O169.75AladdinChemistryCo.Ltd试验所用的化学原料(试剂)详见表2表21.2球磨法合成LiNi0.5Mn1.5O4材料以氢氧化锂、乙酸锰、一水合柠檬酸、碱式碳酸镍为原料按化学计量比准确称量,放入球磨机中研磨均匀,然后取出样品在鼓风干燥箱内80℃烘干。将样品放入玛瑙研体中仔细研磨后在管式电阻炉中分别在450℃条件下恒温预烧8h、800℃煅烧15h、650℃退火处理12h。在电阻炉内冷却至室温,再次充分研磨后得到LiNi0.5Mn1.5O4。反应流程图如图2。1.3溶胶凝胶法合成LiCr0.1Ni0.5Mn1.4O3.95F0.05材料以氟化锂、氢氧化锂、硝酸镍、碳酸锰、硝酸铬、一水合柠檬酸为原料按化学计量比准确称量,研磨均匀混合配成悬浊液以后缓慢加入到一定量的柠檬酸(柠檬酸的总量为各金属离子物质的量之和)溶液中,在加入悬浊液的同时进行水浴加热并且不断搅拌,使其能混合均匀充分反应。在90℃的水浴加热条件下,持续搅拌混合溶液,直至溶液变成粘稠状,然后用电热鼓风干燥箱在80℃的条件下烘干直至形成干凝胶。将干凝胶磨碎后,在管式电阻炉中分别在450℃条件下恒温预烧8h、800℃煅烧15h、650℃退火处理12h。在电阻炉内冷却至室温,研磨得到LiCr0.1Ni0.5Mn1.4O3.95F0.05。反应流程图如图3。1.4电池的制备将PTFE、炭黑、正极材料按1:1:8精确称量,先将PTFE放入烧杯中,滴入少量酒精,混合均匀,然后把炭黑与正极材料放入其中,滴加一定量的酒精,充分搅拌混合,之后用超声仪分散均匀,放入鼓风干燥箱中在80℃条件下干燥至粘稠状,碾成电极片,取纽扣电池大小的一部分电极片,放在纽扣电池底壳上,用压片机压片后放入真空干燥箱中干燥6小时以上。取出后,将正极材料、隔膜、锌片、电解液等材料送入小型扣式封口机中,以上面制备的圆形电极片为正极,一定大小的圆形锂片为负极,隔膜和电解液为原料制备纽扣电池。制备完毕后,用封口机将电池封好。2.结果和讨论2.1LiNi0.5Mn1.5O4的合成及电化学性能研究2.1.1LiNi0.5Mn1.5O4的合成(见实验部分1.2)2.1.2LiNi0.5Mn1.5O4的热重分析(TG)图4为LiNi0.5Mn1.5O4的TG/DTA分析曲线,样品随着温度的升高,不断失重,至400℃左右,样品整体失重70%。在100℃以前,TG曲线下降,是由于样品失去表面湿存水,同时乙酸锰失去结晶水;100~200℃,TG曲线下降是由于氢氧化锂材料失去结晶水;200~300℃,TG曲线下降是由于乙酸锰分解,此时DTA曲线有一个小的吸收峰,即乙酸锰分解吸热;300~400℃,TG曲线下降,是由于碱式碳酸镍分解成氧化镍和二氧化碳,DTA曲线存在一个很大的放热峰,是由于柠檬酸分解放出大量的热。2.1.3LiNi0.5Mn1.5O4的结构表征图5为800℃高温煅烧15h条件下合成的LiNi0.5Mn1.5O4的X射线衍射图。从图5中可以看出,所合成的产物的X射线粉末衍射图与标准的LiNi0.5Mn1.5O4衍射图材料的X射线衍射图高度吻合,并且材料的衍射峰可以按照尖晶石的结构进行指标化,说明合成产物为具有尖晶石结构的LiNi0.5Mn1.5O4。在衍射峰(222)(400)(440)左侧有其他的峰,根据文献可知当合成温度高于650℃氧缺陷严重时,材料的化学组成会偏离化学计量比,产生LizNiz-1O杂质,材料元素组成比列偏离。通过一定时间的退火处理,可以避免杂质的产生。2.1.4LiNi0.5Mn1.5O4的形貌表征(SEM-EDS)从图6中可以看出颗粒大小不均匀,基本为八面体形,形状较为清晰,但团聚现象较为明显,没有清晰单独的颗粒。由于在从管式电阻炉中取出后研磨过,所以在不同区域有大小不同的颗粒,大的颗粒大小在1~3μm,小的颗粒大小在300nm左右。LiNi0.5Mn1.5O4的EDS能谱分析,由EDS能谱分析可以看出材料中含有Ni、Mn、O元素且分布较为均匀。标准LiNi0.5Mn1.5O4中,Ni的原子百分比为8.3%,Mn为25%,O为66.7%,而测量结果显示Ni元素的含量偏高,相对而言,Mn元素的含量下降,可能原因:a.球磨后,用水冲洗,使乙酸锰溶解损失;b.乙酸锰溶于水,放入烘箱干燥时,附着于烧杯内壁;c.EDS为表面分析,Ni附于表面较多,故含量偏高。2.1.5LiNi0.5Mn1.5O4的电化学性能如图7所示,样品的总体充电平台为4.7V,放电为4.5V。0.1C倍率下,放电容量为63.23mAh/g,0.2C倍率下,放电容量为48.98mAh/g,0.4C倍率下,放电容量为23.03mAh/g,当放电速率从0.1C到0.2C时,容量保持率为77.46%,当放电速率从0.1C到0.4C时,容量保持率为36.42%,因此,随倍率增大,放电容量大幅降低。因为随着倍率的增大,充放电电流明显增大,因此电池严重极化,导致容量衰减,同时电池容量明显低于理论容量。2.1.6LiNi0.5Mn1.5O4的循环性能图8是样品LiNi0.5Mn1.5O4在0.1C,0.2C和0.4C倍率下的循环性能曲线。从曲线上看出,LiNi0.5Mn1.5O4的循环性能较好,基本保持不变,但不可避免的出现容量衰减的现象。当倍率重新回到0.1C时,材料容量基本回到初始容量,表明材料结构较稳定,能经受大电流充放电。2.2LiNi0.5Mn1.5O4材料掺杂改性2.2.1LiCr0.1Ni0.5Mn1.4O3.95F0.05的合成(见实验部分1.3)2.2.2LiCr0.1Ni0.5Mn1.4O3.95F0.05前驱体的热重分析(TG)图9为LiCr0.1Ni0.5Mn1.4O3.95F0.05的TG/DTA分析曲线,样品随着温度的升高,不断失重,至400℃左右,样品整体失重68%。在100℃以前,TG曲线下降,是由于样品失去表面湿存水,硝酸镍失去结晶水;100℃~200℃,TG曲线下降是由于氢氧化锂失去结晶水,同时Cr(NO3)3·9H2O分解,硝酸镍开始分解,生成碱式盐,继续受热,则生Ni2O3和NiO。300℃~400℃,TG曲线下降,是由于硝酸镍完全分解和柠檬酸分解,DTA曲线存在一个很大的放热峰,便是由于柠檬酸分解放出大量的热。2.2.3LiCr0.1Ni0.5Mn1.4O3.95F0.05的结构表征图10为800℃煅烧15h条件下合成的LiCr0.1Ni0.5Mn1.4O3.95F0.05的X射线衍射图。从XRD图中可以看出,合成产物的X射线衍射图与标准的LiNi0.5Mn1.5O4材料的X射线衍射图高度吻合,并且产物的衍射峰可以按照尖晶石的结构进行指标化,说明产物为具有尖晶石结构的LiCr0.1Ni0.5Mn1.4O3.95F0.05。在衍射峰(222)(400)(440)左侧有其他的峰,根据文献当合成温度高于650℃氧缺陷严重时,材料的化学组成会偏离化学计量比,产生LizNiz-1O杂质,材料元素组成比例偏离。通过一定时间的退火处理,可以避免杂质的产生。掺杂后的样品的峰更为尖锐,杂质峰相对较少,说明样品中杂质较少,纯度高,具有更好的晶体结构。2.2.4LiCr0.1Ni0.5Mn1.4O3.95F0.05的形貌表征(SEM-EDS)从图11中可以看出颗粒大小比较均匀,明显为八面体形结构,形状结构边缘非常清晰,团聚现象不明显,存在清晰单独的颗粒。由于在从管式电阻炉中取出后研磨过,所以在不同区域有大小不同的颗粒,颗粒基本在1~3μm左右。LiCr0.1Ni0.5Mn1.4O3.95F0.05的EDS能谱分析,由EDS能谱分析看出中看出材料中含有Cr、Ni、Mn、O元素且分布较为均匀,由于F元素含量过低,无法检测出来。标准LiCr0.1Ni0.5Mn1.4O3.95F0.05中,Ni的原子百分比为8.3%,Cr为1.67%,Mn为23%,O为66.7%,而测量结果计算结果基本吻合,但显示Ni、Mn元素的含量偏低,可能原因是EDS只测量样品八面体其中一个面的一部分,只是表面测量,故存在着一定的误差。2.2.5LiCr0.1Ni0.5Mn1.4O3.95F0.05的电化学性能如图12所示,用充放电测试仪测定LiCr0.1Ni0.5Mn1.4O3.95F0.05电池的充放电容量。样品的总体充电平台为4.8V,放电平台为4.6V,但材料在4V附近存在一个放电平台,说明样品中存在三价锰杂质。0.1C倍率下,放电容量为137mAh/g;0.2C倍率下,放电容量为130mAh/g;0.4C倍率下,放电容量为114.4mAh/g;0.8C倍率下,放电容量为90.6mAh/g,当放电速率从0.1C到0.2C时,容量保持率为94.9%;当放电速率从0.1C到0.4C时,容量保持率为83.5%;当放电速率从0.1C到0.8C时,容量保持率为66.17%。因此,随倍率增大,电池出现极化,放电容量明显下降。与未掺杂时相比,LiCr0.1Ni0.5Mn1.4O3.95F0.05的容量明显增大,在4.6V有个放电平台,是由于Ni2+被氧化为Ni4+形成。在4V电位区域,有一个放电平台,说明材料中存在少量的Mn3+。2.2.6LiCr0.1Ni0.5Mn1.4O3.95F0.05的循环性能图13是样品LiCr0.1Ni0.5Mn1.4O3.95F0.05在0.1C,0.2C,0.4C,0.8C,1C和2C倍率下的循环性能曲线。从曲线上看出,与未掺杂相比LiCr0.1Ni0.5Mn1.4O3.95F0.05的循环性能更好,在大电流充放电情况下,样品的循环性能仍然非常稳定。0.1C倍率下,电池放电容量先减少后趋于稳定,可能原因是电池开始没有较好的活化,电解液没有充分浸润。经过几次循环后,容量趋于稳定。2.3两种材料的比较2.3.1结构与形貌未掺杂的LiNi0.5Mn1.5O4颗粒大小不均匀,基本为八面体形,形状较为清晰,但团聚现象较为明显,没有清晰单独的颗粒。掺杂后的LiCr0.1Ni0.5Mn1.4O3.95F0.05颗粒大小比较均匀,明显为八面体形结构,形状结构边缘非常清晰,团聚现象不明显,存在清晰单独的颗粒。颗粒基本在1~3μm左右。因此掺杂后的材料结构更好,且大小更均匀。2.3.2容量用充放电测试仪测定LiNi0.5Mn1.5O4和LiCr0.1Ni0.5Mn1.4O3.95F0.05电池的充放电容量。LiNi0.5Mn1.5O4样品0.1C倍率下,放电容量为63.23mAh/g;LiCr0.1Ni0.5Mn1.4O3.95F0.05样品0.1C倍率下,放电容量为137mAh/g。LiNi0.5Mn1.5O4样品0.2C倍率下,放电容量为48.98mAh/g;LiCr0.1Ni0.5Mn1.4O3.95F0.05样品0.2C倍率下,放电容量为130mAh/g。LiNi0.5Mn1.5O4样品0.4C倍率下,放电容量为23.03mAh/g;LiCr0.1Ni0.5Mn1.4O3.95F0.05样品0.4C倍率下,放电容量为114.4mAh/g。当放电速率从0.1C到0.2C时,LiNi0.5Mn1.5O4样品容量保持率为77.46%,LiCr0.1Ni0.5Mn1.4O3.95F0.05样品容量保持率为94.9%。当放电速率从0.1C到0.4C时,LiNi0.5Mn1.5O4样品容量保持率为36.42%,LiCr0.1Ni0.5Mn1.4O3.95F0.05样品容量保持率为83.5%。从中可以看出:掺杂后样品的容量明显提高,而且容量保持率也明显改善。2.3.3倍率性能从图14、图15和图16可以明显看出:掺杂后的LiCr0.1Ni0.5Mn1.4O3.95F0.05样品,不管是在低倍率还是高倍率下,其容量都显著高于未掺杂的样品LiNi0.5Mn1.5O4,可能原因是LiNi0.5Mn1.5O4未掺杂时,团聚现象严重,导电性能差,并非所有材料都发挥其电化学性能,在LiNi0.5Mn1.5O4材料中掺入一定量的过渡金属元素,可增加材料结构的稳定性,有利于电池容量的提高,增加电池的可逆性。2.3.4循环性能从图17上看出,LiNi0.5Mn1.5O4的循环性能较好,基本保持不变,但不可避免的出现容量衰减的现象。当倍率重新回到0.1C时,材料容量基本回到初始容量,表明材料结构较稳定。与未掺杂相比,LiCr0.1Ni0.5Mn1.4O3.95F0.05的循环性能更好,尤其在大电流充放电情况下,样品的循环性能仍然非常稳定,能经受大电流充放电,循环性能明显更为优异。以球磨法制得的LiNi0.5Mn1.5O4为八面体,含有少量杂质相,原子分布较为均匀,只存在一个放电平台,说明用球磨法制备LiNi0.5Mn1.5O4具有一定的优势。但电池存在容量低,容量保持效果不好等问题。在LiNi0.5Mn1.5O4中掺入Cr、F,用溶胶凝胶法制备出材料LiCr0.1Ni0.5Mn1.4O3.95F0.05,该材料相对未掺杂材料而言,0.1C倍率下,放电容量为137mAh/g,基本接近理论值,而且容量保持率高,具有优良的电化学性能。以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1