一种锂镍钴氧化物正极材料及其制备方法、锂离子电池与流程
本发明涉及一种锂镍钴氧化物正极材料及其制备方法、锂离子电池。
背景技术:
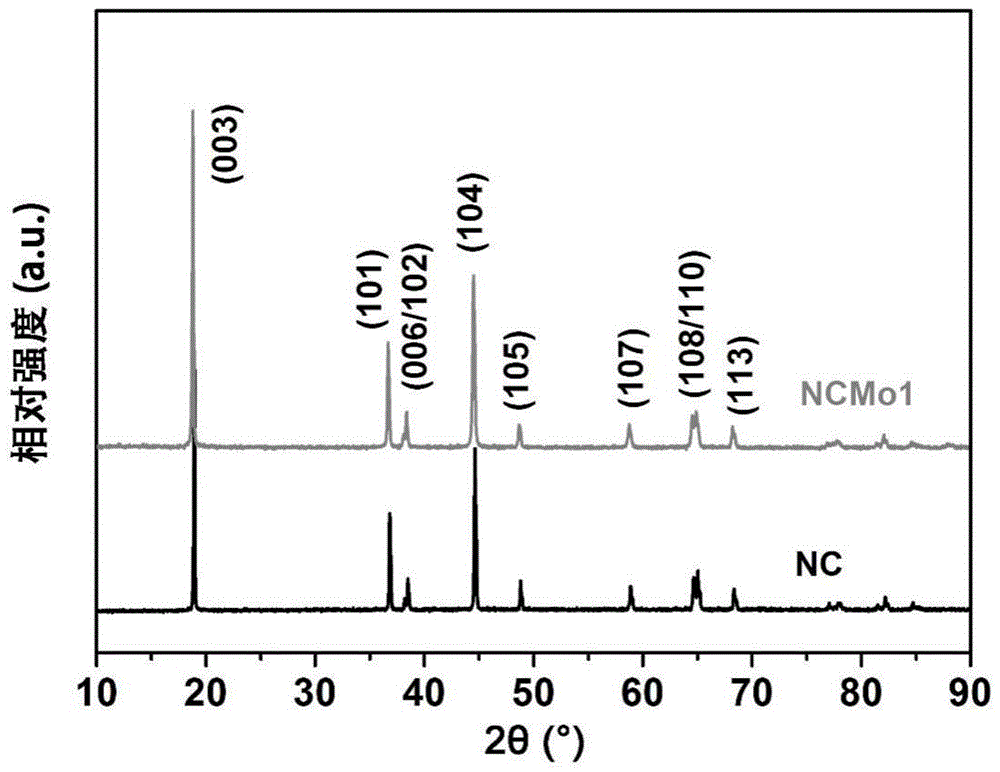
:随着人们对电动汽车续航里程要求的逐渐提升(≥500km),高能量密度锂离子电池迫在眉睫。然而,受限于低能量密度以及高成本的正极材料(如licoo2,lini1/3co1/3mn1/3o2),目前最先进的锂离子电池仍难以满足上述需求。因此,研发高容量,低成本以及长寿命的正极材料对于电动汽车的进一步发展具有重要意义。高镍含量的linizco(1-z)o2(z>0.8)正极材料因具有高的可逆比容量(~210mahg-1),低成本以及低毒性成为最有前景的下一代锂离子电池的正极材料。但较差的结构稳定性以及快速的容量衰减严重阻碍了它的商业应用。一方面,充电末期发生的不可逆的h2-h3相变会引起剧烈的体积变化,产生晶格应力,进而引发材料产生微裂纹甚至破碎,加速电解液的渗透以及界面处的寄生副反应,导致较差的结构稳定性。另一方面,由于ni2+(0.069nm)和li+(0.076nm)具有相似的离子半径,更易发生的li/ni混排导致材料表面结构发生层状→尖晶石相→盐岩相的不可逆转变,造成容量的快速衰减。目前,高镍正极材料linizco(1-z)o2中镍含量z一般不超过0.8,例如,中国专利文献cn110571422a公开了一种高镍正极材料,其记载的镍含量的值在0.8~1之间,但是实施例只公开其可解决镍含量为0.8时的正极材料循环稳定性。另外,高虹(liniym1-yo2(m=co,mn,ti,0<y<1)的制备和性能,2001.9.10,电源技术)探讨了liniyco1-yo2中y=0.7、0.8和0.9时,材料的电化学性能,结果表明y=0.8时的放电平台较高、放电平稳,电极材料的可逆容量和循环性能较佳。掺杂改性是解决上述问题,缓解h2-h3相变,稳定其结构的有效手段。目前,许多工作通过对成品湿化学包敷掺杂源以及后续的二次高温煅烧实现阳离子掺杂,但该方法容易在材料表面生成惰性化合物降低掺杂效率。此外,大多数阳离子具有电化学惰性以及较高的价态,在改善结构稳定性的同时易在材料表面生成不均匀的惰性盐岩相结构,阻碍离子和电子的传输并造成一定程度的容量损失。但是,目前在正极材料中,掺杂改性来改善材料的循环性能也只停留在针对linizco(1-z)o2式中,z在0.8以下的掺杂改性。无法更进一步的在减少成本的同时,还能够使得循环稳定性和可逆容量等性能在较高的水平。技术实现要素:本发明所要解决的技术问题在于克服了现有技术中无法得到循环稳定性高、可逆容量高,且更高镍含量的锂镍钴氧化物正极材料,而提供了一种锂镍钴氧化物正极材料及其制备方法、锂离子电池。本发明的锂镍钴氧化物正极材料在添加更高含量的镍(linizco(1-z)o2,式中的z在0.8以上)之后,同时结合钼的高价态和高键能,得到了钼元素掺杂的锂镍钴氧化物正极材料可显著抑制h2-h3相变,使锂镍钴氧化物正极材料的结构更加稳定,且循环稳定性高、可逆容量高、工艺简单、成本低,可应用于大规模工业化生产。目前,现有技术中在锂镍钴氧化物(linizco(1-z)o2)正极材料领域,linizco(1-z)o2式中代表镍含量的z值一般不超过0.8。当超过0.8时,锂镍钴氧化物正极材料的循环稳定性差、可逆容量低,无法达到使用的要求。本发明的发明人经过创造性的劳动筛选了多个实验条件,得到了本发明的技术方案。例如筛选了式中ni的含量为0.8~0.95(不包括0.8),以及掺杂的元素等均对本发明正极材料的性能存在显著的影响。本发明巧妙的将上述诸多特征进行了限定,才能够使得本发明的锂镍钴氧化物正极材料具有诸多优异性能。本发明提供了一种锂镍钴氧化物正极材料,其化学式为:liniz-xco1-zmoxo2,0<x≤0.02,0.8<z-x≤0.95。所述liniz-xco1-zmoxo2中,所述的x较佳地为0.005~0.02,例如0.005、0.01或0.02。所述liniz-xco1-zmoxo2中,所述的z-x较佳地为0.85~0.95,例如0.87、0.88、0.89、0.895或0.91。更佳地为0.85~0.9,例如0.87、0.88、0.89、0.895;或者,更佳地为0.9~0.95,例如0.9~0.93,再例如0.91。本发明某较佳实施例中,所述锂镍钴氧化物正极材料的化学式为lini0.89co0.1mo0.01o2、lini0.895co0.1mo0.005o2、lini0.88co0.1mo0.02o2、lini0.87co0.12mo0.01o2或lini0.91co0.08mo0.01o2。本发明还提供了一种上述锂镍钴氧化物正极材料的制备方法,其包括以下步骤:将“镍钴氢氧化物、锂盐和四水合钼酸铵”的总混物烧结即可。本发明中,根据所需的锂镍钴氧化物正极材料合理的选择所述镍钴氢氧化物即可。根据所述的锂镍钴氧化物正极材料可知,所述镍钴氢氧化物的化学式可为niyco1-y(oh)2,式中,0.8<y≤0.95。其中,所述niyco1-y(oh)2中,y较佳地为0.85~0.9,例如0.88;或者,所述niyco1-y(oh)2中,y较佳地为0.9~0.95,更佳地为0.9~0.93,例如0.92。本发明在添加更高含量的镍的前提下,得到的正极材料的循环稳定性和可逆容量依然保持较高的水平。本发明中,所述镍钴氢氧化物的制备方法可为本领域常规,通常采用化学共沉淀法。其中,所述化学共沉淀法可为本领域常规,通常包括下述步骤:将“镍盐和钴盐的混合溶液”和碱溶液并流进入反应釜中,混合反应即可。所述“镍盐和钴盐的混合溶液”中,所述“镍盐和钴盐”的总浓度可为本领域常规,一般为1~3mol/l,例如2mol/l。所述“镍盐和钴盐的混合溶液”中,所述镍盐与所述钴盐的摩尔比,根据所需的锂镍钴氧化物正极材料合理的选择即可。所述“镍盐和钴盐的混合溶液”中的溶剂可为本领域常规,一般为去离子水。所述镍盐的种类可为本领域常规的种类,例如为硝酸镍和/或硫酸镍。所述钴盐的种类可为本领域常规的种类,例如为硝酸钴和/或硫酸钴。所述“镍盐和钴盐的混合溶液”的进料速率可为本领域常规,一般为2~6ml/min,例如5ml/min。所述碱溶液的摩尔浓度可为本领域常规,一般为1~5mol/l,例如1.95mol/l或4mol/l。所述碱溶液中,碱的种类可为本领域常规,例如氢氧化钠和/或氨水。所述氨水通常为质量分数为25~28%的氨水。在本发明一较佳实施例中,所述碱溶液为氢氧化钠溶液和氨水溶液;所述氢氧化钠溶液的浓度为3~5mol/l,例如4mol/l;所述氨水溶液的浓度为1~3mol/l,例如1.95mol/l。在本发明一较佳实施例中,当所述碱溶液为氢氧化钠溶液和氨水溶液时,所述并流为所述“镍盐和钴盐的混合溶液”、所述氢氧化钠溶液和所述氨水溶液同时进入所述的反应釜中。所述碱溶液的进料速率通常使得所述反应釜中的ph值保持在10~12即可,例如为11。所述碱溶液的进料速率可为本领域常规,一般为2~6ml/min。当所述的碱溶液为氨水时,所述氨水的进料速率可为2~6ml/min,例如5ml/min。所述混合反应的时间可为本领域常规,一般为20~25h,例如20h。所述混合反应从所述反应釜中同时含有所述“镍盐和钴盐的混合溶液”和所述碱溶液开始计算。本领域技术人员知晓,在所述“镍盐和钴盐的混合溶液”和所述碱溶液加入反应釜之前,所述反应釜中先加入底液。所述的底液可为本领域常规,通常指的是碱和/或水,例如氨水。所述底液的浓度例如可为0.4~0.8mol/l,再例如0.6mol/l。所述底液的体积可为本领域常规的体积,例如可为1400~1600ml。所述反应釜中的反应温度可为本领域常规的温度,一般为40~60℃,例如50℃。本发明中,所述锂盐的种类可为本领域常规,通常为氢氧化锂。所述氢氧化锂通常指的是lioh·h2o。本发明中,所述镍钴氢氧化物和所述四水合钼酸铵的摩尔比可为本领域常规的摩尔比,较佳地为(50~200):1,例如100:1。本发明中,所述镍钴氢氧化物和所述锂盐的摩尔比可为本领域常规的摩尔比,较佳地为1:(1~1.06),例如1:1.03或1:1.056。本发明中,所述总混物为所述镍钴氢氧化物、所述锂盐和所述四水合钼酸铵混合所得到固体。其中,所述总混物较佳地按下述步骤制得:将“所述镍钴氢氧化物与所述四水合钼酸铵”的固体混合物与所述锂盐进行第一混合即可。所述第一混合的时间可为本领域常规,较佳地为10~30min,例如15min、20min或25min。所述第一混合的操作可为本领域常规,通常为研磨。所述“所述镍钴氢氧化物与所述四水合钼酸铵”的固体混合物的制备较佳地包括以下步骤:将所述镍钴氢氧化物与所述四水合钼酸铵溶液进行第二混合即可。所述四水合钼酸铵溶液中的溶剂可为本领域常规,通常为去离子水。所述第二混合较佳地将所述的镍钴氢氧化物加入到所述四水合钼酸铵溶液中。所述第二混合的时间可为本领域常规的时间,较佳地为3~5h,例如4h。所述第二混合的操作可为本领域常规的固液混合的操作,通常为搅拌。所述搅拌的转速可为本领域常规,通常满足混合物搅动起来即可,一般为10~1000r/min。所述第二混合的温度可为本领域常规的混合温度,一般为室温。所述第二混合后,一般还需进行后处理的操作。所述后处理的操作可为本领域常规的后处理,通常为干燥。所述干燥的温度可为本领域常规的干燥温度,一般为70~90℃,例如80℃。本发明中,所述烧结的温度可为本领域常规烧结温度,较佳地为700~750℃,更佳地为710~735℃,例如720℃。所述烧结过程中,升温至所述烧结的温度的升温速率可为本领域常规的升温速率。所述的升温速率通常为3~5℃/min,较佳地为5℃/min。本发明中,所述烧结的时间可为本领域常规,一般为10~15h,较佳地为15h。所述烧结的时间从升温至所述烧结温度时开始计算。本发明中,本领域技术人员知晓,所述烧结的环境通常为富氧环境。其中,本领域技术人员知晓,所述的富氧环境一般为氧气的含氧量在30~50%的环境。本发明中,本领域技术人员知晓,所述烧结的设备可为管式炉。本发明中,本领域技术人员知晓,所述烧结之前通常还进行预烧处理。其中,所述预烧处理的温度可为本领域常规,较佳地为500~550℃,更佳地为500~540℃,例如500℃。所述预烧处理过程中,升温至所述预烧处理的温度的升温速率可为本领域常规的升温速率。所述的升温速率通常为3~5℃/min,较佳地为5℃/min。其中,所述预烧处理的时间可为本领域常规,较佳地为5~8h,较佳地为5~6h。所述预烧处理的时间从升温至所述烧结温度时开始计算。其中,本领域技术人员知晓,所述预烧处理的环境通常为富氧环境。本领域技术人员知晓,所述的富氧环境一般为氧气的含氧量在30~50%的环境。其中,本领域技术人员知晓,所述预烧处理的设备可为管式炉。在本发明一较佳实施方式中,所述的烧结之前还包括预烧处理,所述预烧处理的温度为500~540℃,所述预烧处理的时间为5~8h;所述烧结的温度为710~735℃,所述烧结的时间为10~15h。在本发明一较佳实施方式中,所述的烧结之前还包括预烧处理,所述预烧处理的温度为500℃,所述预烧处理的时间为5h,所述预烧处理中,升温至所述预烧处理的温度的升温速率为5℃/min;所述烧结的温度为720℃,所述烧结的时间为15h,所述烧结中,升温至所述烧结的温度的升温速率为5℃/min。本发明还提供了一种锂离子电池,其正极材料为上述的锂镍钴氧化物正极材料。在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。本发明所用试剂和原料均市售可得。本发明中所述的室温一般指的是0~40℃,例如20~35℃。本发明的积极进步效果在于:本发明的锂镍钴氧化物正极材料的化学式liniz-xco1-zmoxo2中,z-x值在0.8以上,结合了特定钼盐的种类及用量等参数,在镍钴氢氧化物前驱体嵌锂的过程中掺杂钼元素,最终得到本发明的锂镍钴氧化物正极材料。本发明的锂镍钴氧化物正极材料实现了微量mo6+的高效掺杂且掺杂量可控,同时缓解了h2-h3相变,抑制了微裂纹的产生以及传播,提高了晶体结构的稳定性,从而改善锂镍钴氧化物正极材料的电化学性能,得到的锂镍钴氧化物正极材料的循环稳定性好、可逆容量高。在2.7~4.3v,1c下循环100圈后仍然可保持原始比容量的95.9%。即使是在5c大电流密度下仍然可保持139.0mahg-1的比容量。同时也显著减少了钴的用量,可实现公斤级正极材料的制备,适合工业化生产。附图说明图1是实施例1和对比例1中所得产物的x射线衍射(xrd)图谱。图2是对比例1的锂镍钴氧化物正极材料的扫描电子显微镜(sem)图。图3是实施例1的锂镍钴氧化物正极材料的扫描电子显微镜(sem)图。图4是对比例1的锂镍钴氧化物正极材料所组装的电池前三圈的循环伏安(cv)曲线图。图5是实施例1的锂镍钴氧化物正极材料所组装的电池前三圈的循环伏安(cv)曲线图。图6是实施例1和对比例1所得的锂镍钴氧化物正极材料所组装的电池在2.7~4.3v电化学性能测试。图6a为实施例1和对比例1的锂镍钴氧化物正极材料在不同电流密度下的比容量测试,图6b为实施例1和对比例1的锂镍钴氧化物正极材料的循环稳定性测试。图7是实施例1和对比例1所得的锂镍钴氧化物正极材料所组装的电池的dq/dv曲线图。图7a为实施例1的锂镍钴氧化物正极材料组装的电池的dq/dv曲线图;图7b为对比例1的锂镍钴氧化物正极材料组装的电池的dq/dv曲线图。具体实施方式下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。实施例1本实施例正极材料的制备方法如下:镍钴氢氧化物前驱体ni0.9co0.1(oh)2的制备:按照ni:co=9:1的摩尔比称取niso4·6h2o固体116.64g,coso4·7h2o固体15.12g;将该两种硫酸盐加入到468.24ml去离子水中,配成总浓度为2mol/l的混合硫酸盐溶液a;称取氢氧化钠固体96g溶于去离子水中形成4mol/l氢氧化钠溶液b;称取质量分数为25~28%的浓氨水87.77ml与去离子水混合形成1.95mol/l的氨水溶液c。在反应釜中加入0.6mol/l的氨水溶液1600ml作为底液,并且利用水浴加热保持反应釜50℃恒温,控制搅拌速度600r/min。反应开始前通入氩气,保证反应在氩气氛围下进行,同时泵入氢氧化钠溶液调节底液ph在11±0.02。将溶液a、b、c同时缓慢的泵入反应釜中,a溶液进料速度为5ml/min,c溶液进料速度为5ml/min,控制b溶液的进料速度保证共沉淀反应ph在11±0.02,反应20小时后经过滤,清洗,100℃干燥后得到ni0.9co0.1(oh)2。先将0.019g的四水合钼酸铵溶于去离子水中,得四水合钼酸铵溶液,再将1g镍钴氢氧化物加入四水合钼酸铵的溶液中,室温下以10~1000r/min的转速搅拌4小时后80℃烘干,得四水合钼酸铵和镍钴氢氧化物的混合材料;再将该混合材料与0.4752g的lioh·h2o固体混合研磨20min;将研磨后的混合物在管式炉富氧环境中依次进行预烧和烧结处理,即得到了锂镍钴氧化物正极材料,记为ncmo1。其中,预烧的温度为500℃,预烧的时间为5h,烧结的温度为720℃,烧结的时间为15h,升温至预烧处理的温度和煅烧的温度的升温速率均是5℃/min。预烧处理的时间从升温至500℃时开始计算,烧结的时间从升温至720℃时开始计算。本实施例得到的锂镍钴氧化物正极材料的化学式lini0.89co0.1mo0.01o2,计为ncmo1。实施例2本实施例添加的四水合钼酸铵的质量为0.0095g,其余原料的添加量与浓度、制备方法的参数同实施例1。本实施例得到的锂镍钴氧化物正极材料的化学式lini0.895co0.1mo0.005o2。实施例3本实施例添加的四水合钼酸铵的质量为0.038g,其余原料的添加量与浓度、制备方法的参数同实施例1。本实施例得到的锂镍钴氧化物正极材料的化学式lini0.88co0.1mo0.02o2。实施例4本实施例中镍钴氢氧化物前驱体为ni0.88co0.12(oh)2,按照ni:co=0.88:0.12的摩尔比称取niso4·6h2o和coso4·7h2o,其余的原料含量、浓度以及制备方法的参数同实施例1。本实施例得到的锂镍钴氧化物正极材料的化学式lini0.87co0.12mo0.01o2。实施例5本实施例中预烧处理的温度为500℃,烧结的温度为750℃。其余制备方法的参数同实施例1。本实施例得到的锂镍钴氧化物正极材料的化学式lini0.89co0.1mo0.01o2。实施例6本实施例中镍钴氢氧化物前驱体为ni0.92co0.08(oh)2,按照ni:co=0.92:0.08的摩尔比称取niso4·6h2o和coso4·7h2o,其余的原料含量、浓度以及制备方法的参数同实施例1。本实施例得到的锂镍钴氧化物正极材料的化学式lini0.91co0.08mo0.01o2。实施例7在实施例1的基础上,将实施例1制备得到的1gni0.9co0.1(oh)2和0.019g的四水合钼酸铵固体、0.4752g的lioh·h2o固体混合研磨20min,其余制备方法的参数同实施例1。本实施例得到的锂镍钴氧化物正极材料的化学式lini0.89co0.1mo0.01o2。对比例1未添加四水合钼酸铵,其余制备方法的参数同实施例1。得到的锂镍钴氧化物正极材料的化学式为lini0.9co0.1o2计为nc。对比例2镍钴氢氧化物前驱体为ni0.8co0.2(oh)2,按照ni:co=8:2的摩尔比称取niso4·6h2o和coso4·7h2o,其余的原料含量、浓度其余制备方法的参数同实施例1。该锂镍钴氧化物正极材料的化学式为lini0.79co0.02mo0.01o2。效果实施例1(1)x-射线衍射(xrd)测试:德国布鲁克axs有限公司生产的多晶/d8advance达芬奇。实施例1和对比例1中所得锂镍钴氧化物正极材料的x射线衍射(xrd)图谱如图1所示。图中nc代表的是对比例1的锂镍钴氧化物正极材料,图中ncmo1指的是实施例1的锂镍钴氧化物正极材料。由图1可知,掺杂1%摩尔数mo元素的锂镍钴氧化物正极材料的晶体结构没有发生变化,晶体结构未被破坏。(2)锂镍钴氧化物正极材料的组分测定对实施例1~3和对比例1的锂镍钴氧化物正极材料进行icp测试,其测试结果如下表1所示,由表1可知与本发明实施例1~3和对比例1中的锂镍钴氧化物正极材料lini0.89co0.1mo0.01o2的组成相吻合。其中,icp型号为icp-aes,agilent725。表1理论设计的化学式icp的测试结果实施例1lini0.89co0.1mo0.01o2lini0.889co0.101mo0.01o2实施例2lini0.895co0.1mo0.005o2lini0.893co0.103mo0.004o2实施例3lini0.88co0.1mo0.02o2lini0.878co0.103mo0.019o2对比例1lini0.9co0.1o2lini0.895co0.105o2同理,将实施例4~7和对比例2的锂镍钴氧化物正极材料进行icp测试,各实施例和对比例的锂镍钴氧化物正极材料的组成与icp测试结果均相吻合。(3)锂镍钴氧化物正极材料的形貌表征采用扫描电子显微镜(sem)测试:仪器型号:novananosem450,美国。对实施例1~7中的锂镍钴氧化物正极材料的形貌采用sem进行表征,可得实施例1~7的锂镍钴氧化物正极材料的平均粒径为10微米。具体的,对比例1所得产物的扫描电子显微镜(sem)图如图2所示,实施例1所得产物的扫描电子显微镜(sem)图如图3所示。由图2和图3可知,实施例1掺杂了mo元素的锂镍钴氧化物正极材料的形貌和球形度与原材料对比未发生变化,表明锂镍钴氧化物正极材料的结构在掺杂的过程中未被破坏,且从图中可得实施例1的锂镍钴氧化物正极材料的平均粒径为10微米。(4)电化学性能测试多倍率cv测试:仪器型号:autolabpgstat302n。cr2016钮扣电池的组装及测试:将上实施例1~6和对比例1~2制得的正极材料、炭黑、pvdf(聚偏氟乙烯)按照8:1:1的质量比制成浆料并涂覆在铝箔上,用裁片机将烘干的负载浆料的铝箔裁成直径约为1.2cm的小圆片用作正极,以金属锂片作为负极、celgard2400为隔膜、1m的混合有机溶液为电解液(其中,溶剂是体积比为3:7的碳酸乙烯酯和乙烯碳酸二甲酯的混合溶液,溶质为lipf6),在氩气手套箱内组装成cr2016纽扣电池。由对比例1的锂镍钴氧化物正极材料所组装的电池前三圈的循环伏安(cv)曲线图如图4所示,图中nc代表的是对比例1的锂镍钴氧化物正极材料。由实施例1的锂镍钴氧化物正极材料所组装的电池前三圈的循环伏安(cv)曲线图如图5所示,图中ncmo1指的是实施例1的锂镍钴氧化物正极材料,图中第二圈(2nd)和第三圈(3rd)相互重合。由图4和图5可知,相较对比例1(0.28v),实施例1中掺杂了mo元素的锂镍钴氧化物正极材料(0.18v)的前三圈曲线重合度较好而且首圈氧化还原峰电位差明显减少,表明实施例1的锂镍钴氧化物正极材料的极化明显减少,进而表明电极材料的可逆容量高。将实施例1~6和对比例1~2的锂镍钴氧化物正极材料组装的得到的电池在2.7~4.3v,测试温度在25℃条件下的电化学性能,测试结果如下表2所示。表2实施例1~6和对比例1~2的锂镍钴氧化物正极材料的性能参数具体的,对实施例1和对比例的锂镍钴氧化物正极材料的电化学性能进行对比分析,如图6所示,图中nc代表的是对比例1的锂镍钴氧化物正极材料,图中ncmo1指的是实施例1的锂镍钴氧化物正极材料。其中,图6a为实施例1和对比例1的锂镍钴氧化物正极材料在不同电流密度下的比容量测试结果图,图6b为实施例1和对比例1的锂镍钴氧化物正极材料的循环稳定性测试结果图。由图6可知,实施例1的锂镍钴氧化物正极材料具有优异的倍率性能和循环性能,在5c时电池的可逆容量高达139mah/g;1c下循环100圈,可逆容量保持率高达95.9%,可逆容量为171.3mah/g。实施例1和对比例1所得的锂镍钴氧化物正极材料所组装的电池的dq/dv曲线图如图7所示。其中,图7a为实施例1的锂镍钴氧化物正极材料组装的电池的dq/dv曲线图;图7b为对比例1的锂镍钴氧化物正极材料组装的电池的dq/dv曲线图。由图7可知,掺杂了mo元素的锂镍钴氧化物正极材料ncmo1的曲线重合度更高,h2~h3相变的可逆性得到了显著提高,材料的结构更加稳定。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1