可再充电金属卤化物电池的制作方法
可再充电金属卤化物电池
背景技术:
1.可充电电池在广泛范围的应用(例如像工业装置、医疗装置、电子装置、电动车辆以及电网能量存储系统)中用作电源。电池技术不断发展以能够实现更高的能量密度和更高的效率,从而允许将电池用作额外应用的电源。
2.对高比容量和高比能量的需求已经导致对不同金属元件电池的研究。嵌入锂的阴极材料,如锂镍锰钴氧化物(nmc)、锂镍钴氧化铝(nca)、锂钴氧化物(lco)、磷酸铁锂(lfp)等具有相对低的能量密度并且可能是昂贵的。为了鉴定新的和更有效的阴极材料,已经研究了转化阴极材料如硫、氧、空气以及其他。
3.用锂
‑
氧、锂
‑
空气、以及锂与其他含氧的气体混合物制成的电池具有优异的性能,这至少部分是由于元素锂的低原子序数、低密度、以及高还原能力。此外,锂
‑
氧电池可能潜在地具有比常规锂离子电池大三到五倍的理论比能。
4.锂金属具有高能量存储容量并且已经被用作主要的电池阳极材料。在一些情况下,锂金属阳极可形成枝状晶体,这可在电池操作期间引起短路。还已经证明难以找到可以适应从锂金属阳极提取的大量锂离子和电子的合理廉价的阴极材料。
技术实现要素:
5.包括硫、氧气、空气、或其他活性阴极材料的一些电池具有差的循环能力、低功率密度、或两者。例如,这样的电池可能相对不稳定和/或经历寄生反应,这可能导致电化学不可逆的碳酸盐副产物,其例如由于电解质分解或碳表面氧化而降低电池的循环能力和/或功率密度。
6.通常,本发明涉及具有包括氧化气体、金属卤化物、和包括杂环化合物的溶剂的电池。在本发明的不同实施例中,电池具有相对快的充电速率、高能量效率、高功率密度和良好的循环能力中的一个或多个。另外,在本发明的一些实施例中,电解质可以比一些其他电池电解质更具成本效益并且潜在地危害更小。电解质可以通过形成也具有相对一致的尺寸的小且致密的核而在基于金属的电池中提供高功率密度,这可以有力地并且自然地抑制阳极上不希望的枝晶生长。此外,电解质不包括重金属,例如钴或镍,因此预期可降低电池总成本。
7.在一个方面中,本公开涉及一种电池,包括:阳极;电解质,所述电解质包括:氧化气体;活性阴极材料,所述活性阴极材料包括金属卤化物;以及溶剂,所述溶剂包括杂环化合物;以及接触活性阴极材料的集电器。
8.在另一方面,本发明是针对一种电池,该电池包括:(a)阳极,所述阳极在充电过程中从电解质中吸收金属离子,并且在放电过程中将所述离子释放到所述电解质,所述电解质包括:(i)包含杂环化合物的溶剂,和(ii)溶解的卤化物,其中所述卤化物用作所述电池的阴极;(b)与所述阳极接触的固体电解质相间(sei)层,所述sei层包含所述金属的氧化物;以及(c)包含导电多孔材料的集电器,其中所述集电器接触所述溶解的卤化物。
9.在另一方面,本发明涉及形成电池的方法,包括:将金属卤化物溶解在包含杂环化
合物的溶剂中以形成溶液;用所述溶液浸泡分离器;堆叠阳极、用所述溶液浸泡的所述分离器和集电器,其中所述堆叠包括将用所述溶液浸泡的所述分离器放置在所述阳极与所述集电器之间;以及将氧化气体引入堆叠的所述阳极、用所述溶液浸泡的所述分离器、以及所述集电器以形成所述电池,其中,所述电池包括:阳极、电解质,所述电解质包括:氧化气体;包括金属卤化物的活性阴极材料;和包括杂环化合物的溶剂;以及接触活性阴极材料的集电器。
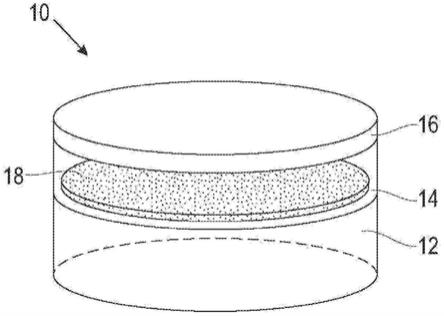
10.在附图和以下描述中阐述了本发明的一个或多个示例的细节。本发明的其他特征、目的和优点将从说明书和附图以及权利要求中变得清楚。
附图说明
11.图1是示出了包括阳极、电解质、集电器和可选的分离器的示例性电池的概念图。
12.图2是示出了封闭单元内的图1的示例电池的概念图。
13.图3是示出用于制造电池的示例技术的流程图。
14.图4a
‑
4b是如在实例2中描述的在氧气存在下使用1m lii
‑
gbl的第一循环的放电和充电恒电流循环行为以及面积比放电容量相对于电池的循环数的曲线图。在5ma/cm2的电流密度下操作电池。
15.图5a
‑
5b是如实例3中描述的在氧气存在下使用1m lii
‑
ecl的第一循环的放电和充电恒电流循环行为以及面积比放电容量相对于电池的循环数的曲线图。在5ma/cm2的电流密度下操作电池。
16.图6a
‑
6b是如在实例4中描述的在氧气存在下使用1m lii
‑
thf电解质的第一循环的放电和充电恒电流循环行为以及面积比放电容量相对于电池的循环数的曲线图。在5ma/cm2的电流密度下操作电池。
17.图7是对比实例1的电池中在不存在氧气的情况下使用1m lii
‑
gbl的第一循环的放电和充电恒电流循环行为的曲线图。在5ma/cm2的电流密度下操作电池。
18.图8是在比较实例2的电池中在氧气存在下使用1m lii
‑
tegdme电解质的第50次循环的放电和充电恒电流循环行为的曲线图。在5ma/cm2的电流密度下操作电池。
19.附图中相同的符号表示相同的元件。
具体实施方式
20.图1是示出了包括负极12、电解质14、集电器16和可选的分离器18的示例性电池10的概念图。电池10通过还原
‑
氧化(氧化还原)反应来操作,并且利用一个或多个部件或元件的不同氧化态和氧化还原反应来进行充电和放电。
21.阳极12可以由任何金属制成,并且适合的实例包括但不限于锂、镁、钠、以及其混合物和组合物。在一些实例中,阳极12基本上由元素锂、镁、或钠、或与一种或多种另外的元素合金化的锂、或镁、或钠组成。在一些实施例中,阳极12由元素锂、镁、钠、或锂组成。
22.阳极12可在充电期间从电解质14吸收金属离子,并且在放电期间向电解质14释放金属离子。在一些实施例中,阳极12可为能够吸收金属离子的嵌入宿主材料。在一些实例中,固体电解质相间(sei)层可与阳极12接触。例如,sei层可以包括来自电解质14的金属的氧化物。
23.电解质14可以是水性或非水性的,包括包含杂环化合物、金属卤化物和氧化气体的溶剂。在本技术中,术语杂环化合物是指具有至少两种不同元素的原子作为环成员的芳族或非芳族环状化合物。本技术中使用的环状化合物(环化合物)是指化合物中的一个或多个原子系列连接形成环的化合物。在不同实施例中,用于电解质14的适合的环状化合物包括5元环,如吡咯烷、氧杂戊环、硫杂环戊烷、吡咯、呋喃和噻吩;6元环,如哌啶、噁烷、噻烷、吡啶、吡喃和噻喃;和7元环,如氮杂环庚烷、氧杂环庚烷、硫杂环庚烷、氮杂环庚烷、氧杂环庚烷、和噻烯。适合的杂环化合物的实例包括但不限于四氢呋喃、四氢吡喃、四氢噻吩、氧硫杂环戊烷、琥珀酰亚胺、噁唑烷酮、γ
‑
丁内酯、γ
‑
己内酯、ε
‑
己内酯、γ
‑
戊内酯、吡咯烷、咪唑烷、环丁砜、硫杂环己烷以及其混合物和组合。在一些实施例中,合适的杂环化合物包括但不限于环醚、环酯、以及它们的混合物和组合。
24.在一些示例中,电解质14可以包括一种或多种另外的溶剂。在一些实施例中,该一种或多种另外的溶剂可以选自非水性有机溶剂,如醚、甘醇二甲醚、碳酸酯、腈、酰胺、胺、有机硫溶剂、有机磷溶剂、有机硅溶剂、氟化溶剂、己二腈(adn)、碳酸亚丙酯(pc)、二甲氧基乙烷(dme)、以及其混合物和组合。在一些实例中,电解质14包括相等部分的溶剂(包含杂环化合物)和一种或一种以上额外溶剂。在一些实例中,可选择电解质14中的一种或多种另外的溶剂以进一步改善电池10的电化学性能,例如,通过增强可再充电性、可循环性等。
25.电解质14包括氧化气体。在一些实例中,电解质14可以是在一种氧化气体的存在下,并且短语“包括一种氧化气体”旨在包括这样一种配置。在一些实施例中,可以将氧化气体溶解在包含电解质14的杂环化合物的溶剂中。在一些不旨在进行限制的实例中,该氧化气体包括氧气、空气、一氧化氮、或二氧化氮中的至少一种。氧化气体有助于诱导如上所述的电池10的氧化还原反应,并且有助于实现高度可逆的氧化还原反应,这可以有助于增强电池10的电化学性能。氧化气体可帮助诱导这样的氧化还原反应,但是在电池10的使用期间不被消耗或释放(例如,氧化气体不参与电池10的氧化还原反应)。在一些实例中,包含金属卤化物的电解质和包含杂环化合物但不包含氧化气体的溶剂可展现极少或不展现可再充电性。
26.电解质14还包括金属卤化物(例如,mx,其中m是金属元素并且x是卤素元素)。在一些示例中,金属卤化物包括电解质盐,该电解质盐解离成相应的卤化物离子和相应的金属离子。例如,金属卤化物可以溶解在包括杂环化合物的溶剂中,并且离解成相应的金属和卤化物离子。在一些实例中,卤素离子可以包括i、br、cl或f中至少一个的离子(例如,x可以是i、br、cl或f),并且金属离子可以包括li、mg或na中至少一个的离子(例如,m可以是li、mg或na)。在其他实例中,金属卤化物可以包括除了i、br、cl、f、li、mg和/或na之外的元素。金属卤化物可以为电解质14提供离子导电性。
27.在一些实施例中,电解质14包括离解成对应的金属离子和对应的抗衡阴离子的任选的另外的盐。在不旨在限制的一些实例中,金属离子包括li、mg和na中的至少一种,并且抗衡阴离子包括硝酸根(no3‑
)、六氟磷酸根(pf6‑
)、四氟硼酸根(bf4‑
)、二草酸硼酸根(bob
‑
)、二氟草酸硼酸根(dfob
‑
)、三氟甲磺酸根(tf
‑
)和三氟磺酰亚胺(tfsi
‑
)中的一种或多种。
28.另外地或替代地,电解质14的金属卤化物可以充当活性阴极材料。例如,金属卤化物可以在电池10的充电和放电期间接收、存储和释放金属离子。以这种方式,电池10可以不
包括专用的阴极材料。相反,电池10可以包括电解质14的金属卤化物的活性阴极材料和集电器16。进而,电池10可以更便宜地制造、更轻量化、具有更高的功率密度、或其组合。在一些情况下,包括充当活性阴极材料的金属卤化物的电解质的高功率密度可以使电池10能够比不包括在此描述的电解质的一些其他电池显著更快地充电。在一些实例中,与电解质14相比,包含溶剂(包含杂环化合物)和氧化气体(但不包含金属卤化物)的电解质可具有降低的电化学性能(例如,可逆性、可再充电性和/或可循环性),产生不可逆的碳酸盐副产物,具有降低的功率密度,或其组合。
29.集电器16可以包括具有合适导电性的材料,该材料收集在电池10的放电过程中由氧化还原反应产生的电子并且提供到电池10所连接的外部电路的导电路径。类似地,在电池10的再充电期间,集电器16在外部电压源与电解质14之间提供电通路,以供应电压用于另一氧化还原反应以对电池10充电。在一些实例中,集电器16可以包括导电粉末,如金属和/或碳粉末、织造或非织造金属纤维、金属泡沫、织造或非织造碳纤维、等。另外地或替代地,当前的收集器16可以包括不锈钢网、铝(al)网、镍(ni)泡沫和/或碳纸。例如,在一个实施例中,集电器16可以包括其上沉积有碳纳米粒子的不锈钢网。作为又一个实例,集电器可以是导电的多孔材料。
30.在其他实例中,除了用作活性阴极材料和集电器16的金属卤化物之外,电池10还可以包括专用阴极材料。例如,电池10可包括阴极,其提供到电池10连接到的外部电路的导电路径。在一些情况下,电池10可包括可用于锂离子电池的阴极。例如,阴极可以包括锂钴氧化物(lco,例如,licoo2)、镍钴铝(nca,例如,lini
x
co
y
al
z
o2、lini
0.8
co0.15al
0.05
o2)、锂离子锰氧化物(lmo,例如,limn2o4),锂镍锰钴氧化物(nmc,例如,linimncoo2)、镍钴锰(ncm,例如,lini
x
co
y
mn
z
o2、lini
0.33
co
0.33
mn
0.33
o2)或磷酸铁锂(lfp,例如,lifepo4)中的至少一种。在其他实例中,电池10可以包括不同的或另外的阴极材料。
31.在一些示例中,电池10包括可选的分离器18。分离器18可迫使电子穿过电池10所连接的外部电路,使得电子不行进穿过电池10(例如,穿过电池10的电解质14),同时在充电和放电期间仍使金属离子流过电池10。在一些示例中,分离器18可以用电解质14浸泡、在电解质14内、被电解质14包围等。分离器18可包括非导电材料,以防止电子移动通过电池10,使得电子通过外部电路移动。例如,分离器18可包括玻璃、非织造纤维、聚合物膜、橡胶等。
32.在一些示例中,电池10具有闭合或基本上闭合的体积。例如,阳极12、电解质14、集电器16和分离器18可位于封闭或基本上封闭的电池或其他外壳内。这样,电解质14的氧化气体保留在电池10内,使得电池10具有相对快的充电速率、高能量效率、高功率密度、高可逆性、高循环能力或其组合,如本文所述。
33.电池10能够经受许多充电和放电循环(例如,展现出良好的可再充电性),甚至在相对高的充电密度下。在一些实例中,电池10能够在大于或等于约1ma/cm2、约5ma/cm2、约10ma/cm2、或约20ma/cm2的电流密度下完成至少100个循环的充电和放电。作为一个实例,电池10可以能够在大于或等于约1ma/cm2、约5ma/cm2、约10ma/cm2、或约20ma/cm2的电流密度下完成至少1000次充电和放电循环。
34.附加地或替代地,电池10可呈现相对高的能量效率。例如,在大于或等于约1ma/cm2、约5ma/cm2、约10ma/cm2、或约20ma/cm2的电流密度下,电池10可表现出大于或等于90%的能量效率。在一些实例中,在大于或等于约1ma/cm2、约5ma/cm2、约10ma/cm2、或约20ma/
cm2的电流密度下,电池10可表现出大于或等于99%的能量效率。
35.图2是示出了图1的示例电池10在封闭的电池系统20内的概念图。封闭的电池系统20可包括在电池10的操作期间容纳电池10的电池、用于制造电池10的电池或两者。例如,封闭的电池系统20可包括以商品名swagelok购自俄亥俄州solon的swagelok的电池,并且可用于制造电池10。在一些实例中,封闭的电池系统20可以包括入口管22和/或出口管24。入口管22和出口管24可用于将空气或其他气体(诸如电解质14的氧化气体)引入和移除进出封闭的电池。
36.图3是示出用于制造图1的电池10的示例技术的流程图。将针对图2的封闭式池系统20描述图3的技术。然而,在其他示例中,图3的技术可以用于除图2的封闭式池系统20之外的系统。此外,虽然图3的技术是关于封闭的电池系统描述的,但是在一些实例中,图3可以与未完全封闭的(例如,至少部分开放的)电池一起使用。
37.图3的技术包括将金属卤化物溶解在包含杂环化合物的溶剂中以形成溶液(30)。为了将金属卤化物溶解在包含杂环化合物的溶剂中,可以将金属卤化物添加到包含杂环化合物的溶剂中并轻轻搅拌,例如轻轻搅拌过夜。在一些实例中,金属卤化物溶解于包括杂环化合物的溶剂中的溶液可具有介于约0.1m与约20m之间、约0.5m与约10m之间、或约1m与约5m之间的浓度。
38.在一些实例中,金属卤化物可以在溶解于包括杂环化合物的溶剂中之前被干燥。可以基于有待用于电解质14中的金属卤化物来选择干燥温度和/或干燥时间,并且在一些非限制性实例中,可以在加热板上在氩气填充的手套箱中在约120℃下将该金属卤化物干燥大于12小时。
39.另外,或者作为干燥金属卤化物的替代方案,在一些实例中,也可以在将金属卤化物溶解在其中之前干燥包括杂环化合物的溶剂。例如,包含杂环化合物的溶剂可以用分子筛储存过夜。
40.图3的技术进一步包括使用溶液(32)浸泡任选的分离器18。用溶液浸泡分离器18可包括将分离器18浸入溶液中,将溶液施加至分离器18,或者用溶液浸泡分离器18的任何其他方法。在一些实例中,用溶液浸泡分离器18可以包括用在约1μl/cm2至约500μl/cm2、约10μl/cm2至约250μl/cm2、或约50μl/cm2至约100μl/cm2的范围内的溶液浸泡分离器18。
41.图3的技术另外包括在封闭的电池系统20(34)内堆叠阳极12、使用该溶液浸泡的任选的分离器18、以及集电器16,例如,如图2所示。在一些实例中,堆叠可以包括在阳极12与集电器16之间放置分离器18。在一些实例中,可以在用溶液浸泡分离器18之前堆叠阳极12、使用溶液浸泡的分离器18或集电器16中的一个或多个。例如,分离器18可以堆叠在阳极12上并且然后用该溶液浸泡。在一些情况下,封闭的电池系统20在堆叠过程期间可以至少部分地打开,在将阳极12、浸泡有溶液的分离器18和集电器16堆叠之后,封闭的电池系统20可以是封闭的或基本上封闭的以形成围绕阳极12、浸泡有溶液的分离器18和集电器16的封闭的或基本上封闭的体积。
42.在其他实例中,电池10可不包括分离器18。在这样的示例中,电解质14可以以不同的方式被引入到电池10。例如,电池10可以包括在阳极12与集电器16之间的电解质14而没有分离器18。电解质14可以以任何可应用的方式被引入电池10中,使得电解质14可以如本文所述起作用。以这种方式,图3的技术可以包括在封闭的电池系统20内堆叠阳极12和集电
器16。
43.图3的技术还包括将氧化气体引入封闭的电池系统20以产生电解质14并且制造电池10(36)。在一些实例中,将氧化气体引入封闭的电池系统20以产生电解质14并且制造电池10包括经由入口管24将氧化气体引入封闭的电池20。在一些实例中,在将氧化气体引入封闭的电池系统20之前,封闭的电池系统20可以包括惰性气体(如氩气)或在惰性气体的存在下。在一些此类实例中,该氧化气体的引入可以净化并且用该氧化气体完全替换封闭的池系统20内的惰性气体。例如,氧化气体可以经由入口管24被引入到封闭的单元20中,并且惰性气体可以通过出口管26被净化。在一些实例中,该氧化气体在封闭的池系统20中的浓度可以是在封闭的池系统20内的气体的总量(例如在封闭的池系统20内的氧化气体和惰性气体的总量)的约5重量(wt)%与约100wt%之间,约50wt%和约100wt%之间、或约80wt%和约100wt%之间。
44.现将针对以下非限制性实例描述本发明。
45.实例
46.实例1:电解质和电池组件的制备
47.将碘化锂(lii)放置在小瓶中并且在120℃下在氩气填充的手套箱(<0.1ppm h2o,o2)内的热板上干燥1小时。选择γ
‑
丁内酯(gbl)、ε
‑
己内酯(ecl)、以及四氢呋喃(thf)作为用于电池电解质的杂环化合物的适合的实例,并且用分子筛纯化过夜。添加1m的干燥的lii粉末,将其溶解于包括所选择的杂环化合物的溶液中,并且轻轻搅拌过夜。
48.使用杂环化合物电解质溶液中的1m lii浸泡位于锂金属阳极顶部的分离器,并且将碳涂覆的集电器放置在分离器的另一侧上。因此,将由电解质溶液润湿的分离器放置在阳极和阴极之间并且与阳极和阴极两者接触。在氩气填充的手套箱中进行电池组装。
49.将所有电池组件放置在以商品名swagelok从俄亥俄州索隆的swagelok公司(swagelok,inc.,solon,oh)可获得的电池内,该电池包括用于氧气流动的入口和出口管两者。然后通过入口管引入氧气,吹扫并完全替换电池内的氩气。
50.如下所示,使用包括gbl的电解质的电池显示出更高的能量效率,而使用ecl提供了更长的循环寿命。这些溶剂的混合物将可能提供每种溶剂的强度并且变成用于可再充电金属卤化物电池的理想电解质系统。
51.对于对比实例,以相同的电池配置测试在无氧环境中的1m lii
‑
gbl和在含氧环境中的四乙二醇二甲醚(tegdme)中的1m lii。
52.实例2:具有gbl电解质和氧气的可再充电碘化锂电池
53.图4a示出了在5ma/cm2的电流密度下,在超高纯度氧气的存在下,结合1m lii
‑
gbl电解质的实例1的电池的第一次放电和充电循环。选择lii作为金属卤化物盐的实例,选择gbl作为杂环化合物的实例,并且选择氧气作为氧化气体的实例。
54.如图4b所示,电池在超过500个循环内维持优异的能量效率(>90%)并且产生高输出功率(>10mw/cm2)。比容量通过电极的面积标准化。
55.实例3:具有ecl电解质和氧气的可再充电碘化锂电池
56.图5a示出了在5ma/cm2的电流密度下,在超高纯度氧气的存在下,结合1m lii
‑
ecl电解质的实例1的电池的第一次放电和充电循环。选择lii作为金属卤化物盐的实例,ecl是杂环化合物,并且氧气是氧化气体。
57.如图5b所示,电池在超过500个循环内维持高输出功率(>10mw/cm2)。比容量通过电极的面积标准化。
58.实例4:具有thf电解质和氧气的可再充电的碘化锂电池
59.图6a示出了在5ma/cm2的电流密度下,在超高纯度氧存在下,结合1m lii
‑
thf电解质的实例1的电池的第一次放电和充电循环。选择lii作为金属卤化物盐,选择thf作为杂环化合物的实例,并且选择氧气作为氧化气体。
60.如图6b所示,电池在超过100个循环内维持高输出功率(>10mw/cm2)。比容量通过电极的面积标准化。
61.对比实例1:具有gbl电解质而没有氧气的碘化锂电池
62.图7示出了在5ma/cm2的电流密度下,在不存在氧气的情况下,结合1m lii
‑
gbl电解质的实例1的电池的第一次放电和充电循环。该电池在第一循环中使用与实例2的电池中所使用的相同的电解质溶液提供了可忽略不计的放电容量。在第一循环中库仑效率小于10%并且在随后的循环中根本没有改善。比容量通过电极的面积标准化。
63.对比实例2:具有tegdme电解质和氧气的碘化锂电池
64.图8示出了在5ma/cm2的电流密度下,在超高纯度氧气的存在下,结合1mlii
‑
tegdme电解质的实例1的电池的第50次放电和充电循环。电池在氧气环境下在第50次循环中提供可忽略的放电容量。尽管在第一个循环中电池的库仑效率大于90%,但是其从下一个循环开始显著降低,并且最终在第50个循环中降低至小于10%。比容量通过电极的面积标准化。从该实例的结果值得注意的是,当电解质中的环状化合物不包括醚基时,电池性能下降。
65.已经描述了本发明的各种实施方式。本发明的这些和其他实施例在所附权利要求的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1