一种土田七的组织培养快速繁殖方法与流程
本发明涉及土田七,具体涉及一种土田七的组织培养快速繁殖方法,属于植物组织培养快速繁殖技术领域。
背景技术:
土田七(Stahlianthus involucratus)属于姜科(Zingiberaceae)土田七属(Stahlianthus)植物,产于广东、广西、云南、福建;印度和锡金也有分布。土田七植株高约15~30厘米,根茎外面棕褐色,内面棕黄色,芳香而有辛辣味,根末端膨大成球状;叶片披针形,叶面深绿色,叶被绿色或淡紫红色,叶柄较长;花序从根茎抽出,10~15朵花聚生于钟状的总苞内,总苞绿色;花白色,唇瓣中央具杏黄色斑,内被长柔毛;生于海拔800~900米的林下、荒坡荫湿处;花期5~7月;观叶类,可作为林下地被和盆栽观叶植物(高江云,等2006;路国会和王英强,2011)。土田七的根茎具药用价值,能活血散瘀,消肿止痛,主治跌打损伤,风湿骨痛(《中国植物志》第16分卷第2分册)。
土田七可通过切分根茎进行分株的方式繁殖,但分株繁殖速度慢,且对母株的根茎也有损伤。目前,尚未见对土田七进行组织培养和种苗大规模生产的报道,因此,进行土田七的组织培养快速繁殖研究,对提高其种苗繁殖速度、在园艺园林上和作为药用植物种植的推广应用上具有重要意义。
技术实现要素:
本发明所解决的技术问题在于提供一种土田七组织培养快速繁殖方法,可在短期内获得大量性状稳定的试管苗,能保持母株的优良特性,具有低投入高产出的优势。
本发明的目的通过如下技术方案实现:
一种土田七的组织培养快速繁殖方法,包括以下步骤:
(a)外植体的选择:取生长旺盛的土田七幼嫩新芽的根茎为外植体;
(b)外植体的消毒:将外植体用自来水洗净,剪刀剪掉叶片,留根茎和距离根茎高5~7厘米的茎,进行外植体的消毒;切掉距离根茎高1~2厘米的茎留根茎,并接种根茎到诱导培养基中培养;
(c)丛生芽的诱导:在诱导培养基上培养直至外植体形成不定芽;所述的诱导培养基成分为MS、6‐苄氨基腺嘌呤1.0~3.0mg/L、萘乙酸0.01~0.10mg/L、椰汁10.0~15.0%、蔗糖20~30g/L、卡拉胶9.5~10g/L;
(d)增殖继代:将诱导出的不定芽切掉部分叶片后再切割,继代培养于增殖培养基中进行不定芽的增殖;所述的增殖继代培养基成分为MS、6‐苄氨基腺嘌呤3.0~8.0mg/L、萘乙酸0.1~0.20mg/L、椰汁10.0~15.0%、蔗糖20~30g/L、卡拉胶9.5~10g/L;
(e)生根培养:当继代苗高3~5厘米时,切下接种到生根培养基中,所述的生根培养基成分为MS、萘乙酸0.1~1.0mg/L、椰汁10.0~15.0%、蔗糖20~30g/L、卡拉胶9.5~10g/L;
(f)炼苗移栽:当生根培养基上的苗高5~8厘米时,在温室自然光照下炼苗10~15天,取出试管苗,洗净根部培养基,用0.1%~0.3%的百菌清溶液浸泡30~40分钟,移栽到由黄泥、珍珠岩和泥炭土混合的基质中,保持通风透气,湿度在70‐85%,温度在20‐32℃,自然光照条件培养后得到移栽苗。
为进一步实现本发明目的,优选地,步骤(a)所述的外植体为土田七(Stahlianthus involucratus)的5~20厘米高的幼嫩新芽的根茎。
优选地,以质量百分比浓度计,所述外植体的消毒是先用0.1%‐0.2%高锰酸钾溶液浸泡根茎30~40分钟,再用0.1%~0.3%的百菌清和甲基硫菌灵混合溶液,浸泡根茎40~50分钟,接着在自来水下反复冲洗根茎30~40分钟;晾干表面水分后,在超净工作台上,切掉高4~6厘米的茎,留1~2厘米高的带根茎的茎,用棉球蘸取70%酒精擦拭根茎及1~2厘米高的茎表面,最后用0.1%升汞溶液消毒15~20分钟,灭菌水冲洗4~5次。
优选地,所述百菌清和甲基硫菌灵的体积比为1:1。
优选地,所述黄泥、珍珠岩和泥炭土的体积比为1:1:1。
优选地,步骤(f)中如果温度高于32℃,用风机和水帘降温。
优选地,所述诱导培养基、增殖继代培养基和生根培养基的pH都为5.6~5.8;培养基灭菌条件为125℃,30分钟。
优选地,步骤(b)、步骤(c)、步骤(d)和步骤(e)所述培养温度为25~30℃,光照强度为2000~2300lx,光照时间控制为12小时/天。
应用本发明的外植体消毒方法,消毒成活率可达到75~85%,15~25天能在外植体上形成绿色的不定芽。
相对于现有技术,本发明的优点和有益效果为:
本发明只需简单的植物组织培养设备就可在110~150天内完成从外植体到试管苗形成的一个周期,大大加快了土田七的繁殖速度,经过继代增殖,每个继代增殖周期对不定芽可增殖4~7倍,因此,可在短时间内获得大量的试管苗。本发明繁殖的土田七种苗,能保持母株的优良特性,移栽成活率可达85%以上,具有低投入高产出的优势。
附图说明
图1A为实施例2的土田七母株上新长的嫩芽。
图1B为实施例2的从土田七母株上取下的嫩芽外植体。
图2为实施例2的外植体升汞消毒。
图3为实施例2的土田七外植体诱导形成绿色不定芽。
图4为实施例2的土田七外植体获得的再生植株。
图5A为实施例2的土田七试管苗移栽成活的种苗。
图5B为实施例2的土田七二次移栽上盆栽培的种苗。
具体实施方式
为更好地理解本发明,下面结合实施例对本发明作进一步的说明,但本发明的实施方式不限如此。
实施例1
(a)选择外植体:取生长旺盛的土田七幼嫩新芽(5~10厘米高)的根茎为外植体;
(b)外植体的消毒:将外植体用自来水洗净,剪刀剪掉叶片,留根茎和距离根茎高约5~7厘米的茎,以质量百分比浓度计,先用0.1%高锰酸钾溶液浸泡根茎30分钟,再用0.1%的百菌清和甲基硫菌灵(1:1)混合溶液浸泡根茎40分钟,接着在自来水下反复冲洗根茎30分钟。晾干表面水分后,在超净工作台上,切掉高约4~5厘米的茎,留约1~2厘米高的带根茎的茎,用棉球蘸取70%酒精擦拭根茎及约1~2厘米高的茎表面,最后用0.1%升汞溶液消毒15分钟,灭菌水冲洗4次,切掉距离根茎高约1~2厘米的茎留根茎,并接种根茎到诱导培养基中。
(c)丛生芽的诱导:在诱导培养基上培养3周,根茎上有绿芽形成并长出;再经4周,新芽长出1~2片叶,高约3~5厘米。所述的诱导培养基成分为MS+6‐苄氨基腺嘌呤1.0mg/L+萘乙酸0.01mg/L+10.0%椰汁+蔗糖30g/L+卡拉胶10g/L。
(d)增殖继代:将诱导出的不定芽切掉部分叶片后再切割,继代培养于增殖培养基中进行不定芽的增殖,培养60天,可获得增殖倍数为4~5的增殖丛生芽。所述的增殖继代培养基成分为MS+6‐苄氨基腺嘌呤3.0mg/L+萘乙酸0.10mg/L+10.0%椰汁+蔗糖30g/L+卡拉胶9.5g/L。
(e)生根培养:当继代苗高3~5厘米时,切下接种到生根培养基中,培养约40天得到生根苗。所述的生根培养基成分为MS+萘乙酸0.1mg/L+10.0%椰汁+蔗糖30g/L+卡拉胶9.5g/L。
(f)炼苗移栽:当生根培养基上的苗高5~8厘米时,在温室自然光照下炼苗10天,取出试管苗,洗净根部培养基,0.1%的百菌清溶液浸泡30分钟,移栽到由黄泥、珍珠岩和泥炭土(1:1:1)等体积混合的基质中,保持通风透气,湿度在70‐85%,温度在20‐32℃,高于32℃需用风机和水帘降温,自然光照条件培养后得到移栽苗。
上述b、c、d、e四个步骤中,所用的培养基:诱导培养基、增殖继代培养基和生根培养基的pH为5.6~5.8,培养基灭菌条件为125℃,30分钟,培养条件为25~30℃,光照强度2000~2300lx,光照12小时/天。
移栽苗注意通风、浇水和遮荫,成活率可达90%以上,移栽45天后可上盆栽培。从选择外植体到再生试管苗约需要149天的时间。
实施例2
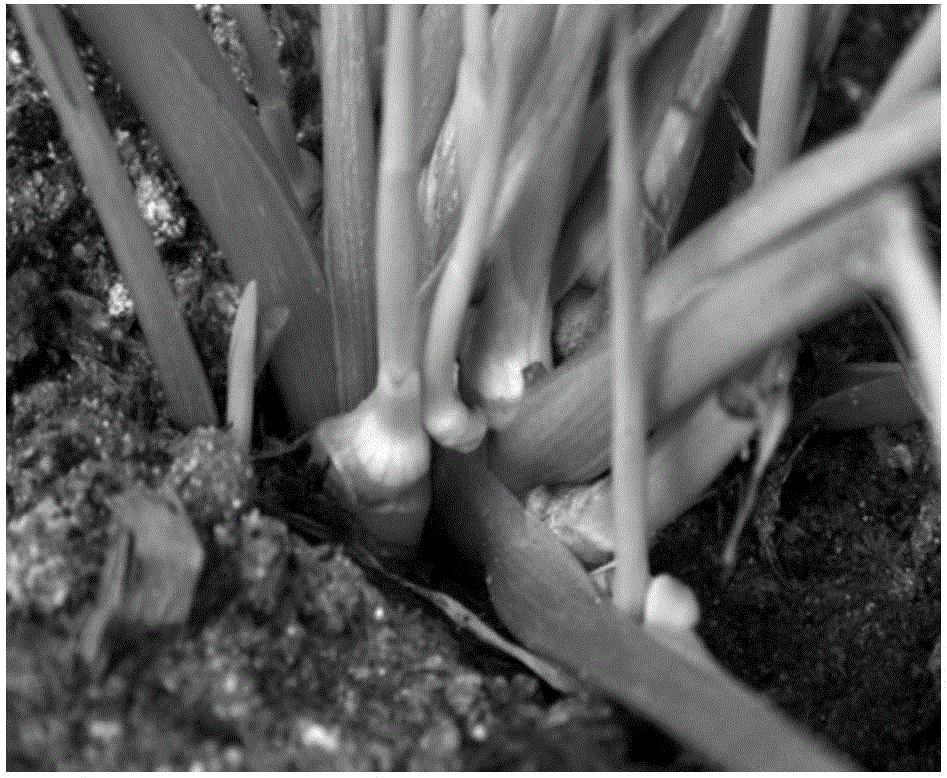
(a)选择外植体:如图1A所示,为土田七母株上长出的幼嫩新芽,取8~15厘米高的幼嫩新芽的根茎为外植体。
(b)外植体的消毒:如图1B所示,为从土田七母株上切取下的幼嫩新芽外植体,先用自来水洗净,剪刀剪掉叶片,留根茎和距离根茎高约5~7厘米的茎,先用0.2%高锰酸钾溶液浸泡根茎30分钟,再用0.2%的百菌清和甲基硫菌灵(1:1)混合溶液浸泡根茎40分钟,接着在自来水下反复冲洗根茎40分钟。晾干表面水分后,在超净工作台上,切掉高约4~6厘米的茎,留约1~2厘米高的带根茎的茎,用棉球蘸取70%酒精擦拭根茎及约1~2厘米高的茎表面,最后如图2所示,用0.1%升汞溶液消毒18分钟,灭菌水冲洗4次,切掉距离根茎高约1~2厘米的茎留根茎,并接种根茎到诱导培养基中。
(c)丛生芽的诱导:在诱导培养基上培养2周,如图3所示,根茎上有绿芽形成并长出;再经4周,新芽长出1~2片叶,高约3~5厘米。所述的诱导培养基成分为MS+6‐苄氨基腺嘌呤2.0mg/L+萘乙酸0.05mg/L+15.0%椰汁+蔗糖20g/L+卡拉胶9.5g/L。
(d)增殖继代:将诱导出的不定芽切掉部分叶片后再切割,继代培养于增殖培养基中进行不定芽的增殖,培养50天,可获得增殖倍数为4~6的增殖丛生芽。增殖继代培养基成分为MS+6‐苄氨基腺嘌呤5.0mg/L+萘乙酸0.20mg/L+15.0%椰汁+蔗糖20g/L+卡拉胶9.5g/L。
(e)生根培养:当继代苗高3~5厘米时,切下接种到生根培养基中,培养35天后,如图4所示,得到生根苗。所述的生根培养基成分为MS+萘乙酸0.5mg/L+15.0%椰汁+蔗糖20g/L+卡拉胶9.5g/L。
(f)炼苗移栽:当生根培养基上的苗高5~8厘米时,在温室自然光照下炼苗12天,取出试管苗,洗净根部培养基,0.2%的百菌清溶液浸泡30分钟,然后如图5A所示,移栽到由黄泥、珍珠岩和泥炭土(1:1:1)等体积混合的基质中,保持通风透气,湿度在70‐85%,温度在20‐32℃,高于32℃需用风机和水帘降温,自然光照条件培养后得到移栽苗。
上述(b)、(c)、(d)、(e)四个步骤中,所用的培养基:诱导培养基、增殖继代培养基和生根培养基的pH为5.6~5.8,培养基灭菌条件为125℃,30分钟,培养条件为25~30℃,光照强度2000~2300lx,光照12小时/天。
移栽苗注意通风、浇水和遮荫,成活率可达85%以上,移栽45天后上盆栽培,如图5B所示,为土田七种苗二次移栽上盆栽培的种苗。从选择外植体到再生试管苗约需要127天的时间。
实施例3
(a)选择外植体:取生长旺盛的土田七幼嫩新芽(10~20厘米高)的根茎为外植体;
(b)外植体的消毒:将外植体用自来水洗净,剪刀剪掉叶片,留根茎和距离根茎高约5~7厘米的茎,先用0.1%高锰酸钾溶液浸泡根茎40分钟,再用0.3%的百菌清和甲基硫菌灵(1:1)混合溶液浸泡根茎50分钟,接着在自来水下反复冲洗根茎40分钟。晾干表面水分后,在超净工作台上,切掉高约4~6厘米的茎,留约1~2厘米高的带根茎的茎,用棉球蘸取70%酒精擦拭根茎及约1~2厘米高的茎表面,最后用0.1%升汞溶液消毒20分钟,灭菌水冲洗5次,切掉距离根茎高约1~2厘米的茎留根茎,并接种根茎到诱导培养基中。
(c)丛生芽的诱导:在诱导培养基上培养2周,根茎上有绿芽形成并长出;再经3周,新芽长出1~2片叶,高约3~5厘米。所述的诱导培养基成分为MS+6‐苄氨基腺嘌呤3.0mg/L+萘乙酸0.10mg/L+15.0%椰汁+蔗糖30g/L+卡拉胶10g/L。
(d)增殖继代:将诱导出的不定芽切掉部分叶片后再切割,继代培养于增殖培养基中进行不定芽的增殖,培养45天,可获得增殖倍数为5~7的增殖丛生芽。所述的增殖继代培养基成分为MS+6‐苄氨基腺嘌呤8.0mg/L+萘乙酸0.20mg/L+15.0%椰汁+蔗糖30g/L+卡拉胶10g/L。
(e)生根培养:当继代苗高3~5厘米时,切下接种到生根培养基中,培养30天得到生根苗。所述的生根培养基成分为MS+萘乙酸1.0mg/L+15.0%椰汁+蔗糖30g/L+卡拉胶9.5g/L。
(f)炼苗移栽:当生根培养基上的苗高5~8厘米时,在温室自然光照下炼苗15天,取出试管苗,洗净根部培养基,0.3%百菌清溶液浸泡40分钟,移栽到由黄泥、珍珠岩和泥炭土(1:1:1)等体积混合的基质中,保持通风透气,湿度在70‐85%,温度在20‐32℃,高于32℃需用风机和水帘降温,自然光照条件培养后得到移栽苗。
上述b、c、d、e四个步骤中,所用的培养基:诱导培养基、增殖继代培养基和生根培养基的pH为5.6~5.8,培养基灭菌条件为125℃,30分钟,培养条件为25~30℃,光照强度2000~2300lx,光照12小时/天。
移栽苗注意通风、浇水和遮荫,成活率可达85%以上,移栽45天后可上盆栽培。从选择外植体到再生试管苗约需要110天的时间。
对比例1
本对比例土田七的外植体消毒方式为:将外植体用自来水洗净,剪刀剪掉叶片,留根茎和距离根茎高约5~7厘米的茎,在自来水下加少量洗衣粉反复冲洗根茎40分钟。晾干表面水分后,在超净工作台上,切掉高约4~6厘米的茎,留约1~2厘米高的带根茎的茎,用棉球蘸取70%酒精擦拭根茎及约1~2厘米高的茎表面,最后用0.1%升汞溶液消毒10分钟,灭菌水冲洗4次,切掉距离根茎高约1~2厘米的茎留根茎,并接种根茎到诱导培养基中。本对比例的诱导培养基与实施例3的条件都相同。接种1周左右观察发现,诱导培养基100%污染。
对比例2
本对比例土田七的外植体消毒方式为:将外植体用自来水洗净,剪刀剪掉叶片,留根茎和距离根茎高约5~7厘米的茎,在自来水下反复冲洗根茎40分钟。晾干表面水分后,在超净工作台上,切掉高约4~6厘米的茎,留约1~2厘米高的带根茎的茎,用棉球蘸取70%酒精擦拭根茎及约1~2厘米高的茎表面,最后用0.1%升汞溶液消毒15分钟,灭菌水冲洗5次,切掉距离根茎高约1~2厘米的茎留根茎,并接种根茎到诱导培养基中。本对比例的诱导培养基与实施例3的条件都相同。接种1周左右观察发现,诱导培养基100%污染。
本发明实施例相对于对比例的优点如下:由于外植体消毒方法的不同,本发明实施例大大降低了外植体在诱导培养基中的污染率,从而提高了工作效率。
- 还没有人留言评论。精彩留言会获得点赞!