一种维持DC‑CIK细胞高杀伤力的冻存保护剂的制作方法
本发明属于免疫领域,涉及DC-CIK细胞的培养,具体涉及一种维持DC-CIK细胞高杀伤力的冻存保护剂。
背景技术:
申请人于2016年12月22日提交了一件DC-CIK细胞培养的专利申请,该申请公开了miRNA-155及其抑制剂在DC-CIK细胞培养方面的应用,miRNA-155可以作为药物靶标在提高DC细胞共培养增强的CIK细胞对肿瘤细胞的杀伤力中的应用。该申请的说明书公开了miRNA-155下调表达的DC-CIK细胞比miRNA-155正常表达的DC-CIK细胞具有更高的杀伤力,而miRNA-155下调表达的DC细胞与miRNA-155正常表达的DC细胞的杀伤力基本一致,无显著性差异。这表明,miRNA-155下调并不能直接提高DC细胞对白血病细胞的杀伤力,但是miRNA-155下调的DC细胞可以通过共培养显著增强CIK细胞对肿瘤细胞的杀伤力。申请人还发现,太子参环肽B和太子参环肽C为miRNA-155的有效抑制剂。
出于实验需要,研究人员通常需要将细胞进行冻存,以便日后复苏使用。申请人发现,miRNA-155低表达的DC-CIK细胞在冻存前虽然对白血病细胞的杀伤力非常高,但是,冻存复苏后杀伤力明显下降。这表明,传统的细胞冻存保护剂可能不适用于miRNA-155低表达DC-CIK细胞的冻存,虽然能维持其复苏率,但是不能维持其对白血病细胞的杀伤力。
传统的细胞冻存保护剂多为基于DMSO的标准冻存液,由培养基、胎牛血清和DMSO组成。申请人在CIK细胞常用冻存保护剂基础上[RPMI 1640、胎牛血清和二甲基亚砜按照体积比5:4:1混合,可参见文献:冻存对细胞因子诱导的杀伤细胞免疫表型及细胞内因子表达的影响,郑州大学学报(医学版)2014年1月]进行了优化研究,试图在保证DC-CIK细胞冻存复苏率的基础上最大限度维持DC-CIK细胞的高杀伤力。
技术实现要素:
本发明旨在克服背景技术中存在的不足,提供一种维持DC-CIK细胞高杀伤力的冻存保护剂,在保证DC-CIK细胞冻存复苏率的基础上最大限度维持DC-CIK细胞的高杀伤力。
本发明通过如下技术方案得以实现:
一种维持DC-CIK细胞高杀伤力的冻存保护剂,由RPMI 1640、胎牛血清和二甲基亚砜、太子参环肽B或C组成。
优选地,RPMI 1640、胎牛血清和二甲基亚砜按照体积比6:3:1混合。
优选地,所述太子参环肽B的浓度为7-9μg/ml。
优选地,所述太子参环肽C的浓度为4-6μg/ml。
使用上述冻存保护剂冻存DC-CIK细胞的方法:首先于4℃冰箱中放置1h,然后-20℃冰箱中放置2h,转至-80℃低温冰箱放置。
本发明优点:
本发明冻存保护剂能在保证DC-CIK细胞冻存复苏率的基础上最大限度维持DC-CIK细胞的高杀伤力,延续miRNA-155低表达所带来的强杀伤力。
附图说明
图1为不同组效应细胞复苏后存活率;
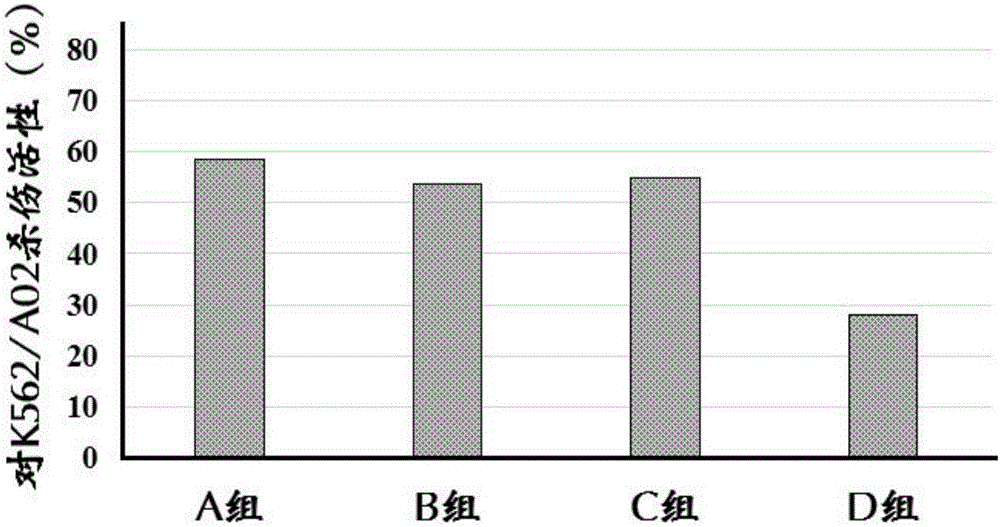
图2为不同组效应细胞对白血病K562/A02细胞系的杀伤活性;
图3为不同组效应细胞对白血病THP-1细胞系的杀伤活性;
图4为不同组效应细胞对白血病HL-60细胞系的杀伤活性。
具体实施方式
为了更好地解释本发明的技术方案,下面结合具体实施例进一步介绍。实施例中未特别强调的实验材料均为常规实验材料,属于本领域技术人员易于获得的范畴。
实施例1:冻存对miRNA-155低表达DC-CIK细胞杀伤力的影响
一、实验材料
1、miRNA-155inhibitor由上海吉玛制药技术有限公司提供(如下序列1);inhibitor negative control由上海吉玛制药技术有限公司提供(如下序列2)。
序列1:5’-ACCCCUAUCACGAUUAGCAUUAA-3’;
序列2:5’-CAGUACUUUUGUGUAGUACAA-3’。
2、肿瘤细胞为白血病细胞,包括K562/A02、THP-1及HL-60细胞。
二、实验方法
1、效应细胞DC与CIK的分离培养
(1)单个核细胞的分离:采集健康志愿者外周血20mL,预冷的PBS 1:1稀释,缓慢加入淋巴细胞分离液上层,650g,4℃离心20min,收集白色细胞层,分离单个核细胞,1640培养基重悬细胞后置于37℃,5%CO2孵箱中孵育2h。
(2)DC细胞的培养:单个核细胞培养2h后收集贴壁细胞,在完全培养基(1640+10%FBS)中添加GM-CSF(1000U/mL)、IL-4(1000U/mL)诱导DC生成,于37℃,5%CO2孵育箱中培养,每2天半量换液一次,换液后补充GM-CSF、IL-4,于第6d在培养基中添加TNF-α诱导DC成熟(100ng/mL),连续培养7d,收集细胞备用。
(3)CIK细胞的培养:收集单核细胞中的悬浮细胞,调整细胞密度至1×106/ml,在完全培养基(1640+10%FBS)中加入INF-γ(1000U/mL),并于24h后添加IL-2(300U/mL)、IL-1α(l00U/mL)和抗人CD3单抗(50μg/mL)。每2-3d进行换液,并补充等量的细胞因子,连续培养7天,收集细胞备用。
2、效应细胞DC的转染
转染试剂为美国Invitrogen公司生产的lipofectamine2000,严格按照使用说明操作。
(1)传细胞培养板:以6孔板为例,转染前一天,按1×106/ml密度接种DC细胞于6孔板,每孔加2ml培养基,使转染时贴壁细胞密度达60%。
(2)用DEPC水稀释miRNA-155inhibitor或inhibitor negative control(NC),配制终浓度为20μM的存储液,分装使用。
(3)配制混合液:
miRNA-155inhibitor或NC混合液:取10μl上述存储液,用opti-MEM稀释,轻轻混匀,配制250μl稀释液A;lipofectamine2000稀释液:取5μl lipofectamine2000,用opti-MEM稀释,轻轻混匀,配制250μl稀释液B。
(4)稀释液A和稀释液B室温孵育5分钟后,将二者轻轻混匀,室温孵育20分钟,配制总体积为500μl的稀释液C。
(5)将6孔板内原培养基吸去,PBS冲洗1次后吸去,每孔加入1.5ml opti-MEM。将稀释液C加入每孔,使得每孔液体总体积为2ml,miRNA-155inhibitor或NC浓度为100nM。
(6)将6孔板放入细胞培养箱培养6小时,吸去含有miRNA-155inhibitor或NC的培养基,PBS冲洗1次后,加入完全培养基2ml,放入细胞培养箱中继续培养48小时。
3、效应细胞DC转染后miRNA-155的表达量(qRT-PCR)
3.1细胞总RNA的提取
(1)吸去6孔板中的培养基,用PBS冲洗细胞2次,吸去PBS,每孔注入RNAiso Plus 1ml,缓慢吹打细胞,使细胞充分裂解;
(2)将裂解液吸出转入1.5ml EP管中,冰上静置5min;
(3)在EP管中加入氯仿200μl,剧烈震荡混匀约15秒,冰上静置3min;然后于4℃条件下12000g/min离心15分钟;
(4)离心后吸取EP管中上层水相液体500μl转入新的1.5ml EP管中,加入异丙醇500μl,颠倒混匀,冰上静置10min;然后于4℃条件下12000g/min离心10分钟;
(5)将EP管中沉淀留下,加入75%乙醇1ml震荡混匀,重悬白色沉淀;然后于4℃条件下7500g/min离心10分钟;
(6)吸去EP管中液体,可见管中沉淀,室温中干燥5分钟后用DEPC水30μl左右溶解沉淀获得总RNA,置于4℃冰箱过夜;
(7)取2μl上述总RNA,加198μl DEPC水,配制200μl稀释的总RNA,测定浓度和纯度;置于-80℃冰箱保存备用。
3.2miRNA-155逆转录
(1)将总RNA逆转录成cDNA
用Hairpin-itTM miRNAs qPCR Quantitation Kit(上海吉玛制药技术有限公司)按照说明书在DEPC处理的200μl EP管中配制如下反应体系:5×RT Buffer,4μl;dNTP(10mM),0.75μl;miR-RT primers(1μM),1.2μl;MMLV Reverse Transcriptase(200U/μl),0.2μl;RNA sample,1μg;加RNase Free H2O至20μl。将该体系轻轻混匀后,瞬时离心,设置反应条件如下:16℃,30min;42℃,30min;85℃,10min。反应产物cDNA置于-20℃冰箱保存备用。
(2)实时荧光定量PCR
将cDNA稀释3倍,然后混匀并吸取2μl作模板,用逆转录试剂盒按说明书配制如下反应体系:2×RT PCR Buffer,10μl;miR specific Primer set(5μM),0.4μl;miRNA RT Product,2μl;Taq DNA polymerase(5U/ml),0.2μl;加ddH2O至20μl。将该体系轻轻混匀后,瞬时离心,设置反应条件如下:95℃,3min;95℃,12sec;62℃,40sec;40cycles。
miRNA-155以U6为内参,miRNA-155和U6的引物由上海吉玛制药技术有限公司提供。
4、效应细胞DC与CIK共培养
将上述成熟的DC和CIK按1:8混合,置于含300U/mL IL-2的RPMI1640培养基中,于37℃、5%CO2孵箱中继续培养,隔天半量换液,共培养4天,收集细胞。
5、DC-CIK的冻存和复苏
将收集的DC-CIK细胞1500r/min离心10min弃上清后,加入冻存保护剂,吸吹均匀,调整至密度为2×106个/mL,分装于冻存管中,标记冻存日期,首先于4℃冰箱中放置1h,然后-20℃冰箱中放置2h,转至-80℃低温冰箱放置3个月。
分为本发明冻存保护剂组和常规冻存保护剂组,保护剂成分如下:
本发明冻存保护剂组1:RPMI 1640、胎牛血清和二甲基亚砜按照体积比6:3:1混合,并添加8μg/ml太子参环肽B;太子参环肽B在7-9μg/ml均可,过高会造成细胞损伤;
本发明冻存保护剂组2:RPMI 1640、胎牛血清和二甲基亚砜按照体积比6:3:1混合,并添加5μg/ml太子参环肽C;太子参环肽C在4-6μg/ml均可,过高会造成细胞损伤;
常规冻存保护剂组:RPMI 1640、胎牛血清和二甲基亚砜按照体积比5:4:1混合。
6、DC-CIK细胞的复苏
将冻存的DC-CIK细胞从-80℃低温冰箱中取出后放入37℃水浴锅内迅速融化,用完全培养基洗1遍,重悬于RPMI1640培养基中。
7、复苏后细胞存活率测定
将复苏细胞用台盼蓝染色后,利用血细胞计数板计数细胞,测定台盼蓝拒染率,并与冷冻前相比较,计算细胞存活率:细胞存活率=(1-台盼蓝染色细胞数/总细胞数)×100%。
根据效应细胞不同分为如下组别:
B组:冻存保护剂组1冻存复苏的miRNA-155低表达DC-CIK细胞;
C组:冻存保护剂组2冻存复苏的miRNA-155低表达DC-CIK细胞;
D组:常规冻存保护剂组冻存复苏的miRNA-155低表达DC-CIK细胞。
8、冻存前后对白血病细胞杀伤力的测定
分别使用K562/A02,THP-1及HL-60细胞作为靶细胞,使用完全培养基调整细胞浓度为105个/mL,按照效靶5:1将效应细胞及靶细胞加入96孔板中,37℃、5%CO2孵育箱中培养48h。通过MTT检测试剂盒检测细胞活率。
杀伤活性(%)=[1-(试验孔均值-效应对照孔均值)/靶细胞对照孔均值]×100%。
根据效应细胞不同分为如下组别:
A组:冻存前miRNA-155低表达DC-CIK细胞;
B组:冻存保护剂组1冻存复苏的miRNA-155低表达DC-CIK细胞;
C组:冻存保护剂组2冻存复苏的miRNA-155低表达DC-CIK细胞;
D组:常规冻存保护剂组冻存复苏的miRNA-155低表达DC-CIK细胞。
三、实验结果
1、DC、CIK细胞增殖情况和表型分析
从外周血分离获得单个核细胞,通过诱导刺激分别得到DC和CIK细胞。经过传代培养,使用MTT检测试剂盒分析两种细胞的增殖活性,从570nm的吸光值结果可以看出,初种细胞后的1-2d,DC、CIK细胞生长缓慢,d3细胞进入快速生长期,6d以后细胞生长速度减缓。提取培养7d后的DC及CIK,通过流式细胞仪检测其表面标志物,其中DC细胞表面CD80、CD83、CD86的阳性率分别为72.17%、55.56%、60.09%,说明DC细胞已经成熟,纯度较高。CIK细胞表面CD3+CD8+、CD3+CD56+双阳性比率分别为57.65%、51.43%。
2、DC细胞转染后miRNA-155表达情况
转染miRNA-155inhibitor的DC细胞中的miRNA-155表达量显著下调,约为不转染inhibitor或negative control的对照组DC细胞、转染negative control的阴性对照组DC细胞的0.3倍。各组DC细胞的活力及增殖行为基本一致,证明miRNA-155低表达后并不影响DC细胞的活力和增殖行为。
3、复苏后细胞存活率
各组存活率差异不大,均在80%左右,如图1所示。
4、复苏后对白血病细胞的杀伤力
各组效应细胞对白血病细胞杀伤力的结果如图2-4所示。
结果可以看出,冻存保护剂组1和冻存保护剂组2DC-CIK细胞对白血病细胞的杀伤力与冻存前基本一致,显著优于常规冻存保护剂组的DC-CIK细胞。
综合上述实验可以看出,本发明提供的冻存保护剂虽然不能进一步提高复苏率,但是能最大限度维持DC-CIK细胞的高杀伤力,延续miRNA-155低表达所带来的强杀伤力。
上述实施例仅用于进一步解释本发明的技术方案,本领域技术人员应当明白,任何简单替换或修改均不脱离本发明,本发明的保护范围并不受限于上述具体实施例。
- 还没有人留言评论。精彩留言会获得点赞!