一种防控瓜类细菌性果斑病的方法及其专用种子杀菌剂与流程
本发明属于生物技术领域,具体涉及一种防控瓜类细菌性果斑病的方法及其专用种子杀菌剂。
背景技术:
瓜类细菌性果斑病(bacterialfruitblotch,简称bfb),又称细菌性果腐病,是可造成西瓜和甜瓜减产甚至绝收的毁灭性病害,也是世界性检疫病害。bfb由西瓜嗜酸菌(acidovoraxcitrulli)引起,具有发病快、传播速度快、爆发力强、危害重等特点,可侵染哈密瓜、南瓜、西葫芦、丝瓜、苦瓜、黄瓜等多种葫芦科作物,给农业安全生产造成严重威胁。自上世纪九十年代瓜类细菌性果斑病在美国的西瓜种植田大爆发以来,近二十年该病在全球多个国家迅速传播,这主要是与西瓜嗜酸菌的种子传带和日益频繁的国际种子贸易相关。瓜类细菌性果斑病在我国北京、新疆、东北、海南、山东、江苏等多个省市均有危害,不仅给我国的西瓜生产造成严重的损失,也对西瓜制种业带来了很大冲击。由于对于瓜类细菌性果斑病尚缺乏抗病品种,田间依靠铜制剂和抗生素的化学防治也面临着西瓜嗜酸菌产生抗药性、防治效果有限的问题。因此,保证种子和幼苗的健康是瓜类细菌性果斑病综合防治的首要环节。然而尽管对制种田采取田间监控、种子检测、种子处理的措施,但通过种子引起的苗期病害发生与流行并没有完全避免。
近年来对于西瓜种子传带西瓜嗜酸菌的研究发现:西瓜嗜酸菌可以通过侵染果皮和雌花柱头,从而感染果瓤和种子外部和内部;通过果皮接种的种子外胚乳层感染率达到95%;通过雌花接种的种胚感染率达90%;而且西瓜嗜酸菌在种子存活时间长达7年以上。上述研究表明,西瓜嗜酸菌不仅是种子的表面携带,更重要的是在种子的内部寄藏。种子内部寄藏细菌具有很高的抗逆性,存活时间更长,病害传播能力也更强,同时内部寄藏细菌对种子检测,种子处理造成难度。目前预防西瓜细菌性果斑病的种子传带主要通过种子采后发酵和使用盐酸、physan20、tsunami100等处理种子,但处理影响发芽率,尤其是三倍体无籽西瓜种子。干种子的温汤浸种和铜制剂处理虽然降低了苗期发病率,但不能完全去除病原菌,依靠农用抗生素和铜制剂的苗期病害防控效果有限,而且容易导致细菌抗药性的产生。研究发掘新型高效的种子和幼苗处理药剂是当前西瓜制种和育苗生产中迫切需要研究的问题。
小分子化合物是分子量小于500,天然或人工合成的化合物,大部分具细胞穿透能力,选择性的作用于蛋白。
技术实现要素:
本发明的目的是防控瓜类细菌性果斑病。
本发明首先保护吡硫锌在制备产品中的应用;所述产品的功能可为a1)-a7)中的至少一种:
a1)杀灭西瓜嗜酸菌;
a2)种子杀菌;
a3)葫芦科作物的种子杀菌;
a4)防控作物病害;
a5)防控葫芦科作物病害;
a6)防控由西瓜嗜酸菌引起的病害;
a7)防控瓜类细菌性果斑病。
本发明还保护吡硫锌的应用,可为a1)-a7)中的至少一种:
a1)杀灭西瓜嗜酸菌;
a2)种子杀菌;
a3)葫芦科作物的种子杀菌;
a4)防控作物病害;
a5)防控葫芦科作物病害;
a6)防控由西瓜嗜酸菌引起的病害;
a7)防控瓜类细菌性果斑病。
上述任一所述的应用中,所述产品可为种子杀菌剂。
本发明还保护一种产品,其可含有吡硫锌。
上述产品中,所述产品可为种子杀菌剂。所述种子可为葫芦科作物的种子。
本发明还保护上述任一所述产品的的应用,可为a1)-a7)中的至少一种:
a1)杀灭西瓜嗜酸菌;
a2)种子杀菌;
a3)葫芦科作物的种子杀菌;
a4)防控作物病害;
a5)防控葫芦科作物病害;
a6)防控由西瓜嗜酸菌引起的病害;
a7)防控瓜类细菌性果斑病。
上述任一所述的应用中,所述由西瓜嗜酸菌引起的病害具体可为瓜类细菌性果斑病。
上述任一所述应用中,所述西瓜嗜酸菌可为西瓜嗜酸菌nm-4、西瓜嗜酸菌ps196、西瓜嗜酸菌xu4-14、西瓜嗜酸菌xu5-14、西瓜嗜酸菌xu20-15、西瓜嗜酸菌xu18-7、西瓜嗜酸菌bj-13、西瓜嗜酸菌pslbtw102、西瓜嗜酸菌xu3-14、西瓜嗜酸菌xu2-14、西瓜嗜酸菌xu8-14和西瓜嗜酸菌xu3-15中的至少一种。
本发明还保护一种种子的杀菌方法,可为用吡硫锌处理种子。
本发明还保护一种防控瓜类细菌性果斑病的方法,可为用吡硫锌处理种子。
上述任一所述的方法中,所述吡硫锌处理的时间为20h以上(如20h、24h、30h或40h)。
上述任一所述的方法中,所述吡硫锌处理的浓度为10-200μm(如10-100μm、100-200μm、10μm、100μm或200μm)。
上述任一所述的方法中,吡硫锌处理种子的方式可为浸种、拌种等常见的种子处理方式。
上述任一所述种子可为葫芦科作物的种子。
上述任一所述葫芦科作物可为西瓜、甜瓜、哈密瓜、南瓜、西葫芦、丝瓜、苦瓜或黄瓜。
上述任一所述吡硫锌的化学式如式(i)所示。
实验证明,吡硫锌可以有效去除葫芦科作物(如西瓜、甜瓜)的种子外部和内部的西瓜嗜酸菌,且在种子萌发的过程中可以被幼苗吸收,降低西瓜嗜酸菌种子—幼苗的传带,有效抑制携带西瓜嗜酸菌的种子出苗发病率,达到防控瓜类细菌性果斑病的目的;同时,吡硫锌不影响种子萌发和幼苗生长;此外吡硫锌抑制病原菌(如番茄溃疡病菌、十字花科黑腐病菌)生长的同时,对植物生长促进根际菌(如荧光假单胞菌、枯草芽孢杆菌)生长也无显著影响。由此可见,吡硫锌可作为种子杀菌剂进行生产推广。本发明具有重要的应用价值。
附图说明
图1为小分子化合物的初次筛选结果。
图2为小分子化合物对西瓜嗜酸菌groupi混合菌和groupii混合菌的评分汇总图。
图3为不同浓度小分子化合物对西瓜嗜酸菌xu3-14的生长影响和对待测菌的生长影响。
图4为根据小分子化合物处理发芽种子外部带菌量的减少量和二次筛选所有项目评分总和对77个小分子化合物的分组图。
具体实施方式
以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
下述实施例中的西瓜的品种均为京欣1号。拟南芥均为野生型拟南芥哥伦比亚型。
pf培养基:将月示蛋白胨20g、琼脂15g、甘油10ml溶于蒸馏水,用蒸馏水定容至1l,调节ph值至7.3;然后121℃灭菌20min;灭菌后冷却至50℃时,加入14ml浓度为1m的k2hpo4水溶液(无菌)和24ml浓度为1m的mgso4水溶液(无菌)。
nby培养基记载于如下文献中:vidaver,a.k.1967.syntheticandcomplexmediaforrapiddetectionoffluorescenceofphytopathogen-ispseudomonads:effectofthecarbonsource.appl.microbiol.,15:1523-1524.
下述实施例中涉及的菌株名称及其来源见表1中第1列和第2列。来源中为发明人分离鉴定的菌株均为自行采集,具体采集人、采集时间、采集地点依次见表1中第3列、第4列和第5列。西瓜嗜酸菌的rep-pcr鉴定结果(西瓜嗜酸菌的rep-pcr鉴定方法参考文献如下:r.r.walcott,a.fessehaiedanda.c.castro.differencesinpathogenicitybetweentwogeneticallydistinctgroupsofacidovoraxavenaesubsp.citrullioncucurbithosts.j.phytopathology152,277-285(2004).)见表1中第6列。
表1
注:文献1为徐秀兰,芦钰,赵子婧,吴萍,宋顺华,宫国义,张海军.不同发酵条件对瓜类细菌性果斑病菌感染西瓜种子的影响.植物保护.2018年04期.;文献2为shashayan,yuwenyang,tielinwang,tingchangzhaoandnormanw.schaad.geneticdiversityanalysisofacidovoraxcitrulliinchina.eurjplantpathol(2013)136:171–181.;“-”表示不存在;“发明人分离鉴定”的具体方法为:1、西瓜嗜酸菌采用mebb培养基(schaadnwandsechlerxa.animprovedsemiselectiveagarmediumforacidovoraxavenaesubsp.citrulli[j].phytopathology,1999,89:s68-69.)进行分离,pf培养基进行纯化,鉴定方式为pcr分子鉴定,pcr鉴定引物为wfb1:5’-gaccagccacactgggac-3’和wfb2:5’-ctgccgtactccagcgat-3’。2、番茄溃疡病菌采用ydc培养基(wilsone.e.,f.m.zeitounandd.l.fredrickson.1967.bacterailphloemcanker,anewdiseaseofpersianwalnuttrees.phytopahatholagy,57:618-621.)进行分离纯化,鉴定方式为pcr分子鉴定,pcr鉴定引物为cmm5:5’-gcgaataagcccatatcaa-3’和cmm6:5’-cgtcaggaggtcgctaata-3’。3、十字花科黑腐病菌的分离纯化及鉴定方法参照internationalrulesforseedtesting20157-019:detectionofxanthomonascampestrispv.campestrisonbrassicaspp.中的规定进行。
实施例1、小分子化合物的筛选及其在防控瓜类细菌性果斑病中的应用
一、西瓜嗜酸菌菌株的致病能力实验
1、将表1所示的12个西瓜嗜酸菌的菌株保存液(菌株均保存于15%(v/v)甘油水溶液,-80℃)分别接种于pf培养基或nby培养基,28℃培养2-3d(目的为活化)。
2、完成步骤1后,分别将活化的西瓜嗜酸菌进行扩大培养,得到浓度为108cfu/ml的菌悬液。
3、取西瓜种子,常规种植,得到长出两片真叶的西瓜幼苗。取甜瓜种子,常规种植,得到长出两片真叶的甜瓜幼苗。
4、将无菌解剖剪(通过将解剖剪在火焰上加热或用75%酒精浸泡获得)在步骤2制备的菌悬液中浸一下(目的为使解剖剪的刃口蘸上菌悬液),然后剪去步骤3得到的西瓜幼苗的子叶和甜瓜幼苗的子叶(rep-pcr鉴定结果为groupi的西瓜嗜酸菌接种甜瓜幼苗,rep-pcr鉴定结果为groupii的西瓜嗜酸菌接种西瓜幼苗),完成接种。
其它接种注意事项如下:接种前浇水,接种过程中不同菌株之间需要注意消毒,更换手套,解剖剪需彻底消毒,避免交叉污染。
5、完成步骤4后,常规培养2周,观察记录菌株接种后幼苗的发病时间和病情,综合判定菌株的致病能力。
结果表明,12个西瓜嗜酸菌菌株中,西瓜嗜酸菌xu3-14对西瓜的致病能力最强,用于小分子化合物的初次筛选及后续西瓜种子的接种;西瓜嗜酸菌xu18-7对甜瓜的致病性最强,用于后续甜瓜种子的接种。
二、小分子化合物的初次筛选
高通量初次筛选在96孔板中进行,共筛选4952个小分子化合物。初次筛选的步骤如下:
1、将西瓜嗜酸菌xu3-14单克隆接种至lb液体培养基,28℃、120rpm振荡培养12h,得到培养菌液。
2、完成步骤1后,取无菌离心管,加入50ml培养菌液,12000rpm离心5min,弃上清液,向沉淀中加入适量灭菌去离子水稀释,最终得到od600nm值为0.05的菌悬液。
3、取96孔细胞培养板,每个检测孔加入100μl菌悬液和1μl待测小分子化合物的溶液(溶剂为dmso或水),得到体系1;体系1中,待测小分子化合物的浓度为100μm。
取96孔细胞培养板,对照孔1加入100μl菌悬液和1μldmso,得到体系2(作为对照1)。取96孔细胞培养板,对照孔2加入100μl菌悬液和1μl卡那霉素水溶液(浓度为50ng/μl),得到体系3(作为对照2)。取96孔细胞培养板,对照孔3加入100μl菌悬液,得到体系4(作为对照3)。取96孔细胞培养板,对照孔4加入100μllb液体培养基,得到体系5(作为对照4)。
每个96孔细胞培养板上均设置对照1至对照4,每个对照孔重复2次。
4、完成步骤3后,取所述96孔细胞培养板,检测每孔的od600nm值。
5、完成步骤4后,取所述96孔细胞培养板,28℃、150rpm振荡培养24h。然后检测每孔的od600nm值。
6、完成步骤5后,计算西瓜嗜酸菌xu3-14生长抑制指数,然后进行如下判断及评分:如果西瓜嗜酸菌xu3-14生长抑制指数小于50%,则检测孔对应的小分子化合物对西瓜嗜酸菌xu3-14的生长无显著影响,评分为1分;如果西瓜嗜酸菌xu3-14生长抑制指数为50%以上且99%以下,则检测孔对应的小分子化合物对西瓜嗜酸菌xu3-14部分抑制,评分为2分;如果西瓜嗜酸菌xu3-14生长抑制指数大于99%,则检测孔对应的小分子化合物对西瓜嗜酸菌xu3-14高抑制,检测孔内的菌液划线接种于pf培养基(目的为活化),28℃培养48h;如果西瓜嗜酸菌xu3-14恢复生长、则检测孔对应的小分子化合物对西瓜嗜酸菌xu3-14为完全抑制,评分为3分;如果西瓜嗜酸菌xu3-14无法恢复生长、则检测孔对应的小分子化合物对西瓜嗜酸菌xu3-14为致死,评分为4分。
西瓜嗜酸菌xu3-14生长抑制指数=(阳性对照孔od600nm值-检测孔od600nm值)/(阳性对照孔od600nm值-阴性对照孔od600nm值)×100%。
筛选结果见图1。从4952个小分子化合物中筛选出西瓜嗜酸菌xu3-14生长抑制指数大于99%的小分子化合物127个,其中45个小分子化合物(15个小分子化合物属于mce小分子化合物库,30个小分子化合物属于chembridge小分子化合物库)对西瓜嗜酸菌xu3-14完全抑制,82个(62个小分子化合物属于mce小分子化合物库,20个小分子化合物属于chembridge小分子化合物库)小分子化合物对西瓜嗜酸菌xu3-14致死。
三、小分子化合物的二次筛选
a、小分子化合物的敏感性评估
对步骤二筛选出的127个小分子化合物的敏感性进行评估。
1、测试一
(1)根据表1中rep-pcr鉴定结果,从groupi中选择西瓜嗜酸nm-4、西瓜嗜酸菌psl96、西瓜嗜酸菌xu4-14、西瓜嗜酸菌xu5-14和西瓜嗜酸菌xu20-15,作为groupi混合菌;从groupii中选择西瓜嗜酸菌bj-13、西瓜嗜酸菌pslbtw102、西瓜嗜酸菌xu2-14、西瓜嗜酸菌xu8-14和西瓜嗜酸菌xu3-15,作为groupii混合菌。groupi混合菌和groupii混合菌作为待测菌,共10个。
(2)完成步骤(1)后,将10个待测菌分别接种至lb液体培养基,28℃、120rpm振荡培养12h,得到培养菌液。
(3)完成步骤1后,取无菌离心管,加入50ml培养菌液,12000rpm离心5min,弃上清液,向沉淀中加入适量灭菌去离子水稀释,最终得到od600nm值为0.05的菌悬液。
将菌悬液按照groupi和groupii的分组进行等量混合,得到groupi混合菌悬液和groupii混合菌悬液。
(4)完成步骤(3)后,取96孔细胞培养板,每个检测孔加入100μl混合菌悬液(groupi混合菌悬液或groupii混合菌悬液)和1μl待测小分子化合物的溶液(溶剂为dmso或水),得到体系1;体系1中,待测小分子化合物的浓度为100μm。
取96孔细胞培养板,对照孔1加入100μl混合菌悬液(groupi混合菌悬液或groupii混合菌悬液)和1μldmso,得到体系2(作为对照1)。取96孔细胞培养板,对照孔2加入100μl混合菌悬液(groupi混合菌悬液或groupii混合菌悬液)和1μl卡那霉素水溶液(浓度为50ng/μl),得到体系3(作为对照2)。取96孔细胞培养板,对照孔3加入100μl混合菌悬液(groupi混合菌悬液或groupii混合菌悬液),得到体系4(作为对照3)。取96孔细胞培养板,对照孔4加入100μllb液体培养基,得到体系5(作为对照4)。
每个96孔细胞培养板上均设置对照1至对照4,每个对照孔重复2次。
(5)完成步骤(4)后,将所述96孔细胞培养板置于酶标仪,28℃孵育24h。孵育期间,每隔15min测量混合菌悬液的od600nm值。以孵育时间为横坐标,混合菌悬液的od600nm值为纵坐标,绘制生长曲线。
(6)计算待测菌的相对抑制率,然后进行如下判断和评分:如果相对抑制率大于0.5,则检测孔对应的小分子化合物对待测菌的生长均无显著影响,评分为1分;如果相对抑制率为0以上且0.5以下,则检测孔对应的小分子化合物对待测菌的生长部分抑制,评分为2分;如果相对抑制率为0,则检测孔对应的小分子化合物对待测菌的生长高抑制,检测孔内的菌液划线接种于pf培养基(目的为活化),28℃培养48h;如果待测菌恢复生长、则检测孔对应的小分子化合物对待测菌为完全抑制,评分为3分;如果待测菌无法恢复生长、则检测孔对应的小分子化合物对待测菌为致死,评分为4分。
相对抑制率=检测孔生长曲线下的面积/阴性对照孔生长曲线下的面积。
以小分子化合物对groupii混合菌的评分为横坐标,对groupi混合菌的评分为纵坐标,计算不同评分的小分子化合物的数目。实验结果见图2(圆圈中的数字为相对应groupi和groupii评分的小分子的数目)。
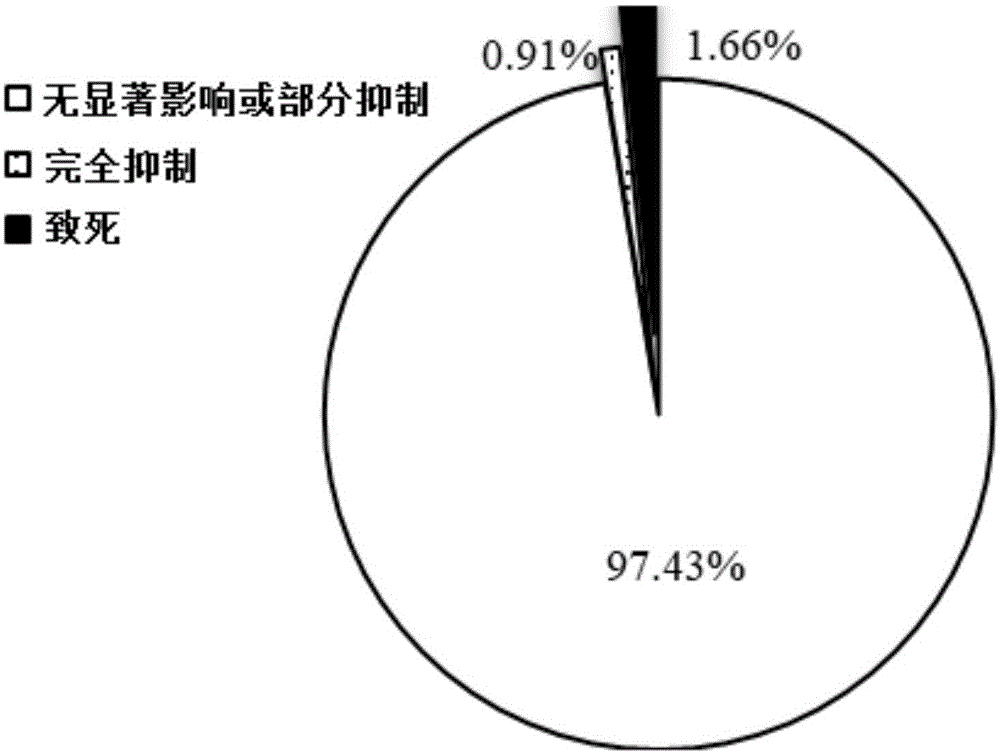
结果表明,97个小分子化合物对groupi混合菌和groupii混合菌的生长均为高抑制,其中60个小分子化合物对groupi混合菌和groupii混合菌均为致死;96个小分子化合物对groupi混合菌和groupii混合菌效果相同,27个小分子化合物对groupii混合菌效果更好,只有4个小分子化合物对groupi混合菌更有效。
2、测试二
测试西瓜嗜酸菌xu3-14的最小抑制浓度(mic)和最小杀菌浓度(mbc)。
对二次筛选的96个小分子测试西瓜嗜酸菌xu3-14的最小抑制浓度(mic),与初次筛选步骤相同,只是对添加的小分子化合物的浓度进行了梯度稀释。对同一小分子化合物来说,对西瓜嗜酸菌xu3-14产生致死效果的最低浓度即为该小分子化合物的最小杀菌浓度,对菌株产生完全抑制效果的最低浓度即为该小分子化合物的最小抑制浓度。
不同浓度小分子化合物对西瓜嗜酸菌xu3-14的生长影响见图3中a。结果表明,当小分子化合物的浓度为25μm时,仅有1/3的小分子化合物对西瓜嗜酸菌xu3-14仍然具有致死性;浓度为100μm时能够完全抑制西瓜嗜酸菌xu3-14生长的小分子化合物,当其浓度为12.5μm时基本失去抑制效果;当小分子化合物的浓度为12.5μm时,20个小分子化合物对西瓜嗜酸菌xu3-14仍然具有致死性,23个小分子化合物能够完全抑制西瓜嗜酸菌xu3-14的生长。
b、小分子化合物的特异性评估
对步骤二筛选出的127个小分子化合物的特异性进行评估。
番茄溃疡病菌和十字花科黑腐病菌均为植物病原菌。枯草芽孢杆菌和荧光假单胞菌均为促进植物生长根际菌。
1、将待测菌(番茄溃疡病菌、十字花科黑腐病菌、枯草芽孢杆菌或荧光假单胞菌)接种至lb液体培养基,28℃、120rpm振荡培养12h,得到培养菌液。
2、取步骤1得到的培养菌液,加入lb液体培养基稀释,得到od600nm值为0.05的菌悬液。
3、完成步骤2后,取96孔细胞培养板,每个检测孔加入100μl菌悬液和1μl待测小分子化合物的溶液(溶剂为dmso或水),得到体系1;体系1中,待测小分子化合物的浓度为100μm。
取96孔细胞培养板,阴性对照孔加入100μl菌悬液和1μl卡那霉素水溶液(浓度为50ng/μl),得到体系2(作为阴性对照)。
4、完成步骤3后,将所述96孔细胞培养板置于酶标仪,28℃孵育24h。孵育期间,每隔15min测量菌浓度。以孵育时间为横坐标,菌浓度为纵坐标,绘制生长曲线。
5、计算番茄溃疡病菌或十字花科黑腐病菌的相对抑制率,然后进行如下判断和评分:如果相对抑制率大于0.5,则检测孔对应的小分子化合物对番茄溃疡病菌或十字花科黑腐病菌的生长均无显著影响,评分为1分;如果相对抑制率为0以上且0.5以下,则检测孔对应的小分子化合物对番茄溃疡病菌或十字花科黑腐病菌的生长部分抑制,评分为2分;如果相对抑制率为0,则检测孔对应的小分子化合物对番茄溃疡病菌或十字花科黑腐病菌的生长高抑制,检测孔内的菌液划线接种于nby培养基(目的为活化),28℃培养48h;如果番茄溃疡病菌或十字花科黑腐病菌恢复生长、则检测孔对应的小分子化合物对番茄溃疡病菌或十字花科黑腐病菌为完全抑制,评分为3分;如果番茄溃疡病菌或十字花科黑腐病菌无法恢复生长、则检测孔对应的小分子化合物对番茄溃疡病菌或十字花科黑腐病菌为致死,评分为4分。
相对抑制率=检测孔生长曲线下的面积/阴性对照孔生长曲线下的面积。
6、计算枯草芽孢杆菌或荧光假单胞菌的相对抑制率,然后进行如下判断和评分:如果相对抑制率大于0.5,则检测孔对应的小分子化合物对枯草芽孢杆菌或荧光假单胞菌的生长均无显著影响,评分为4分;如果相对抑制率为0以上且0.5以下,则检测孔对应的小分子化合物对枯草芽孢杆菌或荧光假单胞菌的生长部分抑制,评分为3分;如果相对抑制率为0,则检测孔对应的小分子化合物对枯草芽孢杆菌或荧光假单胞菌的生长高抑制,检测孔内的菌液划线接种于pf培养基(目的为活化),28℃培养48h;如果枯草芽孢杆菌或荧光假单胞菌恢复生长、则检测孔对应的小分子化合物对枯草芽孢杆菌或荧光假单胞菌为完全抑制,评分为2分;如果枯草芽孢杆菌或荧光假单胞菌无法恢复生长、则检测孔对应的小分子化合物对枯草芽孢杆菌或荧光假单胞菌为致死,评分为1分。
小分子化合物对待测菌的生长影响见图3中b。结果表明,近半数小分子化合物对植物病原菌(如番茄溃疡病菌、十字花科黑腐病菌)的生长影响显著;大部分小分子化合物完全抑制荧光假单胞菌的生长,过半小分子化合物对枯草芽孢杆菌生长抑制效果明显。部分小分子化合物在抑制病原菌(如番茄溃疡病菌、十字花科黑腐病菌)生长的同时,对植物生长促进根际菌(如荧光假单胞菌、枯草芽孢杆菌)生长无显著影响。
c、小分子化合物的植物毒性评估
使用西瓜和拟南芥对步骤二筛选出的127个小分子化合物的植物毒性进行评估。
1、拟南芥毒性评估
(1)将拟南芥种子置于无菌水中,得到悬浮液。
(2)取96孔细胞培养板,每孔加入100μl水琼脂和1μl待测小分子化合物的溶液(溶剂为dmso或水),得到体系;体系中,待测小分子化合物的浓度为100μm。
(3)完成步骤(2)后,每孔加入5μl悬浮液(10个拟南芥种子),正常培养,5天后记录每孔种子的生长情况及发芽率。
按照上述步骤,将步骤(2)中待测小分子化合物的溶液替换为无菌水,其它步骤均不变,作为对照。
按照上述步骤,将步骤(2)中待测小分子化合物的溶液替换为dmso,其它步骤均不变,作为对照。
实验结果见表2。结果表明,接近半数的小分子化合物(58个)对拟南芥的生长影响显著,拟南芥发芽率受到显著影响,表现为种子不发芽或长出畸形苗;44个小分子化合物抑制种子萌发(表现为发芽率50-90%),只有25个小分子化合物(19.6%)对拟南芥萌发无影响(表现为发芽率≥90%)。对照中,拟南芥种子全部发芽且生长正常,说明dmso对拟南芥发芽率影响不显著。
表2.不同小分子化合物对拟南芥和西瓜发芽情况的影响
2、西瓜毒性测试
(1)取西瓜种子,置于55℃的水中静置处理30min,室温晾干(目的为清除西瓜种子内部和外部的病菌)。
(2)取48孔细胞培养板,每孔加入500μl水琼脂和5μl待测小分子化合物的溶液(溶剂为dmso或水),得到体系;体系中,待测小分子化合物的浓度为100μm。
(3)完成步骤(2)后,每孔加入步骤(1)得到的西瓜种子1粒,正常培养,7天后记录每个孔的种子发芽情况及生长状态。
按照上述步骤,将步骤(2)中待测小分子化合物的溶液替换为无菌水,其它步骤均不变,作为对照。
按照上述步骤,将步骤(2)中待测小分子化合物的溶液替换为dmso,其它步骤均不变,作为对照。
实验结果见表2。结果表明,近半41.7%的小分子化合物(53个)对西瓜发芽及幼苗生长无显著影响;17.3%的小分子化合物(22个)抑制幼苗生长,但不影响种子的发芽;16.5%的小分子化合物(21个)长出了畸形苗,31个小分子化合物种子不发芽。对照中,西瓜种子全部发芽且生长正常,说明dmso对西瓜发芽率影响不显著。
综合上述结果,超过50%的小分子化合物可以保证在用于种子处理或幼苗时不会在拟南芥或西瓜中引起畸形或死亡。大多数小分子化合物在所测试的剂量下,只对细菌有效。
选取二次筛选评分总和(参考如下文献获得:xiulanxu,anandkumar,
四、小分子化合物的出苗评估
利用西瓜嗜酸菌xu3-14接种的西瓜种子进行小分子化合物的出苗评估。具体的,用小分子化合物处理西瓜嗜酸菌xu3-14接种的西瓜种子,然后测定发芽种子外部带菌量,从而评估小分子化合物对病菌对寄主侵染互作的影响。
1、将西瓜嗜酸菌xu3-14单克隆接种至lb液体培养基,28℃、120rpm振荡培养24h,得到培养菌液。
2、完成步骤1后,取培养菌液,加入lb液体培养基稀释,得到浓度为108cfu/ml(od600nm值为0.15)的菌悬液。
3、完成步骤2后,将300ml菌悬液置于无菌烧杯,然后加入1000粒西瓜种子,28℃、120rpm振荡培养4h。
4、取完成步骤3的西瓜种子,参照植物毒性评估方法(xiulanxu,anandkumar,
每次试验需要同时进行接种种子dmso处理(小分子化合物替换为dmso)、接种种子无处理(小分子化合物替换为水)、不接种种子dmso处理(不接种种子且小分子化合物替换为dmso)和不接种种子无处理(不接种种子且小分子化合物替换为水),共4个对照组。
5、完成步骤4后,根据小分子化合物处理西瓜嗜酸菌xu3-14接种的西瓜种子单粒发芽实验中,小分子化合物处理发芽种子外部带菌量的减少量(发芽种子外部带菌量的减少量=log(10)(小分子化合物处理发芽带菌种子外部带菌量-对照组发芽带菌种子外部带菌量))及综合二次筛选所有项目评分总和,将77个小分子化合物分为三组(图4):
group1:发芽种子外部带菌量减少量>1.5。
group2:二次筛选评分总和>32。
group3:二次筛选评分总和≤32,同时发芽种子外部带菌量减少量≤1.5。
选取group1(6个)和group2(3个)共9个小分子化合物进行后续试验。
五、小分子化合物处理带菌种子的效果评估
对接种西瓜嗜酸菌xu3-14后的西瓜种子及接种西瓜嗜酸菌xu18-7甜瓜种子(接种方法同步骤五中1-3)进行带菌种子的发病率检测。带菌种子在播种前需催芽24h,催芽时添加浓度为100μm的小分子化合物溶液。培养基质使用灭菌的草炭和蛭石,以3:1的比例混合。每个小分子化合物处理设置3个重复,每个重复50粒种子。以8h光照,28℃;16h黑暗,20℃条件培养。7d后,观察种子发芽及发病情况,并做好记录。发现病株需及时移除,防止交叉感染。每次试验应添加接种种子灭菌水处理(将小分子化合物替换为水,简称带菌种子对照)及不接种种子对照(简称无菌对照)。
小分子化合物处理对接种种子的病害抑制率如表3所示:hy-b0479、hy-b0506和hy-b0572处理的西瓜种子的发病率与无菌对照的种子的发病率差异不显著,发病率分别为4.8%、12.0%和13.4%,其中hy-b0479抑制效果最明显,与带菌种子对照(71.8%)相比,抑制率高达93.3%。hy-b0450、hy-b1210、80175891和5217485这4个小分子化合同样显著抑制接种西瓜的发病率,发病率在26-38%之间,抑制率基本保持在48%以上。
选取效果最好的5个小分子化合物(即hy-b1210、hy-b0450、hy-b0572、hy-b0506和hy-b0479)进行后续实验。这5个小分子化合物均来自mce小分子化合物库。
表3.不同小分子化合物处理带菌西瓜种子对发病率及病害抑制率的影响
注:a不同字母标记表明两个处理之间存在显著差异,p=0.01;b病害抑制率(%)=(1-该处理的发病率/对照的发病率)×100
六、小分子化合物处理对带菌种子田间试验
对接种西瓜嗜酸菌xu3-14后的西瓜种子(接种方法同步骤五中1-3)和接种西瓜嗜酸菌xu18-7后的甜瓜种子(接种方法同步骤五中1-3,仅将西瓜嗜酸菌xu3-14替换为西瓜嗜酸菌xu18-7)进行温室出苗实验。带菌种子在播种前需催芽24h,催芽时添加浓度为200μm的小分子化合物的溶液。培养基质使用灭菌的草炭和蛭石,以3:1的比例混合,播种于96孔穴盘中。每个小分子化合物处理设置3个重复,每个重复1个穴盘即72粒种子。每次试验需加入无菌种子作为对照。保持温室温度25-28℃,控制温室湿度保持在50%-70%。7d后开始观察幼苗发病情况。如发现病株需及时移除,防止交叉感染。每次试验应添加接种种子灭菌水处理(将小分子化合物替换为水,无处理对照)及不接种种子对照(即无菌对照)。
试验结果见表4。结果表明,小分子化合物处理带菌种子可有效抑制携带西瓜嗜酸菌的西瓜/甜瓜种子的发病率,在将小分子化合物处理浓度提高到200μm后,5种小分子化合物对带菌种子的发病率均有明显抑制。其中那氟沙星和吡硫锌对于两种group类型的西瓜嗜酸菌在种子-种苗的传带过程中抑制效果显著。虽然消旋甲砜霉素对带菌西瓜种子抑制效果明显,但对带菌甜瓜种子发病率无显著抑制。
表4
由此可见,采用那氟沙星和吡硫锌处理携带西瓜嗜酸菌的西瓜/甜瓜种子,可有效抑制西瓜/甜瓜种子的发病率,且对出苗率的影响较低。那氟沙星和吡硫锌的化学式、分子式、分子量、类型等信息具体见表5。
表5
- 还没有人留言评论。精彩留言会获得点赞!