一种板栗胚轴超低温保存和恢复培养方法与流程
本发明涉及植物种子(胚)保存技术领域,尤其涉及一种板栗胚轴超低温保存和恢复培养方法。
背景技术:
板栗(castaneamollissimabl.)属壳斗科栗属植物,是我国重要的木本粮食树种,种子营养价值高,分布广泛,种植面积大,产业化水平高,素有“干果之王”、“铁杆庄稼”的美称。我国是全球板栗的原产地和主产区,种植面积和产量均居世界第一。板栗种质资源极为丰富,全国大部分省份均有分布,但是由于板栗种子是典型的顽拗性种子,不耐脱水和低温,无法按照正常型种子保存方法长期保存,超低温保存作为顽拗性种子长期保存的重要途径,将是板栗种子保存的重要方向。
目前,现有技术中关于板栗种子超低温保存研究主要集中在板栗胚轴不同冷冻方式和解冻方式对板栗胚轴超低温保存的影响。但是均存在超低温保存后胚轴萌发率较低的问题(低于30%)。
因此,亟需一种板栗胚轴超低温保存和恢复培养方法,以解决现有板栗胚轴超低温保存后胚轴萌发率较低的技术问题。
技术实现要素:
本申请提供了种板栗胚轴超低温保存和恢复培养方法,以解决现有板栗胚轴超低温保存后胚轴萌发率较低以及没有形成超低温保存和恢复培养的完整体系的技术问题。
为了解决上述技术问题,本申请实施例公开了如下技术方案:
根据本发明实施例的第一方面,提供了一种板栗胚轴超低温保存方法,所述方法包括:
步骤一:切取板栗中含有胚轴的大块组织,对所述大块组织块进行表面消毒,然后切取超低温贮藏所需胚轴组织,对所述胚轴组织脱水;
步骤二:将脱水后的胚轴组织,放入经灭菌的冻存管中,加入上载液,做加载处理;
步骤三:加载处理结束后,移除上载液,加入预冷的pvs2溶液,做玻璃化处理;
步骤四:将经玻璃化处理后含胚轴组织的冻存管快速放入生物样品液氮罐贮藏,做超低温储藏处理;
步骤五:超低温储藏处理后,对胚轴进行解冻处理;
步骤六:对解冻处理后的冻存管消毒,吸尽pvs2溶液,加入卸载液,做卸载处理。
优选地,所述上载液组成为:2m甘油+0.4m蔗糖,溶解于wpm基础培养基,调整溶液ph=5.8。
优选地,所述pvs2溶液组成为:30%甘油+15%乙二醇+15%二甲基亚砜+0.4mol/l蔗糖,溶解于wpm基础培养基,调整溶液ph=5.8。
优选地,所述卸载液组成为:1.2m蔗糖,溶解于wpm基础培养基,调整溶液ph=5.8。
根据本申请的第二方面,提供了一种板栗胚轴超低温保存后恢复培养方法,经由本申请第一方面提供的板栗胚轴超低温保存方法处理后获得的板栗胚轴做恢复培养,所述恢复培养方法包括:
板栗胚轴卸载处理结束后,吸尽卸载液,加入wpm基础培养基清洗,再吸尽wpm基础培养基,之后将胚轴转接在超低温恢复培养基上。
优选地,所述恢复培养基组成为:wpm+1.5mg/l6-苄氨基嘌呤(6-ba)+0.1mg/l萘乙酸(naa)+1g/l聚乙烯吡咯烷酮(pvp)+1g/l活性炭+30g/l蔗糖+3g/l琼脂(agar),调整溶液ph=5.8。
根据本申请的第三方面,提供了一种板栗胚轴幼苗组织培养基,在经过本申请第一方面提供的板栗胚轴超低温保存方法处理后,以及本申请第二方面提供的恢复培养方法处理后,在板栗胚轴幼苗组织培养基中进行板栗幼苗组织培养,所述培养基组成为:dkw+6-ba2mg/l+naa0.2mg/l+iba0.04mg/l。
与现有技术相比,本申请的有益效果为:
本申请通过板栗胚轴超低温保存和恢复培养方法,通过胚轴组织做脱水处理、加载处理、玻璃化处理、超低温储藏处理、解冻处理、卸载处理对板栗胚轴进行超低温保存。在现有技术的超低保存前后加入加载和卸载程序,最大限度的减少超低温保存过程中的结冰伤害,显著提高了胚轴组织超低温贮藏之后的萌发率。此外,进一步研究了萌发胚轴的组织培养方法,筛选优化基本培养基和激素种类,获得了适合板栗胚轴的最佳板栗胚轴幼苗组织培养基。
附图说明
为了更清楚地说明本申请的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,对于本领域普通技术人员而言,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
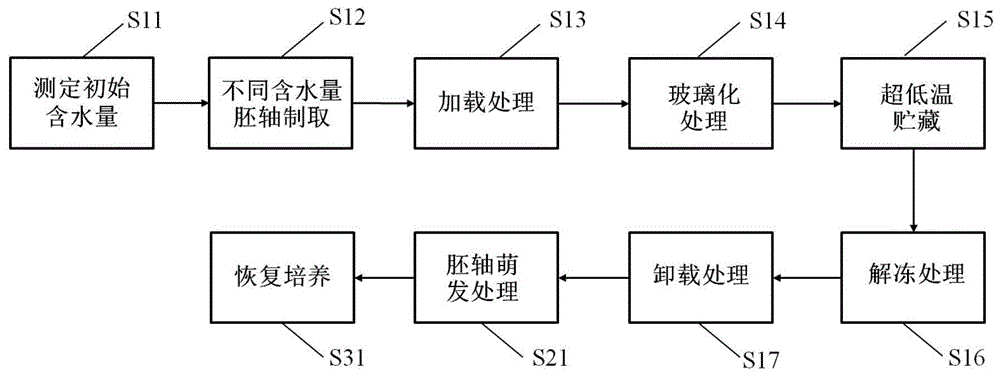
图1(a)和图1(b)为本发明实施例提供的一种板栗胚轴超低温保存和恢复培养流程图;
图2为本发明实施例提供的一种不同含水量胚轴超低温贮藏萌发情况;
图3为本发明实施例提供的一种不同6-ba浓度对外植体生长的影响;
图4为本发明实施例提供的一种不同iba浓度对外植体生长的影响;
图5为本发明实施例提供的一种不同ga3浓度对外植体生长的影响;
图6为本发明实施例提供的一种胚轴组织培养示意图。
具体实施方式
为了使本技术领域的人员更好地理解本申请中的技术方案,下面将结合本申请实施例中的附图,对本申请实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本申请一部分实施例,而不是全部实施例。基于本申请中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都应当属于本申请保护的范围。
1.材料与方法
1.1试验材料
秋季采集山东济南地区栽培的‘烟泉’品种板栗成熟种子,挑选大小和形状一致的种子,采后立即送至设施保存库,开展超低温保存和恢复培养实验。
1.2板栗胚轴超低温保存和恢复培养方法
图1(a)和图1(b)为本发明实施例提供的一种板栗胚轴超低温保存和恢复培养流程图,如图1(a)和图1(b)所示,板栗胚轴超低温保存和恢复培养方法包括以下步骤:
s11测定初始含水量。
切取20个大小相同的胚轴组织,称取鲜重,置于烘箱中(温度103℃,烘干17h)脱水至恒重,称取干重,初始含水量=(鲜重-干重)/鲜重×100%,重复3次。
s12不同含水量胚轴制取。
为避免消毒导致胚轴伤害,首先切取含有胚轴的大块组织(约4g),对组织块进行表面消毒,在75%(v/v)酒精中浸泡30s,无菌水清洗3次,转移至5%次氯酸钠溶液中消毒5min,无菌水漂洗3次。组织块消毒后,在超净工作台内切取超低温贮藏所需胚轴组织(约0.2g)。在超净工作台无菌环境下,不同含水量胚轴采用减重法获得,将胚轴组织脱水至30%、25%、20%、15%、10%等含水量梯度。
s13加载处理。
对于不同含水量的板栗胚轴组织,放入经灭菌的冻存管中,加入2ml上载液,加载处理20min。上载液组成:2m甘油+0.4m蔗糖,溶解于wpm基础培养基,调整溶液ph=5.8。
s14玻璃化处理。
加载处理结束后,用移液枪将加载液吸尽,加入2ml冰上预冷的pvs2溶液,冰浴处理60min。pvs2溶液组成:30%甘油+15%乙二醇+15%二甲基亚砜+0.4mol/l蔗糖,溶解于wpm基础培养基,调整溶液ph=5.8。
s15超低温贮藏。
玻璃化处理结束后,将冻存管冻固定在冻存管支架上,快速放入生物样品液氮罐贮藏。
s16解冻处理。
液氮中贮藏超过24h后,对胚轴进行解冻处理,将水浴锅温度设置为40℃,达到稳定温度后,将冻存管快速插入40℃恒温水浴中,水浴解冻2min。
s17卸载处理.
水浴后的冻存管,使用75%的酒精消毒,在超净工作台内,用移液枪吸尽pvs2溶液,加入2ml卸载液,25℃环境下处理20min。卸载液组成:1.2m蔗糖,溶解于wpm基础培养基,调整溶液ph=5.8。
1.3板栗胚轴超低温保存后恢复培养方法
s21胚轴萌发处理
卸载处理结束后,用移液枪吸尽卸载液,加入2ml的wpm基础培养基清洗,再用移液枪吸尽wpm基础培养基,之后将胚轴转接在超低温恢复培养基上。恢复培养基组成:wpm+1.5mg/l6-ba+0.1mg/lnaa+1g/lpvp(聚乙烯吡咯烷酮)+1g/l活性炭+30g/l蔗糖+3g/lagar,调整溶液ph=5.8。
s31恢复培养
在25℃黑暗条件下恢复培养一周,之后转移到环境温度25℃的12h/12h光周期环境中培养一周,最后统计萌发率。以相同处理条件下,未经超低温贮藏的胚轴为对照,20个一组,重复3次。
1.4组织培养试验方法
以超低温保存后恢复萌发的胚轴嫩茎为材料,开展组织培养研究,具体试验方法如下。
(1)基本培养基和激素正交试验
以wpm、ms、dkw等3种基本培养基和6-ba、naa、iba等3种激素浓度为主要因素设计3水平4因素正交实验,利用正交设计助手v3.1软件,设计正交实验如表1所示。每组接种15-20个茎段,重复3次,培养28天后调查生长情况。
表1基本培养基和激素正交试验设计
(2)激素浓度优化实验
根据正交实验结果,以dkw为基础培养基,优化部分激素的浓度梯度。所有实验每组接种15-20个茎段,重复3次,培养28d后调查生长情况。
①6-ba浓度梯度实验
表26-ba浓度梯度试验设计
②iba浓度梯度实验
表3iba浓度梯度试验设计
③ga3浓度梯度实验
表4ga3浓度梯度试验设计
(3)组培数据调查
培养28d后调查瓶苗分化率、出芽数量及出芽高度并计算平均出芽数和平均高度。其中:分化率=分化出芽的茎段数量/接种茎段总数,平均出芽数=出芽总数/接种茎段总数,平均高度=芽总高度/芽总数量。
2结果与分析
2.1胚轴超低温贮藏方法
本发明实施例重点从4个方面进行超低温贮藏方法的优化。(1)增加超低温贮藏前的上载处理,与之对应的增加超低温贮藏之后卸载处理。(2)调整了板栗胚轴超低温贮藏后的恢复萌发培养基,由原来改良的ms培养基,调整为改良的wpm培养基。(3)pvs2溶液配制和预处理进行了优化,优化为以wpm液体基础培养基为基础配制pvs2溶液,同时加入了冰浴处理过程。(4)将胚轴组织消毒过程提前,最大限度的降低表面消毒对胚轴的伤害。
图2为本发明实施例提供的一种不同含水量胚轴超低温贮藏萌发情况。经过超低温贮藏方法优化之后,结果如图2所示。随着胚轴含水量的降低,对照组板栗胚轴萌发率呈现逐渐下降趋势,从含水量30%降到含水量10%的过程中,对照组胚轴萌发率从95%,降低到40%,说明此时板栗胚轴由于脱水伤害,导致萌发活力逐渐下降。不同含水量胚轴超低温贮藏萌发结果显示,从含水量30%,降到含水量10%的过程中,胚轴萌发率从60%,降低到15%,随着含水量的降低,超低温贮藏后胚轴萌发率呈现逐渐下降趋势,这应该是板栗胚轴脱水伤害导致的结果。含水量30%的胚轴超低温贮藏后萌发率最高,为60.0%,导致这一现象的可能原因有三方面,一是加入上载液和卸载液,可以有效调节胚轴内部的水分状态,最大限度的降低超低温环境下的冷冻伤害;二是以蒸馏水为基质配制的pvs2玻璃化冷冻保护液效果低于以培养基为基质配制的pvs2,后者能够更好的使细胞在超低温条件下处于玻璃化状态;三是pvs2冰浴处理可以给胚轴低温锻炼,诱导细胞外结冰,从而降低原生质含水量,提高植物组织超低温耐性。
综上所述,使用优化后的超低温贮藏方法,不需要将胚轴含水量降至脱水临界含水量以下,就能够对板栗胚轴进行超低温贮藏,可避免板栗胚轴的脱水伤害和低温伤害,而且超低温贮藏之后萌发率相对较高,对板栗等顽拗性种子超低温贮藏研究具有重要的理论价值和应用价值。优化的超低温贮藏技术,将胚轴组织消毒步骤提前,可以最大限度的降低消毒过程对胚轴的伤害,但是消毒过程前置,对后续步骤无菌操作要求增加,因此需要尽量减少污染,避免发生胚轴染菌情况。
2.2基本培养基和激素筛选
根据极差结果分析,就分化率而言,基本培养基种类和naa浓度影响最大,显著性分析表明,二者差异均达到显著水平(p<0.05),最佳效果出现在基本培养基为wpm且naa浓度为0.2mg/l。出芽数结果显示,基本培养基仍然是影响最大的因素(极差=1.267),激素浓度影响相对较小,且不具有显著性差异,说明板栗胚轴外植体的出芽数主要和培养基种类有关,出芽数最高的组合为:ms+6-ba2mg/l+naa0.2mg/l,但在此处理下板栗幼苗玻璃化较严重。外植体高度极差结果显示,对平均高度影响最大的因素是基本培养基,但是没有达到显著水平,平均高度最高的组合为dkw+6-ba2mg/l+iba0.2mg/l,在实验中该组合平均高度达到1.17,dkw培养基对板栗胚轴外植体苗高生长促进效果显著。
根据正交实验的极差结果,发现基本培养基在分化率、平均出芽数、平均高度3个指标中极差都是最大的,说明在所有因素中,基本培养基给生长指标带来的影响最大,选择合适的基本培养基对板栗组培较为重要。实验中使用了3种培养基,其中wpm对提高分化率有最佳效果,使用ms培养基可以得到较高的平均出芽数,而在dkw培养基上芽的平均高度最大。实际培养过程中发现,板栗胚轴外植体在dkw培养基上,瓶苗生长茁壮,玻璃化较少,质量相对较高,继代培养效果好,因此在后续培养中使用dkw作为基本培养基,并在此基础上进行激素调整实验。从激素角度分析,6-ba对平均出芽数和平均高度有一定影响,但未达到显著水平,6-ba为2mg/l的时候效果最好,3个生长指标都达到峰值。naa的影响主要体现在分化率上,达到显著水平。iba对平均出芽数和平均高度的影响正好相反,随浓度升高平均出芽数呈下降趋势,平均高度呈上升趋势。因此,下一步将重点针对没有达到显著变化的6-ba和iba进一步优化激素浓度。
表5基本培养基和激素正交实验结果分析
2.3激素浓度优化
图3为本发明实施例提供的一种不同6-ba浓度对外植体生长的影响。在基本培养基和激素正交实验中,dkw培养基的6-ba浓度表现出不同的作用,6-ba浓度2mg/l时促进高度生长效果优于1mg/l的6-ba,但是分化率和出芽率低于1mg/l的6-ba,因此对6-ba的两种浓度重新进行比较,确定最佳浓度。结果显示(图3),当6-ba浓度为2mg/l时,分化率和平均出芽数较高,而平均高度较低。方差分析发现,6-ba浓度对平均出芽数的影响达到极显著水平(p<0.01),对于分化率和高度的影响不显著(p>0.05)。说明平均出芽数受6-ba浓度影响最大,而平均出芽数的多少直接影响了组培快繁效率,因此在胚轴幼苗组培快繁中选取2mg/l6-ba更合适。
图4为本发明实施例提供的一种不同iba浓度对外植体生长的影响,iba浓度对比结果显示(图4),平均出芽数受iba浓度影响最为明显,且随浓度升高呈递增趋势,对分化率和平均高度的影响较小,在iba浓度0.02mg/l时分化率最高(100%),iba为0mg/l时平均高度最高(1.24cm)。方差分析显示,iba对分化率和平均出芽数的影响都达到极显著水平(p<0.01)。平均出芽数最高的浓度为0.04mg/liba。
图5为本发明实施例提供的一种不同ga3浓度对外植体生长的影响。ga3对板栗种子解除休眠具有一定作用,本申请实施例对比了0mg/l和100mg/lga3培养基的作用效果(图5)。在两组对照中,添加ga3的实验组平均出芽数和平均高度明显偏低,可见100mg/lga3不利于芽的生长,但是可以提高分化率。综上所述,ga3能够提高组培茎段的分化率,同时出现了对芽的抑制作用。
综合上述实验结果,本品种板栗胚轴幼苗的组织培养最适培养基为dkw+6-ba2mg/l+naa0.2mg/l+iba0.04mg/l,可以同时保证组培苗的数量和质量,另外通过添加ga3可以提高分化率。
图6为本发明实施例提供的一种胚轴组织培养示意图,如图6所示,经本申请提供的板栗胚轴超低温保存方法、恢复培养方法以及板栗胚轴幼苗组织培养基培养后获得的板栗幼苗茁壮成长。
由于以上实施方式均是在其他方式之上引用结合进行说明,不同实施例之间均具有相同的部分,本说明书中各个实施例之间相同、相似的部分互相参见即可。在此不再详细阐述。
本领域技术人员在考虑说明书及实践这里发明的公开后,将容易想到本申请的其他实施方案。本申请旨在涵盖本发明的任何变型、用途或者适应性变化,这些变型、用途或者适应性变化遵循本申请的一般性原理并包括本申请未公开的本技术领域中的公知常识或惯用技术手段。说明书和实施例仅被视为示例性的,本申请的真正范围和精神由权利要求的内容指出。
以上的本申请实施方式并不构成对本申请保护范围的限定。
- 还没有人留言评论。精彩留言会获得点赞!