一种丝胶蛋白水凝胶及其制备方法和应用与流程
本发明涉及生物医用复合材料领域,尤其涉及一种丝胶蛋白水凝胶及其制备方法和应用。
背景技术:
丝胶蛋白(Silk Sericin)是包裹在丝素纤维表层的一种天然大分子蛋白。长期以来由于人们对丝胶蛋白认识的不足和研究的局限性,导致每年约有50,000吨丝胶在缫丝工业中被当作废物处理,浪费了大量宝贵的天然资源,并对环境造成了严重的污染。如果将废弃的丝胶蛋白回收作为绿色材料应用于组织工程与再生医学领域,将可能会带来巨大的社会经济效益和环保效益。
近年来,在组织工程领域,丝胶蛋白因其良好的生物活性如生物可降解性、低免疫原性、抗氧化性、细胞粘附性而越来越受到广泛的关注。目前,已经有研究团队将高温碱提法提取的丝胶蛋白与其他高分子材料如明胶、聚乙烯醇、羟甲基纤维素、聚丙烯酰胺等简单混合制备成薄膜、生物支架、混合凝胶等应用于组织工程领域。然而,目前丝胶制备成水凝胶形式最主要的方法还是将其简单的掺加入其他聚合物网络中而不是自主形成交联。这主要是因为要将蚕茧中的丝胶与丝素完全分离需要高温或者碱液等处理方法,这势必会导致丝胶蛋白的严重降解。这可能就是丝胶蛋白不能通过交联的方式形成凝胶的原因。
迄今为止,还没有高温或者碱提法提取的丝胶蛋白通过自主交联的方式制备成注射水凝胶的报道。
技术实现要素:
本发明提供一种丝胶蛋白水凝胶的制备方法,该方法通过将经酰肼修饰的丝胶蛋白溶液与氧化葡聚糖溶液混合即可制备具有良好的稳定性及机械性能的丝胶蛋白水凝胶,操作方法简便易行。
本发明还提供了一种丝胶蛋白水凝胶,有良好的生物降解性和生物相容性,作为药物载体搭载多种大分子和小分子药物,并可通过皮下注射或者肌肉注射的方式注入体内释放药物。
本发明还提供了所述丝胶蛋白水凝胶在荧光探针、药物载体,以及制备组织工程材料中的应用。
本发明还提供了一种丝胶蛋白水凝胶冻干支架,通过将所述的丝胶蛋白水凝胶置于零度以下冷冻、并真空干燥得到。
本发明还提供了所述的丝胶蛋白水凝胶冻干支架在组织工程中的应用。
本发明提供的一种丝胶蛋白水凝胶的制备方法,包括以下步骤:
1)提取丝胶蛋白,并将其制成粉末:
称取家蚕蚕茧,并将其剪成碎片,用水清洗,去除水分;
按每克蚕茧碎片加入10-50mL去离子水或10-50mL的0.01-0.2mol/L Na2CO3水溶液,然后在70-100℃条件下搅拌0.5-3小时,使丝胶蛋白溶解,得到丝胶蛋白溶液;
离心去除所述丝胶蛋白溶液中的不溶性物质,并透析丝胶蛋白溶液12~72小时,获得澄清丝胶蛋白溶液;
冻干该澄清丝胶蛋白溶液,得到丝胶蛋白粉末;
2)制备酰肼修饰的丝胶蛋白:
将步骤1)中得到的丝胶蛋白粉末以0.2-10g/mL比例溶解于30-200mL的二甲基亚砜中,再按照每克丝胶蛋白粉末加入0.1-2g的比例,添加N,N-羰基二咪唑反应1~3小时,得到丝胶蛋白的二甲基亚砜溶液;
同时将己二酸二酰肼以0.5-50g/mL比例溶于50-400mL二甲基亚砜中,得到己二酸二酰肼的二甲基亚砜溶液;
并按每克丝胶蛋白加入6-10g己二酸二酰肼,将所述己二酸二酰肼的二甲基亚砜溶液与所述丝胶蛋白的二甲基亚砜溶液混合,置于20~45℃下反应0.5~36小时,将反应液透析12~72小时,获得酰肼修饰的丝胶蛋白溶液,再经冻干得到酰肼修饰的丝胶蛋白粉末;或者
将步骤1)中得到的丝胶蛋白粉末以0.001-0.1g/mL比例溶解于100-1000mL的质量百分数为2%的2-吗啉乙磺酸溶液,再按照每克丝胶蛋白粉末加入8-10g的1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐及4-40g的N-羟基琥珀酰亚胺,室温搅拌12-24小时,得到丝胶蛋白反应液;将按照每升所述丝胶蛋白反应液加入2.5-25mL的比例,将质量百分数为85%的水合肼溶液滴加到所述丝胶蛋白反应液中,室温下反应12-24小时,将反应液透析12~72小时,获得酰肼修饰的丝胶蛋白溶液,再经冻干得到酰肼修饰的丝胶蛋白粉末;
3)制备氧化葡聚糖:
称取葡聚糖、高碘酸钠分别以0.1-0.8g/mL,0.01-0.2g/mL比例溶于10-50mL水中得到葡聚糖水溶液和高碘酸钠水溶液;
在冰浴下将10-50mL的高碘酸钠溶液缓慢滴加到10-50mL的葡聚糖水溶液中,4℃条件下避光反应1~24小时;
将反应液透析12~72小时,再经冻干得到氧化度为10-40%的氧化葡聚糖粉末;
4)制备酰肼修饰的丝胶蛋白溶液及氧化葡聚糖溶液
将步骤2)获得的酰肼修饰的丝胶蛋白粉末溶于蒸馏水中,制成浓度为50-400g/L酰肼修饰的丝胶蛋白溶液;将步骤3)获得的氧化葡聚糖粉末溶于蒸馏水中,制成浓度为5-500g/L氧化葡聚糖溶液;
5)按1:1-5的体积比将4)中得到的酰肼修饰的丝胶蛋白溶液与氧化葡聚糖溶液混合得到所述丝胶蛋白水凝胶。
进一步的,在本申请的方案中,所述酰肼修饰的丝胶蛋白溶液的浓度为0.2g/L。
更进一步的,所述氧化葡聚糖溶液的浓度为100-350g/L。
更进一步的,所述氧化葡聚糖的氧化度为10%-35%。
在本申请的方案中,酰肼修饰的丝胶蛋白溶液及氧化葡聚糖溶液的浓度容易控制,且可通过调控浓度控制凝胶的多种特性,如吸水膨胀,降解,药物释放等。
进一步的,在本发明的方案中,所述葡聚糖的分子量为40-120kDa。
更进一步的,步骤1)中的透析使用截留分子量为8~14kDa的透析袋进行。
更进一步的,步骤2)和3)中的透析使用截留分子量为3.5kDa的透析袋进行。
本发明还提供了一种丝胶蛋白水凝胶的制备方法,包括以下步骤:
1)提取丝胶蛋白,并将其制成粉末:
称取家蚕蚕茧,并将其剪成碎片,用水清洗,去除水分;
按每克蚕茧碎片加入10-50mL去离子水或10-50mL的0.01-0.2mol/L Na2CO3水溶液,然后在70-100℃条件下搅拌0.5-3小时,使丝胶蛋白溶解,得到丝胶蛋白溶液;
离心去除所述丝胶蛋白溶液中的不溶性物质,并透析丝胶蛋白溶液12~72小时,获得澄清丝胶蛋白溶液;
冻干该澄清丝胶蛋白溶液,得到丝胶蛋白粉末;
2)制备酰肼修饰的丝胶蛋白:
将步骤1)中得到的丝胶蛋白粉末以0.2-10g/mL比例溶解于30-200mL的二甲基亚砜中,再按照每克丝胶蛋白粉末加入0.1-2g的比例,添加N,N-羰基二咪唑反应1~3小时,得到丝胶蛋白的二甲基亚砜溶液;
同时将己二酸二酰肼以0.5-50g/mL比例溶于50-400mL二甲基亚砜中,得到己二酸二酰肼的二甲基亚砜溶液;
并按每克丝胶蛋白加入6-10g己二酸二酰肼,将所述己二酸二酰肼的二甲基亚砜溶液与所述丝胶蛋白的二甲基亚砜溶液混合,置于20~45℃下反应0.5~36小时,将反应液透析12~72小时,获得酰肼修饰的丝胶蛋白溶液,再经冻干得到酰肼修饰的丝胶蛋白粉末;或者
将步骤1)中得到的丝胶蛋白粉末以0.001-0.1g/mL比例溶解于100-1000mL的质量百分数为2%的2-吗啉乙磺酸溶液,再按照每克丝胶蛋白粉末加入8-10g的1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐及4-40g的N-羟基琥珀酰亚胺,室温搅拌12-24小时,得到丝胶蛋白反应液;将按照每升所述丝胶蛋白反应液加入2.5-25mL的比例,将质量百分数为85%的水合肼溶液滴加到所述丝胶蛋白反应液中,室温下反应12-24小时,将反应液透析12~72小时,获得酰肼修饰的丝胶蛋白溶液,再经冻干得到酰肼修饰的丝胶蛋白粉末;
3)制备酰肼修饰的丝胶蛋白溶液
将步骤2)获得的酰肼修饰的丝胶蛋白粉末溶于蒸馏水中,制成浓度为50-400g/L酰肼修饰的丝胶蛋白溶液;
4)按6:1-3:1的体积将3)中得到的酰肼修饰的丝胶蛋白溶液与浓度为10g/L的京尼平水溶液混合制得所述丝胶蛋白水凝胶。
本发明还提供了一种丝胶蛋白水凝胶的制备方法,包括以下步骤:
1)提取丝胶蛋白,并将其制成粉末:
称取家蚕蚕茧,并将其剪成碎片,用水清洗,去除水分;
按每克蚕茧碎片加入10-50mL去离子水或10-50mL的0.01-0.2mol/L Na2CO3水溶液,然后在70-100℃条件下搅拌0.5-3小时,使丝胶蛋白溶解,得到丝胶蛋白溶液;
离心去除所述丝胶蛋白溶液中的不溶性物质,并透析丝胶蛋白溶液12~72小时,获得澄清丝胶蛋白溶液;
冻干该澄清丝胶蛋白溶液,得到丝胶蛋白粉末;
2)制备酰肼修饰的丝胶蛋白:
将步骤1)中得到的丝胶蛋白粉末以0.2-10g/mL比例溶解于30-200mL的二甲基亚砜中,再按照每克丝胶蛋白粉末加入0.1-2g的比例,添加N,N-羰基二咪唑反应1~3小时,得到丝胶蛋白的二甲基亚砜溶液;
同时将己二酸二酰肼以0.5-50g/mL比例溶于50-400mL二甲基亚砜中,得到己二酸二酰肼的二甲基亚砜溶液;
并按每克丝胶蛋白加入6-10g己二酸二酰肼,将所述己二酸二酰肼的二甲基亚砜溶液与所述丝胶蛋白的二甲基亚砜溶液混合,置于20~45℃下反应0.5~36小时,将反应液透析12~72小时,获得酰肼修饰的丝胶蛋白溶液,再经冻干得到酰肼修饰的丝胶蛋白粉末;或者
将步骤1)中得到的丝胶蛋白粉末以0.001-0.1g/mL比例溶解于100-1000mL的质量百分数为2%的2-吗啉乙磺酸溶液,再按照每克丝胶蛋白粉末加入8-10g的1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐及4-40g的N-羟基琥珀酰亚胺,室温搅拌12-24小时,得到丝胶蛋白反应液;将按照每升所述丝胶蛋白反应液加入2.5-25mL的比例,将质量百分数为85%的水合肼溶液滴加到所述丝胶蛋白反应液中,室温下反应12-24小时,将反应液透析12~72小时,获得酰肼修饰的丝胶蛋白溶液,再经冻干得到酰肼修饰的丝胶蛋白粉末;
3)制备酰肼修饰的丝胶蛋白溶液
将步骤2)获得的酰肼修饰的丝胶蛋白粉末溶于蒸馏水中,制成浓度为50-400g/L酰肼修饰的丝胶蛋白溶液;
7)按100:1-5的体积将3)中得到的酰肼修饰的丝胶蛋白溶液与250g/L的戊二醛水溶液混合制得所述丝胶蛋白水凝胶。
本发明提供的一种丝胶蛋白水凝胶,由所述制备方法制成。
进一步的,本发明还提供了所述的丝胶蛋白水凝胶在制备荧光探针中的应用。
更进一步的,本发明还提供了所述丝胶蛋白水凝胶在制备药物载体中的应用。
更进一步的,本发明还提供了所述丝胶蛋白水凝胶在制备组织工程材料中的应用。所述组织工程材料例如可以是用于皮肤修复的凝胶、生物胶水。
本发明还提供了一种丝胶蛋白水凝胶冻干支架的制备方法,通过将所述的丝胶蛋白水凝胶置于零度以下冷冻、并真空干燥得到。该方法制成的丝胶蛋白水凝胶冻干支架可作为组织工程生物支架使用。
在本发明的方案中,所述从家蚕为野生型家蚕。
本发明还提供过了一种丝胶蛋白水凝胶药物制剂,包括所述的丝胶蛋白水凝胶,以及用于杀伤肿瘤的化疗药。
进一步的,所述化疗药为阿霉素。更进一步的,所述丝胶蛋白水凝胶药物制剂为单位制剂。所述单位制剂中丝胶蛋白水凝胶的量为200μL,所述阿霉素的量为100μg。在本申请的方案中,所述单位制剂为满足对一只小鼠一次给药所需有效成分的制剂,如一单位(针)针剂等。
本发明还提供过了一种用于伤口愈合的药物制剂,包括所述的丝胶蛋白水凝胶,以及伤口愈合用敷料。进一步的,所述伤口愈合用敷料为多爱肤。
本发明的方案具有以下优点:
1)本发明以野生型家蚕蚕茧作为原料,采用高温碱液法提取并通过酰肼修饰获得了其中丝胶蛋白保留了良好的天然特性的丝胶蛋白溶液,该溶液可通过简单过滤的方式进行灭菌;并通过冷冻干燥的方式制备成粉末状长期保存。
2)本发明首次将酰肼修饰的丝胶蛋白与氧化葡聚糖等天然高分子化合物交联制作水凝胶,操作方法简便易行。并获得了具有良好的生物降解性和生物相容性,可作为药物载体搭载多种大分子和小分子药物的水凝胶。
3)本发明提供的丝胶蛋白水凝胶可通过调整酰肼修饰的丝胶蛋白溶液、氧化葡聚糖溶液的浓度及温度调控凝胶速度(可根据需要实现原位成胶)。
4)本发明的丝胶蛋白水凝胶作为药物载体,可通过皮下注射或者肌肉注射的方式注入体内释放药物,并可通过调整酰肼修饰的丝胶蛋白溶液、氧化葡聚糖溶液的浓度控制有效控制大分子和小分子药物的释放速度,有效的解决了药物暴释的问题,并可搭载抗肿瘤药物有效抑制肿瘤的生长。
5)本发明丝胶蛋白水凝胶具有荧光特性,可以通过荧光监测凝胶的降解以及药物的释放。
6)本发明的丝胶水凝胶具有良好的皮肤修复功能。
7)本发明的丝胶水凝胶经可经冷冻干燥得到不同孔径和尺寸的丝胶蛋白水凝胶支架,可用于制备多种组织损伤修复材料。
附图说明
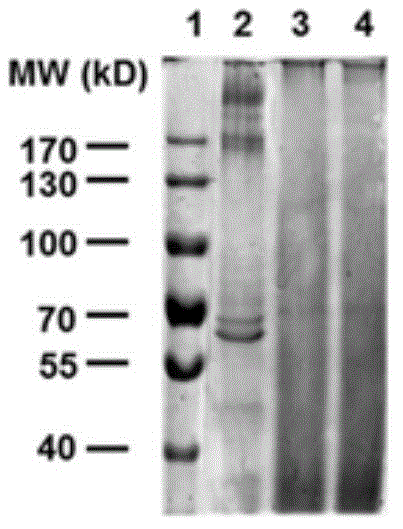
图1A为溴化锂提取的丝素缺陷型丝胶蛋白(2)、碳酸钠提取丝胶蛋白(3)、酰肼修饰的丝胶蛋白(4)的SDS-PAGE电泳图谱。
图1B为丝胶蛋白、酰肼修饰的丝胶蛋白及丝胶蛋白水凝胶SDH-2的红外光谱。
图1C为葡聚糖及氧化葡聚糖DEX-AL-3红外光谱图。
图1D为葡聚糖及氧化葡聚糖DEX-AL-3核磁共振图谱。
图2A为丝胶蛋白水凝胶(SDH-1、SDH-2、SDH-3)在不同温度条件下凝胶时间柱状图。
图2B为丝胶蛋白水凝胶(SDH-1、SDH-2、SDH-3)在不同pH环境下的最大吸水膨胀率(37℃)柱状图。
图2C为丝胶蛋白水凝胶(SDH-1、SDH-2、SDH-3)流变性能图。
图3为扫描电子显微镜下观察到的不同浓度丝胶蛋白水凝胶冻干产物内部结构图。
图4为丝胶蛋白水凝胶(SDH-1、SDH-2、SDH-3)在不同pH值PBS中的降解率(37℃)曲线图
图5为人正常肝细胞(HL7702)、小鼠肌细胞(C2C12)丝胶蛋白水凝胶细胞毒性检测统计柱状图。
图6A为丝胶蛋白水凝胶(SDH-1、SDH-2、SDH-3)体外HRP释放曲线图。
图6B为丝胶蛋白水凝胶(SDH-1、SDH-2、SDH-3)体外阿霉素DOX释放曲线图。
图7A为碳酸钠高温提取的丝胶蛋白荧光光谱。图7B为酰肼修饰的丝胶蛋白荧光光谱。
图7C、7D、7E为丝胶蛋白水凝胶荧光光谱。
图7F、7G为激光共聚焦显微镜下观察到的丝胶蛋白水凝胶(SDH-1、SDH-2、SDH-3)冻干产物图.
图8A为丝胶蛋白水凝胶注射入C57BL/6J小鼠背部皮下小动物成像图。
图8B为丝胶蛋白水凝胶搭载阿霉素注射入C57BL/6J小鼠背部皮下不同时间点小动物成像图(绿色-丝胶蛋白水凝胶(SDH-2),红色-阿霉素(DOX))。
图8C为丝胶蛋白水凝胶搭载阿霉素注射入C57BL/6J小鼠背部皮下不同时间点阿霉素(DOX)荧光强度变化曲线图。
图8D为丝胶蛋白水凝胶体内不同时间点降解与荧光变化图。
图8E为丝胶蛋白水凝胶体内降解率与荧光强度相关性分析图。
图9A为丝胶蛋白水凝胶搭载阿霉素抑制黑色素瘤C57BL/6J小鼠肿瘤大小图。
图9B为丝胶蛋白水凝胶搭载阿霉素抑制黑色素瘤C57BL/6J小鼠体重变化图。
图9C为丝胶蛋白水凝胶搭载阿霉素抑制黑色素瘤C57BL/6J小鼠生存期图。
图9D为丝胶蛋白水凝胶搭载阿霉素抑制黑色素瘤C57BL/6J小鼠肿瘤大小实物图(治疗后第14天)。
图9E为丝胶蛋白水凝胶搭载阿霉素抑制黑色素瘤C57BL/6J小鼠肿瘤石蜡包埋H&E染色图(治疗后第14天)。
图9F为丝胶蛋白水凝胶搭载阿霉素抑制黑色素瘤C57BL/6J小鼠肿瘤石蜡包埋TUNEL荧光染色图(治疗后第14天)。
图10为丝胶蛋白水凝胶修复C57BL/6J小鼠烫伤不同时间点伤口尺寸统计图,多爱肤为商业化伤口敷料,作为对照。
具体实施方式
实施例1本发明提供的丝胶蛋白水凝胶的制备
蚕茧的选择:
选用野生型家蚕蚕茧(中国农业科学院蚕业研究所提供),主要的化学成分为:丝胶蛋白和丝素。
步骤1)、提取丝胶蛋白,并将其制成粉末
1.称取野生型家蚕蚕茧(100g剪成1cm2的碎片,后置于洁净的烧杯中,用超纯水清洗3次,3500rpm离心5分钟去除水分;
2.向步骤1中得到的蚕茧碎片中加入3~4L的摩尔浓度为0.02mol/L的Na2CO3溶液或3~4L的去离子水,将该烧杯放入恒温水浴锅内100℃水浴1h,使丝胶蛋白溶解,得到丝胶蛋白溶液;
3.将步骤2得到溶液转入离心管内3500rpm离心5分钟,去除不溶性物质,得到已离心的溶液;
4.将步骤3中的已离心的溶液转入到预处理好的透析袋(截留分子量:8-14kDa)中,将装有已离心的丝胶液的透析袋两端用透析袋夹子夹紧,放置含有ddH2O的烧杯中;将该烧杯置于搅拌器上慢速搅拌透析,每隔3小时换一次水,共透析72小时,获得澄清丝胶蛋白溶液;
5.可选的,再将澄清丝胶液转到离心管中,3500rpm离心5分钟,去除沉淀;
6.将丝胶液置于冷冻干燥机中冻干成丝胶蛋白粉末;
7.将丝胶蛋白粉末置于-20℃冰箱保存备用。
步骤2)、制备酰肼修饰的丝胶蛋白
1.称取丝胶蛋白粉末6g在35℃条件下溶解于30mL二甲基亚砜中;
2.再将4.3gN,N-羰基二咪唑加入到1)中,反应1~3小时,得到丝胶蛋白的二甲基亚砜溶液;
3.称取己二酸二酰肼54g在45℃条件下溶解于100mL二甲基亚砜中,得到己二酸二酰肼的二甲基亚砜溶液;
4.并按每克丝胶蛋白加入6-10g己二酸二酰肼,将所述己二酸二酰肼的二甲基亚砜溶液与所述丝胶蛋白的二甲基亚砜溶液混合,置于20~45℃下充分反应0.5~36小时;
5.将步骤4中的反应液转入到预处理好的透析袋(截留分子量:3500Da)中,将装有丝胶液的透析袋两端用透析袋夹子夹紧,放置含有ddH2O的烧杯中;将该烧杯置于搅拌器上慢速搅拌透析,每隔3小时换一次水,共透析48小时;
6.将步骤5中所得到的酰肼修饰的丝胶蛋白溶液置于冷冻干燥机中冻干成酰肼修饰的丝胶蛋白粉末,置于-20℃冰箱保存备用。
步骤3)、制备氧化葡聚糖
1.称取10g相对分子量为40kDa的葡聚糖溶解于50mLddH2O中;
2.称取2.64g的NaIO4溶解于20mLddH2O中;
3.将NaIO4水溶液在冰浴条件下缓慢滴加到氧化葡聚糖水溶液中,后置于-4℃冰箱中充分反应24小时;
4.将步骤3中的溶液转移入到透析袋中(3500Da),将该透析袋放置于含有ddH2O的烧杯中;将该烧杯置于搅拌器上慢速搅拌透析,每隔3小时换一次水,共透析48小时;
5.将氧化葡聚糖水溶液置于冷冻干燥机中冻干成氧化葡聚糖粉末,置于-20℃冰箱保存;
6.采用氧化还原滴定法测得制成的氧化葡聚糖的氧化度为35%。
步骤4)制备酰肼修饰的丝胶蛋白溶液及氧化葡聚糖溶液
1.将酰肼修饰的丝蛋白粉末溶解于ddH2O中,浓度调整到200g/L左右,得到的酰肼修饰的丝胶蛋白溶液;
2.将氧化葡聚糖粉末溶解于ddH2O中,浓度调整到100g/L左右,得到氧化葡聚糖溶液。
步骤5)丝胶蛋白水凝胶的制备
将4)中的每1mL的所述酰肼修饰的丝胶蛋白溶液中加入1mL的氧化葡聚糖溶液;充分搅拌混匀后分别置于4℃、25℃、37℃下,得到丝胶蛋白水凝胶SDH-1。
实施例2本发明提供的丝胶蛋白水凝胶的制备
本实施例中丝胶液制备方法与实施例1的制备方法相同,不同之处在于,步骤4)和步骤5)按照以下进行:
1.将酰肼修饰的丝蛋白粉末溶解于ddH2O中,浓度调整到200g/L左右,得到的酰肼修饰的丝胶蛋白溶液;
2.将氧化葡聚糖粉末溶解于ddH2O中,浓度调整到200g/L左右,得到氧化葡聚糖溶液;
3.每1mL丝胶蛋白溶液中加入5mL氧化葡聚糖溶液;
4.充分搅拌混匀后分别置于4℃、25℃、37℃下,得到丝胶蛋白水凝胶SDH-2。
实施例3本发明提供的丝胶蛋白水凝胶的制备
本实施例中丝胶蛋白水凝胶的制备方法与实施例1的制备方法不同之处在于,步骤4)和步骤5)按照以下进行:
1.将酰肼修饰的丝蛋白粉末溶解于ddH2O中,浓度调整到200g/L左右,得到的酰肼修饰的丝胶蛋白溶液;
2.将氧化葡聚糖粉末溶解于ddH2O中,浓度调整到350g/L左右,得到氧化葡聚糖溶液;
3.每1mL丝胶蛋白溶液中加入1mL氧化葡聚糖溶液;
4.充分搅拌混匀后分别置于4℃、25℃、37℃下,得到丝胶蛋白水凝胶SDH-3。
实施例3-1
丝胶蛋白水凝胶冻干支架的制备
将25℃获得的到丝胶蛋白水凝胶SDH-1,SDH-2,SDH-3迅速置于-80℃,冷冻24h后取出;将样品置于冷冻真空干燥机中干燥(根据样品大小确定适宜的干燥时间),得到三种不同孔径丝胶冻干支架,孔径分别为128nm、47.1nm、10.4nm。
实施例4本发明提供的丝胶蛋白水凝胶的制备
本实施例中丝胶蛋白水凝胶的制备方法与实施例1的制备方法不同之处在于,步骤3)按照以下进行:
1.称取10g相对分子量为40kDa的葡聚糖溶解于50mLddH2O中;
2.称取0.66g的NaIO4溶解于10mLddH2O中;
3.将NaIO4水溶液在冰浴条件下缓慢滴加到氧化葡聚糖水溶液中,后置于-40℃冰箱中充分反应24小时;
4.将步骤3中的溶液转移入到透析袋中(3500Da),将该透析袋放置于含有ddH2O的烧杯中;将该烧杯置于搅拌器上慢速搅拌透析,每隔3小时换一次水,共透析48小时;
5.将氧化葡聚糖水溶液置于冷冻干燥机中冻干成氧化葡聚糖粉末,置于-200℃冰箱保存;制成的氧化葡聚糖采用氧化还原滴定法测得氧化度为10%。
再按照实施例1方法制成水凝胶,其性能参数经检测与SDH-1,SDH-2,SDH-3相似。
申请人还利用不同的葡聚糖与高碘酸钠配比制成氧化度在10-40%的氧化葡聚糖及其参数:
表1
a商品化葡聚糖分子量为(Mw)为40kDa.
实施例5本发明提供的丝胶蛋白水凝胶的制备
本实施例中丝胶蛋白水凝胶的制备方法与实施例1的制备方法不同之处在于,步骤2)按照以下进行:
1.称取丝胶蛋白粉末1g在35℃条件下溶解于1L质量百分数为2%的2-吗啉乙磺酸溶液中;
2.向步骤1溶液中加入8g 1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐及4-40g N-羟基琥珀酰亚胺,室温搅拌24小时,得到丝胶蛋白反应液;
3.向步骤2的丝胶蛋白反应液中滴加2.5ml质量百分数为85%的水合肼溶液,室温下充分反应24小时。
4.将步骤3中的溶液转入到预处理好的透析袋(3500Da)中,将装有丝胶液的透析袋两端用透析袋夹子夹紧,放置含有ddH2O的烧杯中;将该烧杯置于搅拌器上慢速搅拌透析,每隔3小时换一次水,共透析48小时;
6.将步骤4中所得到的酰肼修饰的丝胶蛋白溶液置于冷冻干燥机中冻干成酰肼修饰丝胶蛋白粉末,置于-20℃冰箱保存备用。
再按照实施例1方法制成水凝胶,其性能参数经检测与SDH-1,SDH-2,SDH-3相似。
实施例6本发明提供的丝胶蛋白水凝胶的制备
本实施例中丝胶蛋白水凝胶的制备方法与实施例1的制备方法不同之处在于,步骤4)和步骤5)按照以下进行:
1.将酰肼修饰的丝蛋白粉末溶解于ddH2O中,浓度调整到200g/L左右,得到的酰肼修饰的丝胶蛋白溶液;
2.每1mL丝胶蛋白溶液中加入10~50μL戊二醛水溶液(250g/L);
3.充分搅拌混匀后分别置于25℃下,得到淡黄色丝胶蛋白水凝胶。
实施例7本发明提供的丝胶蛋白水凝胶的制备
本实施例中丝胶蛋白水凝胶的制备方法与实施例1的制备方法不同之处在于,步骤4)和步骤5)按照以下进行:
1.将酰肼修饰的丝蛋白粉末溶解于ddH2O中,浓度调整到200g/L左右,得到的酰肼修饰的丝胶蛋白溶液;
2.将京尼平粉末溶解于ddH2O中,浓度调整到10g/L左右,得到京尼平溶液;
2.每1mL~1.8mL丝胶蛋白溶液中加入300μL京尼平水溶液;
3.充分搅拌混匀后分别置于4℃下,得到深蓝色丝胶蛋白水凝胶。
实施例6和实施例7提供的丝胶蛋白水凝胶,有较好的生物相容性,可用于组织工程与再生医学领域,而未经修饰的丝胶蛋白不能形成水凝胶。
实施例8丝胶蛋白、酰肼修饰的丝胶蛋白、丝胶蛋白水凝胶、以及所述丝胶蛋白水凝胶冻干支架的表征测试
图1A为现有技术使用溴化锂从丝素缺陷型蚕茧提取的丝胶蛋白、本申请实施例1步骤1)制成的碳酸钠提取的丝胶蛋白、实施例1步骤2)制成的酰肼修饰的丝胶蛋白的SDS-PAGE电泳图谱。
分别将实施例1中步骤1)、2)制成的碳酸钠提取的丝胶蛋白,以及酰肼修饰的丝胶蛋白,与现有技术使用溴化锂从丝素缺陷型蚕茧提取的丝胶蛋白通过SDS-PAGE电泳进行分析,结果见图1A。其中1为标准带(marker),2为溴化锂提取丝素缺陷型蚕茧提取的丝胶蛋白,3为碳酸钠提取的丝胶蛋白,4为酰肼修饰的丝胶蛋白。与溴化锂提取的丝素缺陷型丝胶蛋白相比,碳酸钠提取的丝胶蛋白、酰肼修饰的丝胶蛋白均主要为弥散型,但经过酰肼修饰后弥散型的丝胶蛋白也可制备成水凝胶。
图1B为实施例1步骤2)制成的酰肼修饰的丝胶蛋白(Sericin-ADH),步骤1)制成的丝胶蛋白(Sericin)、以及实施例2步骤5)制成的丝胶蛋白水凝胶(SDH-2)的红外光谱图。
利用傅里叶变换红外光谱仪(Nexus,Thermal Nicolet,USA)测定丝胶蛋白、酰肼修饰过的丝胶蛋白及丝胶蛋白水凝胶在4000–650cm-1的特征峰。
如图1B所示:从特征峰酰胺Ⅰ、酰胺Ⅱ、酰胺Ⅲ可以看出,丝胶蛋白(Sericin)、酰肼修饰的丝胶蛋白(Sericin-ADH),丝胶蛋白水凝胶(SDH-2)的红外光谱图谱基本相同,表明丝胶蛋白水凝胶(SDH-2)中的多肽二级结构与纯丝胶蛋白相似,丝胶蛋白水凝胶(SDH-2)能很好的维持丝胶蛋白的天然构象。
图1C为实施例1中步骤3)制成的葡聚糖(Dextran)与氧化葡聚糖(DEX-Al-3)的核磁共振图谱。
由图1C可以看出,在位移为5.0-6.0之间出现的峰为氧化葡聚糖(DEX-Al-3)上所接的羰基峰,证明已成功制备氧化葡聚糖。
图1D为葡聚糖及氧化葡聚糖红外光谱图。
利用傅里叶变换红外光谱仪(Nexus,Thermal Nicolet,USA)测定丝胶蛋白水凝胶在4000–650cm-1的特征峰。
如图1D所示:氧化葡聚糖(DEX-AL-3)红外图谱上在1729处有一峰,此峰为醛基上的-C=O-伸缩振动峰,而在葡聚糖的红外图谱上无此峰,说明葡聚糖经氧化其分子上的羟基变成了醛基,葡聚糖变成了氧化葡聚糖;另外从图谱上还可以看出,氧化葡聚糖除上述醛基上的-C=O-伸缩振动峰外,其他的峰基本与葡聚糖的红外吸收峰一致,说明葡聚糖分子上的羟基只有一部分变成了醛基。
图2A为实施例1-3制成的丝胶蛋白水凝胶SDH-1、SDH-2、SDH-3在不同温度条件下凝胶时间柱状图。
该丝胶蛋白水凝胶由酰肼修饰的丝胶蛋白与氧化葡聚糖(氧化度为35%,浓度分别为100g/L,200g/L,350g/L)在4℃、25℃和37℃下按体积比(1︰1)制备,观察并记录其交联时间。
如图2A所示,随着氧化葡聚糖浓度的升高,所需的交联时间越短;随着温度的升高,所需要的交联时间越短。说明通过控制氧化葡聚糖浓度及温度调节成胶时间,可利用该性质将该水凝胶制备成可注射型水凝胶。并且该注射型水凝胶作为药物载体可克服大多数注射型水凝胶注入体内易扩散的确定,并可减少药物初期的暴释。
图2B为实施例1-3制成的丝胶蛋白水凝胶SDH-1、SDH-2、SDH-3在不同pH环境下的最大吸水膨胀率(37℃)柱状图。
上述吸水膨胀率通过将丝胶蛋白水凝胶冻干、称重、浸泡于三种不用pH值(pH 6.0、pH 7.4、pH 11.0)的PBS溶液中,在不同时间点,取出按以下公式测定。(其中Ws为膨胀状态下的重量,Wd为干重)。
如图2B所示:SDH-1丝胶蛋白水凝胶在pH 6.0、pH 7.4及pH 11.0的环境下,最大的膨胀率可分别达到5.3倍、9.1倍、9.3倍;SDH-2丝胶蛋白水凝胶在pH 6.0、pH 7.4及pH 11.0的环境下,最大的膨胀率可分别达到4.2倍、7.3倍、7.7倍;SDH-3丝胶蛋白水凝胶在pH 6.0、pH 7.4及pH 11.0的环境下,最大的膨胀率可分别达到3.7倍、6.2倍、6.5倍。表明该丝胶蛋白水凝胶有很好的吸水性能,并且该水凝胶的吸水性能可通过控制氧化葡聚糖的浓度调节。
图2C为实施例1-3制成的丝胶蛋白水凝胶SDH-1、SDH-2、SDH-3流变性能图。
如图2C所示,当G’>G”时,说明丝胶蛋白已经变成凝胶。氧化葡聚糖浓度为350g/L,200g/L和100g/L的丝胶蛋白水凝胶的凝胶时间分别为:5秒、145秒和618秒左右。最大弹性模量分别为:2218Pa、1355Pa、369Pa。最大粘性模量分别为:487.5Pa、351.2Pa、62.29Pa。表明该丝胶蛋白水凝胶有很好的弹性粘性性能,并且该水凝胶的弹性粘性性能可通过控制氧化葡聚糖的浓度调节。
图3为扫描电子显微镜下观察到的不同浓度丝胶蛋白水凝胶冻干产物内部结构图。
如图3所示:具有不同氧化葡聚糖浓度(100g/L,200g/L,350g/L)的丝胶蛋白水凝胶SDH-1(A)、SDH-2(B)、SDH-3(C)的冻干产物在扫描电子显微镜下观察内部存在大量孔洞结构。
表3为不同浓度丝胶蛋白水凝胶冻干产物孔径与孔隙率统计表
如表3所示:具有不同氧化葡聚糖浓度(100g/L,200g/L,350g/L的丝胶水凝胶冻干产物孔径分别约为128.83±34.88μm,47.13±27.77μm,和10.41±4.83μm。此外,经统计计算三种具有不同氧化葡聚糖浓度(100g/L,200g/L,350g/L)的丝胶蛋白水凝胶冻干产物的孔隙率分别为81.06±0.46、76.58±4.00、73.82±3.28。表明丝胶蛋白水凝胶冻干产物孔径及孔隙率可通过调节氧化葡聚糖浓度调控。并且该丝胶蛋白水凝胶内部的孔洞结构是作为药物载体的有力条件。
图4为丝胶蛋白水凝胶(SDH-1、SDH-2、SDH-3)在不同pH值PBS中的降解(37℃)曲线图。
对于测试pH环境对降解的影响,将丝胶蛋白水凝胶浸泡于不同pH值(pH 6.0、pH 7.4、pH 11.0)的PBS溶液中,在不同时间点,取出PBS烘干称重,结果见图4。
如图4所示,丝胶蛋白水凝胶在第1天内迅速降解,在7天后丝胶蛋白水凝胶逐渐开始缓慢降解,水凝胶降解具有pH响应性。其中在pH 11.0条件下,丝胶蛋白水凝胶(SDH-1、SDH-2、SDH-3)降解速率最快,在65天即可基本完全降解;而降解速率最慢的为pH 6.0,丝胶蛋白水凝胶(SDH-1、SDH-2、SDH-3)65天降解率分别为40.58%、43.45%、38.14%。
实施例9丝胶蛋白水凝胶体外生物相容性测试
一、实验过程
1.首先使用DMEM高糖培养基,在37℃,在5%的CO2,100%湿度情况下对人肝脏细胞HL7702、小鼠成肌细胞C2C12培养24小时,将从细胞培养瓶收集的人肝脏细胞HL7702、小鼠成肌细胞C2C12使用培养基重新悬浮、吹散后,种植于96孔板中,每孔细胞数目约为8000;
2.接着将丝胶蛋白水凝胶(SDH-1、SDH-2、SDH-3)铺于含有细胞的96孔板中,设置丝胶蛋白水凝胶添加量相比于细胞培养基分别为4g/L、8g/L、16g/L、32g/L、64g/L,每种浓度每种质量的丝胶蛋白水凝胶各种三孔平行样;
3.接下来孵育48小时;
4.48小时后向3中每孔加入10μL CCK-8共孵育1小时;
5.利用酶标仪测量其在490nm和630nm的吸光度值。
二、实验分析
1.丝胶蛋白水凝胶(SDH-1、SDH-2、SDH-3)对HL7702、C2C12细胞毒性的测试:如图5所示,丝胶蛋白水凝胶(SDH-1、SDH-2、SDH-3)对HL7702、C2C12细胞基本没有毒性,细胞存活率(即细胞活力)基本都保持在90%左右;
2.实验结果证明,该丝胶蛋白水凝胶有较好的生物相容性。
实施例10丝胶蛋白水凝胶作为大分子药物HRP控释载体
一、实验过程
1.取4μL辣根过氧化物酶(HRP)溶液(2μg/μL)与150μL酰肼修饰的丝胶蛋白液(200g/L)混合;
2.向1中加入体积比150μL的氧化葡聚糖(浓度分别为100g/L,200g/L,350g/L),室温放置0.5小时,后放入4℃冰箱放置24小时;
3.在样品中加入PBS(pH 7.4)2mL置于37℃;
4.在第0.5、1、2、3、4、6、8、12、19、24、30、40、50天,小心取出清液,并重新加入1mL PBS(pH 7.4);
5.采用酶联免疫法(ELISA)测量上清液中HRP的含量,通过计算各个时间点上清液中累计的HRP含量与实际载药量的比值即得到累计释放率。
二、实验分析
丝胶蛋白水凝胶HRP释放分析
将辣根过氧化物酶(HRP)溶液与酰肼修饰的丝胶蛋白液按体积比2/75混合,加入与酰肼修饰的丝胶蛋白液等体积的氧化度为35%的氧化葡聚糖溶液(浓度100g/L,200g/L,350g/L),室温放置0.5小时,后放入4℃冰箱放置24小时,在样品中加入PBS(pH 7.4)置于37℃。在相应时间点,小心收集上清液,并重新加入PBS(pH 7.4),采用酶联免疫法(ELISA)测量收集到的上清液中的HRP的含量,通过计算各个时间点上清液中累计的HRP含量与实际载药量的比值即得到累计释放率。
如图6A所示:丝胶蛋白水凝胶对大分子蛋白质药物(HRP)有良好的控释作用,可通过调节氧化葡聚糖的浓度调控释药速度,是良好的大分子蛋白质药物载体材料。
实施例11丝胶蛋白水凝胶作为小分子抗肿瘤药物阿霉素控释载体
一、实验过程
1.取6μL阿霉素(DOX)溶液(20μg/μL)与150μL酰肼修饰的丝胶蛋白液(20%,g/L)混合;
2.向1中加入体积比150μL的氧化葡聚糖(浓度分别为100g/L,200g/L,350g/L),室温放置0.5小时,后放入4℃冰箱放置24小时;
3.在样品中加入PBS(pH 7.4)1mL置于37℃;
4.在第0.5、1、2、3、4、7、10、15、22、32、42天,小心取出清液,并重新加入1mL PBS(pH 7.4);
5.使用Nanodrop测量上清液吸光度值,通过标准曲线计算各个时间点上清液中累计的阿霉素含量,将得到的数值与实际载药量的比值即得到累计释放率。
二、实验分析
丝胶蛋白水凝胶阿霉素释放分析
将阿霉素(DOX)溶液与酰肼修饰的丝胶蛋白液按体积比1/50混合,加入与酰肼修饰的丝胶蛋白液等体积的氧化度为35%的氧化葡聚糖溶液(浓度100g/L,200g/L,350g/L),室温放置0.5小时,后放入4℃冰箱放置24小时,在样品中加入PBS(pH 7.4)置于37℃。在相应时间点,小心收集上清液,并重新加入PBS(pH 7.4),使用Nanodrop测量上清液吸光度值,通过标准曲线计算各个时间点上清液中累计的阿霉素含量,将得到的数值与实际载药量的比值即得到累计释放率
如图6B所示:丝胶蛋白水凝胶对小分子化学药物良好的控释作用,可通过调节氧化葡聚糖的浓度调控小分子化学药物的释放速度,是良好的小分子化学药物载体材料。
实施例12丝胶蛋白水凝胶体外荧光特性
一、丝胶蛋白荧光特性测试
1.分别取冻干的碳酸钠提取的丝胶蛋白粉末及酰肼修饰的丝胶蛋白粉末各100μg用水配制成浓度为100μg/mL的丝胶蛋白溶液;
2.利用荧光光谱测试仪测试1中丝胶蛋白溶液从320nm~600nm的荧光光谱。
二、丝胶蛋白水凝胶(SDH-1、SDH-2、SDH-3)荧光特性的测试
1.分别取丝胶蛋白水凝胶(SDH-1、SDH-2、SDH-3)各100μL,制备成丝胶蛋白水凝胶膜;
2.利用荧光光谱测试仪测试1中丝胶蛋白水凝胶(SDH-1、SDH-2、SDH-3)从320nm~600nm的荧光光谱。
三、丝胶蛋白水凝胶(SDH-1、SDH-2、SDH-3)冻干产物激光共聚焦测试
1.制备丝胶蛋白水凝胶(SDH-1、SDH-2、SDH-3)经冻干后得到冻干产物;
2.利用激光共聚焦显微镜观察丝胶蛋白水凝胶(SDH-1、SDH-2、SDH-3)的冻干产物。
五、实验分析
1.如图7A、7B所示,酰肼修饰过后的丝胶蛋白与碳酸钠提取的丝胶蛋白相比,荧光光谱并没有发生明显的变化,说明酰肼修饰对丝胶蛋白的荧光特性并没有显著影响;
2.如图7C、7D、7E所示,丝胶蛋白水凝胶与丝胶蛋白及酰肼修饰过的丝胶蛋白相比荧光光谱并没有发生明显的变化,说明丝胶蛋白水凝胶仍然保持了丝胶蛋白的荧光特性;
3.如图7F、7G所示,激光共聚焦结果表明丝胶蛋白水凝胶冻干产物仍然保持了丝胶的荧光特性。
实施例13丝胶蛋白水凝胶体内荧光特性
一、丝胶蛋白水凝胶(SDH-1、SDH-2、SDH-3)小鼠体内荧光测试
1.将丝胶蛋白水凝胶(SDH-1、SDH-2、SDH-3)各200μL通过注射的方式注射到C57BL/6J小鼠的背部;
2.利用小动物成像仪观察其在激发光为420nm,发射光为520nm的荧光。
二、丝胶蛋白水凝胶小鼠体内释放阿霉素荧光示踪测试
1.取2μL阿霉素(DOX)溶液(20μg/μL)与100μL酰肼修饰的丝胶蛋白液(200g/L)混合;
2.向1中加入体积比100μL的氧化葡聚糖(浓度为200g/L),通过注射的方式注射到C57BL/6J小鼠体皮下;
3.使用小动物成像仪对该C57BL/6J小鼠在第1第0、2、4、8、12、18天进行测试。
三、实验分析
1.如图8A所示,小动物成像结果表明丝胶蛋白水凝胶(SDH-1、SDH-2、SDH-3)在C57BL/6J小鼠体内仍旧保持了其荧光的特性,可利用其荧光的特性进行体内药物控释的示踪。
2.如图8B、8C所示,可通过该丝胶蛋白水凝胶的荧光特性定位药物载体在体内的具体方位,并通过检测阿霉素的荧光强度监控药物在体内的释放情况。
实施例14
一、丝胶蛋白水凝胶荧光特性监测体内降解
1.制备丝胶蛋白水凝胶(SDH-2)各200μL通过注射的方式注射到C57BL/6J小鼠的背部;
2.在第4、8、12、16、22、40、70天小心取出小鼠背部的凝胶,将该凝胶冻干称重。
二、实验分析
如图8D、8E所示,该丝胶蛋白水凝胶与其在体内的降解情况有较强关联性,可通过监测该丝胶蛋白水凝胶的荧光强度了解其在体内的降解情况。
实施例15
一、丝胶蛋白水凝胶搭载阿霉素(DOX)抑制黑色素瘤
1.通过注射的方式将0.2mL包含2×105B16F10小鼠黑色素瘤细胞的PBS溶液注射到C57BL/6J小鼠背部;
2.当肿瘤长到30~40mm2时,将小鼠(每只体重25g)随机分为四组,分别为:SDH-2+DOX组;SDH-2组;DOX组;PBS组;
3.通过注射的方式将SDH-2(200μL/只小鼠体重)+DOX(4mg/kg小鼠体重);SDH-2(200μL);DOX(4mg/kg);PBS(200μL)注射到肿瘤附近;
4.每隔1天检测小鼠的肿瘤大小,记录生存期及体重;
5.于第15天,四组随机选取小鼠一只,切出肿瘤观察大小,并将该肿瘤组织石蜡包埋,切片进行H&E、TUNEL染色。
二、实验分析
1.如图9A所示,SDH-2+DOX组肿瘤大小明显小于其他三组,说明该丝胶蛋白水凝胶搭载阿霉素可明显抑制黑色素瘤;
2.如图9B所示,四组小鼠体重没有明显的变化,说明该丝胶蛋白水凝胶搭载阿霉素无明显毒副作用;
3.如图9C所示,SDH-2+DOX组生存期明显长于其他三组,说明该丝胶蛋白水凝胶搭载阿霉素可明显抑制黑色素瘤;
4.如图9D所示,第15天时,SDH-2+DOX组肿瘤大小明显小于其他三组,说明该丝胶蛋白水凝胶搭载阿霉素可明显抑制黑色素瘤;
5.如图9E所示,SDH-2+DOX组细胞凋亡程度明显大于其他三组,说明该丝胶蛋白水凝胶搭载阿霉素可明显抑制黑色素瘤;
6.如图9F所示,SDH-2+DOX组细胞凋亡程度明显大于其他三组,说明该丝胶蛋白水凝胶搭载阿霉素可明显抑制黑色素瘤。
综上,相比于单独施用DOX组,或者单独施用SDH-2组,本申请的丝胶蛋白水凝胶搭载阿霉素(SDH-2+DOX)组具有显著增强的抑制黑色素瘤的能力
实施例16
一、丝胶蛋白水凝胶应用于组织修复
1.将底面直径为1cm2圆柱形不锈钢柱浸入100℃水中10分钟;
2.将1中圆柱取出按压至C57BL/6J小鼠背部5秒;
3.将2中C57BL/6J小鼠随机分为两组:多爱肤(Duoderm)组,多爱肤+SDH-2组;
4.于第三天将2中C57BL/6J小鼠背部烫伤皮肤剪去,敷上多爱肤+SDH-2;
5.将步骤4作为治疗起始点,于治疗后第7、14、21天观察伤口恢复情况。
二、实验分析
1.如图10所示,多爱肤+SDH-2组C57BL/6J小鼠伤口尺寸在第7、14天较多爱肤(Duoderm)组小。说明本申请的丝胶蛋白水凝胶与多爱肤同时使用较单独的商业化的多爱肤敷料具有显著提高的伤口修复效果。
- 还没有人留言评论。精彩留言会获得点赞!