以PDIA4蛋白作为糖尿病的诊断、监测及治疗的目标的制作方法
本发明有关以Pdia4作为糖尿病治疗目标的作用及用途。
背景技术:
现今的抗糖尿病药剂,包括胰岛素敏化剂、胰岛素释放剂、α-葡萄糖苷酶抑制剂、肠促胰泌素(incretin)系药物(GLP-1类似物及二肽基胜肽酶第4型抑制剂)、SGLT2抑制剂等,已发展成可经由不同机制控制葡萄糖稳态。然而,上述治疗药剂仅可改进第二型糖尿病(T2D)症状,但无法逆转病症。人体及动物研究证据显示,T2D的特征为功能性β细胞量减少,其无法适应胰岛素分泌以补偿逐渐升高的胰岛素抗性,致使发展成T2D(图1)。临床前及临床试验数据显示,β细胞功能及量持续下降,导致发展成T2D。已有累积的数据显示,此减少情况可经稳定化、推迟及甚而逆转,尤其是在糖尿病早期阶段,这提高了一种可能性,即保留功能性β细胞量为预防及治疗T2D所不可或缺。然而,纵使TZDs及GLP-1类似物经报告于临床前动物研究中能预防β细胞萎缩,但目前尚无抗糖尿病药物于临床上经证实能有效保留β细胞量及功能。
蛋白质双硫键异构酶(protein disulfide isomerases;PDIs)家族对哺乳类动物的发育及疾病起重要作用。人体中有九个PDI成员,其含有1至3个CGHC活性位点。于九个人类PDIs中,Pdia-4为唯一具3个CGHC模体(motif)的PDI成员。Pdia-4基因功能对胰脏β细胞的细胞生长及存活能力目前未知,更不用说其对糖尿病的作用。
技术实现要素:
本发明有关于一种发现,即Pdia4对β细胞的表达可因反应于代谢应激(metabolic stress)而向上调节。糖尿病动物血中Pdia4增加。此外,Pdia4负向调控β细胞功能。反之,减少Pdia4可保护β细胞。Pdia4于小鼠模式中使糖尿病发展加剧。令人意外地,藉由Pdia4抑制/消除而保留β细胞连同藉由胰岛素敏化剂二甲双胍(metformin,甲福明)及二甲双胍/罗格列酮(rosiglitazone)而减少胰岛素抗性的组合,于临床前试验中可逆转糖尿病及减少糖尿病并发症。
一方面,本发明有关一种治疗有效量的Pdia4抑制剂的用途,以制造用于预防、缓解及/或治疗有需求的个体的糖尿病及/或糖尿病相关并发症的药剂,其中Pdia4抑制剂抑制Pdia4蛋白活性及/或抑制Pdia4蛋白表达,且其中Pdia4抑制剂的用途不含使用式(I)化合物:
其中,
R为H或COCH2COOH;
m=3或4;
n=0或1;
o=2;以及
p=1或2。
在本发明的一具体实施方式中,Pdia4抑制剂选自
及
另一方面,本发明有关一种治疗有效量的Pdia4抑制剂及治疗有效量的其他抗糖尿病药剂的用途,用于制造组合疗法的药剂,以预防、缓解、治疗有需求的个体的糖尿病及/或糖尿病相关并发症,及/或逆转糖尿病,其中Pdia4抑制剂抑制Pdia4蛋白活性及/或抑制Pdia4蛋白表达。在本文提及的本发明具体实施方式中,Pdia4抑制剂的用途可包含式(I)化合物的使用:
其中,
R为H或COCH2COOH;
m=3或4;
n=0或1;
o=2;以及
p=1或2。
在本发明的另一具体实施方式中,Pdia4抑制剂选自
及
的化合物。
在本发明的另一具体实施方式中,Pdia4抑制剂抑制Pdia4蛋白表达,且选自反义分子、三螺旋分子、核糖核酸酶及shRNA。
在本发明的另一具体实施方式中,Pdia4抑制剂抑制Pdia4蛋白活性,且选自抗Pdia4抗体、类萜及多炔。
在本发明的另一具体实施方式中,多炔是式(II)化合物:
其中R1为H、C1-C10烷基、C2-C10烯基、C2-C10炔基、C3-C20环烷基、C3-C20环烯基、C1-C20杂环烷基、C1-C20杂环烯基、芳基或杂芳基;
R2为H或单糖残基;R3为H或C1-C10烷基;m为2、3或4;n为0、1、2或3;o为0、1、2、3或4;以及p为1、2、3或4。
在本发明的另一具体实施方式中,多炔是式(I)化合物:
其中,
R为H或COCH2COOH;
m=3或4;
n=0或1;
o=2;以及
p=1或2。
在本发明的另一具体实施方式中,式(I)化合物选自
及
在本发明的另一具体实施方式中,化合物为聚多炔糖苷。
类萜可为二类萜,其选自12-O-乙酰基-8,14-二羟基-17-甲基-3-乙酰甲胺磷甲苯磺酰基乙酸(12-O-acetyl-8,14-dihydroxy-17-methyl-3-orthenthosyletienicacid)、8,14-二羟基-12-O-(4,5-二甲基己酰基)-17-甲基-3-乙酰甲胺磷甲苯磺酰基孕甾烯醇酮(8,14-dihydroxy-12-O-(4,5-dimethylhexanoyl)-17-methyl-3-orthenthosylpregnen olone)及12-O-桂皮酰基-8,14-二羟基-17-甲基-3-乙酰甲胺磷甲苯磺酰基乙酸(12-O-cinnamoyl-8,14-dihydroxy-17-methyl-3-orthenthosyletienic acid)。
在本发明的另一具体实施方式中,个体患有第二型糖尿病。
在本发明的另一具体实施方式中,其他抗糖尿病药剂是胰岛素敏化剂。
在本发明的另一具体实施方式中,shRNA包含核苷酸序列,其选自SEQ ID NOs:1-4。
抗糖尿病药剂可选自胰岛素敏化剂(双胍、PPARγ促效剂)、类升糖素胜肽第一型(GLP-1)类似物、DPPV抑制剂、钠/葡萄糖共运输蛋白第二型(SGLT2)抑制剂、β-葡萄糖苷酶抑制剂、胰淀素(amylin)类似物、胆酸螫合剂及多巴胺促效剂。
糖尿病相关并发症包括眼部疾病、心血管疾病、肾脏疾病及足部溃疡。
或者,本发明有关一种治疗有效量的Pdia4抑制剂,用于预防、缓解及/或治疗有需求的个体的糖尿病及/或糖尿病相关并发症,其中Pdia4抑制剂抑制Pdia4蛋白活性及/或抑制Pdia4蛋白表达,且其中Pdia4抑制剂不含式(I)化合物:
其中,
R为H或COCH2COOH;
m=3或4;
n=0或1;
o=2;以及
p=1或2。
或者,本发明有关一种预防、缓解及/或治疗有需求的个体的糖尿病及/或糖尿病相关并发症的方法,其包含:投予个体治疗有效量的Pdia4抑制剂,以缓解及/或治疗个体的糖尿病,其中Pdia4抑制剂抑制Pdia4蛋白活性及/或抑制Pdia4蛋白表达,且其中Pdia4抑制剂不含式(I)化合物:
其中,
R为H或COCH2COOH;
m=3或4;
n=0或1;
o=2;以及
p=1或2。
或者,本发明有关治疗有效量的Pdia4抑制剂及其他抗糖尿病药剂,用于组合疗法,以预防、缓解及治疗有需求的个体的糖尿病及糖尿病相关并发症,及/或逆转糖尿病,其中Pdia4抑制剂抑制Pdia4蛋白活性及/或抑制Pdia4蛋白表达。
或者,本发明有关一种方法,用于预防、缓解及治疗有需求的个体的糖尿病及/或糖尿病相关并发症,及/或逆转糖尿病,其包含:以组合疗法投予个体治疗有效量的Pdia4抑制剂及其他抗糖尿病药剂,以缓解、治疗个体的糖尿病及糖尿病相关并发症,及/或逆转糖尿病,其中Pdia4抑制剂抑制Pdia4蛋白活性及/或抑制Pdia4蛋白表达。
另一方面,本发明有关一种诊断、治疗及监测糖尿病的方法,其包含:
(a)量化个体血中Pdia4蛋白浓度;
(b)当个体血中Pdia4蛋白浓度高于正常对照组个体时,将该个体鉴定为糖尿病患者;
(c)给予该鉴定为糖尿病患者的个体抗糖尿病药剂;
(d)于投予该鉴定为糖尿病患者的个体抗糖尿病药剂后,进一步量化血中Pdia4蛋白浓度;以及
(e)相较于投予抗糖尿病药剂前的情况,当血中Pdia4蛋白浓度减少时,确定该个体于投予抗糖尿病药剂后显示糖尿病的改善。
在本发明的一具体实施方式中,抗糖尿病药剂包含Pdia4抑制剂。
此外,另一方面,本发明有关一种筛选Pdia4抑制剂及/或抗糖尿病药剂的方法,其包含:
(a)于投予糖尿病动物测试化合物前或后,量化糖尿病动物的血中Pdia4蛋白浓度;以及
(b)当糖尿病动物于投予测试化合物后血中Pdia4蛋白浓度减少时,鉴定该测试化合物为Pdia4抑制剂及/或抗糖尿病药剂;或者
(i)于存在及不存在测试化合物下,测定Pdia4蛋白活性;以及
(ii)当于测试化合物存在下Pdia4蛋白活性减少时,鉴定该测试化合物为Pdia4抑制剂及/或抗糖尿病药剂,
其中Pdia4抑制剂抑制Pdia4蛋白活性或抑制Pdia4蛋白表达。
此外,另一方面,本发明有关一种筛选Pdia4抑制剂的方法,其包含:
(i)于测试化合物的存在及不存在下,其是于缓冲溶液中经鉴定,将减少的BPTI培养于GST-Pdia4;
(ii)于测试化合物的存在及不存在下,其是于步骤(c)的缓冲溶液中经鉴定,测定减少的BPTI的量;以及
(iii)鉴定测试化合物为Pida4抑制剂。
又,另一方面,本发明有关一种治疗个体糖尿病前期或糖尿病的方法,其包含:(a)投予个体治疗有效量的Pdia4抑制剂;(b)于投予至个体后,藉监测血中葡萄糖或胰岛素浓度,及/或胰脏β细胞功能及量一段时间而鉴定个体的糖尿病前期或糖尿病为Pdia4抑制反应性,其中血中葡萄糖或胰岛素浓度的改进,及/或胰脏β细胞功能及/或量的维持,则该个体的糖尿病前期或糖尿病被鉴定为Pdia4抑制反应性;以及(c)进一步投予Pdia4抑制剂或不同的Pdia4抑制剂至个体。
本发明的彼等及其他方面将因下列较佳具体实施方式并结合附图说明而显见,虽然可能进行变化及改良,但不背离本发明新颖概念的精神及范畴。
附图说明本发明的一或多个具体实施方式,连同书面说明,一并阐述本发明的原理。尽可能,贯穿附图使用相同组件符号,以指称具体实施方式的相同或类似组件。
附图说明
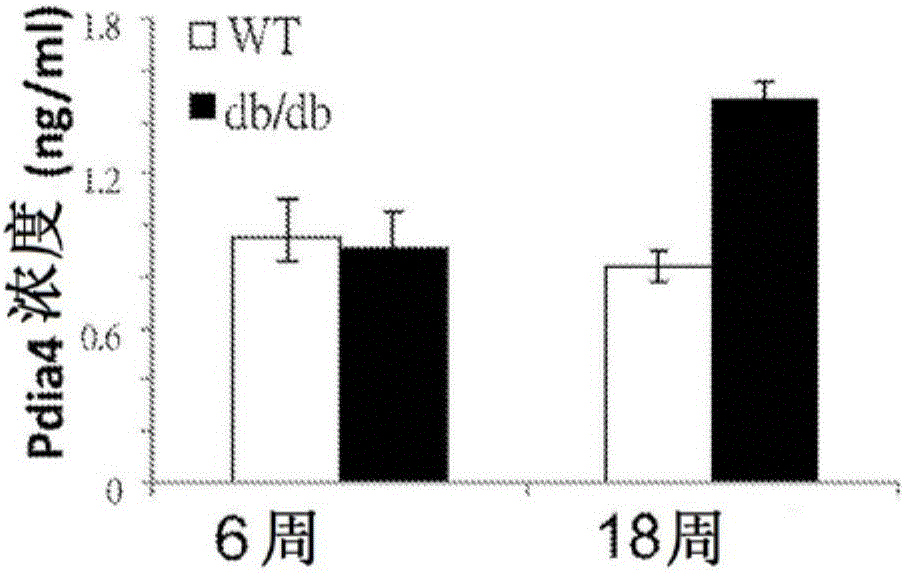
图1A-C显示Pdia4蛋白于β细胞、血液及其他组织中的浓度。(A)小鼠胰岛是以指示浓度的葡萄糖处理48小时。以总溶解产物进行SDS-PAGE,并以指示抗体进行蛋白质印迹法。(B)非糖尿病(WT)及糖尿病db/db小鼠的血清Pdia4蛋白浓度,其分别以ELISA试剂盒及抗Pdia4抗体量化。(C)收集不同小鼠组织,并分析Pdia4蛋白浓度。蛋白质印迹法的结果列于图1B。结果以平均值±SEM表示,其取自3次独立实验。*P<0.05;**P<0.01;***P<0.001。
图2A-D显示β细胞的Pdia4蛋白浓度响应代谢应激而向上调节。(A-C)Min-6细胞,一种β细胞株,以指示浓度的葡萄糖(A)、棕榈酸盐(B)及STZ(C)处理48小时。以总溶解产物进行SDS-PAGE,并以抗Pdia4或肌动蛋白抗体进行蛋白质印迹法。(D)将无糖尿病野生型(WT)及糖尿病leprdb/db小鼠的胰脏胰岛分离及溶解,接着以抗Pdia4及抗肌动蛋白抗体进行蛋白质印迹法。结果以平均值±SEM表示,其取自3次独立实验。*P<0.05;**P<0.01;***P<0.001。
图3A-C显示Pdia4缺乏可增加β细胞功能及胰岛保护。(A)野生型(WT)及pdia4-/-小鼠胰岛以指示剂量的葡萄糖(3.3mM与16.7mM)刺激30分钟。测定上清液的胰岛素浓度。(B)野生型(WT)及pdia4-/-小鼠接受80mg/kg体重(BW)的STZ单一腹腔(i.p.)注射。于牺牲后,以相对二羟基乙锭荧光及胰岛尺寸测定小鼠胰岛的活性氧为(ROS)浓度。(C)野生型(WT)及pdia4-/-小鼠接受80mg/kg体重(BW)的三剂STZ。移除小鼠胰腺,并以抗胰岛素抗体及苏木精与曙红(H&E)染色。确定胰岛面积,是依据胰岛型态,藉组织化学染色显示。数据以平均值±SEM表示。*P<0.05;**P<0.01。
图4A-F显示于化学诱发性及自发性糖尿病模式中,Pdia4缺乏可抑制糖尿病发展。(A-B)与图3C相同的小鼠的空腹血糖(FBG,A部分)及进食后血糖(PPBG,B部分),其是于指示年龄以血糖计测定。(C-D)以标准饮食喂食野生型(WT)、pdia4-/-、leprdb/db及pdia4-/-leprdb/db小鼠。测定小鼠空腹血糖(FBG,C部分)及进食后血糖(PPBG,D部分),其是于指示年龄以血糖计测定。(E-F)根据公式HOMA-β=20×胰岛素(μU/mL)/〔葡萄糖(mmol/L)–3.5〕取得图4C小鼠的HOMA-β(E)。(F)以TUNEL试验量化与图4C相同的小鼠的死亡细胞数。小鼠数目(n)是表示于括号内。WT是*P<0.05;leprdb/db是#P<0.05。
图5A-C显示Pdia4缺乏/抑制及胰岛素敏化剂的组合可逆转糖尿病。(A)leprdb/db及pdia4-/-leprdb/db小鼠每日接受PBS载剂(Veh)、二甲双胍(MET,60mg/kg BW)及二甲双胍(MET,60mg/kg BW)/罗格列酮(ROS,20mg/kg BW)的剂量。以血糖计测定其进食后血糖。(B)藉聚多炔糖苷(cytopiloyne)抑制GST-Pdia4的双硫键异构酶活性。减少的BPTI是于载剂、GST-Pdia4或GST-Pdia4存在下培养于氧化还原缓冲液,其中含不同剂量的CP。GST-Pdia4的酶活性以减少的BPTI的减少百分比呈现。(C)leprdb/db小鼠每日接受PBS载剂(Veh)、聚多炔糖苷(CP,2.5mg/kg)、聚多炔糖苷(CP,2.5mg/kg)/二甲双胍(MET,60mg/kg BW)及聚多炔糖苷(CP,2.5mg/kg)/二甲双胍(MET,60mg/kg BW)/罗格列酮(Ros,20mg/kg BW)的剂量。以血糖计测定其进食后血糖。
图6A-E显示于糖尿病小鼠模式,Pdia4缺乏可减少糖尿病相关并发症。(A)六周大野生型(WT)及pdia4-/-小鼠连续3天接受腹腔注射PBS或STZ(80mg/kg BW/天)。四周后,小鼠接受全身X光分析。其中显示小鼠骨密度,且箭头代表股骨及膝关节。(B-C)六周大野生型(WT)及pdia4-/-小鼠分别以皮肤穿孔器及氢氧化钠于皮肤(B)及角膜(C)产生伤口。其中显示指定时间点的伤口影像。(D)收集及测定leprdb/db及pdia4-/-leprdb/db小鼠于30周龄的尿液样本。其中显示肌酸酐清除率(creatinine clearance ratio;CCR)。(E)收集及测定leprdb/db及pdia4-/-leprdb/db小鼠于46周龄的血液样本。其中显示三酸甘油酯及高密度脂蛋白(HDL)的浓度。
图7A-E显示以Pdia4抑制剂的虚拟筛选及化学结构筛选及鉴定Pdia4抑制剂。Pdia4活性结构域用于筛选Pdia4抑制剂。(A)Pdia4活性结构域与CP结合的结构。(B-D)Pdia4活性结构域与化合物00322271(B)、00547011(C)及00244418(D)结合的结构。Pdia4活性结构域及化合物分别以绿色及棕色表示。(E)与Pdia4活性结构域最适化的萜炔类结构。
图8A-C分别说明一些经鉴定的Pdia4抑制剂的化学结构(A)、其生物活性(B)及相对抑制作用(%)(C)。Pdia4(缩写成A4)于存在及不存在Pdia4抑制剂(109291、156588、156590、302308及CP)下培养于其受质胰岛素。
具体实施方式
定义
本说明书所使用的术语一般而言具有其于本领域、本发明全文中及使用各术语的特定上下文中的普通涵义。用于说明本发明的特定术语是讨论如下或本说明书的他处,以提供执行人额外的指导关于本发明的说明。为方便起见,可使用如斜体及/或引号凸显特定术语。使用凸显方式不会影响术语的范畴及意义;无论是否经凸显,相同上下文的术语的范畴及意义相同。应理解到,可以一种以上的方式描述相同事物。因此,本文所论及的术语的任一者或多者可使用另一语言及同义词,且其非以任何特殊意义替代,不论本文所阐述或论及的术语为何。本文提供特定术语的同义词。一或多个同义词的声明并未排除使用其他同义词。本说明书中随处使用的实例是仅用于阐述,该实例包括本文所论及的任何术语的实例,且不以任何方式局限本发明或任何示例性术语的范畴及意义。同样地,本发明未局限于本说明书给定的各具体实施方式。
除非另有定义,本文使用的所有技术性及科学性术语具本发明所属领域的技术人员能普遍理解的相同意义。于冲突情况下,将以本文件,包括定义为基准。
本文所使用的“约略”、“约”或“大约”等词一般应指介于一给定数值或范围的20百分比内,较佳为介于10百分比内,且更佳为介于5百分比内。本文给定的数字量皆为近似值,是指若无明文规定时,可以“约略”、“约”或“大约”等词推断。
“治疗”或“处理”等词是指投予一有效量的治疗剂至有需求的个体,其目的在于治愈、缓解、舒缓、治疗、改善或预防该疾病、其症状或其倾向。该个体可由健康照护专业人员界定,其是基于任何适用诊断方法的结果。
“有效量”是指需赋予治疗效果予待处理个体所需的活性药剂量。有效剂量将可变,如本领域技术人员的理解,其取决于投予途径、赋形剂使用及与其他治疗共同使用的可能性。
Pdia4意指蛋白质双硫键异构酶A家族第4成员。人类Pdia4蛋白序列如SEQ ID NO:5所示。shRNAs序列的实例如SEQ ID NOs:1-4所示。
由美国保健与服务部食品药物管理局出版的“Guidance for Industry and Reviewers Estimating the Safe Starting Dose in Clinical Trials for Therapeutics in Adult Healthy Volunteers”揭示“人体等效剂量”可取自下列公式的计算:
HED=动物剂量(mg/kg)×(动物体重(kg)/人类体重(kg))0.33。
目前关于Pdia4对糖尿病的作用仍不明。本发明有关发现Pdia4表达以反应代谢应激。本发明亦有关发现Pdia4对β细胞功能及量的作用。本发明进一步有关发现Pdia4缺乏/抑制与胰岛素敏化剂的组合对T2D发展的影响。本发明亦有关发现Pdia4对T2D并发症的作用。Pdia4的表达是因反应于代谢应激而向上调节,该代谢应激如高剂量的葡萄糖、脂质及化学物质。相对于无糖尿病小鼠,糖尿病小鼠血中Pdia4增加。如此,使得Pdia4可作为糖尿病诊断的良好指标。同时,Pdia4消除减少糖尿病并发症,如骨质疏松、皮肤溃疡、眼部疾病、肾脏疾病、及心血管疾病。此外,Pdia4可用于筛选及鉴定Pdia4抑制剂为抗糖尿病药剂。
相较于现有技术,本发明的独特特征及优势如下:(1)无报告指出糖尿病与Pdia4的间有关联;(2)现已发现,糖尿病小鼠β细胞及血液的Pdia4表达量向上调节;(2)现亦发现,Pdia4是位于细胞核、细胞质及细胞膜部位。本发明的商业上应用包括但不局限于,以Pdia4作为糖尿病诊断标记、以Pdia4作为抗糖尿病治疗目标;以及以目标Pdia4单独地及结合其他抗糖尿病药物以预防及治疗糖尿病。
实施例
未意图局限本发明的范畴,本发明具体实施例的示例性仪器、装置、方法及其相关结果描述如下。应注意到,标题或子标题可用于实例以方便读者,其不应以任何方式局限本发明的范畴。此外,本文提出及揭示特定理论;然而,不论对错,其不应以任何方式局限本发明的范畴,只要该发明根据本发明实施,且不考虑任何特定理论或作用机制。
研究设计及方法
试剂、细胞及动物
链佐霉素(Streptozotocin;STZ)、葡萄糖、棕榈酸盐、二羟基乙锭(DHE)、二甲双胍及罗格列酮购自Sigma-Aldrich。苏木精购自Biocare Medical Inc.。曙红购自Muto Pure Chem Inc.。MIN6细胞,一种小鼠β细胞株,培养于RPMI-1640(Invitrogen),内含20%FBS及5%青霉素/链霉素。细胞培养于37℃的5%CO2潮湿环境。C57BL/6及leprdb/m小鼠购自Jackson laboratory。欲产生pdia4-/-C57BL/6小鼠,首先以细菌人工染色体(BAC)重组策略构筑Pdia4基因目标载体。简言之,一230-kb BAC殖株(Geneservice,USA)含有所指小鼠pdia4基因的完整等位基因。Neo基因匣,其由二同源臂、二loxP位点及Neo基因组成,是经由同源重组插入BAC的pdia4基因的内含子6。于首个Neo基因匣藉Cre弹出后,第二个Neo基因匣,内含二同源臂、二frt位点、一loxP位点及Neo基因,是经由同源重组插入BAC的pdia4基因的内含子2。于线性化后,此BAC构筑体是经电穿孔进入C57BL/6ES细胞。于重组筛选后,选取经目标的ES是以进行胚囊注射,且反过来,产生嵌合体小鼠。欲产生pdia4-/-小鼠,嵌合体小鼠是首先以C57BL/6小鼠配种,以取得pdia4floxed/+小鼠,接着同型育种。随后,pdia4floxed/floxed小鼠是与EIIa/Cre清除子小鼠交配,以取得pdia4+/-小鼠,其外显子3至6是清除。pdia4+/-小鼠同型交配产生野生型(pdia4+/+)、pdia4+/-及pdia4-/-小鼠,接着以PCR及蛋白质印迹法进行基因型分析。此外,pdia4-/-小鼠是以leprdb/m小鼠育种,以取得pdia4-/-leprdb/db小鼠。所有动物皆自由取得饮食及水,且于21-23℃的动物机构设施维持12小时明亮-12小时黑暗的周期。所有的小鼠作业皆根据中央研究院机构动物照护及使用的准则处理。
药物投予及代谢参数测定
欲清除小鼠胰脏β细胞,6周大WT及pdia4-/-C57BL/6小鼠是以80mg/kgSTZ连续腹腔注射3天。此外,部份WT及pdia4-/-小鼠是接受食盐水以作为载剂对照组。欲测定空腹血糖浓度,于STZ的最终投予后,小鼠禁食整夜。隔天,小鼠自由取用饮食2小时,接着移去饮食。于0.5小时后,测定进食后血糖及胰岛素的浓度。于STZ的最终注射后,于第0、3、5、7、9、11及13天监测血糖浓度。糖尿病性高血糖症是定义为于二或多个连续测试中,空腹血糖浓度≧200mg/dl。欲处理leprdb/db小鼠,于指定时间喂食PBS或结合聚多炔糖苷(2.5mg/kg/天)、二甲双胍(60mg/kg/天)及二甲双胍(60mg/kg/天)加上罗格列酮(20mg/kg/天)。测定进食后血糖。欲处理pdia4-/-leprdb/db小鼠,于指定时间喂食PBS、二甲双胍(60mg/kg/天)及二甲双胍(60mg/kg/天)加上罗格列酮(20mg/kg/天)。测定进食后血糖。
细胞凋亡试验
进行末端脱氧核苷酸基转移酶dUTP链裂端标签化(TUNEL)试验,其使用ApopTag原位细胞凋亡检测试剂盒(Millipore)。TUNEL阳性细胞是以Axio Vision显微镜(Carl Zeiss)拍照,并由影像手动计数。利用Axio Vision程序(Carl Zeiss)测量胰岛面积。
测定葡萄糖及胰岛素
于空腹整夜后,小鼠自由取用饮食2小时。以Elite血糖计(Bayer)测定小鼠空腹或进食后血糖浓度。以ELISA试验(Mercodia)测定血液样本或小鼠胰岛上清液的胰岛素浓度。
测定ROS产生
二羟基乙锭(DHE)是反应于超氧阴离子,形成红色荧光产物乙锭,其是插入DNA。胰脏冷冻切片或小鼠胰岛是于37℃下培养于10μM DHE中10分钟。于ddH2O清洗三次后,以Axio Vision荧光显微镜(Carl Zeiss)观察乙锭染色情形。以Axio Vision程序(Carl Zeiss)量化胰脏胰岛细胞的荧光强度。
分离胰脏胰岛及测定胰岛素分泌
将十八周大的小鼠禁食整夜。以胶原蛋白酶P(Roche)分解作用分解其胰腺,并以histopaque-1077(Sigma)梯度离心法收取。胰脏胰岛(5胰岛/孔)是于基础葡萄糖(3.3mM)或高葡萄糖(16.7mM)存在下培养于克雷布斯-林格碳酸氢盐(Krebs-Ringer bicarbonate;KRB)缓冲液中30分钟。收集上清液,进行胰岛素ELISA试验。
蛋白质印迹法分析
MIN6细胞或小鼠胰岛于RPMI无葡萄糖培养基中饥饿1小时。随后,细胞或胰岛以指定的葡萄糖浓度处理48小时。于高脂处理方面,细胞或胰岛随后以载剂或0.4mM棕榈酸盐(含有5.6mM葡萄糖及0.92%BSA)处理48小时。于STZ处理方面,细胞或胰岛随后于指定时间以载剂或10mM STZ处理。于充分清洗后,以裂解缓冲液(10mM Tris-HCl pH 7.4、10mM KCl、1.5mM MgCl2、250mM蔗糖、1mM EDTA、1mM EGTA、1%NP-40及1X蛋白酶抑制剂)裂解细胞或小鼠胰岛。于离心后,将总溶解产物进行SDS-PAGE,并将蛋白转移至PVDF薄膜。于阻断后,以指定的抗体探测薄膜。
基于牛胰脏胰蛋白酶抑制剂(BPTI)的试验
由大肠杆菌纯化谷胱甘肽琼脂糖珠结合GST-Pdia4(0.15μg)。欲测试CP对GST-Pdia4的双硫键异构酶活性的影响,减少的BPTI(0.39μg)于载剂、5.64μg GST-Pdia4或5.64μg GST-Pdia4加上不同剂量的CP(0、0.33μg、3.3μg及33μg)的存在下培养于氧化还原缓冲液。GST-Pdia4的酶活性以所述减少的BPTI百分比(%)表示。
评估糖尿病并发症
欲评估骨密度,野生型小鼠及pdia4-/-小鼠,其以PBS或STZ处理,接受全身X光分析。骨密度及股骨与膝关节髓腔如所指。欲评估皮肤溃疡,野生型小鼠及pdia4-/-小鼠,其以PBS或STZ处理,以打孔器产生伤口。以测径器测量伤口。于眼部伤害方面,野生型小鼠及pdia4-/-小鼠,其以PBS或STZ处理,以氢氧化钠产生伤害。当小鼠曝露于紫外线时,拍摄眼部的损伤。欲评估糖尿病小鼠的肾功能,于18周时收集leprdb/db及pdia4-/-leprdb/db小鼠的尿液样本,并以肌酸酐试验试剂盒(ab65340)分析肌酸酐。以7600Clinical Aanazyler(Hitachi)测定血液样本的生化参数。
Pdia4试验
于25℃的氧化还原缓冲液,于指定剂量的载剂或CP存在下,将胰岛素(200μM)与重组型Pdia4(1.65μg)培养30分钟。经由公式100%×(载剂的OD595–CP的OD595)/(载剂的OD595),取得Pdia4酶活性的抑制作用结果。
虚拟筛选
欲制备化学数据库,将内部(in-house)化学物质库(261个化合物)转换成3D坐标,其藉Discovery Studio/Prepare Ligand Module,使用力场CHARMm以最小化化合物。欲制备蛋白质结构,使用源自PDB的Pdia4活性结构域晶体结构。残基的质子化状态调整至pH 7.5的主离子形式。以GOLD 5.1版(CCDC Software Limited,Cambridge,U.K.)进行分子嵌合(molecular docking)。以GOLD将内部化学物质库嵌合至Pdia4蛋白活性结构域,其中开启弹性嵌合选项。于下列嵌合程序期间,Cys260与Cys269胺基酸残基的侧链结构维持弹性,并以内建GOLD软件包旋转异构体库建构模型。进行初始100个独立基因演算周期的计算,其中配位体扭转角(torsion angles)于-180与180度间变化。搜寻效率设定为100%,以确保最彻底搜寻嵌合构形空间。于有效使用计算资源方面,嵌合计算限定在以活性位点为中心的半径球体内,其于应用约束(constraints)下涵盖所有可能的化合物。所有原始参数用于GOLD基因演算。所得的配位体-蛋白质复合体结构以GOLDSCORE评分功能进行排名,以决定最高命中(top hits)(8,14-二羟基-12-O-(4,5-二甲基己酰基)-17-甲基-3-乙酰甲胺磷甲苯磺酰基孕甾烯醇酮、12-O-乙酰基-8,14-二羟基-17-甲基-3-乙酰甲胺磷甲苯磺酰基乙酸及12-O-桂皮酰基-8,14-二羟基-17-甲基-3-乙酰甲胺磷甲苯磺酰基乙酸)。CP及其衍生物亦采取相同策略。
结果
Pdia4蛋白向上调节以反应糖尿病小鼠β细胞及血液的代谢应激。
欲探索Pdia4对β细胞及糖尿病的作用,发明人首先评估Pdia4于小鼠胰岛的表达。发明人发现,Pdia4主要表达于胰腺及胰脏胰岛(图1A-图1C)。更重要地,胰脏胰岛的Pdia4蛋白浓度,而非PDI及ERP57,经向上调节以响应高葡萄糖(图1A)。发明人亦确认,Pdia4于β细胞的浓度是向上调节以响应代谢应激(图2A-图2C)。同样地,糖尿病leprdb/db小鼠β细胞的Pdia4蛋白浓度增加(图2D)。
欲测试Pdia4蛋白浓度与糖尿病间的关联性,发明人以Elisa试剂盒测定无糖尿病C57BL/6及糖尿病leprdb/db小鼠血中Pdia4的蛋白浓度。发明人的结果显示,于6或18周龄的无糖尿病C57BL/6小鼠及6周龄的leprdb/db小鼠,血中Pdia4蛋白浓度不断变低(图1B)。然而,18周大糖尿病小鼠血中Pdia4浓度明显向上调节(图1B)。数据显示,血中Pdia4为糖尿病诊断标记。
Pdia4缺乏可增加胰岛素分泌及胰岛保留但减少β细胞的ROS。
接着,发明人调查Pdia4对β细胞功能及保留的基因功能。发明人比较野生型及pdia4-/-小鼠胰岛的胰岛素分泌。于3.3mM葡萄糖存在下,pdia4-/-胰岛释放的胰岛素高于野生型胰岛2倍以上(图3A)。于16.7mM葡萄糖存在下,pdia4-/-胰岛释放的胰岛素比野生型胰岛高出更多(图3A)。数据显示,Pdia4缺乏可增进β细胞功能。发明人亦测定以一剂PBS或STZ处理的野生型及pdia4-/-小鼠胰岛的ROS浓度。发明人发现,STZ明显增强野生型小鼠胰岛的ROS浓度(图3B)。相反地,pdia4-/-胰岛产生的ROS浓度比野生型胰岛的低(图3B)。数据显示,Pdia4缺乏可减少ROS累积。此外,发明人评估以3剂PBS或STZ处理的野生型及pdia4-/-小鼠的胰岛架构。发明人发现,pdia4-/-胰岛对STZ介导的细胞凋亡抗性比野生型胰岛的高,是如胰岛面积所示(图3C)。
Pdia4缺乏可经由增进β细胞功能及减少胰岛细胞死亡而降低糖尿病小鼠模式的血糖。
欲评估Pdia4于糖尿病发展的基因功能,发明人首先以化学物质STZ于野生型及pdia4-/-小鼠诱发糖尿病。发明人发现,野生型小鼠的空腹血糖及进食后血糖类似于pdia4-/-小鼠(图4A-图4B)。相反地,STZ处理的野生型小鼠的空腹血糖及进食后血糖比STZ处理的pdia4-/-小鼠的高(图4A-图4B)。与取自图3C的数据一致的是,取自图4A-图4B的数据显示,Pdia4缺乏可赋予保护小鼠胰岛对抗β细胞及糖尿病。发明人亦比较leprdb/db及pdia4-/-leprdb/db小鼠的糖尿病发展。leprdb/db小鼠自8周龄自发地发展糖尿病,如空腹血糖(图4C)及进食后血糖(图4D)所示。相反地,pdia4-/-leprdb/db小鼠的空腹血糖(图4C)及进食后血糖(图4D)比leprdb/db小鼠的低。数据显示,Pdia4缺乏可赋予保护小鼠胰岛β细胞及糖尿病(图4C-图4D)。
恒定模式评估(HOMA)用于评估β细胞功能。野生型小鼠的HOMA-β值比pdia4-/-小鼠的稍低(图4E)。相反地,pdia4-/-leprdb/db小鼠的HOMA-β值比leprdb/db小鼠的明显更高(图4E)。数据显示,Pdia4缺乏可改进β细胞功能。
接着,发明人研究Pdia4对野生型C57BL/6、pdia4-/-C57BL/6、leprdb/db及pdia4-/-leprdb/db小鼠的β细胞死亡的影响。发明人发现,pdia4-/-小鼠的胰脏胰岛细胞死亡比野生型小鼠的稍低。据此,pdia4-/-leprdb/db小鼠的胰脏胰岛细胞死亡比leprdb/db小鼠的更低(图4F)。
整体而言,数据显示,Pdia4缺乏可经由改进β细胞功能及存活率而减少糖尿病。
结合Pdia4缺乏/抑制与降低胰岛素抗性可逆转糖尿病。
保留β细胞为治疗糖尿病的关键。发明人的数据显示,Pdia4缺乏可改进及保留β细胞功能,但无法逆转糖尿病。接着,发明人调查Pdia4消除/抑制与胰岛素敏化剂二甲双胍(60mg/kg BW)、罗格列酮(20mg/kg BW)或两者对pdia4-/-leprdb/db及leprdb/db小鼠糖尿病的组合效应。发明人指出,leprdb/db小鼠具较高的进食后血糖(图5A)。相反地,pdia4-/-leprdb/db小鼠的进食后血糖200mg/dL(图5A)。以二甲双胍(60mg/kg BW)、罗格列酮(20mg/kg BW)或两者处理,能正常化pdia4-/-leprdb/db小鼠的高血糖症(图5A)。数据显示,Pdia4缺乏及胰岛素敏化剂可治疗糖尿病。
聚多炔糖苷显示可抑制Pdia4酶活性(图5B)。发明人亦检查结合聚多炔糖苷与胰岛素敏化剂(二甲双胍、罗格列酮或两者)对leprdb/db小鼠糖尿病的影响。leprdb/db小鼠具较高的进食后血糖(图5C)。相反地,聚多炔糖苷可降低leprdb/db小鼠的进食后血糖(图5C)。此外,结合聚多炔糖苷与二甲双胍或二甲双胍加上罗格列酮可完全正常化leprdb/db小鼠的进食后血糖(图5C)。数据显示,Pdia4抑制及胰岛素敏化剂可治疗糖尿病。
整体而言,数据显示,Pdia4基因剔除/抑制并伴随敏化剂可逆转糖尿病。
Pdia4对糖尿病相关并发症的影响
发明人亦调查Pdia4于糖尿病相关并发症的基因功能,该并发症如肾病、骨质疏松、皮肤溃疡及眼部损伤。发明人比较糖尿病性野生型C57BL/6及pdia4+/-C57BL/6小鼠于STZ处理后股骨及膝关节的骨质疏松。全身X光分析的数据显示,野生型及pdia4-/-小鼠的骨密度于STZ处理后4周降低(图6A)。有趣的是,pdia4-/-小鼠的髓腔比野生型小鼠的大(图6A)。然而,于STZ处理后4周,pdia4-/-小鼠的股骨头(femur head)比野生型小鼠的更密集(图6A)。数据显示,Pdia4缺乏可减少骨质疏松。
接着,发明人评估Pdia4对野生型及pdia4-/-小鼠伤口愈合的影响。发明人发现,pdia4-/-小鼠的伤口愈合比野生型小鼠的更好(图6B)。同样地,pdia4-/-小鼠的角膜损伤恢复优于野生型小鼠(图6C)。此外,发明人亦发现,pdia4-/-leprdb/db小鼠的肌酸酐清除率比leprdb/db小鼠的高(图6D),显示Pdia4缺乏可减少肾病。最后,发明人检查Pdia4于心血管疾病(CVD)的影响。发明人发现,Pdia4缺乏可减少血清三酸甘油酯且增加高密度脂蛋白(HDL)(图6E),显示Pdia4缺乏可拯救CVD。
整体数据显示,Pdia4负向调节糖尿病相关并发症。总之,Pdia4可作为糖尿病及其并发症的诊断标记及治疗目标。
Pdia4可用于筛选糖尿病的Pdia4抑制剂
利用虚拟筛选策略,评估含261个化合物的内部数据库,发明人发现,聚多炔糖苷、聚多炔糖苷衍生物及3个其他类萜最适于Pdia4活性位点(图7)。发明人亦确认,聚多炔糖苷确实抑制Pdia4活性(图5B)。
前述的本发明示例性具体实施方式的呈现目的是仅说明及阐述,且未旨在穷尽或局限本发明于所揭示的精确形式。鉴于上述实施,可能有许多改良及变更。所选用及描述的具体实施方式及实例是旨在阐述本发明的原理及其实际应用,以使本领域的技术人员能利用本发明及各具体实施方式,以及进行各种修饰,以适合预期的特定用途。其他具体实施方式为本领域技术人员所显见,而不背离本发明的精神及范畴。据此,本发明的范畴是由所附权利要求定义,而非本文前面的描述及示例性具体实施方式。
本说明书引用及讨论的所有参考数据在此全部并入本案以作为参考数据,且某种程度上如同各参考数据皆单独地并入本案以作为参考数据。
- 还没有人留言评论。精彩留言会获得点赞!